INTRODUCCIÓN
La anaplasmosis es una enfermedad infecciosa hemoparasitaria producida por bacterias gram negativas, intracelulares obligadas, inmóviles, de morfología cocoide; su blanco son las células hematopoyéticas (especialmente neutrófilos y plaquetas), se replican dentro de una vacuola derivada de la membrana de la célula eucariota del hospedero, vertebrado o invertebrado. Generalmente es transmitida por artrópodos, pueden afectar a humanos y numerosas especies de animales domésticos y silvestres, entre las que se reportan perros, caballos, cabras, ovejas, gatos, rumiantes, aves, entre otros que podrían desempenar un papel importante en la persistencia y diseminación de la enfermedad 1,2.
La anaplasmosis se presenta en áreas tropicales y subtropicales con las condiciones que favorecen la supervivencia y reproducción del vector. Es es endémica en regiones del Medio Oeste, Este y Noreste de los Estados Unidos, así como las regiones costeras occidentales, en donde la mayoría de los brotes son estacionales y coinciden con la aparición de garrapatas. En países como Reino Unido, Noruega, Suecia, Suiza y Alemania se han reportado infecciones en rumiantes, caninos y humanos; mientras que en Asia y Suramérica ha sido menos frecuente su estudio. La necesidad de conocer su ocurrencia y distribución radica en su importancia como enfermedad zoonótica, su amplia distribución geográfica y la complejidad de los cuadros clínicos que genera 3,4. Especialmente en perros el enfoque es muy importante por el aumento de las mascotas de diferentes regiones, el elevado número de adopciones y la cercanía de los caninos con los humanos, lo que hace de esta situación un hecho epidemiológico de importancia que implica conocer a profundidad el agente implicado 5.
En los caninos los principales agentes etiológicos son Anaplasma phagocytophilum y Anaplasma platys6,7. La infección causada por A. phagocytophilum es transmitida por garrapatas del género Ixodes, produciendo la anaplasmosis granulocítica canina, y la infección causada por A. platys es transmitida principalmente por Rhipicephalussanguineus, produciendo la Trombocitopenia Cíclica Infecciosa Canina (TCIC). Los principales signos de esta enfermedad en los perros son fiebre, depresión, cojera, anorexia, inflamación articular, signos neurológicos y cuadro hemático y uroanalisis con hallazgos de trombocitopenia, anemia no regenerativa, leucopenia, hiperglobulinemia y proteinuria durante varias etapas de infección 8,9. Los signos clínicos asociados con Anaplasma spp. en ocasiones no son muy específicos; por consiguiente, se dificulta su diagnóstico clínico. Adicional a esto, algunos reportes indican que los perros infectados por A. platys pueden cursar con una trombocitopenia cíclica que puede ser lo suficientemente grave como para producir hemorragia, incluyendo petequias y equimosis, pero se cree que la mayoría de los perros controlan la infección inmunológicamente 10.
El diagnóstico incluye frotis sanguíneo con tinción de Giemsa, el cual presenta baja sensibilidad ante baja bacteriemia o infecciones transitorias. También se cuenta con pruebas inmunoenzimáticas e inmunofluorescentes con buena sensibilidad y especificidad, pero limitadas por el hecho que los anticuerpos generalmente están ausentes durante las dos primeras semanas de aparición de los signos de la enfermedad, persisten hasta ocho meses después de la eliminación del agente y pueden presentarse reacciones cruzadas con otros agentes de la familia Anaplasmataceae y rickettsiales 2.
Finalmente, la PCR es utilizada mundialmente como herramienta en el diagnóstico de enfermedades infecciosas y para caracterizar agentes patógenos, la utilidad de esta técnica es sustentada por la identificación rápida y precisa de enfermedades que de otro modo serían difíciles de detectar, mediante el uso de cebadores universales dirigidos contra el ADN ribosómico 16S bacteriano y el análisis de secuenciación 11. Publicaciones previas han demostrado la especificidad de la PCR, baja reactividad cruzada con otras especies y buena reproducibilidad con bajos coeficientes de variación intra e inter ensayo, lo cual permite superar limitaciones de otros métodos diagnóstico, pues permite detectar y cuantificar el ADN de Anaplasma spp. en sangre canina, lo que resulta crucial para la detección, diagnóstico y seguimiento de la infección 12.
La magnitud de la infección puede presentar una elevada heterogeneidad atribuible a su carácter asintomático, hallazgos de laboratorio (hematológicos y bioquímicos) inespecíficos, variaciones en la utilidad diagnóstica de las técnicas utilizadas y factores ambientales, particularmente los relacionados con la presencia de vectores específicos que condicionan la epidemiología en diferentes regiones del mundo 13.
Por lo anterior, es relevante desarrollar una revisión sistemática que permita conocer un panorama global de la prevalencia de Anaplasma spp. en caninos, caracterizar la ocurrencia por especie de A platys o A. phagocytophilum, este último es uno de los principales patógenos causales en perros que en condición doméstica puede relacionarse con infecciones en seres humanos 14. También es relevante comparar la prevalencia según lugar, periodo de estudio y prueba diagnóstica, para orientar acciones sanitarias e investigativas posteriores. Además, las revisiones sistemáticas como una búsqueda estructurada, explícita, sistemática, exhaustiva y reproducible de estudios referidos a una pregunta de investigación, permite aumentar las posibilidades de extrapolación de resultados, mejora la precisión en la estimación y comparación de prevalencias, es una herramienta clave en la toma de decisiones en salud y en la evaluación de las necesidades de investigación, y a menudo se usan como punto de partida para el trabajo de grupos de consenso, paneles de expertos o comisiones con responsabilidades reguladoras y de alto impacto sanitario 15.
El objetivo de este estudio fue estimar la prevalencia general de Anaplasma spp. y la prevalencia específica de A platys y A. phagocytophilum en caninos, mediante estudios publicados entre 2000 y 2018.
MATERIALES Y MÉTODOS
Tipo de estudio. Revisión sistemática de la literatura y metanálisis.
Estrategia de búsqueda y selección de artículos según fases PRISMA Preferred Reporting Items for Systematic reviews and Meta-Analyses.
Identification. Se realizó una búsqueda exhaustiva de la literatura científica publicada en PubMed, Scielo y Lilacs, combinando los términos Anaplasma o Anaplasmosis con los sinónimos que aparecen en los descriptores en Ciencias de la Salud (DeCS) para prevalencia, es decir, frecuencia, ocurrencia, epidemiología, vigilancia, brotes e incidencia, para un total de 14 estrategias de búsqueda diferentes en espanol e inglés.
Tamización. En esta fase se aplicaron los criterios de inclusión de tener los términos de búsqueda en título/ resumen, ser un estudio observacional de prevalencia, en caninos como población central y con el reporte explícito de la prevalencia, es decir, la población y el número de positivos; no se aplicaron restricciones de tiempo en la búsqueda y selección, aunque la primera publicación hallada es de 2001, y prospectivamente la última actualización del protocolo de búsqueda se realizó en abril del 2018, por lo que se delimitó como ventana de tiempo de este estudio el periodo 2000-2018. Algunas sintaxis usadas en la búsqueda y selección fueron: (Anaplasma[Title]) AND Prevalence[Title/Abstract], (Anaplasmosis[Title]) AND Ocurrence[Title/Abstract], (ti: (anaplasma)) AND (ab: (prevalencia)).
Elección. Se excluyeron los estudios que no eran investigaciones originales tipo editoriales o revisiones de tema, estudios con información incompleta como no incluir el nombre de la prueba diagnóstica usada, estudios de caso o series de casos con bajo tamano de muestra (10 o menos).
Inclusion. Se realizó una síntesis cualitativa y cuantitativa de los estudios que cumplieron el protocolo anterior, con dichos artículos se realizó una base de datos en un archivo plano de Excel con las variables título, autores, ano de publicación, país de realización, número de caninos evaluados, número de caninos positivos y prueba diagnóstica usada; en algunos estudios fue posible analizar variables adicionales como la especie infectante y la presencia de coinfecciones.
Análisis de reproducibilidad y evaluación de la calidad metodológica. Se garantizó la reproducibilidad de la búsqueda y selección de los estudios por consenso y remisión a un tercero, para la reproducibilidad de la extracción de la información de los artículos incluidos se hizo un diligenciamiento de la base de datos en Excel de manera independiente por dos investigadores hallando un índice kappa de 1.00 en las variables cualitativas y un coeficiente de correlación intraclase de 1.00 para las cuantitativas. Para la evaluación de la calidad metodológica de los estudios se aplicaron los criterios contenidos en la guía STROBE STrengthening the Reporting of OBservational studies in Epidemiology para estudios transversales.
Análisis de la información. La descripción de las variables del estudio se hizo con frecuencias (absolutas y relativas), se construyó un Forest Plot para graficar la prevalencia de infección reportada en cada estudio, agrupados según la prueba diagnóstica, con sus intervalos de confianza del 95%. Además, se estimaron prevalencias específicas por periodo de estudio, continente y prueba diagnóstica, y en los casos que fue posible, se estimó la prevalencia específica de infección por A. platys y A. phagocytophilum con sus intervalos de confianza del 95% mediante un modelo de efectos aleatorios (que incluye en la estimación la variabilidad intra e inter estudios) dada la heterogeneidad en los reportes individuales según esta coeficiente RI (I2 Proporción de la varianza total debida a la varianza entre estudios). Las prevalencias específicas de cada especie se compararon con la Prueba Z o intervalo de confianza para la diferencia de proporciones.
Aspectos éticos. Con base en la Resolución 8430 del Ministerio de Salud de Colombia 1993, el estudio se clasifica como una investigación sin riesgo, dado el uso de fuentes documentales o secundarias.
RESULTADOS
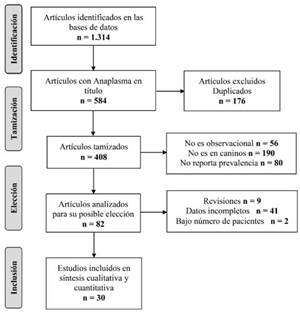
En la búsqueda inicial se hallaron 1.314 estudios en todas las bases de datos y con la totalidad de estrategias de búsqueda, de éstos se tamizaron 408 artículos que incluían los términos de búsqueda en título, resumen o ambos; sólo 30 estudios cumplieron el protocolo de búsqueda e inclusión de estudios (Figura 1).
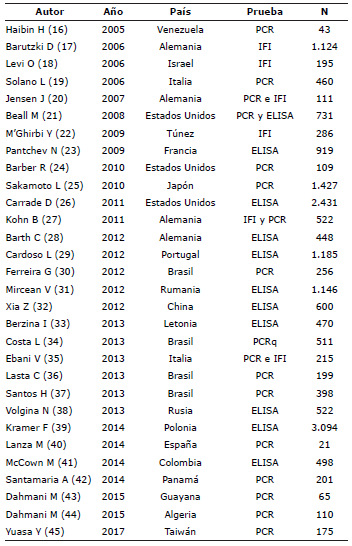
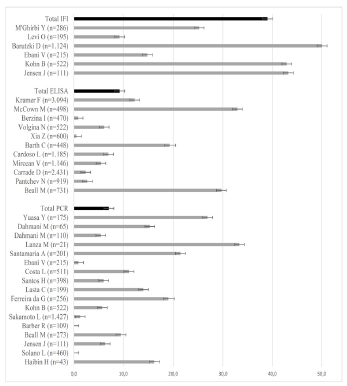
Los estudios se publicaron entre 2005 y 2017 con mayor proporción de publicaciones a partir del 2011 con un 66.7% (n = 20). El 43.3% (n = 13) se realizó en países de Europa, el 36.7% (n = 11) de América, 13.3% (n=4) de Asia y 6.7% de África (n = 2); los países con el mayor número de estudios fueron Brasil, Estados Unidos y Alemania. El 56.6% (n = 17) de los estudios empleó PCR, 36.6% (n=11) ELISA y el 20.0% (n=6) IFI; uno usó simultáneamente PCR y ELISA, y tres PCR e IFI (Tabla 1).
La revisión sistemática se desarrolló en una población de 18.472 caninos, con un 70.7% (n = 13.067) en el periodo 2011-2017; 55.4% (n = 10.237) en Europa, 29.5% (n=5.442) en América, 13.0% (n=2.397) en Asia y 2.1% (n=396) en África. 65.2% (n=12.044) de los caninos se tamizó o diagnosticó con ELISA, 30.1% (n=5.554) com PCR y 13.3% (n=2.453) con IFI (Tabla 1).
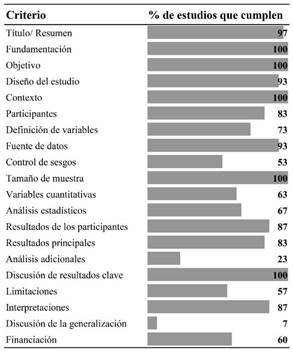
Los estudios presentaron buena calidad metodológica al cumplir 70% o más de los criterios de la guía STROBE; sin embargo, algunos criterios son poco explícitos en los estudios como los referidos al control de sesgos de selección e información, la realización de análisis adicionales que mejoren la exploración de factores asociados y la discusión de las posibles generalizaciones de resultados (Figura 2).
En los 2.453 individuos tamizados con IFI se halló una seroprevalencia de infección estadísticamente mayor a las demás pruebas con un 39.0% (IC95%= 37.0-41.0), en 12.044 caninos en los cuales se aplicó ELISA la seroprevalencia fue 9.3% (IC95%= 8.8-9.8) y en los 5.096 caninos analizados con PCR fue 7.1% (IC95%= 6.4-7.8); en todas las pruebas se halló una elevada heterogeneidad con prevalencia entre 0.0% y 50.1% (Figura 3).
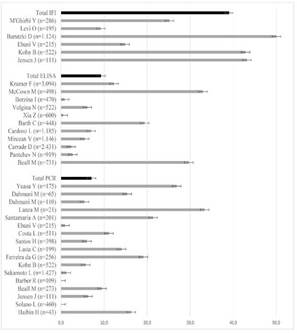
Figura 3 Prevalencia global de infección por técnica diagnóstica e individual de cada estudio, con sus intervalos de confianza del 95%.
Con base en el periodo de estudio, se halló una menor prevalencia en los estudios más recientes (entre 2011 y 2017), con excepción de los estudios basado en PCR en los cuales se halló una prevalencia de 2.4% (IC95%=1.8-3.0) en las publicaciones del periodo 2001-2010 en contraste con un 11.3% (IC95%=10.1-12.5) entre 2011 y 2017 (Figura 4).
Nota: el número total resulta mayor a la población de caninos evaluados por los estudios que aplicaron simultáneamente dos pruebas.
Figura 4 Prevalencia de infección según periodo, lugar y prueba diagnóstica.
Según el lugar de estudio, se halló una prevalencia estadísticamente mayor en África, aunque al analizar sólo la prevalencia basada en PCR fue estadística mayor en América con un 11.9% (IC95% = 10.5-13.3) frente a África con un 5.5% (IC95%=1.2-9.7), Asia 4.1% (IC95% = 3.1-5.1) y Europa 3.5% (IC95% = 2.5-4.5) (Figura 4).
En los estudios incluidos fue deficiente el reporte de prevalencias específicas según la zona de procedencia, la especie implicada, la frecuencia de coinfecciones y la presencia o ausencia de signos en los caninos.
En este sentido, algunos estudios reportaron una mayor prevalencia en la zona rural durante la temporada de lluvias, seguido de zonas rurales en temporada seca y menor en las zonas urbanas 34.
En los estudios que reportaron la prevalencia de infección según la presentación de signos, no se observaron diferencias significativas con un 44.9% en perros con signos y 41.9% en los asintomáticos 20; 46.9% en caninos enfermos y 39.8% en animales sanos 27; 4.5% en caninos sanos y 9.2% en animales con enfermedades caninas de transmisión vectorial 30. Sólo un estudio reportó la prevalencia de A. bovis con un 1.3% (IC95%=0.5-1.6) 25.
La prevalencia de A. platys en 1.581 individuos evaluados con PCR fue heterogénea (coeficiente RI = 0.90) con estudios que reportaron prevalencias entre 5.5% y 33.3%; para una prevalencia global de 16.1% (IC95%=14.2-17.9); ésta resultó estadísticamente mayor a la prevalencia de A. phagocytophilum que en 1.706 caninos evaluados con PCR fue 3.7% (IC95%= 2.8-4.6), lo que equivale a una diferencia que oscila entre 10.3% y 14.5% (Estadístico Z para la diferencia de proporciones= 11.95. Vp= 0.000) (Figura 5).
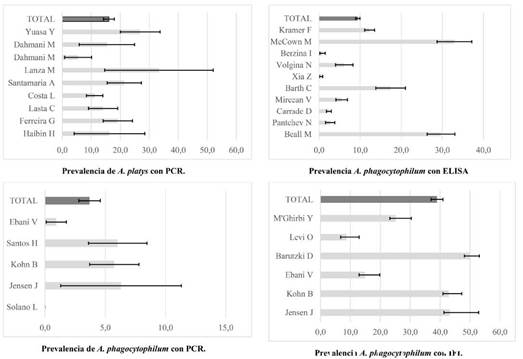
Figura 5 Metanálisis (Forest Plot) de la prevalencia de A. platys y A. phagocytophilum según la prueba diagnóstica.
A su vez, la prevalencia de A. phagocytophilum fue estadísticamente menor al utilizar PCR en comparación con los estudios que usaron ELISA e IFI; en 10.859 caninos analizados con ELISA se halló una seroprevalencia de 9.4% (IC95% = 8.9-10.0) con una diferencia de proporciones de 4.7% a 6.8% (Estadístico Z = 7.8. Vp= 0,000) frente a PCR, y en que en 2.453 caninos diagnosticados con IFI la seroprevalencia fue 39.0% (IC95%= 37.0-40.9) lo que resulta entre 33.1% y 37.5% mayor que los hallazgos con PCR (Estadístico Z = 26.0. Vp= 0,000). Finalmente, la seroprevalencia de A. phagocytophilum con IFI con IFI fue 27.5-31.6% mayor, frente al uso de ELISA (Estadístico Z = 37.1. Vp= 0.000) (Figura 5).
DISCUSIÓN
Se incluyeron 30 publicaciones en 13 años, donde se evaluó la infección en 18.472 caninos, la mayoría de Brasil, Estados Unidos y Alemania, con buena calidad metodológica, lo que evidencia una elevada validez de este metanálisis. En países como Brasil las razones pueden estar dadas por su ubicación geográfica y su clima, dado que las infecciones por Anaplasma spp., se han reportado con mayor incidencia en áreas tropicales y subtropicales 43. Los climas húmedos tropicales proporcionan un medio ambiente adecuado para la presencia de vectores tales como garrapatas y mosquitos. Con respecto a los reservorios naturales, existe una fuerte variación geográfica entre diferentes enfermedades transmitidas por garrapatas. Las poblaciones caninas son susceptibles a la mayor parte de los patógenos transmitidos por las garrapatas que infectan los mamíferos, incluyendo los seres humanos, por lo que los perros son grandes reservorios y centinelas adecuados para las enfermedades infecciosas y zoonóticas 41.
En países Europeos, como Alemania, la anaplasmosis se ha reportado como una zoonosis emergente. Anaplasma spp., muestra una amplia distribución geográfica, pues se extiende por todo el hemisferio norte, desde Canadá hasta China. En Europa, A. phagocytophilum se distribuye por todo el continente. Prueba de ello es la existencia de personas seropositivas en numerosos países, así como la presencia del patógeno en garrapatas y en macro y micromamíferos de la mayoría de los países europeos. En cuanto a la distribución temporal Anaplasma spp., tanto en Europa como en Estados Unidos, se observa una clara estacionalidad. La mayoría de los casos se registran en el verano y a finales del otono, periodo este en el que coincide la aparición de las ninfas y de los adultos de las garrapatas. La diferencia entre seropositivos y casos clínicos se atribuye a diagnósticos incorrectos y a la existencia de variantes de patógenos de Anaplasma spp. 13.
En los estudios que usaron IFI se halló una prevalencia de 39.0%, en ELISA 9.3% y en PCR 7.1%, con una elevada heterogeneidad atribuible a los lugares de estudios y la prueba per se, lo que demuestra el riesgo de hallar falsos positivos en los programas de tamización basados en la estimación de la seroprevalencia. Para establecer la cantidad de perros que presentan infecciones activas, pasadas o persistentes con anaplasmosis, se debe elegir el método más adecuado, se han reportado resultados positivos en la IFI de Anaplasma spp., y resultado negativo en PCR, es entonces cuando se debe determinar si la infección es pasada con presencia de anticuerpos y ausencia de antígenos 20,27,35.
La visualización al microscopio de extendidos de sangre, con tinción giemsa es la técnica diagnóstica de referencia y el método más común para la identificación de Anaplasma spp. en animales con sintomatología clínica; sin embargo, en fases crónicas, en individuos asintomáticos o en el estadio de portador, no expresa una elevada parasitemia que permita su detección con la tinción. Es un método económico y sencillo, capaz de detectar niveles de parasitemia de 0.1 a 0.2%, es decir, sólo pude detectar niveles mayores a 106 eritrocitos infectados por mililitro de sangre, además, resulta tedioso, no apropiado para un gran número de muestras e incapaz de diferenciar especies 48.
La IFI, es uno de los más utilizados y frecuentemente se ha considerado una prueba sensible; sin embargo, en ocasiones se considera poco útil por las reacciones falsas positivas. Por su parte, la detección de anticuerpos por ELISA es sensible, específica y brinda la posibilidad de una mejor interpretación de los resultados cuando se compara con las técnicas antes mencionadas, permite conocer el estado de inmunitario de las poblaciones de animales y determinar la seroprevalencia de la infección; sin embargo, se han reportado casos de reactividad cruzada entre A. platys y A. phagocytophilum, por ser especies relacionadas que comparten epítopos antigénicos 48.
Por último, la PCR es la prueba de mayor sensibilidad y especificidad, lo que permite superar limitaciones de otras pruebas, como la alta proporción de resultados falsos y las reacciones cruzadas entre especies, lo que resulta esencial para apoyar el diagnóstico clínico, evaluar el estado de portador de los animales y estimar la prevalencia de la infección general y por especie 48.
Con base en los estudios que emplearon PCR se halló una prevalencia estadísticamente mayor en América con un 11.9%, frente a África con 5.5%, Asia 4.1% y Europa 3.5%; lo que demuestra una alta heterogeneidad atribuible al país de estudio, al tiempo que evidencia la necesidad de disponer de estudios para cada contexto, con los cuales se mejore el conocimiento de la relación de las características del ambiente, los hospedadores y los vectores específicos de cada lugar (aspectos no descritos en los estudios sistematizados). Esta recomendación toma mayor importancia al considerar otras fuentes de variación en la distribución de la infección como el tipo de población seleccionada, la endemicidad del lugar de estudio, la presencia o ausencia de signos clínicos y la exigencia o no de notificación por las autoridades sanitarias de cada país 20,27,35.
La prevalencia de A. platys con PCR fue 16.1% y de A. phagocytophilum 3.7%, corroborando la primera especie como el principal agente causal en caninos, a diferencia de otras como, A. phagocytophilum que predomina en humanos, caballos, burros, jabalis y pequeños rumiantes como cabras y ovejas 14,46, A. marginale y A. centrale en bovinos, A. ovis causante de un padecimiento limitado a ovinos y caprinos 47.
La principal coinfección fue con Ehrlichia canis y Borrelia burgdorferi. Para el primer agente, un estudio en Brasil reportó un 16.4% de E. canis, 19.4% de A. Platys y 5.5% de coinfección por ambos microorganismos 30; en Panamá se informó una prevalencia de 64.2% de E. canis, 21.4% de A. platys y un 7.5% de coinfecciones por ambos 42 y en tres ciudades de Colombia se reportaron prevalencias de 25% para E. canis, 11% para A. phagocytophilum y coinfección del 6% 41. En el caso de B. burgdorferi, un estudio en Alemania halló seroprevalencias de 4.9% con este agente, 19.4% con A. phagocytophilum y 2,0% de coinfección 28, el Latvia la seroprevalencia de coinfección fue del 36% en los caninos infectados con B. burgdorferi33 y en Polonia la coinfección por A. phagocytophilum y B. burgdorferi fue del 1.7% 39. Estos datos demuestran la importancia de utilizar técnicas que permitan la identificación de especie y el diagnóstico diferencial, principalmente en casos de anemia y trombocitopenia.
Entre las limitaciones se destaca el hecho que en los estudios incluidos fue deficiente o muy heterogéneo el reporte de prevalencias específicas según la zona de procedencia, la especie implicada, la frecuencia de coinfecciones, la presencia o ausencia de signos en los caninos, entre otras variables independientes que resultan útiles en los estudios de prevalencia para identificar potenciales factores asociados y consolidar hipótesis para estudios analíticos.
En conclusión se halló una elevada prevalencia de infección global, con mayor importancia de A. platys, en un bajo número de publicaciones en el ámbito mundial y con una elevada heterogeneidad en la ocurrencia de la infección según el país, la técnica diagnóstica y la especie implicada; información relevante para fomentar el desarrollo de investigaciones epidemiológicas y acciones de sanitarias en población canina.











 text in
text in