INTRODUCCIÓN
La degradación de suelos afecta 3600 millones de hectáreas en el mundo, lo que constituye aproximadamente la cuarta parte de toda la tierra 1. Alrededor del 23% de la tierra cultivable en el mundo ha sido afectado por degradación; en consecuencia, se han disminuido los niveles de productividad. Cerca del 16% de las tierras degradadas se encuentran en América Latina, lo cual representa el tercer lugar después de Asia y África 2. En Colombia, la actividad productiva agropecuaria ha estado acompahada de procesos de deterioro del entorno natural, que afectan su sostenibilidad ambiental y económica. Los departamentos de la región Caribe están entre los más erosionados del país, la mayoría presentan cifras de degradación entre 78 y 100%, como consecuencia de circunstancias históricas, socioeconómicas y ambientales, tales como relieve, clima, viento, entre otras 3.
En América Latina, Colombia es el país con más alto porcentaje de suelo dedicado a las pasturas para la producción ganadera 4. En la región Caribe, este sistema de producción ocupa el 51% de su territorio 5 y juega un papel importante en la economía del país, ya que representa cerca del 35% del hato nacional, aporta el 40% del volumen de leche fresca y el 38% de carne. Sin embargo, a pesar de la importancia que representa este renglón productivo en la economía nacional, su sector primario enfrenta limitantes que influyen en la competitividad y sostenibilidad de los indicadores productivos, particularmente lo relacionado con procesos de degradación de suelos y praderas. Esto se refleja en una baja eficiencia biológica y económica de los sistemas ganaderos, debido a la baja calidad nutricional y oferta de forraje durante la época seca del año.
Dada la importancia de la ganadería en la economía de la región, se hace necesario la implementación de alternativas de manejo que permitan la conservación y/o recuperación de suelos. La sensibilidad de los indicadores biológicos del suelo permite observar los efectos de las prácticas de manejo en los sistemas, como una respuesta simultánea a cambios en las características físicas y químicas de este. Uno de estos indicadores es la formación de la asociación micorrizal entre hongos del suelo y sus plantas hospederas.
La importancia de los hongos micorrízicos arbusculares (HMA) en la nutrición de gramíneas y leguminosas forrajeras, especialmente en la toma de fósforo, amonio y otros elementos poco móviles en el suelo, ha sido objeto de muchos estudios 6. El aumento del volumen de suelo explorado, gracias al gran número de finas hifas de HMA, parece ser, en gran parte, responsable de las considerables diferencias en supervivencia, velocidad de crecimiento y rendimientos entre plantas micorrizadas y no-micorrizadas, particularmente en suelos degradados. La simbiosis efectiva entre gramíneas y HMA ha sido asociada con la recuperación de suelos degradados gracias a que la planta tiene una mejor nutrición por el acceso a un mayor volumen de suelo 7. Por lo anterior, esta investigación buscó determinar la efectividad de HMA de suelos con diferentes usos (bosque, cultivos transitorios de maíz y algodón, pradera degradada y sistemas silvopastoriles de diferente complejidad estructural) del departamento de Córdoba.
MATERIALES Y MÉTODOS
Ubicación. Se estableció un experimento en el invernadero de la Universidad Nacional de Colombia, sede Medellín (6°15'N, 75°35'W y 1495 m de altitud). Muestras de suelo (horizonte B) de un Andisol se utilizaron para llenar materos a razón de 690 g/matero. El suelo fue secado al aire, tamizado a 4 mm, mezclado en proporción 1:1 con cuarzo, y esterilizado dos veces en autoclave a 120°C y 0.1 MPa durante una hora, con un periodo de 24 horas entre cada esterilización 8. El suelo tuvo un pH (1:1, agua) de 5.8 y se realizó una isoterma de adsorción de P 9 para determinar la cantidad de P requerida para obtener una concentración de P en la solución del suelo de 0.02 mg L-1; esta concentración se considera óptima para la actividad micorrizal 10. Al momento de la siembra, se aplicó P a razón de 588 mg kg-1, como fuente de P se utilizó KH2PO4. El sustrato presentó los siguientes resultados del análisis de suelos: materia orgánica 5.5% (Walkley & Black); P 22 mg kg-1 (Bray II); Ca, Mg y K 5.2, 0.9 y 0.31 cmolc kg-1 (Acetato de amonio), respectivamente.
El suelo de los materos fue inoculado separadamente con 30 g/matero de muestras de suelo superficial tomadas de los primeros 10 cm de profundidad (horizonte Ap) del Centro de Investigación Turipaná de Agrosavia (8°50'N, 75°47' W y 15 m de altitud) ubicado en el municipio de Cereté (Córdoba, Colombia). Los suelos estaban sometidos a diferentes usos y manejo así: (i) pradera degradada (Pd) con Dichanthium aristatum bajo ganadería intensiva por más de 15 años, (ii) sistema intensivo de maíz-algodón (MA) en alternancia, (iii) bosque secundario (Bs) de 14 años, (iv) pradera (Pr) en rotación de pasto D. aristatum y Panicum maximum, (v) sistema silvopastoril constituido por pasturas de D. aristatum y P. maximum con especies arbóreas (Pr+A), (vi) sistema silvopastoril constituido por pasturas de D. aristatum y P. maximum con especies arbóreas y arbustivas (Pr+A+a), (vii) sistema silvopastoril constituido por pasturas de D. aristatum y P. maximum con especies arbóreas, arbustivas y maderables (Pr+A+a+M). Como control positivo, se usó un inoculo crudo de Glomus fasciculatum (viii), de la colección del Laboratorio de Microbiología de la Universidad Nacional de Colombia, Sede Medellín; este inoculo contenía 40 propágulos infectivos (esporas, micelio extraradical y raíces colonizadas) por gramo, lo cual fue determinado por la técnica del número más probable 11. Adicionalmente, se incluyó como control negativo (ix) un tratamiento no-inoculado.
En cada matero se sembraron tres semillas germinadas de Leucaena leucocephala, las cuales fueron previamente escarificadas con ácido sulfúrico por 30 minutos y lavadas seis veces con agua destilada. Ésta se empleó como planta indicadora por su muy alta dependencia micorrizal y rápido crecimiento 10. Los materos recibieron agua para mantener el suelo entre 50-60% de la máxima capacidad de retención de agua. Una vez por semana se aplicaron 25 cm3 de solución Hoagland libre de P 10.
Efecto inoculación. Para evaluar el efecto de la inoculación micorrizal se monitoreó el contenido de P foliar en el cuarto pínulo de la hoja joven más desarrollada de las plantas de L. leucocephala10 en función del tiempo (20, 31, 42, 53 y 64 días después de la siembra-dds-). A los 64 dds, se determinó la masa seca de la parte aérea de las plantas de L. leucocephala luego de secar en estufa (60oC) durante 72 horas.
Colonización. La colonización micorrizal de las raíces de L. leucocephala, fue determinada luego de clarificarlas con KOH (10%) 12 y teñirlas con fucsina ácida 13 y luego determinar la extensión de la colonización mediante el método del intercepto de la cuadrícula 14.
Diseno experimental. Se utilizó un diseño experimental completamente al azar, los tratamientos consistieron en las inoculaciones separadas con siete muestras de los suelos descritos anteriormente, la inoculación con G. fasciculatum y el control no-inoculado, es decir nueve tratamientos. Cada tratamiento tuvo cuatro repeticiones, para un total de 36 unidades experimentales.
Los datos fueron sometidos a análisis de varianza y la comparación de medias se realizó con la prueba de mínima diferencia significativa (LSD), con un nivel de significancia (P) de 0.05. Los análisis se realizaron con el paquete estadístico SAS versión 8.
RESULTADOS
El contenido de P foliar en plantas de L. leucocephala fue significativamente superior cuando el suelo se inoculó con G. fasciculatum en comparación a aquel observado con los demás tratamientos (Figura 1). Los efectos favorables de la inoculación con este hongo micorrizal fueron detectados a partir del día 42 dds; este efecto se mantuvo hasta el final del periodo de evaluación (64 dds) (Tabla 1).
Tabla 1 Niveles de significancia de los análisis de varianza y coeficientes de variación (CV) para las variables bajo estudio.
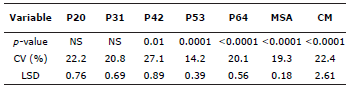
P20-64: contenido de P foliar en los días de muestreo; MSA: masa seca aérea; CM: colonización micorrizal.
En las dos primeras fechas de muestreo (20 y 31 dds), el contenido de P foliar no fue influenciado significativamente por la fuente de inóculo utilizada. La inoculación con las muestras de suelos no incrementó significativamente el contenido de P foliar con respecto al control no-inoculado en las diferentes fechas de muestreo (Figura 1).
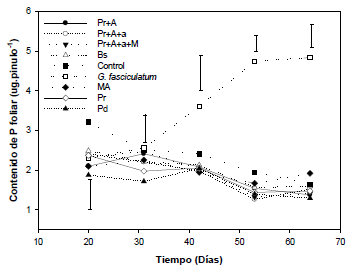
Figura 1 Contenido de P foliar en pínulos de leucaena en función de la inoculación con muestras de suelos bajo diferentes uso y manejo provenientes del valle medio del Sinú a través del tiempo de muestreo. Los datos de las dos primeras fechas no presentaron diferencias en función de los tratamientos. Las barras representan la diferencia mínima significativa (LSD) para p=0.05 entre medias.
El efecto de las fuentes de inóculo usadas también fue fácilmente observado en los registros de masa seca aérea de L. leucocephala (Figura 2) y corroboran los resultados anteriormente sehalados. Las plantas de L. leucocephala que crecieron en suelo inoculado con G. fasciculatum exhibieron una masa seca aérea significativamente superior a la de los otros tratamientos (Tabla 1). Al inocular el suelo con las otras fuentes de inóculo no se incrementó la masa seca aérea por encima de la detectada con el tratamiento control (no-inoculado).
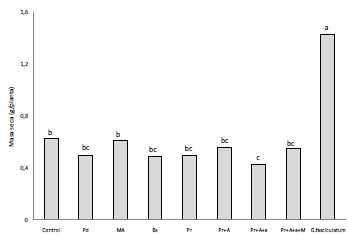
Figura 2 Masa seca aérea de leucaena en función de la inoculación con muestras de suelos bajo diferentes uso y manejo provenientes del valle medio del Sinú.
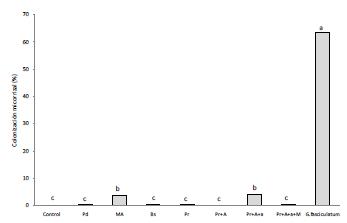
La colonización de raíces de L. leucocephala por HMA fue significativamente diferente en función a las fuentes de inóculo (Tabla 1, Figura 3). La colonización micorrizal fue muy alta en las raíces de L. leucocephala que crecieron en el suelo inoculado con G. fasciculatum (63%). En las raíces de plantas del control no-inoculado no se detectó colonización micorrizal. La colonización micorrizal de las raíces con los otros tratamientos fuentes de inóculo fue muy baja o nula (≤4%).
DISCUSIÓN
Los resultados no soportan la hipótesis de que la efectividad de HMA de los suelos está en función del tipo de cobertura y manejo del suelo y que puede cambiar de acuerdo al grado de complejidad de los sistemas donde los hongos están presentes. Los suelos usados como fuente de inóculo micorrizal exhibieron una baja efectividad micorrizal y no superaron al control no-inoculado. Esta baja efectividad micorrizal se puede deber a las condiciones físico-químicas de los suelos estudiados. Su fracción fina está dominada por arcillas del tipo 2:1, las cuales exhiben una alta capacidad de expansión y contracción según sea el nivel de humedad del suelo, y dada la marcada estacionalidad del periodo de lluvias y sequía esto se constituye en un factor importante en la dinámica física de estos suelos 15,16,17,18.
Durante la época lluviosa cuando la arcilla está expandida se puede limitar la circulación de oxígeno en el suelo, lo cual afecta los HMA que son aeróbicos. Por otra parte, durante la época seca la contracción del material podría generar estrangulamiento de raíces de las plantas y eventualmente ruptura de las hifas de los hongos micorrizales. Varios autores 19,20,21,22,23 han reportado que al disturbar mecánicamente el suelo las hifas de HMA se rompen y, en consecuencia, se reduce su viabilidad e infectividad. De igual manera, los suelos que fueron fuente de inóculo micorrizal están expuestos en mayor o menor grado a inundaciones periódicas y pueden permanecer saturados hasta por tres meses consecutivos al año. Tales condiciones anaeróbicas restringen el acceso de estos hongos al oxígeno, lo cual obviamente es desfavorable para su desarrollo 16.
Pruebas posteriores permitieron determinar que el número de esporas de HMA fue muy bajo en las muestras de suelo (11 a 22 esporas/g) usadas como fuente de inóculo micorrizal (Tabla 2), valores inferiores a los reportados por en estudios realizados en praderas de Bothriochloa pertusa (L) A. Camus de fincas ganaderas del municipio de Corozal en el departamento de Sucre, con registros de 15-60 esporas/g 24. Se puede inferir que las esporas presentes en los suelos usados como fuente de inóculo micorrizal hayan perdido su viabilidad y no sean capaces de formar la asociación micorrizal. Los valores de colonización encontrados en este estudio fueron menores del 5%, esto explicaría la baja efectividad micorrizal detectada en esos suelos; estos resultados son contrastantes con los observados en praderas de D. aristatum en fincas de la zona costanera del departamento de Sucre, donde la colonización exhibió valores superiores al 20% 25, lo cual es atribuible a las diferencias entre ambientes y las características físico-químicas de los suelos.
Tabla 2 Número de esporas de HMA y concentración de P en la solución del suelo de muestras usadas como fuente de inóculo.
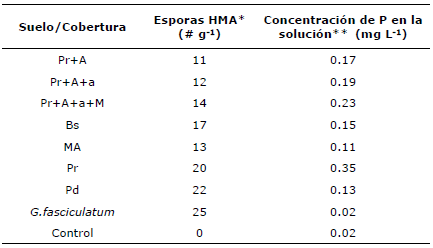
* Método del tamizaje en húmedo
** 0.01 M CaCl2 y determinación por fosfomolibdato
Los suelos evaluados, antes del establecimiento de los sistemas actuales de producción estuvieron bajo ganadería intensiva por no menos de 15 años 26. Dada las condiciones de deficiente drenaje interno y externo estos suelos fueron compactados 27. Se considera que en su momento las plantas de los sistemas silvopastoriles se establecieron porque el suelo químicamente es muy fértil y esto les permitió tolerar esas condiciones físico-químicas y atmosféricas en algunos periodos desfavorables 26. Las plantas de L. leucocephala tiene una muy alta dependencia de la asociación micorrizal para absorber P 10, esto es consistente con los resultados del presente estudio ya que al no haber suficiente inóculo micorrizal viable las plantas que dependen de los HMA pueden desaparecer del sistema, tal como ha ocurrido con L. leucocephala dentro de los sistemas silvopastoriles evaluados en este estudio.
Adicionalmente, el análisis de la concentración de P soluble en el suelo (CaCl2 0.01M) permitió detectar que la disponibilidad de P en estos suelos es relativamente alta (Tabla 2) y está por encima del nivel óptimo (0.02 mg L-1) para la actividad micorrizal. Altas concentraciones de P en la solución del suelo pueden disminuir la actividad y colonización de HMA en los suelos 10,28.
El potencial simbiótico micorrizal de un suelo es el resultado del tipo de suelo, de las prácticas de uso y manejo del suelo (prácticas agrícolas, minería), condiciones fisco-químicas, ambientales, microbiológicas y por la presencia de especies vegetales que pueden favorecer o desfavorecer la asociación micorrizal 29,30,31,32. Los anteriores aspectos, permiten explicar el porqué de la baja efectividad simbiótica micorrizal de las poblaciones nativas en los suelos estudiados. Estos resultados son comparables a los obtenidos 33 al inocular un sustrato de crecimiento con muestras de suelos degradados (como fuente de inóculo) que exhibían un bajo número de propágulos micorrizales infectivos y no hubo una buena colonización micorrizal y, por ende, no encontraron un efecto benéfico sobre la absorción de P y el crecimiento vegetal de plantas de L. leucocephala.
En conclusión, los resultados indican que los HMA nativos de suelos con diferentes usos evaluados, exhibieron bajo potencial para desarrollar simbiosis micorrizal, lo que limitó el crecimiento y la concentración de P foliar en la planta hospedera.











 text in
text in