INTRODUCCIÓN
Algunos moluscos pectínidos de importancia comercial se producen a lo largo de la costa del Pacífico y el Golfo de California, México, pero su pesca se considera insostenible 1. Argopecten ventricosus (Sowerby II, 1842) es una especie cultivable altamente valorada y de rápido crecimiento 2,3 pero la producción de semillas en laboratorio 4 es afectada por mortalidades masivas en etapas iniciales de su desarrollo 5,6. Para prevenir/reducir enfermedades y muerte masiva de larvas y semillas en laboratorio se utilizan antibióticos y otros quimioterapéuticos, que tienen diferentes efectos secundarios en el medio ambiente 7; inducen el desarrollo y la propagación de cepas resistentes a antibióticos 8,9, se acumulan en los tejidos de los organismos tratados 10 y afectan la microbiota de su tracto gastrointestinal (TGI) 11.
La estructura y actividad del TGI tiene un efecto en el huésped y le ayuda a mantener el equilibrio con el entorno circundante. Se han desarrollado diferentes estrategias para modular la comunidad microbiana del TGI y aprovechar su interacción con el hospedero para promover el crecimiento, la salud y la productividad en la acuicultura 6,11,12.
Esto es insuficiente, por lo que se requiere con urgencia enfoques más eficaces y eco-sostenibles como la homeopatía acuícola 13-17, la cual utiliza medicamentos derivados de minerales, plantas y animales, que ejercen su acción a dosis ultra-bajas según el “principio de similitud”, incrementando la inmunidad y resistencia natural del hospedero 18. Los tratamientos homeopáticos también pueden reducir o sustituir el uso de antibióticos, hormonas, desinfectantes y sustancias no ecológicas; disminuyendo costos de producción y aumentando la calidad y la inocuidad de los moluscos, peces y crustáceos cultivados 13-16.
El objetivo de este estudio fue evaluar el efecto de medicamentos homeopáticos sobre el crecimiento, supervivencia, y modulación de la microbiota del TGI en el pectínido marino A. ventricosus.
MATERIALES Y MÉTODOS
Organismos y mantenimiento. Juveniles de A. ventricosus (1.98 ± 0.1 cm de longitud promedio) provenientes de Bahía de La Paz, Baja California Sur, México, fueron limpiados de epifauna con agua de mar filtrada y esterilizada con UV al llegar al laboratorio y se aclimataron durante una semana (22°C, 37 USP de salinidad). Los juveniles se cultivaron en unidades de surgencia con agua de mar filtrada (arena sílica, bolsa de 1 µm y carbón activado) y esterilizada con UV, alimentándose con las microalgas Isochrysis galbana y Chaetoceros calcitrans (1:1) a razón de 10.8% del peso seco de tejidos blandos/día (aproximadamente 2 x 108 células org-1 d-1).
Formulación de los medicamentos homeopáticos. Se utilizaron medicamentos homeopáticos comerciales para uso humano o productos homeopáticos desarrollados en el Centro de Investigaciones Biológicas del Noroeste, S.S. (CIBNOR) a partir de materias primas y aplicando metodologías estandarizadas 15,16. Se aplicaron cinco tratamientos y tres controles (tres repeticiones c/u), incluyendo (T1) ViP-ViA 1D, (T2) ViP-ViA 7C, (T3) AcF-MsS 1D, (T4) PhA-SiT 7C, (T5) ViT 31C, (C1) etanol diluido 1:99, (C2) etanol dinamizado y (C3) agua destilada.
El etanol es el vehículo típico de dilución-sucusión en homeopatía 19, pero puede desencadenar la actividad de fenoloxidasa y profenoloxidasa en camarones 20 y aumentar el recuento de hemocitos en moluscos 21. Para evitar estos posibles efectos secundarios, la dinamización etanólica “stock” (decimal o centesimal) se preparó en agua destilada para preparar la siguiente y última dinamización homeopática “experimental”.
Los tratamientos homeopáticos de T1 y T2 fueron mezclas de dinamizaciones decimales o centesimales obtenidas mediante dilución/sucusión de concentrados o tinturas madre (TM), desarrolladas en el CIBNOR con cultivos bacterianos (1 x 108 UFC mL-1) de cepas patógenas y virulentas de Vibrio parahaemolyticus (CAIM-170, ViP) y Vibrio alginolyticus (CAIM-57 ViA), relacionadas con altas mortalidades en bivalvos y camarón.
Brevemente, y de acuerdo con Mazón-Suástegui et al 16 los siguientes procedimientos fueron aplicados: a) las células bacterianas fueron centrifugadas (8000 g, 4°C, 20 min) y se lavaron dos veces; b) los pellets se diluyeron en 7.5 mL de agua MilliQ, se inactivaron mediante tres ciclos de congelación-descongelación (-80°C y 24°C, respectivamente) y se sonicaron ocho veces, 30 s cada vez, para romper la pared celular y los organelos intracelulares; c) las células no rotas se eliminaron por centrifugación (3000 g, 4°C, 20 min) y el sobrenadante se diluyó (1:1 v /v) en etanol 87º GL (Similia® México) y se agitó dos minutos a 3200 rpm (BenchMixer, ® Edison, NJ, EE. UU) para obtener 15 mL de TM de cada cepa bacteriana.
Las dinamizaciones “stock” (ViP 6C y ViP 6C) se obtuvieron mediante dilución seriada y sucusión en etanol (1:99) de la TM respectiva. Para las dinamizaciones “experimentales” (ViP 7C y ViA 7C) se procedió igual, pero sustituyendo etanol por agua destilada.
El tratamiento homeopático T3 (AcF 1D + MsS 1D) fue la mezcla de dos dinamizaciones decimales (1:9) de ácido fosfórico grado analítico al 86% (Faga Lab®, Guamuchil, Sinaloa, México) y de una solución saturada de metasilicato de sodio (Faga Lab®, Guamuchil, Sinaloa, México). Se definió como TM de AcF al producto comercial sin dilución. La TM de MsS se preparó diluyendo 9.4 g en 45 mL de agua destilada, a 25°C. La primera dinamización decimal “experimental” (1D) de MsS se obtuvo diluyendo 5 mL de MsS en 45 mL de agua destilada (1:9), agitando dos minutos en vortex a 3200 rpm (Benchmark mixer®, Benchmark Scientific Inc.). La primera dinamización decimal “experimental” (1D) de AcF se obtuvo mediante igual procedimiento.
Los tratamientos T4 (PhA 7C + SiT 7C) y T5 (ViT 31C) fueron preparados a partir de medicamentos homeopáticos comerciales para uso humano (dinamizaciones “stock”). T4 fue la siguiente dilución/sucusión centesimal (1:99) de Phosphoricum acid ® 6C y de Silicea terra ® 6C (Similia®, México) y T5 (ViT 31C) la siguiente 1:99 de VidatoX® 30C (Labiofam®, Habana, Cuba). Las dinamizaciones “experimentales” de PhA 7C, Sit 7C y ViT 31C se prepararon utilizando agua destilada.
Diseño experimental. Se utilizaron 24 unidades experimentales con 36 L de agua de mar filtrada y esterilizada y un flujo ascendente de recirculación continuo (1.68 mL s-1) durante 21 h d-1. Cada unidad tenía cuatro cilindros de PVC con un fondo de malla plástica; se colocaron 13 juveniles cilindro-1 y 52 juveniles unidad-1. La temperatura y la salinidad fueron de 23.5±0.5°C y 37±0.5 UPS, respectivamente. Los desechos orgánicos se eliminaron diariamente drenando no más del 60% del agua para reducir variaciones ambientales. Los moluscos se alimentaron de la manera descrita anteriormente.
Los tratamientos se añadieron directamente al agua de mar durante 21 días (100 µL L-1) deteniendo el flujo de agua y el alimento durante tres horas para favorecer su absorción en tejidos epiteliales y branquiales. Al final del ensayo, se registró el crecimiento y supervivencia y se tomaron muestras para metagenómica de cada tratamiento y sus tres réplicas.
Análisis de la microbiota. El ADN bacteriano se extrajo en dos tiempos: 24 muestras al principio (T0) y 192 al final (T21) del bioensayo (ocho individuos réplica-1; 24 individuos tratamiento-1). El TGI de cada individuo fue fijado individualmente (100 mg de tejido en 500 µL de RNA-Later®) y se conservaron a -20°C.
Extracción de ADN y secuenciación de Illumina MiSeq. El tejido del TGI de cada individuo (216 muestras) se homogenizó por separado utilizando el homogenizador FastPrep, (MP Biomedicals®) a alta velocidad (6 m s-1) durante 30 s en 500 μL de tampón TE (50:50 Tris: EDTA, pH 8), seguido de la adición de 20 μL de SDS al 10% e incubación a 56°C durante 30 min. Luego, se agregaron 250 μL de acetato de potasio 7.5 M a las células lisadas y la mezcla se incubó en hielo durante 15 min.
Después de centrifugar el lisado celular a 8000 g a 4ºC durante 10 min, la fase acuosa se extrajo con fenol: cloroformo: alcohol isoamílico (25:24:1) y se centrifugó. La fase acuosa resultante se extrajo con cloroformo: alcohol isoamílico (24:1) y se centrifugó. Posteriormente, se agregó al sobrenadante 350 μL de isopropanol frío, seguido de la incubación durante toda la noche a -20°C y la recolección de ADN mediante centrifugación. El sedimento de ADN se lavó dos veces con etanol frío a 70oGL, se centrifugó, se secó al aire y se resuspendió en 20 μL de agua libre de nucleasa 22.
Los ADN de cada réplica se mezclaron después de la extracción para un total de 27 muestras. La concentración y la calidad del ADN se determinaron a A260 nm y A280 nm a través del espectrofotómetro NanoDrop (NanoDrop 8000, Thermo Scientific®) y la electroforesis en gel de agarosa al 1.5% (p/v), utilizando el indicador Sybr Safe® (Invitrogen). El ADN total de cada muestra individual, se diluyó en agua libre de nucleasas hasta una concentración final de 100 ng µL-1 y se usó para amplificar ±700 pb de la región hipervariable V3-V5 del gen 16S rRNA (posiciones 339 y 939 de Escherichia coli).
La amplificación se realizó con los cebadores universales 357F (5’-CTCCTACGGGAGGCAGCAG-3’) 23 y CD [R] (5′-CTTGTGCGGGCCCCCGTCAATTC-3’) 24. Los amplicones de PCR resultantes se secuenciaron a través del formato 2x300 de la plataforma de secuenciación Illumina MiSeq del Laboratorio Nacional de Genómica y Biodiversidad (LANGEBIO-CINVESTAV) en Irapuato, Guanajuato, México.
Análisis filogenético. Las secuencias se procesaron utilizando el software clasificador RDP (Ribosomal Database Project) con una calidad de secuencia promedio (Phred quality score) >30 y un umbral de similitud (Confidence Cutoff) del 80%, capaz de clasificar las secuencias a nivel de género. La base de datos de genes 16S rRNA de Green (http://greengenes.lbl.gov “Green genes 16S”) se utilizó para la clasificación taxonómica en filo, clase, orden, familia y género, y sólo en algunos casos a nivel de especie. El análisis bioinformático fue realizado por LANGEBIO-CINVESTAV, México.
Se utilizaron las estimaciones de software para el análisis estadístico V.9.1.0 25 para calcular los índices de diversidad de Shannon-Weaver (H) y Simpson (J), así como las estimaciones de riqueza de Chao y para generar las curvas de rarefacción. El software XLSTAT versión 2016.05.33324 (Addinsoft 1995-2016) se usó para comparar comunidades microbianas y tratamientos a través del Análisis de componentes principales (ACP) 26 y para detectar diferencias en la abundancia del filotipo y el tratamiento mediante un análisis de varianza de una vía (ANOVA) y la prueba de comparación múltiple de Tukey. Sólo aquellos componentes principales con valores altos (>1.0) se consideraron estadísticamente significativos.
Accesibilidad a los datos. Las secuencias generadas en este estudio fueron descargadas en el Archivo de Lectura de Secuencias NCBI (SRA) con la clave: Bioproject PRJNA341370 y el número de acceso SRA: SRP089926.
RESULTADOS
Crecimiento y supervivencia. No se encontraron diferencias significativas en la tasa de crecimiento en peso (aumento de peso diario; g d-1) entre los grupos tratados con homeopatía y los grupos control, pero se detectaron diferencias significativas en la tasa de crecimiento en longitud de la concha (Figura 1A). La tasa de crecimiento más alta (p<0.05) correspondió a T1 (117 µm d-1) y T2 (108 µm d-1) comparados con C1 (14 µm d-1), C2 (34 µm d-1) y C3 (20 µm d-1). Los tratamientos homeopáticos T3 y T5 mostraron la mayor supervivencia (p<0.05) (95% y 94%, respectivamente) en comparación con los tratamientos control C1 (88%) y C3 (85%), (Figura 1B).
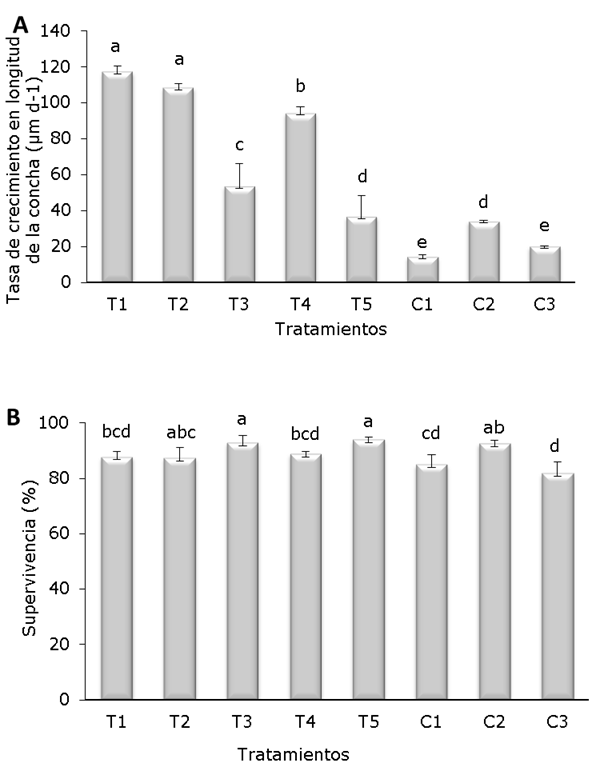
Figura 1 Tasa de crecimiento (A) y supervivencia (B) de A. ventricosus tratados con medicamentos homeopáticos (HOM) durante 21 días. Los valores son medias ± intervalos de confianza al 95%. Letras diferentes denota diferencias significativas (p<0.05).
Análisis de la diversidad alfa. La secuenciación del gen 16S rRNA amplificada por PCR, de la microbiota asociada al TGI de A. ventricosus generó 21,717,584 lecturas con 80% de clasificación de 27 amplicones. Se demostró que el número de Unidades Taxonómicas Operacionales UTOs fue homogéneo y tuvo una gran riqueza con un número de UTOs/Chao-1 de alrededor de 699/779 y 703/768 para los grupos tratados y controles, respectivamente, mientras que el grupo control inicial (T0) al inicio del experimento exhibió el valor más alto de 689/985 (Tabla 1). Los índices de Shannon-Weaver (H′) y Simpson (1-λ) también mostraron una alta y homogénea diversidad para todos los grupos experimentales.
Tabla 1 Análisis de secuencias y estimación de la diversidad alfa de la microbiota asociada con A. ventricosus tratados con medicamentos homeopáticos (HOM).
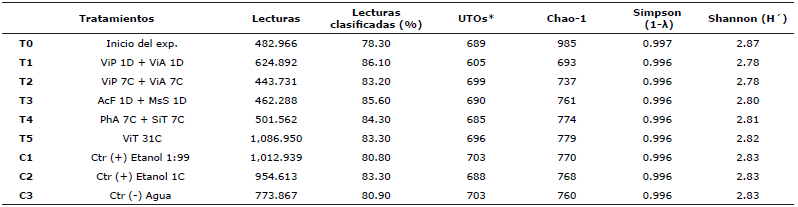
UTOs: Unidades Taxonómicas Operacionales *Base de datos http://greengenes.lbl.gov “Greengenes 16S”.
Aunque las curvas de rarefacción no alcanzaron la fase asintótica, se detectó una clara separación y diferenciación entre las curvas de rarefacción correspondientes a los grupos tratados con HOM y los grupos sin tratar. Como excepción, la curva de rarefacción de la dinamización baja (decimal) del tratamiento homeopático T1 (ViP 1D + ViA 1D) se agrupó junto con T5 y los tratamientos control (Figura 2). Los grupos C1, C2, C3, T1 y T5 alcanzaron la fase asintótica, mientras que T0, T2, T3 y T4 no la alcanzaron claramente. Por lo anterior, se asume que varias UTOs permanecieron sin ser detectadas en estos grupos.
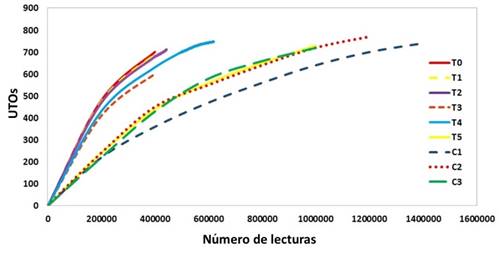
Figura 2 Curvas de rarefacción de la microbiota del tracto gastrointestinal (TGI) asociada a tratamientos homeopáticos (HOM) en juveniles de la escalopa marina A. ventricosus.
Composición de la microbiota. El análisis filogenético mostró la presencia de 32 filos, 68 clases, 134 órdenes, 295 familias, 894 géneros y 3241 especies entre todos los grupos experimentales. La composición microbiana asociada al TGI de A. ventricosus, basada en una abundancia relativa >1%, estuvo dominada por los filos Proteobacteria (≈29%), Actinobacteria (≈20%), Firmicutes (≈12%), Bacteroidetes (≈6.0%), Cianobacterias (≈3.0%) y Cloroflexi (≈1.3%), (Figura 3). En general, todos los grupos experimentales presentaron filos dominantes similares con diferencias significativas (p≤0.05) para Proteobacterias, entre T0 (34.9%) y T4 (26.1%), y para Actinobacteria, entre T0 (22.9%) y T4 (18.7%) (Figura 3).
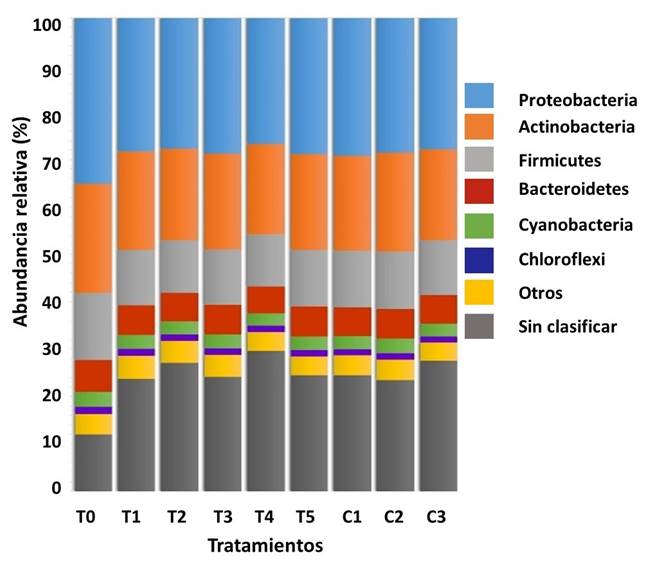
Figura 3 Abundancia relativa (%) de filos dominantes (≥ 1%) en el TGI de A. ventricosus después del tratamiento con diferentes medicamentos homeopáticos (HOM).
Proteobacterias estuvo dominada por las clases α- (≈11%), β- (≈8%), γ- (≈6%, p≤0.001) y δ- (≈4%, p≤0.05). Las diferencias significativas entre T0 y todos los otros grupos se registraron para la clase γ-Proteobacteria. También se detectaron diferencias significativas entre T0 y los tratamientos T2, T3 y T4 para la clase δ-Proteobacteria (Figura 4).
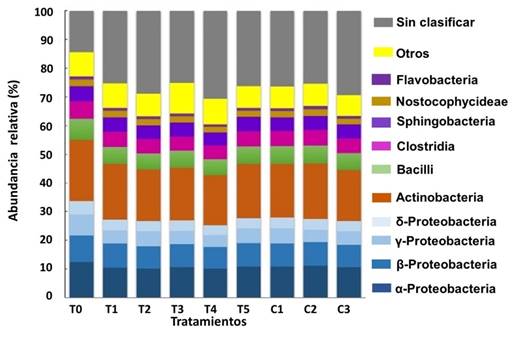
Figura 4 Abundancia relativa (> 1%) a nivel de clase y Proteobacterias asociadas al TGI de A. ventricosus tratados con diferentes medicamentos homeopáticos (HOM).
Symbiobacterium fue el único género, entre todos los géneros dominantes, que presentó diferencias significativas (p≤0.05) entre los individuos tratados con homeopatía (T5, la más abundante) y los no-tratados al inicio del bioensayo (T0, la menos abundante). Otros géneros con una abundancia relativa dominante ≤1% se incluyeron Microbacterium> Methylobacillus> Bacillus> Paenibacillus> Burkholderia> Nostoc> Methylobacterium> Leucobacter (Figura 5).
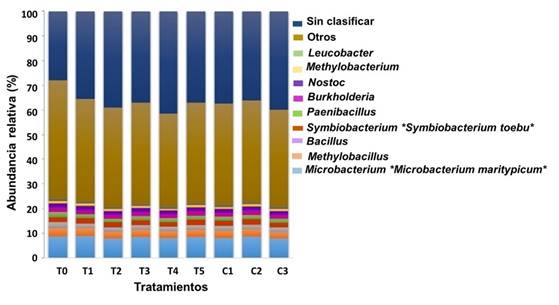
Figura 5 Abundancia bacteriana relativa (> 1%) a nivel de géneros y especies de la microbiota del TGI asociada a vieira marina A. ventricosus bajo tratamientos homeopáticos (HOM) según el análisis de varianza (ANOVA) y la prueba de comparación múltiple de Tukey. (*) Significa diferencia significativa p ≤ 0.05.
A nivel de especie, Microbacterium maritypicum (Actinobacteria) mostró una mayor abundancia relativa (p≤0.05) en individuos tratados con homeopatía que recibieron T1 y T3, contra los no tratados al inicio del bioensayo (T0). Symbiobacterium toebii (Firmicutes) fue la otra especie cuya abundancia fue significativamente mayor (p≤0.05) en T5 y T2 con respecto a T0 (Figura 5).
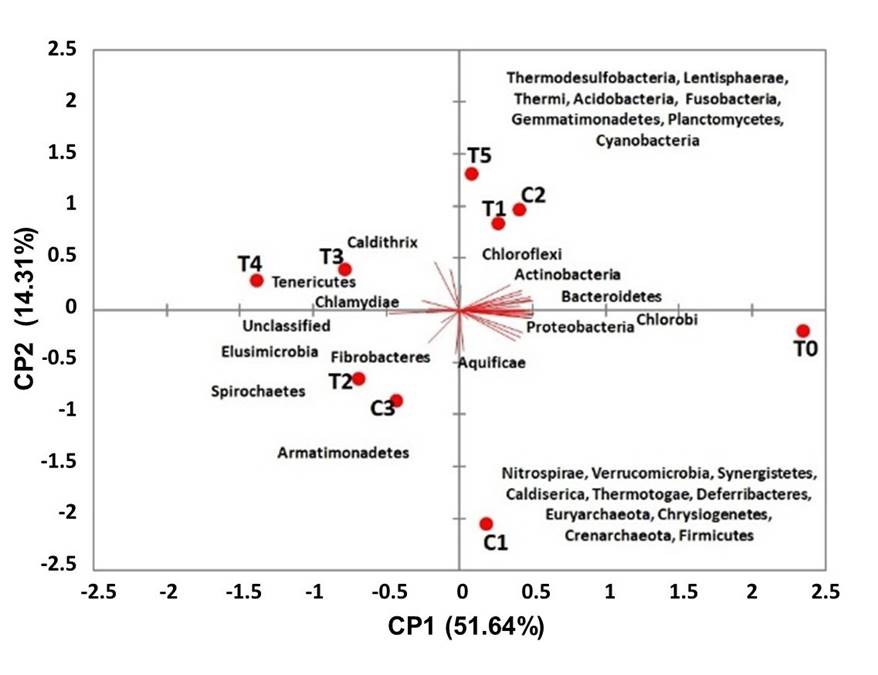
La variación en la composición de la microbiota mediante el Análisis de los Componentes Principales (ACP), de los organismos tratados con diferentes medicamentos homeopáticos puede explicarse por dos componentes principales (CP1 = 51.64%; CP2 = 14.31%) con una varianza acumulada de 65.95%. Los tratamientos T2, T3, T4 y C3 control se encontraron en la CP1 negativa asociada a los filos Spirochaetes, Fibrobacteres, Tenericutes and Chlamydiae, y otros filos menos abundantes, mientras que T0, T1, T5 y el control C2 se encontraron en la CP1 positiva asociada con los filos Proteobacterias, Actinobacterias, Bacteroidetes, Firmicutes, Cianobacterias y otros filos menos abundantes. Estos resultados coincidieron con la abundancia relativa y la composición a nivel de filo descrita anteriormente (Figura 6).
DISCUSIÓN
Las enfermedades relacionadas con las bacterias y los virus causan grandes mortalidades y pérdidas económicas globales en la industria de la acuicultura, e incluso pueden afectar a las poblaciones naturales de moluscos, crustáceos y peces. Las bacterias están presentes de forma natural en la microbiota del TGI de los animales, incluidos los moluscos bivalvos; algunas especies o cepas son patógenos facultativos que pueden atacar a los animales susceptibles. Los moluscos pectínidos, como la almeja Catarina A. ventricosus que son filtro alimentadores pueden convertirse en reservorio de patógenos potenciales transmisibles a otros organismos de la misma o diferente especie, incluido el hombre 27.
En este estudio, la almeja juvenil A. ventricosus tratada con nosodes homeopáticos T1 (ViP 1D + ViA 1D) y T2 (ViP7C + ViA7C) mostró diferencias significativas en la tasa de crecimiento en longitud de la concha (μm d-1) con respecto a los grupos control (p<0.05). Los nosodes son preparaciones homeopáticas de amplio espectro, muy utilizadas y provenientes de material biológico como cultivos o muestras clínicas de microorganismos (por ejemplo, bacterias, hongos y virus), de parásitos, tejidos enfermos (tejidos cancerosos), o de productos en descomposición de humanos o animales 28.
Kiarazm et al 29 realizaron un estudio en vacas con mastitis subclínica y al tratarlas con una combinación de medicinas homeopáticas desarrolladas a partir de nódulos, observaron un menor recuento de células somáticas y una reducción en las bacterias aisladas respecto al grupo control. Carmelink et al 30 demostraron que el agente homeopático Coli 30K es una alternativa potencial atractiva en la prevención de la diarrea por E. coli en lechones. Mazón-Suástegui et al. 16, demostraron el efecto de T2 sobre la respuesta inmune y antioxidante de Seriola rivoliana
La mayor tasa de supervivencia correspondió a los tratamientos T3 y T5 con respecto al grupo control C3. El tratamiento homeopático T3 consistió en dinamizaciones decimales de soluciones concentradas (TMs) de metasilicato de sodio y ácido fosfórico. En ratas, la adición de metasilicato de sodio tiene una acción benéfica en cantidades o concentraciones fisiológicas susceptibles, porque la sílice influye en la compleja red de interacción de citoquinas que regula la respuesta inmune 31.
La nutrición es el factor ambiental más importante que interactúa con otros procesos del cuerpo, y también tiene una profunda influencia en los mecanismos de defensa inmunológica. Los niveles deficientes o excesivos de nutrientes pueden alterar el sistema inmunológico y se refleja no sólo en efectos medibles en diversas funciones inmunitarias ensayadas in vivo o in vitro, sino también en procesos de enfermedades, como infecciones 32.
El fósforo tiene una amplia gama de funciones en el metabolismo animal, y el ácido fosfórico homeopático es apropiado para tratar afecciones gastrointestinales relacionadas con desnutrición y mala asimilación de los alimentos; también se utiliza cuando existen problemas de agotamiento y pérdida de vigor, y se ha relacionado con la mejora del desempeño general de A. ventricosus14. La interacción sinérgica entre metasilicato de sodio y ácido fosfórico en dilución homeopática decimal (1D) incrementó la respuesta inmune en juveniles de A. ventricosus; cuando este tratamiento se aplicó en una dinamización centesimal (7C) no mostró un efecto claro sobre la respuesta inmune en esta especie, pero aumentó sus reservas energéticas en manto, músculo y glándula digestiva, que son importantes tejidos de almacenamiento de energía en moluscos bivalvos. 29.
El tratamiento T5 es un medicamento homeopático comercial (Vidatox®) para uso humano, cuyo principio activo es el veneno del escorpión rojo Rhopalurus junceus, una especie endémica de Cuba. Las propiedades antitumorales atribuidas al Vidatox® se han demostrado a través de varios estudios preclínicos 33. Según Mazón-Suástegui et al 15, aumentó la supervivencia y la inmunidad del camarón blanco juvenil Litopenaeus vannamei retado con una cepa patógena de Vibrio parahaemolyticus.
La microbiota asociada al TGI es un factor clave para el desarrollo de la inmunidad y la nutrición del hospedero 21. La mayoría de esas bacterias pueden ser representativas de la microbiota del ambiente circundante 22 y son relevantes para reducir la vulnerabilidad del huésped contra los patógenos y las enfermedades infecciosas relacionadas 22-24. En este estudio, los valores del índice de Shannon mostraron valores similares en todos los grupos experimentales de 2.75 a 2.83, lo que indica que la microbiota asociada con estos organismos fue diversa en todos los grupos.
En un estudio realizado por Trabal-Fernández et al 11 se demostró que la microbiota asociada a semillas (juveniles) de ostra fue más diversa que la asociada a los adultos de la misma especie. En este sentido, la madurez del TGI puede influir en la composición de la microbiota en organismos marinos 34.
Proteobacterias fue el filo dominante del TGI de A. ventricosus, tanto en los grupos tratados como en los controles, seguido de Actinobacteria y Firmicutes. También se encontró que este filo fue predominante en estadios juveniles y adultos tempranos y avanzados de las ostras C. corteziensis, C. gigas y C. sikamea11; en los estadios larvales de C. gigas35, C. virginica36, Haliotis discus37, Patella pellucida38 y Patinopecten yessoensisis39, en peces como Oncorhynchus mykiss y en camarón L. vannamei40.
La mayoría de las clases dentro de las Proteobacterias, juegan un papel importante en los moluscos bivalvos, ya que son capaces de degradar la celulosa y el agar, los cuales son componentes principales de sus alimentos, y además, fijan el nitrógeno en el TGI en los bivalvos 41. Nuestros resultados concuerdan con los de Lasa et al 42 quienes informaron que Proteobacteria fue el filo más abundante en moluscos ostreidos. En este estudio, Actinobacteria fue el segundo filo con la abundancia relativa más alta. Algunos de sus miembros producen metabolitos secundarios los cuales pueden proteger y beneficiar al huésped contra varias infecciones 43, y juegan un papel importante en la mineralización de la materia orgánica, la inmovilización de nutrientes minerales, la fijación de nitrógeno y la protección del medio ambiente, además de su actividad celulolítica 44 y quitinolítica 45.
Firmicutes fue el tercer filo más abundante (≈12%) en el TGI de A. ventricosus en todos los grupos experimentales, con una abundancia relativa menor a la de los dos filos anteriores. Firmicutes es un grupo altamente relevante en ambientes acuáticos y se encuentra en la microbiota de los ostreidos 11, el cual está involucrado en procesos enzimáticos complejos, como la degradación y fermentación de los polisacáridos 46. El mismo es dominante en el TGI de los organismos herbívoros donde algunas especies, como Lactobacillus, pueden estimular el sistema inmunológico y proteger al hospedero de la invasión y el establecimiento de patógenos 47.
Las clases dominantes en este estudio fueron Alfa- y Betaproteobacterias; las Alfaproteobacterias son dominantes en los ambientes marinos 48, (Figura 4). Nuestros resultados coincidieron con los de Trabal-Fernández et al 11, quienes informaron que las Proteobacterias son las más abundantes en ostras; sin embargo, en la etapa juvenil temprana, Alpha- y Gammaproteobacteria fueron más abundantes, mientras que en adultos, la clase más abundante fue Gammaproteobacteria, seguida de Beta- y Alphaproteobacteria.
Los géneros predominantes en el TGI de juveniles de A. ventricosus fueron Symbiobacterium y Microbacterium, seguido por Methylobacillus, Bacillus, Paenibacillus, Burkholderia, Nostoc, Methylobacterium y Leucobacter, comúnmente en el medio marino 42. Symbiobacterium fue dominante (p≤0.05) en el tratamiento T5 (Vidatox®), el cual estimula el sistema inmune. Symbiobacterium sp. es un género muy extendido en el entorno natural, pero el conocimiento limitado en la sistemática de este género dificulta su aislamiento 49.
Las conchas de las ostras son una fuente común de Symbiobacterium sp. y otras bacterias relacionadas con su crecimiento 50. Ishii et al 51 infirieron que este grupo de bacterias puede jugar un papel importante en el ciclo del nitrógeno en ambientes anaeróbicos, por tanto, son beneficiosas ya que participan en la fijación de nitrógeno, favoreciendo la nutrición de los organismos marinos.
A nivel de especie, Microbacterium maritypicum fue más abundante (p≤0.05) en T1 y T3 con respecto a los controles. Esta bacteria produce sideróforos, los cuales pueden inhibir el crecimiento de patógenos oportunistas que carecen de la capacidad de producir hierro 52. El hierro es un metal bioactivo limitante en el agua de mar, pero es esencial para el crecimiento de bacterias marinas 53, por lo que estos tratamientos con homeopatía pueden contribuir a reducir los patógenos.
Los tratamientos homeopáticos T2 y T5 incrementaron la abundancia de Symbiobacteriun toebii con respecto a T0 (p≤0.05). Las especies de Symbiobacterium son simbióticas 54, pero también muestran un crecimiento mono-marcado si el CO2 o el bicarbonato están disponibles 55. Joong-Jae et al. 54 mostraron que Geobacillus kaustophilus, Escherichia coli y Bacillus subtilis tuvieron efectos sobre el crecimiento de S. toebii, indicativo de que existen factores promotores del crecimiento ampliamente presentes en diversas cepas bacterianas.
Como conclusión, se ha descrito por primera vez la composición y diversidad de la microbiota gastrointestinal de A. ventricosus, con predominio de los filos Proteobacteria, Actinobacteria y Bacteroidetes. La medicación homeopática promovió el crecimiento y la supervivencia en juveniles, pero también la proliferación de Microbacterium maritypicum (T1, T3) y Symbiobacterium toebii (T2, T5). Esto permite asumir que la homeopatía acuícola tiene potencial para modular la microbiota del TGI y mejorar la producción de semillas en el laboratorio.











 text in
text in