INTRODUCCIÓN
La repercusión económica por problemas de enfermedades digestivas en los rumiantes en México es grave y frecuente. Los síntomas patológicos que presentan los rumiantes bajo ese estrés son: bajo consumo de alimento, presencia de diarreas (o disentería), acidosis ruminal, laminitis, cojera, retraso en el desarrollo corporal de corderos, cabritos y terneros 1. Esto se traduce en un costo extra que el productor no tiene contemplado, además, de los gastos en tratamientos veterinarios 2.
En los sistemas de producción intensivos, el índice de corderos muertos por enfermedades digestivas antes del destete llega a ser menor al 10%, mientras que en sistemas extensivos las pérdidas representan hasta un 53% de los corderos nacidos 3. No obstante, en diversos reportes se menciona que los procesos infecciosos y los trastornos de tipo nutricional y metabólicos representan la principal causa de mortalidad neonatal 4. De hecho, entre un 15 y 20% de las pérdidas neonatales pueden ser atribuidas a enfermedades digestivas, y en consecuencia, el resto (alrededor de 80%) se deben a factores ambientales o de manejo 3.
Los Centros para el Control y Prevención de Enfermedades (CDC por sus siglas en inglés) del Departamento de Salud y Servicios Humanos de los Estados Unidos de América mencionan que Escherichia coli es una bacteria que normalmente vive en los intestinos de personas y animales. En su mayoría son inofensivas y en realidad son parte del tracto intestinal sano. Sin embargo, algunos serotipos son patógenos, causando diarreas o enfermedades fuera del tracto intestinal 5.
Escherichia coli se clasifica en seis serotipos que se asocian con diarrea; entre estos se encuentra Escherichia coli enterohemorragica (EHEC), la cual es causante de colitis hemorrágica (HC) y se identifica mediante la producción de toxinas Shiga (Stxs). Escherichia coli productora de toxinas Shiga (STEC) es un grupo de patógenos zoonóticos y Escherichia coli O157:H7 es el serotipo asociado con colitis hemorrágica y síndrome urémico hemolítico (HUS), principalmente en los Estados Unidos de América 6.
Laven et al 7 demostraron que la presencia de Escherichia coli en rumiantes fue más alta en el colon que en el rumen, asociándose la presencia de Escherichia coli con la fase de ingesta y no con la pared intestinal del rumen. Estudios han demostraron que la parte terminal del colon es el principal sitio de desarrollo de la colonización de Escherichia coli O157:H7 y que el tejido linfoide localizado en la unión recto-anal es el sitio de la colonización en el ganado 8, por lo que, esta colonización es considerada como un “super-propagador” que causa severas infecciones con cuadros epidémicos caracterizados por diarreas hemorrágicas, colitis y síndrome urémico hemolítico 9.
El aislamiento adecuado y los métodos de identificación son cruciales para diagnosticar Escherichia coli O157:H7. Antes de confirmar su presencia en una muestra es necesario aislarla e identificarla en medios de cultivos selectivos y diferenciales. Los medios usados convencionalmente para el aislamiento de Escherichia coli O157:H7 incluyen Sorbitol MacConkey Agar (SMAC), CefiximeTellurite Sorbitol MacConkey Agar (CT-SMAC), CHROMagarTM O157 (CHROMagar), Tellurite CHROMagarTM O157 (T-CHROMagar) y Vancomicina Cefixima Cefsoludina CHROMagarTM O157 (VCCCHROMagar) 6,10.
Los sustratos químicos cromogénicos patentados para la identificación de colonias microbianas desencadenaron el desarrollo de una amplia gama de medios para la detección de patógenos. El medio CHROMagarTM O157 promueve selectivamente el crecimiento de Escherichia coli O157:H7 y la diferencia de Escherichia coli no O157, debido a un sustrato cromogénico de β-galactosidasa y un cambio en el pH 6, utilizándose este medio para la detección de Escherichia coli O157:H7 tanto en muestras alimentarias como ambientales, pudiendo ser más selectivo con la adición de tellurita de potasio, o bien con vancomicina, cefixima y cefsoludina 11.
Bajo el contexto anterior, se planteó como objetivo identificar Escherichia coli O157:H7 en heces diarreicas de rebaños de rumiantes lactantes menores a 21 días de vida mediante el uso del agar CHROMagarTM, lo que permitirá a los ganaderos tomar decisiones sobre los tratamientos a emplear para evitar la incidencia de este patógeno y disminuir la mortalidad neonatal.
MATERIALES Y MÉTODOS
Muestras. Se obtuvieron 316 hisopados rectales provenientes de 183 ovinos, 66 de caprinos y 67 de bovinos menores de 21 días de edad y con la seguridad de haber ingerido calostro, con presencia de síndrome diarreico. La colecta de las muestras se realizó vía rectal con un hisopo estéril, se etiquetaron y transportaron en medio Stuar® elaborado en México D.F. El muestreo se realizó durante el período de agosto 2015 a marzo de 2016 en cuatro municipios del estado de Zacatecas: en Calera de Víctor Rosales las localidades El Bordo, Noria de Agostadero, El Duraznillo, El Vergel y El Porvenir: en Morelos las localidades de Hacienda Nueva, Noria de Gringos, Las Pilas y El Palmar: en General Enrique Estrada, las localidades de General Enrique Estrada, Los Ángeles, Puentecillos y San Sebastián y: en Río Grande las localidades El Carrizal, Los Ramírez, San José de Ranchitos y Tierra Blanca (Figura 1). (Coordenadas: El Bordo 102°49’20”O 22°57’02”N, San José de Ranchitos 102°57’35”O 23°40’0”N, El Carrizal 103°01’08”O 23°38’25”N, El Duraznito 102°38’26”O 23°01’29”N, El Palmar 102°39’58”O 22°53’24”N, El Porvenir 102°40’00”O 22°56’42”N, El Vergel 102°41’01”O 22°59’58”N, General Enrique Estrada 102°44’29”O 22°59’40”N, Hacienda Nueva 102°36’21”O 22°49’30”N, Las Pilas 102°36’46”O 22°50’24”N, Los Ramírez 103°01’52”O 23°50’49N”, Los Ángeles 102°43’22”O 22°58’43”N, Noria De Agostadero 102°46’59”O 22°53’14”N, Noria de los Gringos 102°43’04”O 22°50’53”N, Puentecillos 102°45’03”O 23°02’47”N, San Sebastián 102°47’54”O 23°03’37”N, Tierra Blanca 103°04’36”O 23°49’38”N)
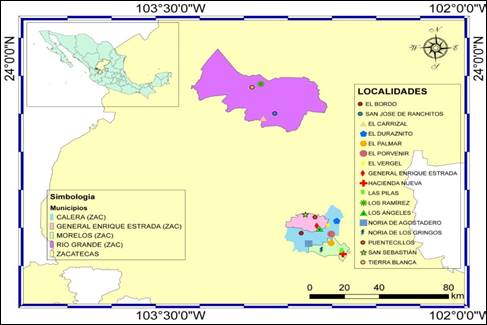
Figura 1 Ubicación geográfica de las localidades muestreadas en los cuatro municipios del estado de Zacatecas.
Cultivo de bacterias Gram negativas. Los cultivos se realizaron por duplicado. Cada muestra se sembró en caja petri con agar MacConkey (SMAC) las cuales fueron incubadas en una estufa bacteriológica a 37°C por 48 horas 12. Las colonias rosas cremosas se tomaron como positivas y éstas se aislaron individualmente para su posterior resiembra.
Identificación de bacterias en medio cromogénico CHROMagarTM. Después de que las bacterias fueron aisladas en agar MacConkey se tomó una colonia para la identificación del serotipo de Escherichia coli O157:H7 o su variante no-móvil O157:H (serotipo VTEC), que es más común en salud pública. Se realizó la resiembra por estría en placa en medio cromogénico CHROMagarTM y se incubó a 37°C durante 24 horas 13, (Tabla 1).
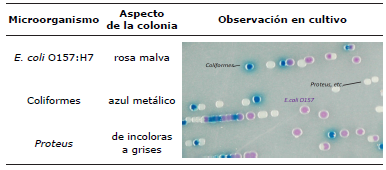
Las colonias de Escherichia coli O157:H7 crecen en CHROMagarTM O157 y producen un color rosa malva debido a sustratos cromogénicos en el medio, permitiendo así, la identificación presuntiva de la placa de aislamiento primario y la diferenciación de otros organismos 13, (Tabla 1).
Análisis estadístico. Los datos experimentales se analizaron primero con estadística descriptiva y después se empleó una tabla de clasificación o tabla de contingencia. Se utilizó la prueba estadística Chi-cuadrada, esta es una estadística que permite determinar el grado de independencia entre las variables. El supuesto de esta prueba es: Ho: La prevalencia de las bacterias es independiente del tipo de rumiante que sea el portador; Ha: La prevalencia de las bacterias es dependiente del tipo de rumiante que sea el portador. El índice más importante de esta prueba es el valor p. En general, con valor p menor de 0.05 se rechaza Ho y se concluye que las bacterias no son independientes. Todo el proceso estadístico se ejecutó con SPSS 25.0 para Microsoft Windows.
RESULTADOS
La determinación de Escherichia coli 0157:H7 se realizó con un medio cromogénico CHROMagarTM diferenciando las colonias bacterianas por color; Escherichia coli O157:H7 presentó coloración rosa malva, Proteus ssp., son de incoloras a grises y los coliformes muestran colonias azul metálico como se puede apreciar en la figura 2.
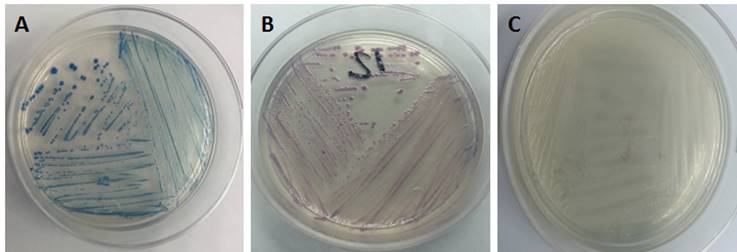
Figura 2 Desarrollo de las bacterias en CHROMagarTM. A) Coliformes, B) E. coli O157:H7 y C) Proteus spp.
Algunas muestras presentaron desarrollo de dos o más colonias con distinta morfología y coloración, por lo que el número total de las colonias de bacterias identificadas fue de 354 y en 25 casos no hubo desarrollo en 24 horas, a pesar de que se encontró desarrollo en agar MacConkey y colonias con morfología descriptiva para Escherichia coli no hubo desarrollo en CHROMagarTM.
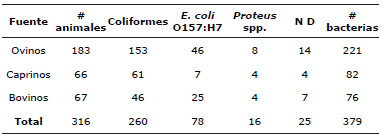
Se identificaron 260 coliformes, 78 Escherichia coli O157:H7 y 16 Proteus spp., en el total de los rumiantes muestreados, de los cuáles 183 fueron ovinos donde se encontró que en 46 de ellos había presencia de Escherichia coli O157:H7, en caprinos se encontraron 7 de 66 y en bovinos 25 de 67 como se muestra en la tabla 2. Además, usando la prueba Chi-cuadrado se comprobó que la prevalencia de las bacterias (coliformes, Escherichia coli O157:H7 y Proteus spp) depende del tipo de rumiante (ovino, bovino y caprino) que sea el portador de la bacteria (Tabla 3).
Tabla 3 Tabla de contingencia: tipo de bacteria vs tipo de rumiante.
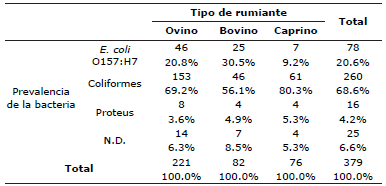
Ho: La prevalencia de las bacterias es independiente del tipo de rumiante que sea el portador; Ha: La prevalencia de las bacterias es dependiente del tipo de rumiante que sea el portador. Valor de Chi-cuadrada de Pearson=13.243. gl=6; p=0.039. Como el valor de p≤0.05 se rechaza Ho. N.D.: No Determinados.
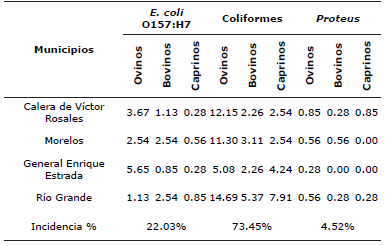
La distribución de bacterias encontradas según su localización geográfica corresponden a: 18 Escherichia coli O157:H7, 60 Coliformes y 7 Proteus ssp., en el municipio de Calera de Víctor Rosales; 40 Escherichia coli O157:H7, 11 Coliformes y 9 Proteus ssp., en localidades de Morelos, 24 Escherichia coli O157:H7, 41 Coliformes y 1 Proteus ssp., en localidades de General Enrique Estrada y 16 Escherichia coli O157:H7, 99 Coliformes y 4 Proteus ssp., en localidades del municipio de Río Grande (Tabla 4).
La mayor incidencia de bacterias fueron las coliformes con el 73.45% en los cuatro municipios, seguida de Escherichia coli O157:H7 con el 22.03% y de Proteus el 4.52% (Tabla 5). Con estos resultados los ganaderos de la región están en condiciones de tomar la mejor decisión de prevención sobre el o los tratamientos que disminuyan la incidencia de este patógeno y con ello la mortalidad de rumiantes lactantes.
DISCUSIÓN
La presencia de la Escherichia coli O157:H7 en bovinos debe tenerse en consideración como un posible problema de salud pública, ya que esta bacteria está presente en las heces y esto constituye una fuente de infección para el hombre. En el proceso de sacrificio del animal, el refrigerado de la canal y también en el ordeño, es posible la contaminación de la carne y la leche respectivamente 14.
Se ha reportado que la presencia de Escherichia coli O157:H7 en heces de bovino parece estar influenciada por la edad del animal 15. Por ejemplo, los terneros de menos de ocho semanas de edad (56 días) y novillas excretan más la cepa de Escherichia coli que el ganado adulto 16.
Escherichia coli O157:H7 se ha convertido en un problema importante para la salud humana principalmente en los Estados Unidos de América 6; Olvera et al 16 han referido que el ganado vacuno es el reservorio primario de la bacteria Escherichia coli O157:H7 causante de síndrome urémico hemolítico en humanos. En efecto, la canal proveniente del sistema de engorda de corral presenta la mayor incidencia de Escherichia coli verotoxigénica asociada al síndrome urémico hemolítico, en comparación con el sistema de pastoreo donde la vacunación redujo en un 54.1% la contaminación de esta bacteria en carne bovina.
Para diagnosticar este patógeno, el aislamiento adecuado y los métodos de identificación son cruciales. Existe poca información disponible sobre su prevalencia en el manejo vaca/becerro. Sin embargo, en Louisiana, Estados Unidos de América, se reporta 8% de prevalencia de este patógeno, sin diferencias significativas entre materia fecal, agua (de canal y estanques) y frotis de superficie (de la cubeta de agua y del comedero) como fuente de contaminación 6.
En la investigación realizada por Fox et al 18 encontraron una prevalencia general de 62%, más elevada que la obtenida en el presente trabajo (22.03%). La prevalencia de Escherichia coli O157:H7 en el ganado es variable entre cada individuo y cada rebaño, en el ganado estabulado se puede encontrar en un rango del 10 al 28%, pero puede ser más elevada, hasta el 80% en los meses de verano 19, el ganado vacuno es el más afectado, seguido de los ovinos 20, lo que indica que no hay selección de hospedero para Escherichia coli O157:H7.
Con el uso del CHROMagarTM ha sido posible determinar la incidencia de forma rápida con una sensibilidad en su identificación del 98% y una especificidad del 100% 13, siendo superior al agar MacConkey sorbitol que, aun teniendo la misma sensibilidad, su especificidad disminuye al 85% y posee una precisión del 86%. Este medio inicialmente se utilizaba sólo en la industria alimentaria para la liberación rápida de alimentos libres de patógenos, pero se ha probado para análisis de muestras clínicas y ha sido empleado en diversos estudios 6,14,21,22. Sin embargo, para una exactitud del método se deberá continuar con la investigación, enfocándola hacia la caracterización basada en la secuencia de ácidos nucleicos mediante procedimientos de PCR (reacción en cadena de la polimerasa) que apunten a los genes de la toxina shiga (stx1 y stx2), ya que BBL CHROMagar O157 no hace diferencia entre las cepas de Escherichia coli O157:H7 productoras y no productoras de toxinas 13.
En conclusión, las bacterias coliformes fueron las de mayor presencia en las muestras analizadas, sin embargo, no son consideradas como el agente causal de diarrea. La presencia de Escherichia coli O157:H7 fue la segunda bacteria con mayor porcentaje en las muestras de heces analizadas (22.03% de incidencia), lo cual no depende de la especie del rumiante, pero representa un factor de riesgo de muerte en rumiantes lactantes (menos de 21 días de nacidos) causando pérdidas económicas y riesgo para la salud de la población del estado de Zacatecas.











 text in
text in