INTRODUCCIÓN
Los leiomiosarcomas son neoplasias del tejido muscular liso de origen mesenquimal y son malignas, por lo tanto, se pueden presentar en cualquier lugar donde haya dicho tejido. Los leiomiosarcomas en caninos que se originan de la pared del tracto gastrointestinal representan entre el 10 y 30 % de los tumores intestinales y afectan a perros viejos 1,2. Con predilección por el sexo macho y reportados principalmente en el estómago 2, aunque incluyen también los del omento y mesenterio 3. Macroscópicamente, los tumores primariamente envuelven la túnica muscular y frecuentemente se extienden transmuralmente, algunas veces de manera exofítica 2. Cuando son seccionados, al corte la consistencia es firme y de color blanco-rosado, su superficie es lisa o lobulada, bien circunscrita y delimitada de los tejidos vecinos. Las metástasis principalmente son a bazo, mesenterio e hígado cuando su sitio primario de origen es el estómago y metástasis a nódulos linfáticos mesentéricos cuando su sitio primario es en el cólon 2.
Microscópicamente, son tumores altamente celulares, infiltrativos compuestos de fascículos arreglados de células ahusadas con citoplasma fibrilar eosinofílico y múltiples núcleos con un prominente nucléolo 1. Son haces de fibras musculares lisas en varias direcciones que se interceptan formando ángulos en donde hay gran cantidad de núcleos centrales elípticos, contienen 1 o 2 nucléolos. La mayoría de las células neoplásicas son elongadas, con núcleo redondo o largo, con atipia. Es de notar moderada cantidad de citoplasma eosinofílico fibrilar con bordes celulares indistintos, soportado por una matriz colagenosa densa separada por células individuales. Este tumor contiene áreas de necrosis multifocal, muchas áreas muestran contorno nuclear irregular, con cromatina vesicular y prominente nucléolo, con varias figuras mitóticas 4.
Histotecnia e inmunohistoquimica. Las muestras de tejidos fijadas en formalina tamponada al 10% fueron procesadas mediante métodos rutinarios para microscopía óptica y los cortes histológicos de 3-4 mm de grosor. Posteriormente, fueron teñidos con la coloración de Hematoxilina-Eosina (H&E). En algunos cortes se realizó la tinción especial de Tricrómica de Masson 5 y se hicieron estudios de inmunohistoquímica para citoqueratina CK5, actina de músculo liso, vimentina y KIT (CD117).
Presentación de caso. A la clínica veterinaria de la escuela de Medicina Veterinaria y Zootecnia de la Universidad de los Llanos, fue llevada un canino hembra de 5 años de edad, de raza Chow Chow, cuyo motivo de consulta fue aumento de la silueta abdominal y disminución del apetito tres meses antes de la consulta. Al examen clínico reveló los siguientes hallazgos anormales: mucosas pálidas, postración, liquido abdominal a la palpación, presencia de una masa en el epigastrio craneal de aproximadamente 15 cm, de consistencia dura, indolora, de superficie irregular y desplazable caudalmente. También se observó halitosis y cálculo dental generalizado.
Diagnósticos diferenciales. Dentro de los diagnósticos diferenciales se incluyeron tumores gastrointestinales de células fusiformes, leiomiomas, mesotelioma maligno fibroso predominantemente (células fusiformes), fibrosarcoma, tumor maligno de la vaina del nervio periférico.
Análisis clínico y de laboratorio. Se obtuvo una muestra de líquido peritoneal, que tuvo caracteristicas serosanguinolentas, turbio que no coaguló, con presencia de leucocitos, hematíes (80% crenados) y proteína. Fue clasificado como un exudado no purulento. El análisis sanguíneo demostró aumento de proteína plasmática total, globulinas y creatinina. Conteo celular sanguíneo mostró leucocitosis, anemia normocítica normocrómica, neutrofilia y trombocitopenia.
Una radiografía abdominal con proyección laterolateral del abdomen se realizó, mostrando radio opacidad generalizada y evidenciando la presencia de líquido en el abdomen (Figura 1A). Mediante ultrasonografía abdominal se observaron áreas anecóicas en la masa abdominal (Figura 1B), lo que sugería contenido liquido dentro del tumor, sin embargo, al examen no se pudo determinar en qué estructura se ubicaba la masa. Se realizó una laparotomía exploratoria, que reveló la ubicación de la masa, unida al mesenterio del intestino delgado. El paciente falleció al intentar retirar la masa debido a una hemorragia severa.
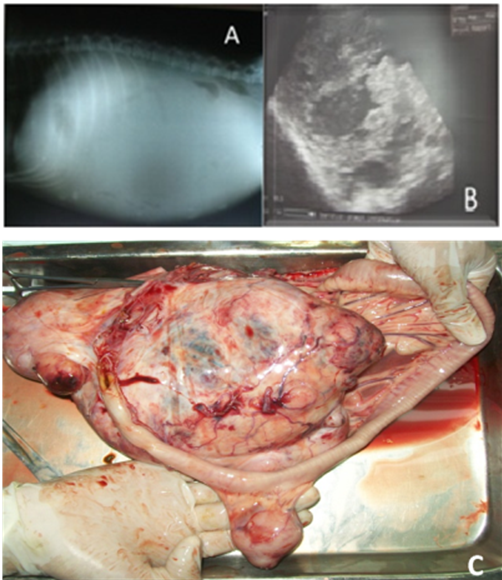
Figura 1 (A) Radiografía, vista lateral posterior del abdomen derecho. La radiodensidad revela líquido en la cavidad abdominal. (B) Ecografía abdominal. Las áreas anecóicas muestran la presencia de líquido dentro del tumor. (C) Vista macroscópica de la masa tumoral durante la necropsia.
Hallazgos patológicos. El canino fue tomado para necropsia. Se extrajo una masa tumoral que fue firme con superficie irregular. Medía unos 18 cm de largo por 13 cm de ancho (Figura 1C). Los ganglios linfáticos estaban edematosos. Se observó una gran vascularización tumoral, con un contenido sanguinolento no coagulado. Cuando se incidió la masa pareció tener una consistencia irregular.
Se evaluaron los hallazgos microscópicos con tinción de hematoxilina/eosina (H&E) en los que se observaron las siguientes características: Células neoplásicas con núcleo central hipercromático y pleomorfismo nuclear, en áreas desmoplásicas, con células de forma ahusada con núcleo alargado y oscuro, con un crecimiento infiltrativo e índice mitótico bajo (Figura 2, A y B).
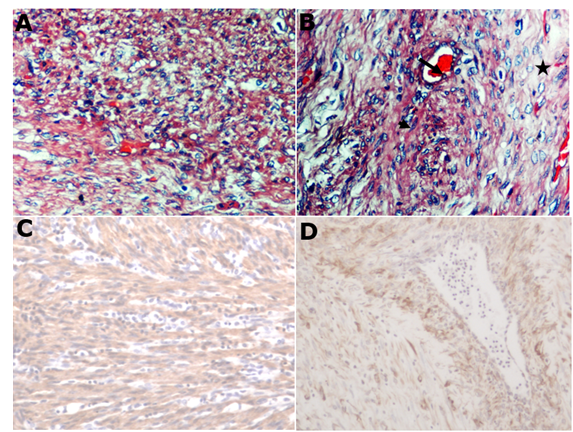
Figura 2 (A) Neoplasia intestinal, 40x H&E. (B) células pleomórficas en áreas desmoplásicas (*), mezcladas con células alargadas con núcleos grandes y oscuros (cabeza de flecha) y un crecimiento infiltrativo (flecha), 40x H&E. (C) Células neoplásicas agrupadas en haces. Actina del músculo liso: tinción inmunohistoquímica de (A), 10x. (D) Vimentina: tinción inmunohistoquímica de (B), 10x.
Las observaciones con hematoxilina y eosina no permitieron una clara diferenciación frente al tipo de tumor. Por lo que se hizo una tinción diferencial la de tricrómico de Masson (TM) en donde se determinó su origen mesenquimal.
Con los hallazgos observados en las tinciones con hematoxilina/eosina y TM se determinó que se trata de un tumor de tipo mesenquimal, la TM colorea las fibras de colágena de azul, las estructuras citoplásmicas, queratina, fibras musculares y fibras intercelulares de rojo y los núcleos negros o de púrpura. No obstante, decidimos investigar más a fondo el origen del tumor, ya que el color TM produjo alrededor de un 50% de tinción azul y un 50% de tinción roja. El siguiente paso fue realizar inmunohistoquímica, para alcanzar un diagnóstico definitivo y clasificar con precisión el origen del tejido por lo cual se hizo inmunohistoquímica para citoqueratina (CK5), para observar el mesotelio, ya que la ubicación del tumor estaba cerca del peritoneo, para descartar el mesotelioma anaplásico.
Como las muestras fueron negativas para CK5, se realizaron otras inmunohistoquímicas para actina, vimentina y antígeno KIT (CD117). De esta manera, se demostró que ambas proteínas estaban altamente expresadas en el tumor, como se observa en la figura 2 C y D y fueron negativas para KIT, como se observa en la figura 3.
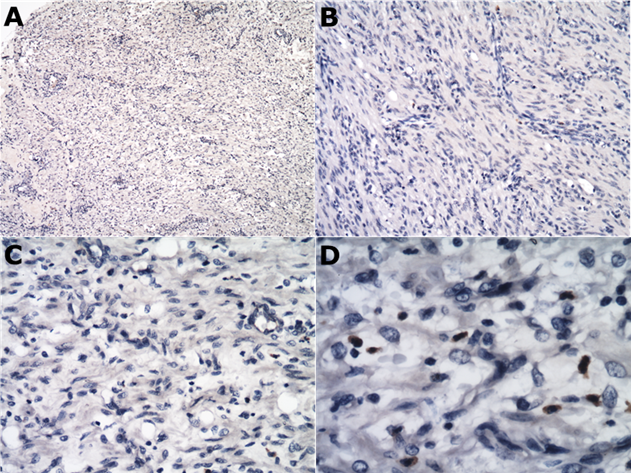
Figura 3 Tinción inmunohistoquímica para KIT (CD117), (A) Neoplasia intestinal, las células neoplásicas fueron negativas para el antígeno KIT (CD117). 4x. (B) Neoplasia intestinal, neoplasia de células fusiformes altamente celular compuesta de células fusiformes dispuestas en ondas y haces, fueron negativas para KIT, 10x. (C) Tinción inmunohistoquímica del antígeno KIT (CD117), 20x y (D); 40x.
DISCUSIÓN
De acuerdo con los signos clínicos y los resultados de las pruebas paraclínicas, el diagnóstico fue orientado hacia un síndrome paraneoplasico (SPN) asociado a leiomiosarcoma peritoneal. La anemia normocítica normocromica no regenerativa es secundaria a enfermedad neoplásica 6. Este tipo de anemia es importante relacionarla con diferentes factores de procesos crónicos que se presentan durante el SPN como son, la disminución de la reutilización del hierro y la hipoplasia eritroide en la médula ósea, esto debido a la liberación excesiva de citocinas como el Factor de Necrosis Tumoral alfa, las IL1, IL6, IL10 y el interferón gamma que son producto del incremento de la actividad fagocítica de los macrófagos o por el proceso neoplásico 6,7.
Estas citocinas causan disminución de los niveles de eritropoyetina e interfieren en la relación normal entre las concentraciones de eritropoyetina y el hematocrito al hacer que se tenga una eritropoyesis defectuosa o reducida 7. Pueden también inhibir la proliferación de la línea eritroide debido a que el hierro es secuestrado por los macrófagos, que reducen el hierro sérico y restringen la capacidad de desarrollar precursores de glóbulos rojos y una disminución moderada de la vida media de los glóbulos rojos 6 con poca respuesta de la médula ósea a la eritropoyetina y, también, muy poca eritropoyetina, así como menores concentraciones de eritropoyetina liberadas 7.
La condición corporal del paciente 2/5 lo cual puede ser debido al cuadro anorexia/caquexia, como parte del síndrome SPN, donde hay una evidente perdida de músculo y grasa. Se origina a partir de factores inductores de anorexia, a la demanda nutricional del tejido tumoral y factores humorales, incluidas las citoquinas y las hormonas 8. Citocinas como el TNF (caquectina), que es producido en gran cantidad por parte de las células del sistema inmunológico como las células NK, los macrófagos, los neutrófilos, ante la presencia del tumor 9 actúa como agente inductor de caquexia inhibiendo las enzimas involucradas en la captación de ácidos grasos y glucosa, como también opera sobre la síntesis de triglicéridos, causando por tanto hiperglucemia e incremento en la concentración de ácidos grasos libres en sangre 10. Asimismo, el aumento en la expresión del gen del TNFα en el tejido adiposo 11 induciría insulino-resistencia gracias a su capacidad de fosforilar la serina del sustrato- 1 del receptor de la insulina, disminuyendo la actividad tirosín-quinasa del receptor de la insulina 12.
La leucocitosis y neutrofília relativa que presentó el paciente de estudio están asociadas a cambios inflamatorios en el conteo de células blancas 6 resultando en una leucocitois sostenida, con alta producción de TNF, este producido por el constante estimulo del tumor. La trombocitopenia encontrada en el hemograma podría ser causada por el proceso neoplásico 13, debido probablemente a defectos en la producción por parte de la medula ósea 14 junto al exudado no séptico peritoneal 15, quienes reportan la predominancia de neutrófilos no degenerados y niveles elevados de proteína.
Los cambios patológicos observados morfológicamente como derrames abdominales son asociados a procesos patológicos de las superficies parietales y viscerales de la cavidad como son los tumores malignos que pueden conducir a ascitis, ya que la membrana serosa contiene la neoplasia 16,17,18 con la consiguiente producción de exudado.
Dentro de los diagnósticos diferenciales se incluyeron tumores gastrointestinales de células fusiformes, leiomiomas, mesotelioma maligno predominantemente fibroso (células fusiformes), fibrosarcoma, tumor maligno de la vaina del nervio periférico.
Entre la lista de diferenciales propuestos después de la observación con la tinción de hematoxilina/eosina, inicialmente se sospechó de un mesotelioma del peritoneo, el cual puede asumir una variedad de patrones histológicos, unos predominantemente papilares que semejan un adenocarcinoma y otro de células ahusadas semejando un fibrosarcoma cuando son predominantemente fibrosos 19. Asímismo, la descripción histopatológica de la neoplasia podría corresponder al de un mesotelioma bifásico peritoneal o mixto, el que presenta áreas con la apariencia de carcinoma y otros sarcomatoides 20.
Como existen informes de mesotelioma bifásico canino, se eligieron el análisis histoquímico y la tinción tricrómica de Masson, y se determinó que era un tumor con características de origen mesenquimal 19. Se descartó el mesotelioma como diagnóstico diferencial considerando como diagnóstico más probable un leiomiosarcoma o fibrosarcoma.
La extirpación quirúrgica es el tratamiento preferido para el leiomiosarcoma intestinal, aunque el pronóstico para los perros después de la cirugía no está claro. Los tiempos de supervivencia postquirúrgicos varían de 0 a 47 meses, con un tiempo medio de supervivencia de unos 12 meses 21,22. Los perros con leiomiosarcoma intestinal que sobreviven al periodo postoperatorio inmediato pueden tener una supervivencia a largo plazo después de la extirpación quirúrgica de 18 a 38 meses 21,22.
La observación de metástasis durante el diagnóstico no dañaría el pronóstico 22. Además, los perros con diagnóstico histológico de metástasis en el momento de la cirugía también parecen tener una larga supervivencia, con un tiempo medio de 21,7 meses (rango 4,2-41,5 meses). Esto indica que el comportamiento biológico de este tumor puede no ser muy agresivo, incluso si hay invasión en el mesenterio en el momento de la cirugía 21.
Si el clínico sospecha de una posible metástasis, se recomienda realizar una biopsia de los sitios potenciales probables de invasión de células neoplásicas 22. En las formas gastrointestinales, los sitios más reportados de metástasis son los ganglios linfáticos regionales, el mesenterio y el hígado. El bazo, los riñones y el peritoneo también pueden verse afectados. El pronóstico es peor para las formas esplénicas (supervivencia media de 8 meses) y empeora para las formas hepáticas, con una supervivencia nula.
Para las formas cutáneas, se observa una pequeña cantidad de recurrencias y solo cuando los márgenes de seguridad en el momento de la escisión no son suficientes 22. Dos perros recibieron quimioterapia después de la escisión. Un perro, que no tenía perforación ni metástasis en el momento de la cirugía, recibió una terapia combinada que consistió en doxorrubicina (30 mg/m2 por vía intravenosa semanas 1, 4, 7), ciclofosfamida (100 mg/m2 por vía intravenosa semanas 1, 4, 7) y vincristina (0.7 mg/m2 IV semanas 2, 3, 5, 6). Este perro se perdió de seguimiento 27,5 meses después de la escisión quirúrgica. El otro perro había confirmado histológicamente metástasis en el bazo e hígado. Este perro recibió doxorubicina por vía intravenosa a 30 mg/m2 cada 3 semanas durante 4 ciclos. Este perro murió por causas relacionadas con tumores 4,2 meses después de la cirugía 21.
Luego se realizaron pruebas inmunohistoquímicas, en las que la inmunoreactividad para los marcadores CK5 revelaron una neoplasia de origen no epitelial (mesotelioma) y negativa para el antígeno KIT (CD117), e inmunopositividad citoplásmica para actina del músculo liso y vimentina, por lo tanto, se concluyó que era altamente probable que fuera un leiomiosarcoma 23. De acuerdo con eso, el LMS se distingue por una alta positividad para actina y la desmina, mientras que los GIST expresan el receptor a la tirosina quinasa c-kit 22.
En conclusión, el tumor fue clasificado por histopatología como de origen mesenquimal e inmunopositividad citoplasmática difusa interna de células neoplásicas para actina de músculo liso, vimentina y negatividad para KIT, condujo al diagnóstico de leiomiosarcoma.











 text in
text in 


