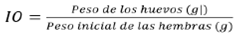INTRODUCCIÓN
La ganadería bovina es una actividad sobresaliente en el contexto económico nacional y genera el 3.5% del PIB nacional y el 56% del PIB pecuario 1. Los ectoparásitos, específicamente la garrapata Rm ha sido asociada con grandes pérdidas económicas para este reglón productivo por la disminución de los índices reproductivos y la ganancia de peso, asociados a la transmisión de agentes patógenos 2. El uso de acaricidas ha tenido una eficacia limitada en la reducción de las infestaciones y es acompañada de problemas de cepas de garrapatas resistentes, contaminación ambiental y de productos cárnicos o lácteos 3,4; esto refuerza la necesidad de enfoques alternativos para controlar las infestaciones de garrapatas, donde los extractos vegetales son una opción dentro de la incursión del manejo integral de parasitosis externa 5,6.
Los productores quienes a través de conocimientos tradicionales existentes en la flora han buscado y encontrado soluciones para el control de ectoparásitos; especies como matarratón (Gs) y Melón amargo (Mc) fueron reportados con efecto antiparasitario en Colombia 7.
El objetivo del presente trabajo de investigación fue validar la información etnofarmacológica del uso de estas plantas forrajeras, además de manto rojo (Me), como antiparasitario para el control de Rm, tanto en modelos in vitro como in situ.
MATERIALES Y MÉTODOS.
Colecta de plantas y elaboración de extractos. Hojas de Mc L. N°COL 580477, Me Lindau N°COL 575462 y Gs (Jacq.) Kunth ex Walp N°COL576461; se colectaron entre los meses de abril y julio, en la granja de la Universidad de los Llanos, ubicada en la vereda Barcelona, Villavicencio (Meta). 4° 04'32,91" Latitud Norte, 73° 35'02,27 Latitud Oeste, altitud 386 msnm, precipitación de 3500 mm/año, HR 87% y temperatura ambiental promedio 27°C.
El material vegetal se trató de acuerdo a la metodología de análisis fitoquímico propuesta por Sanabria, 1983 8, así: fue secado en un horno de aire circulante a 40°C durante 72 h y posteriormente molido hasta pulverización. Para la elaboración de los extractos se pesaron 150 g de material vegetal seco molido de Mc, Me y Gs; posteriormente expuestos a 600 mL de Metanol 99.8%, Etanol 99.8% y Acetona 70% (Sigma-Aldrich, St. Louis, MO), respectivamente; cada uno en un embudo de decantación de vidrio, durante 72 horas, llevando a cabo la técnica de percolación continua hasta agotamiento.
El líquido percolado se filtró y concentró a 40°C en un evaporador rotatorio IKA® RV10 control, a presión reducida, llevándose a sequedad finalmente en baño de María. Los extractos fueron transferidos a viales de vidrio ámbar y conservados a 4°C hasta el momento de realizar las pruebas, el rendimiento promedio del proceso de extracción fue del 5%, posteriormente se realizó análisis fitoquímico preliminar de los extractos con el fin de determinar la presencia de metabolitos secundarios a través de la técnica de colorimetría y CCD.
Colonia de garrapatas. La colecta de teleoginas se desarrolló en el hato bovino (21 animales parasitados naturalmente) de la granja de la Universidad de los Llanos; las teleoginas se lavaron con una solución de hipoclorito 2.5% 6; grupos de 10 teleoginas se colocaron sobre papel kraft en cajas de Petri que luego fueron ubicadas en cajas plásticas para la generación de microambientes e incubadas utilizando una incubadora refrigerada MEMMERT® IPP110 a 27-28°C y HR 85-95%.
Catorce días posteriores a la incubación, los huevos de los grupos de teleoginas son pesados, identificados y colocados en un vial de vidrio individual; los viales son tapados con un tapón de gasa y posteriormente colocados en las cajas plásticas para su incubación; una vez eclosionados, las larvas fueron utilizadas en las pruebas acaricidas in vitro.
Pruebas in vitro. Se aplicó la prueba AIT propuesta por Drummond et al 9, con adaptaciones. Las teleoginas fueron seleccionadas de acuerdo a su morfología, motilidad y máximo de ingurgitamiento; luego pesadas y separadas en grupos de 10 con pesos homogéneos. Seis repeticiones para cada concentración incluyendo el grupo control negativo (agua-Tween 80 2.5%) y el control positivo Amitraz 0.025% se desarrollaron, donde las teleoginas se expusieron a los extractos en concentraciones decrecientes de 320, 160, 80, 40, 20 y 10 mg/mL vehiculizados en agua-Tween 80 2.5%; sumergiéndolas en 10 mL de estas soluciones durante 10 minutos, después secadas y colocadas en cajas de Petri plásticas, luego incubadas en las mismas condiciones descritas con anterioridad.
Mediante estereoscopia se determinó la mortalidad a las 24 horas, 7 días y 14 días postratamiento; el día 14 postinmersión los huevos fueron colectados y pesados, el índice de ovoposición (IO), el porcentaje de inhibición de la ovoposición (IO%), el control de reproducción (CR%) y la eficiencia reproductiva (ER) fue determinado para cada tratamiento y controles a través de las siguientes fórmulas:
Posteriormente, se colocaron 100 huevos de cada unidad experimental en viales de vidrio tapados con un tapón de gasa, llevándose a incubación por 21 días hasta su eclosión; determinado así el porcentaje de eclosión de larvas (E%).
Con la IO y el E% se calculó la ER, así: ER=IOxE%. La ER de cada grupo de garrapatas tratado se comparó con la ER de los grupos control positivo y control negativo; luego se calculó el CR%, así:
Para la prueba LIT se usaron larvas de 7 a 14 días de edad; exponiéndolas a diferentes concentraciones de los extractos 20, 40, 80, 160 mg/mL, controles negativo y positivo igual a los descritos anteriormente; desarrollando tres repeticiones por tratamiento. Para el bioensayo los viales con larvas se colocaron en el centro de una placa de Petri que se llenó posteriormente con agua y jabón; se utilizó la metodología descrita por Klafke et al 10 donde 1 mL de cada solución final de inmersión se distribuyó en tres tubos plásticos para microcentrífuga de 1.5 mL; con el uso de un pincel de nylon N°4, aproximadamente 300 larvas se transfirieron a cada tubo, el cual fue cerrado y agitado vigorosamente hasta asegurar la inmersión por 10 minutos de las larvas; posteriormente 100 larvas son retiradas y trasladadas a un papel filtro Whatman #1 que se dobló y cerró, estos montajes fueron colocados en cajas plásticas para su incubación por 24 horas.
Se consideraron las larvas muertas: las que no se movieron, las que presentaron ataxia o movimientos apendiculares únicamente al examen estereoscópico. Para calcular la mortalidad se utilizó la fórmula:
Pruebas in situ. La actividad acaricida de Eme y EMc se evaluó en bovinos del Hato lechero Barcelona, ubicado en el Km 12 vía Puerto López en el municipio de Villavicencio, Meta; la evaluación del EGs se realizó en el Centro Agroindustrial del Meta "Hachón" (SENA), ubicado en el Kilómetro 17 vía Villavicencio -Puerto López. El uso de animales fue con previo consentimiento informado de los propietarios y la aprobación por parte del Comité de Ética de la Universidad de los Llanos.
Para cada bioensayo se utilizaron 9 bovinos mestizos con infestación alta a media de Rm (aproximadamente 20 teleologías por animal), con edades promedio de 18 meses y peso vivo promedio de 300 Kg; los bovinos no recibieron ningún tipo de medicación acaricida por un periodo de dos meses antes del experimento; los animales pastorearon una pradera de gramíneas y tuvieron agua a voluntad; los cuales se distribuyeron en tres grupos experimentales, donde 3 animales se sometieron a un baño por aspersión con la solución de los extractos a la CL50; 3 animales fueron el control negativo (agua-Tween 80 2.5%); y finalmente 3 animales como control positivo asperjados con Amitraz 0.025%, para cada experimento. Los tratamientos en los bovinos se realizaron con bomba manual de espalda con presión, cada animal recibió tratamiento durante diez minutos con 1 litro de solución por cada 100 Kg de peso vivo.
Para la evaluación del efecto de los extractos en los bovinos se realizó la metodología descrita por Bianchi et al 3, en la cual teleoginas (garrapatas >4.5 y <8 mm de longitud corporal) y larvas (garrapatas <4.5 mm de longitud corporal) fueron contadas del lado derecho del cuerpo del bovino, específicamente en 4 áreas de 10 cm2: aspecto ventrolateral y dorsolateral cervical, base de la cola y periné (Figura 1).
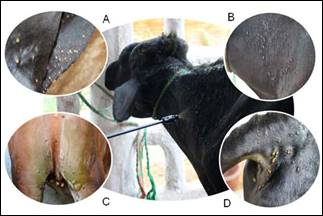
Figura 1 Evaluación dela infestación de garrapatas y conteo de estadios larvarios y teleoginas de Rm. A. Área ventrolateral cervical, B. Área dorsolateral cervical, C. Área periné, D. Área base de la cola.
El conteo de garrapatas se hizo antes del tratamiento (Día 0), días l (D1), día 2 (D2) y día 3 postratamiento (D3). Conteos diarios de garrapatas se efectuaron siempre a la misma hora (07:00-8 am) y por el mismo investigador. Al final del D3 se colectaron las teleoginas trasladándolas a condiciones in vitro, de tal forma se organizaron grupos de 10 teleoginas para los diferentes tratamientos, los cuales fueron llevados a incubación de acuerdo a la metodología AIT para evaluar la capacidad reproductiva después de haber recibido los baños de aspersión.
Análisis estadístico. El tamaño de la muestra de los experimentos in situ se calculó a partir de un 80 de potencia, intervalo de confianza del 95%, 5% de error máximo, promedio de 12±2 hembras regurgitadas, a través del programa OPenEpi, versión 3.01. Los resultados de mortalidad de larvas y teleoginas fueron sometidos a la prueba de homogeneidad de varianza, prueba de Bartlett, y prueba de normalidad Kolmogorov-Smirnov, posterior análisis paramétrico a través del método Probit para el cálculo de dosis letales 50 y 90; además de Chi-cuadrado para evidenciar diferencias entre tratamientos.
Otros resultados obtenidos de las pruebas in-vitro (%IO, ER, CR%); además de los resultados obtenidos en las pruebas in-situ se sometieron a las pruebas de homogeneidad de varianza y normalidad descritas con anterioridad, para ser procesados a través del análisis de varianza de una vía y comparación múltiple de promedios con la prueba Tukey-Kramer, con un rango de confiabilidad del 95% (p<0.05). Los datos fueron organizados y analizados en el programa estadístico OpenStat 4.0, versión 7.0.
RESULTADOS
La marcha fitoquímica preliminar del EMc determinó la presencia de alcaloides, saponinas y esteroles; del EMe se obtuvo alcaloides y saponinas; y del EGs se hallaron flavonoides, terpenoides, cumarinas, glucósidos cardiotónicos, saponinas y taninos.
Pruebas in vitro. Los EMc y EMe no mostraron actividad larvicida; mientras que EGs mostró una CL50 78 mg/mL (IC 71-83 mg/mL) y CL90 146 mg/mL (IC 128-182 mg/mL) en LIT. Los resultados de la prueba AIT con los extractos evaluados se halló una CL50 125 mg/mL (IC 69-266 mg/mL) y una CL90 930 mg/mL (IC 377-2085 mg/mL) para EMc; para EMe CL50 69 mg/mL (IC 20-176 mg/mL) y CL90 846 mg/mL (IC 268-94906 mg/mL); y para EGs CL50 155 mg/mL (IC 110-241 mg/mL) y una CL90 562 mg/mL (IC 324-2601 mg/mL). Además se estableció que a la concentración de 160 mg/ mL evaluada sobre teleoginas, existe efectos deletéreos significativos (p<0.05) sobre el ciclo de vida de este parásito (Tabla 1).
Tabla 1 Eficacia de los tres extractos vegetales in-vitro mediante la prueba AIT en la inhibición de la ovoposición y reducción de la eclosión de Rm.
| 160mg/mL extracto | IO | IO% | ER | CR% |
|---|---|---|---|---|
| Gs | 0.22 | 46.9 | 16.46 | 62.35 |
| Mc | 0.164 | 66.1 | 16.40 | 66.15 |
| Me | 0.06 | 84.03 | 4.03 | 91.3 |
Pruebas in situ. Los resultados mostrados en promedios y desviación estándar de los conteos de teleoginas del lado derecho de los animales, se evidencian en las Tablas 2,3 y4.
Tabla 2 Efecto Mc sobre los promedios de conteos de teleoginas del lado derecho de los bovinos.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Mc | 9.33 | 7.33 | 6.67 | 3.67 | 5.89 |
| ±7.57A | ±5.51A | ±5.69A | ±4,04 | ±1.95B | |
| Control | 13.33 | 9.33 | 11.67 | NR | 10.50 ± |
| negativo | ±9.02A | ±5.69 A | ±7.51A | 1.64A | |
| Control | 3.67 | 2.67 | 6.67 | NR | 4.67 |
| positivo | ±2.31B | ±1.53B | ±4.93A | ±2.82B |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
Tabla 3 Efecto Me sobre los promedios de conteos de teleoginas del lado derecho de los bovinos.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Me | 21.3 ±2.3A | 9 ±4A | 8.3 ±2.5A | 9.6 ±3.2A | 9 ±0.6A |
| Control negativo | 4.6 ±2.0B | 3.6 ±1.5AB | 18.6 ±8A | 32.6 ±13.5B | 18.3 ±14.5B |
| Control positivo | 6.6 ±1.5B | 1.6 ±1.1B | 1.3 ±0.5B | 0.6 ±1.1C | 1.2 ±0.5C |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
Tabla 4 Efecto de Gs sobre los promedios de conteos de teleoginas del lado derecho de los bovinos.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Gs | 25 ±9.54A | 27 ±9.85A | 36 ±20.52A | 32.3 ±18.8A | 31.7 ±4.5A |
| Control negativo | 23 ±14.18A | 24 ±18.08A | 33 ±22.87AB | 24.3 ±19.14AB | 27.11 ±5.10A |
| Control positivo | 27.33 ±20.03A | 9 ±6.08A | 8.33 ±4.73B | 5.33 ±3.21B | 7.56 ±1.95B |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
En cuanto a los promedios y desviaciones estándar del conteo de larvas se presentan en las Tablas 5,6 y7.
Tabla 5 Resultados prueba in-situ para Mc y sus efectos sobre estadios larvarios.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Mc | 6.67 ±7.33A | 2.75 ±1.76A | 1.67 ±2.35A | 1.17 ±0.94 | 1.86 ±0.80B |
| Control negativo | 4.42 ±4.38A | 3.92 ±3.68A | 2.83 ±2.55A | NR | 3.38 ± 0.76A |
| Control positivo | 12.08 ±11.56A | 4 ±5.13A | 4 ±5.10A | NR | 4 ±0.1A |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
Tabla 6 Resultados prueba in-situ para Me y sus efectos sobre estadios larvarios.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Me | 23.7 ±30.6A | 15 ±13.8A | 19.5 ±17.5A | 18 ±10.6A | 17.5 ±2.2A |
| Control | 39.1 | 20.6 | 22.7 | 28.2 | 23.8 |
| negativo | ±28A | ±19.8A | ±21.9A | ±19.9A | ±3.9B |
| Control | 17 | 11.2 | 7.3 | 7.3 | 8.6 |
| positivo | ±20.8A | ±8.8A | ±4.5A | ±4.8A | ±2.2C |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
Tabla 7 Resultados prueba in-situ para Gs y sus efectos sobre estadios larvarios.
| Tratamientos | Día 0 | Día 1 | Día 2 | Día 3 | Average |
|---|---|---|---|---|---|
| Gs | 15.67 ±18.6A | 11.67 ±11.70A | 11.25 ±14.83A | 14.17 ±9.84A | 12.36 ±1.57A |
| Control negativo | 11 ±13.31A | 12,33 ±15.29A | 10.33 ±13.28A | 14 ±15.96A | 12.22 ±1.83AB |
| Control positivo | 21.92 ±20.16A | 10.67 ±9.63A | 8.42 ±7.55A | 8.42 ±8.15A | 9.16 ±1.29B |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
Así mismo, en la evaluación de los efectos de los extractos vegetales sobre la capacidad reproductiva de las teleoginas recolectadas el día D3, los resultados se presentan en las tablas 8, 9 y 10.
Tabla 8 Efecto en la inhibición de la ovoposición y reducción de la eclosión de Mc sobre teleoginas colectadas D3.
| Tratamientos | IO | IO% | ER | CR% |
|---|---|---|---|---|
| Tween-80 2.5% | 0.650A | NA | 66.25A | NA |
| Amitraz 0.025% | 0.434B | 33.2A | 47.90B | 33.21A |
| AIT CL50 125 mg/mL | 0.378B | 41.8A | 37.80B | 41.83A |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer. NA, no aplica.
Tabla 9 Efecto en la inhibición de la ovoposición y reducción de la eclosión de Me sobre teleoginas colectadas D3.
| Tratamientos | IO | IO% | ER | CR% |
|---|---|---|---|---|
| Tween-80 2.5% | 0.523A | NA | 52.29A | NA |
| Amitraz 0.025% | 0.243B | 53.5A | 7.29B | 79.80A |
| AIT CL50 69 mg/mL | 0.361B | 30.9B | 36.11C | 30.95B |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer. NA, no aplica.
Tabla 10 Efecto en la inhibición de la ovoposición y reducción de la eclosión de Gs sobre teleoginas colectadas D3.
| Tratamientos | IO | IO% | ER | CR% |
|---|---|---|---|---|
| Tween-80 2.5% | 0.417A | NA | 41.67A | NA |
| Amitraz 0,025% | 0.414a | 0.6A | 20.71B | 33.91A |
| Extracto 100 mg/mL | 0.313A | 24.8B | 31.34B | 24.78A |
Letras diferentes en la misma columna indican diferencias significativas p<0.05, ANOVA posthoc Tukey-Kramer.
DISCUSIÓN
No se han realizado estudios previos sobre las propiedades acaricidas de los EMc, EMe y EGs sobre las garrapatas Rm, siendo este el primer reporte. La aplicación de plantas o sus extractos para controlar microorganismos ha sido utilizada por los practicantes de la medicina tradicional; para las últimas décadas las propiedades acaricidas e insecticidas de los extractos de plantas se han usado ampliamente como control biológico de plagas 11.
La planta Mc ha sido ampliamente utilizada como planta medicinal, sus propiedades medicinales incluyen su potencial antidiabético, antiinflamatorio, antipirético, actividad antimicrobiana, antiviral, antiparasítica, antihelmíntica, antimalárica y antifúngica 12. Gs es una leguminosa arbórea usada principalmente como especie forrajera en bovinos, sus hojas tienen un alto valor nutricional con proteína cruda 23% 13; esta planta se utiliza como un antihistamínico, antipirético, expectorante, diurético, antioxidante, antimicrobiana, antimalárica, antihelmíntica, tripanocida, mosquicida y efecto acaricida 14,15.
Por otra parte Me es un arbusto de floración muy vistosa y utilizada comúnmente como planta de ornamentación 16, a diferencia de las otras plantas esta no reporta información acerca de otros usos posibles.
Diversos estudios han demostrado la capacidad de grupos de metabolitos secundarios tipo cumarinas, taninos condensados, flavonoides, triterpenos, rotenoides, entre otros; para alterar la biología de ácaros e insectos 15,17,18,19. Varios de estos grupos de metabolitos secundarios fueron encontrados en la marcha fitoquímica de EGs, EMc y EMe colectadas en condiciones del piedemonte del Meta. A partir de la determinación de estos grupos químicos promisorios desde la perspectiva antiparasitaria externa e interna se han desarrollado varios estudios; por ejemplo en pruebas realizadas con extractos de Gs se observó su efecto antihelmíntico in-vitro reduciendo la motilidad de larvas estadio L3 de Haemonchus contortus; este efecto se relacionó con metabolitos secundarios tales como taninos/compuestos polifenólicos 20, también a terpenoides , flavonoides y lectinas 21; así mismo se ha demostrado que plantas ricas en estos mismos grupos de metabolitos secundarios han mostrado actividad acaricida sobre Rm 22,23,24,25.
Por otro lado, en el grupo de metabolitos secundarios tipo cumarinas, grupo determinado en el EGs, se ha asociado su capacidad antiparasitaria sobre ácaros a través de la inhibición de enzimas digestivas que pertenecen a la familia de las endopeptidasas tipo serina, cisteina, aspartato; además metaloproteasas, tripsina, quimotripsina y catepsinas 26, enzimas con capacidad proteolítica de Rm quienes son las encargadas de la digestión de la hemoglobina y actúan como proteínas de reserva durante la embriogénesis 27. Posiblemente este mecanismo podría explicar los resultados obtenidos en la potente inhibición del ciclo de vida de Rm (%IO, CR%, ER; Tablas 1,8-10) al afectar los estadios larvarios y adultos utilizados en el estudio; y las diferencias significativas sobre la mortalidad en los estadios larvarios y teleoginas (Tablas 2-7); siendo estas enzimas vitales en la supervivencia de este ácaro.
Algunos estudios han evidenciado la actividad acaricida in vitro de Gs sobre Rm, con resultados similares a los encontrados en esta investigación (Tabla 1), por ejemplo Rodríguez et al 28 evaluaron la eficacia in vitro del extracto de Morus alba y Gs en el control Rm y su oviposición; en el cual el extracto puro de Gs manifestó una mortalidad del 53.33%; así mismo obtuvieron una IO del 58%.
Aunque la actividad acaricida in vitro sobre teleoginas de Rm expuestos a los extractos vegetales de este estudio muestran resultados promisorios de la incursión de estas plantas dentro del control integrado de parásitos externos en sistemas de producción bovina del piedemonte del departamento del Meta (Tabla 1,2,3,4,5,6,7).
El interés de este tipo de fitoterapéutico recae sobre la inviabilidad de los huevos de este parasito; encontrándose para este estudio resultados significativos al obtener un 62.35%, 66.15% y 91.3% de CR% y una ER% del 16.46, 16.40% y 4.03%, para Gs, Mc y Me; dentro del ciclo de vida de la Rm a la concentración del 16% de los extractos (Tabla 1), es decir, los extractos bajo este modelo de experimentación generan un fenómeno de inhibición en el proceso de eclosión (CR%) por encima del 50% de los huevos ovopositados por las teleoginas expuestas a estos fitopreparados.
Datos similares fueron reportados por Álvarez et al 15 donde el extracto alcohólico de Gs mostró un efecto signifcativo (p<0.05) sobre el IO% en Rm del 94%. Así mismo sobre su capacidad acaricida se ha publicado que el extracto etanólico 5% de hojas de Gs redujo un 57% la ovoposición del acaro Tetranychus cinnabarinus, obtenido de plantas de frijol negro; además, concentraciones de 5, 10, 15, y 20% del extracto etanólico de la planta causaron 41.7, 80.6, 88.9 y 100% de mortalidad, respectivamente 14.
Por estas razones los resultados obtenidos del estudio in-vitro e in-situ desarrollado validan los reportes etnofarmacológicos del uso de las plantas Gs y Mc29,30 como acaricidas; además de vincular como nueva candidata a la planta Me como fitoterapéuticos promisorios en sistemas de producción animal.
Por otra lado, en los hatos bovinos del trópico bajo la carga parasitaria de la población se establece en un 92% asociada al agroecosistema (fases preparasíticas o de vida libre) y tan sólo un 8% o menos está en su estadio parasitario obligado; resaltando la importancia de vincular dentro del control integrado de parásitos la oportunidad de controlar las fases preparasíticas del agente parasitario a tratar; oportunidad que debe estar soportada en procesos y procedimientos sustentables desde la perspectiva ambiental 11.
En ese momento del control parasitario los extractos vegetales jugarian un importante papel, al poder ser utilizados en la disminución de la carga parasitaria libre con mínimo impacto medio ambiental 30; además de su posible uso sobre el bovino, acción que debe ser validada a través de futuros estudios in-vivo e in-situ que permitan comparar los resultados obtenidos en este estudio. La anterior información es relevante y puede ser usada para consolidar el cultivo del Gs, Mc y Me en los sistemas de producción bovino del piedemonte del departamento del Meta, con la finalidad de ser utilizada como método alternativo dentro del control integrado de la garrapata común del ganado, fortaleciendo el desarrollo silvopastoril de la ganadería colombiana en el marco de la apertura económica del reglón productivo primario o extractivo 1