INTRODUCCIÓN
Varios organismos similares a Perkinsus están involucrados en la infección y mortalidad de moluscos bivalvos silvestres y cultivados causando la enfermedad conocida como dermo o perkinsosis, la cual, ha sido reportada en diferentes países y en diferentes especies. En ostreidos, por ejemplo, se identificó a Perkinsus beihaiensis en los tejidos de la ostra ahuecada del Pacífico Crassostrea rhizophorae y de la ostra brasileña Crassostrea brasiliana, con alta prevalencia del parásito 1. También en América del Sur, se registró la infección de Perkinsus marinus y Perkinsus olseni en Crassostrea gasar (C. brasiliana) mediante análisis molecular 2,3.
Pagenkopp-Lohan et al 4 investigaron la distribución de parásitos tropicales en Panamá encontrando a P. marinus infectando a C. rhizophorae y Crassostrea virginica en el Océano Atlántico, y a Crassostrea columbiensis en la costa del Pacífico. La presencia de organismos similares a Perkinsus en varios moluscos de la Gran Barrera de Coral se registró en Australia 5, mientras que Perkinsus mediterraneus se detectó parasitando la ostra plana europea (Ostrea edulis) 6. Durante poco más de dos décadas, las poblaciones silvestres y cultivadas de la ostra del este (Crassostrea virginica) en el sureste de los Estados Unidos de Norteamérica 7 y en el Golfo de México y el Mar Caribe, en México 8, se han visto afectadas resultando en mortalidades vinculadas con la presencia de P. marinus. Mientras que, en el Océano Pacífico y el Golfo de California, P. marinus se ha asociado con pérdidas en la producción de la ostra japonesa (Crassostrea gigas) en granjas comerciales 9.
Los protistas del género Perkinsus son parásitos intracelulares que infectan a los hemocitos de moluscos bivalvos; su vida libre es característica por la presencia de zoosporas biflageladas, mientras que, en su forma vegetativa, los trofozoitos se multiplican intra o extracelularmente dentro del huésped. Cuando los trofozoítos maduran, se dividen rápidamente para formar una hipnospora que posteriormente libera zoosporas biflageladas 10. Por lo tanto, su ciclo de vida les permite dispersarse fácilmente en el agua. Debido a su capacidad de transmisión y dispersión entre moluscos de diferentes grupos taxonómicos 11, varias especies de Perkinsus spp. también se han encontrado en almejas 12. Por ejemplo, Perkinsus quwadi se relacionó con la mortalidad en la almeja japonesa Patinopecten yessoensis cultivada en Canadá 13 y Perkinsus honshuensis se descubrió en muestras de tejido de la almeja Manila (Ruditapes philippinarum)14.
Por otro lado, se reportó la presencia de Perkinsus chesapeaki en las almejas de concha delgada Mya arenaria y Tagelus plebeius de la Bahía de Chesapeake en el Atlántico medio de Estados Unidos de Norteamérica 15, y la información de perkinsosis en las almejas venosa verrugosa (Venus verrucosa), vieira abigarrada (Chamys varia) y berberecho común (Cerastoderma edule) fue actualizada para nuevos sitios de la costa noroeste del Mediterráneo 16. En la costa de Sonora, México, se identificó a Perkinsus sp. en la almeja venus lisa (Chione fluctifraga) utilizando la técnica de tinción basada en medio de tioglicolato 17. Pero hasta ahora, no hay informes sobre la presencia de este parásito en almejas de la costa de Sinaloa, que incluyen a la almeja chocolata mexicana ( Megapitaria squalida). Detectar la presencia de presuntas hipnosporas de Perkinsus sp. en el tejido de M. squalida en una población silvestre del sureste del Golfo de California, utilizando el medio fluido de tioglicolato de Ray (RFTM), representa el objetivo de este estudio.
MATERIALES Y MÉTODOS
Sitio de colecta. Las almejas se recolectaron en Bahía de Altata (24° 20'-24 ° 40 'N y 107 ° 30'-108 ° 00' O), en la línea costera central de Sinaloa, México, desde septiembre de 2012 hasta septiembre de 2013 (Figura 1). Se capturaron 30 especímenes (63.04 ± 6.8 mm) por buceo libre cada mes, los cuales, fueron transportados al laboratorio en un tanque de 30 L conteniendo agua de mar. En cada muestreo, se registraron la temperatura del agua (°C) y la salinidad (%).

Figura 1 Mapa de México indicando el estado de Sinaloa y el sitio de muestreo (•) en Bahía de Altata.
Los estudiantes del Laboratorio de Malacología del Instituto Politécnico Nacional-Centro Interdisciplinario de Investigación para el Desarrollo, Integral Regional (IPN-CIIDIR), Unidad Sinaloa, colectaron y transportaron las almejas siguiendo los procedimientos estándares (NOM-031-SSA1-1993, Bienes y Servicios. Productos de la pesca. Moluscos bivalvos frescos-refrigerados y congelados). Esta investigación fue aprobada por el Comité de Ética (Colegio de Maestros) del IPN-CIIDIR.
Procesamiento de las almejas. Se obtuvieron las branquias, el manto y la glándula digestiva de cada almeja para incubarse en RFTM (25°C y siete días en condiciones de oscuridad), de acuerdo con las especificaciones estándar 18. Posteriormente, se maceraron, se tiñeron con solución de Lugol y se dejaron descansar durante 10 minutos antes de ser observados bajo el microscopio (10X y 40X) para detectar hipnosporas de Perkinsus sp.
Análisis de la infección. Cada mes, se calculó la prevalencia (% de almejas que presentaron presuntas hipnosporas). También mensualmente, la intensidad de la infección (número de presuntas hipnosporas observadas/ preparación completa) se calculó para muestras que fueron positivas para la presencia del parásito con RFTM, y se clasificó en función de los cinco niveles de la escala de Mackin 19: 1=negativo (0 hipnosporas), 2=muy ligero (1 a 10 hipnosporas/preparación completa), 3=ligero (11 a 30 hipnosporas/preparación completa), 4=moderado (31 a 100 hipnosporas/preparación completa), y 5 = pesado (>101 hipnosporas/ preparación completa).
Estadísticos. Se aplicaron los análisis estadísticos apropiados después de examinar la normalidad de los datos (Lilliefors). Cada mes, se realizaron ANOVA y prueba de Tukey a la intensidad de la infección. Las correlaciones entre la prevalencia e intensidad de la infección con la temperatura y salinidad del agua también se evaluaron mensualmente. Todas las pruebas estadísticas se analizaron con el software Statgraphic Plus 5.0; el nivel de significancia se estableció en 95%.
RESULTADOS
Se detectó a Perkinsus sp. en muestras de tejido de la almeja chocolata mexicana usando la prueba RFTM, lo cual, se basó en la presencia de presuntas hipnosporas (Figura 2). Según el Manual de Diagnóstico para Animales Acuáticos 18, estos corpúsculos redondos y oscuros representan etapas vegetativas del protozoo.
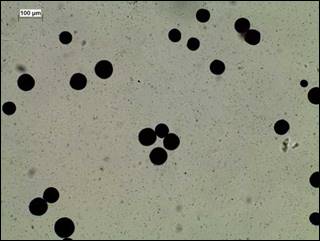
Figura 2 Detección de presuntas hipnosporas de Perkinsus sp. en tejido de Megapitaria squalida por medio de la técnica de tinción de MFTR (40X). Intensidad de infección en nivel 2 (escala de Mackin). Escala de la barra = 100 Lim.
La temperatura del agua en el sitio de muestreo fluctuó de 16.9°C (enero de 2013) a 37°C (julio de 2013), mientras que la salinidad varió de 29%o en octubre de 2012 a 40%o en abril de 2013. La prevalencia mensual de presuntas hipnosporas en M. squalida mostró diferencias significativas (F=2.78, p=0.004) y fluctuó de 0% en noviembre de 2012 a 43.3% en marzo y junio de 2013 (Figura 3), cuando la temperatura del agua aumentó sin alcanzar el gradiente máximo.
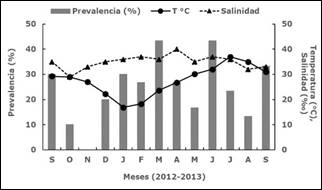
Figura 3 Prevalencia (%) de presuntas hipnosporas de Perkinsus sp. in Megapitaria squalida detectadas con MFTR, y temperatura (°C) y salinidad (°/oo) en Bahía de Altata (Sinaloa, México), de septiembre 2012 a septiembre 2013.
La intensidad de la infección varió de 1 a 3 (escala de Mackin) 19, ya que el número de presuntas hipnosporas observadas por preparación completa varió de 0 (noviembre de 2012) a 34 (febrero de 2013) (Tabla 1).
Tabla 1 Intensidad de la infección mensual (número de presuntas hipnosporas observadas/preparación completa) de Perkinsus sp. en Megapitaria squalida de Bahía de Altata, Sinaloa, México.
| Sep 2012 | Oct | Nov | Dic | Ene | Feb | Mar | Abr | May | Jun | Jul | Ago | Sep 2013 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| M | 49abc | 2.7abc | ND | 3.0abc | 11.5d | 7.0cd | 5.5bc | 6.5c | 4.4abc | 5.5bc | 1.2ab | 1.5abc | 1.3a |
| SD | 3.4 | 1.1 | ND | 1.6 | 8.7 | 1.1 | 3.8 | 3.3 | 1.7 | 4.0 | 0.7 | 1.0 | 0.4 |
| MML | 2-10 | 2-4 | ND | 2-6 | 2-24 | 2-34 | 1-14 | 2-12 | 2-8 | 2-12 | 1-3 | 1-3 | 1-2 |
| N | 9 | 3 | 0 | 6 | 9 | 8 | 13 | 8 | 5 | 13 | 7 | 4 | 10 |
M = media; SD = desviación estándar; MML = límites mínimo y máximo; N = número de observaciones; ND = no determinado. Diferentes letras superscriptas muestran diferencias estadísticas; ANOVA, F=2.78, p=0.004.
Las correlaciones entre los parámetros estudiados y los índices de infección se muestran en la Tabla 2. Solo la salinidad se correlacionó con la prevalencia (r=0.56, p=0.04).
Tabla 2 Correlaciones (r) de la prevalencia e intensidad de la infección de Perkinsus sp. con la temperatura y salinidad del agua de Bahía de Altata, Sinaloa, México.
| Prevalencia vs. Temperatura | Prevalencia vs. Salinidad | Intensidad de infección vs. Temperatura | Intensidad de infección vs. Salinidad |
|---|---|---|---|
| r=0.14 | r=0.56 | r=0.34 | r=0.22 |
| p = 0.64 | p=0.04* | p=0.24 | p = 0.45 |
*Correlación positiva (p<0.05).
DISCUSIÓN
Entre todos los factores ambientales, la temperatura y la salinidad son reconocidos como los que tienen una influencia más importante en la expresión infecciosa de Perkinsus spp. en diferentes especies de moluscos. Junto con la densidad y el tipo de sustrato, los factores ambientales antes mencionados determinaron la prevalencia e intensidad de la infección causada por P. olseni en Ruditapes philippinarum de 24 localidades en Corea 20. Se documentaron observaciones similares para la almeja de concha acanalada (Ruditapes decussatus) y la almeja japonesa (Ruditapes philippinarum) en el Atlántico nororiental y el Mediterráneo 21. Aunque algunas temperaturas registradas en el presente estudio se encontraron dentro del rango óptimo para la esporulación del protozoo (24 a 28°C) 22, la prevalencia y la intensidad de la infección no se correlacionaron con este parámetro. Por otro lado, la prevalencia más alta (43.33%) ocurrió cuando la salinidad excedió 35% (es decir, entre marzo y julio).
El clima del sistema lagunar Altata-Ensenada de Pabellones, donde se encuentra la Bahía de Altata, se caracteriza por ser cálido con temperaturas que varían anualmente de 19 a 35°C; con lluvias de junio a octubre y secas de noviembre a mayo. Durante la estación seca, la salinidad supera los 30%, mientras que 0% puede ser registrado en la estación lluviosa, lo que junto con la influencia de los desagües derivados de la actividad agrícola en el área podría haber afectado el efecto infeccioso de Perkinsus sp en la almeja callista. Es aceptado que la prevalencia de la perkinsosis en poblaciones silvestres de moluscos aumenta cuando se presentan altas salinidades como parte de la dinámica de la infección 10. Aunque la salinidad en marzo y julio fue superior al límite máximo óptimo para la formación de esporas del protozoario (35%), como se demostró in vitro22, la alta prevalencia obtenida pudiera ser más el resultado de la combinación de altos niveles de salinidad y temperatura, que la acción aislada de la salinidad, ya que la temperatura también aumentó de 23.7 a 37° C durante esos meses. La intensidad de la infección moderada obtenida durante los 13 meses de muestreo en la Bahía de Altata, sugiere que la variación estacional de estos dos parámetros no potenció el efecto infeccioso de Perkinsus sp. en M. squalida.
Debido a su sensibilidad, simplicidad y bajo costo 18,23, la técnica de RFTM en la identificación de presuntas hipnosporas de Perkinsus spp. se considera como un método preliminar fiable para después, llevar a cabo ensayos moleculares en los tejidos procesados. La detección de esferas redondas oscuras en M. squalida, característica de presuntas hipnosporas de Perkinsus sp. con RFTM, confirmaron la presencia de esta etapa vegetativa del parásito en el tejido de la almeja con una intensidad de infección que varió de negativa a moderada. Los nódulos blanquecinos 20 o los tejidos acuosos 21 pueden indicar lesiones causadas por el protozoo; sin embargo, no se observó daño tisular. Algunos autores mencionan que esto puede deberse a un bajo nivel en la intensidad de la infección 17, al pequeño tamaño de la muestra de tejido procesada con esta técnica 24 y/o a hipnosporas encontradas fuera de los tejidos en la capa externa del manto que se incorporaron en la muestra teñida durante el procesamiento. Solo una de las 95 almejas con presencia positiva por RFTM, tuvo más de 30 hipnosporas por preparación completa analizada, lo que refleja un nivel de infección bajo.
Se reportan, por primera vez, presuntas hipnosporas de Perkinsus sp. en una población silvestre de la almeja chocolata mexicana (M. squalida) del sureste del Golfo de California, detectadas con RFTM, con una prevalencia moderada y una intensidad de infección que varió de negativa a moderada, aparentemente sin comprometer la salud de la almeja, ya que no se observó daño tisular visualmente. Para las almejas en el Golfo de California, solo hay un informe sobre la detección de Perkinsus sp. utilizando la técnica RFTM en una población cultivada de la almeja venus (Chione fluctifraga)17.
Específicamente, la detección de Perkinsus marinus en los bivalvos del Golfo de California se ha centrado principalmente en diferentes especies de ostras (Crassostrea gigas, C. corteziensis y Saccostrea palmula) debido a su importancia comercial 10,25,26,27. Considerando la confirmación de la especie (P. marinus) y su alta incidencia en la región, es posible suponer que la especie Perkinsus en este estudio es la misma que ya se ha dispersado en diferentes localidades y en varias especies de bivalvos no ostreidos. Se detectó Perkinsus sp. en el callo de hacha (Atrina maura) de una localidad a pocos kilómetros al norte del área de estudio del presente trabajo 28.
Esto refuerza el argumento de que el parásito en cuestión se ha dispersado intraespecíficamente y ha encontrado nuevos hospedadores bivalvos en el sureste del Golfo de California, por lo tanto, la almeja chocolata mexicana debe considerarse en el catálogo de especies infectadas con Perkinsus sp. 18.
Con relación a la parasitación de Perkinsus sp. a M. squalida en la región, es necesario realizar más estudios sobre la patología, la interacción huésped-huésped, los patrones de infección y la epidemiología utilizando RFTM, junto con otras técnicas de confirmación de detección del parásito (histología, PCR, secuenciación genética y análisis filogenético), con el fin de aclarar el estado de salud actual de este bivalvo e implementar un programa de monitoreo permanente














