INTRODUCCIÓN
El Pacífico colombiano, territorio continental, comprendido entre los límites fronterizos de la república de Panamá, en el norte, y Ecuador, en el sur, y entre el Océano Pacífico y la Cordillera Occidental, abarca una extensión aproximada de 71.000 km2 (1. En la zona costera de esta región tienen jurisdicción los departamentos de Chocó, Valle del Cauca, Cauca y Nariño 1. Más del 90% de los 650.000 habitantes son afrodescendientes y se concentran en los cascos urbanos de los municipios de Buenaventura, Tumaco y Bahía Solano, donde también se congregan las principales actividades portuarias y comerciales de la región 1. Tumaco, ubicado al oeste del departamento de Nariño, limita con la república del Ecuador y tiene una población de 199.659 habitantes (DANE, Colombia, 2015). Las principales actividades económicas en Tumaco son la agricultura, la pesca y el turismo.
El puerto de Tumaco es considerado el segundo más importante en la costa del Pacífico en Colombia después del puerto de Buenaventura; para el año 2013, la exportación del atún entero en Tumaco fue U$8.045.375 2. Para esta región, el producto de la pesca es una de las principales fuentes de alimento proteico, estos productos son una fuente principal de proteínas para la población de la costa del Pacífico, un alimento que se ha promovido debido a los beneficios protectores para la salud que han identificado diferentes estudios, como en la prevención de enfermedades cardiovasculares 3,4,5,6. Sin embargo, el consumo de productos mínimamente procesados (crudo, semi crudo, en sushi, salazón, marinado) se pueden asociar a diferentes afecciones, causadas principalmente por la presencia de parásitos en los peces 3,7. Los nematodos de la familia Anisakidae son los de mayor importancia en salud pública, al ser los responsables de la anisakidosis, una enfermedad zoonótica reportada en las poblaciones costeras de los cinco continentes (7,8,9,10,11,12,13,14, causada principalmente por los géneros Anisakis y Pseudoterranova, ocasionando cuadros gástricos, alérgicos o gastroalérgicos 15.
De las especies que conforman la familia Anisakidae, A. simplex es la especie que cuenta con el mayor número de registros de anisakiasis humana con cuadros alérgicos 16. Sin embargo, desde el año 2015 varias investigaciones han demostrado que A. simplex no es una sola especie, sino un complejo de tres especies hermanas, A. simplex sensu stricto, A. simplex C y A. pegreffii, quienes no presentan diferencias morfológicas entre sí, por lo que es necesario para su identificación realizar diagnóstico diferencial de ADN 17.
En Colombia estos patógenos son desconocidos por la mayoría del personal de salud, razón por la cual, puede existir un subregistro de la enfermedad 3,18.
En América, solo se conocen reportes de anisakidosis en Chile y Perú 10,19, mientras en Colombia, aunque no se han descrito casos de anisakidosis en humanos, investigaciones realizadas en el Mar Caribe y en Buenaventura han registrado la presencia Contracaecum sp. y Anisakis sp. en peces de consumo 14,20,21. Aun que es importante destacar que la identificación taxonómica se ha realizado solo a nivel de género, por lo que es necesario profundizar en una caracterización a nivel de especie que permita conocer los anisakidos que circulan en aguas marítimas de Colombia para establecer una relación con las posibles enfermedades que pueden ocasionar.
Por lo anterior, el objetivo de este estudio fue realizar la identificación a nivel de especie de las larvas de anisakidos encontradas en el pez de consumo M. curema de Tumaco; una especie de importancia económica para la región, siendo una de las principales fuentes de proteína para la población y que en los últimos años ha reportado altos índices de captura por pesca artesanal.
MATERIALES Y MÉTODOS
Área de estudio. Las muestras fueron colectadas en el puerto pesquero de Tumaco, en el departamento de Nariño, Colombia.
Muestreos. Los peces fueron suministrados por pescadores de la región; luego de almacenarse y etiquetarse se conservaron en nevera con hielo para su traslado. La revisión parasitológica se realizó en el Laboratorio de Histología en la Facultad de Salud de la Universidad del Valle en Cali, Colombia.
Las muestras obtenidas fueron revisadas en músculos y vísceras en búsqueda de nematodos anisakidos. Los parásitos obtenidos se colocaron en cajas de Petri con agua destilada; posteriormente se fijaron en formalina caliente al 4% (v/v) e inmediatamente se transfirieron a alcohol 96% (v/v) hasta su identificación por taxonomía y biología molecular.
Identificación morfológica de nematodos. Los nematodos fueron aclarados en soluciones graduales de glicerina. La observación de las estructuras internas se realizó bajo un microscopio óptico con cámara clara incorporada (Leica DM750). Se identificaron los nematodos de la familia Anisakidae hasta nivel de género. Los nematos se fotografiaron con magnificaciones de 40x, 100x y 400x (Application Suite LAS V 3.8). Posteriormente, los anisakidos fueron separados por características morfológicas, contados, y se calculó el porcentaje de infección.
Extracción de ADN. Las larvas fueron cortadas en tres piezas. Se realizó la extracción individual de cada parte media de los nematodos utilizando el kit PureLink™ Genomic DNA Mini Kit (Invitrogen, USA), siguiendo las instrucciones del fabricante. El ADN se eluyó en tampón de elución que se mantuvo a -20°C hasta su uso.
Identificación por PCR convencional para larvas de la familia Anisakidae. Para la PCR convencional, se utilizaron cebadores específicos forward diseñados para seis especies de anisakidos 22: Anisakis physeteris (Baylis, 1923) APY (5'-GGCTGGTTGATGAACTGTTG-3'), Pseudoterranova decipiens (Krabbe,1878) PD (5'-CGAGTACTTTTTATGGTCGTGAAGT-3'), Anisakis simplex sensu stricto (Rudolphi, 1809) AC (5'- GACATTGTTATTTCATTGTATGTGTTGAAAATG-3'), Contracaecum osculatum (Rudolphi, 1802) COS (5'-TGATATGCTTGAAAGGCAGG-3'), Hysterothylacium aduncum (Rudolphi, 1802) HAD (5'-GCCTTCCATATGCGCGTATA-3') y para Anisakis pegreffii (Campana-Rouget & Biocca,1955) se utilizaron dos cebadores APE1 (5'-GAGCAGCAGCTTAAGGCAGAGGC-3') y APE2(5'-GAGCAGCAGCTTAAGGCAGATGC-3'). Como cebador reverse se utilizó uno de tipo universal B (5'-GCCGGATCCGAATCCTGGTTAGTTTCTTTTCCT-3') (Integrated DNA Technologies, USA).
Identificación por PCR multiplex. Se realizaron las PCRs, utilizando un volumen final de reacción 25ul: 9.38 ul de agua grado PCR; 2.5 ul de buffer PCR (10X HotMaster™ Taq 10X Reaction Buffer, 5PRIME, USA); 0.63 ul de mezcla de dNTPs (0.2 mM c/u 10mM dNTPs RBC Bioscience, USA), 1 ul por cada cebador específico (2 ng/ul), 0.5 ul de enzima polimerasa (5 U/ul HotMaster™ Taq DNA Polymerase, 5PRIME, USA) y ADN genómico (5 ul). El programa del termociclador (2720 Thermal Cycler, Applied Biosystems, USA) consistió en 30 ciclos de desnaturalización inicial a 95°C durante 3 min, seguido de 30 ciclos de desnaturalización a 95°C durante 30 s, hibridación a 52°C durante 30 s, extensión a 72°C durante 45 s, y una extensión final a 72°C durante 7 min. Todos los productos se sometieron a electroforesis en gel de agarosa al 1% (p/v) (UltraPure™ Agarose, Invitrogen, USA) visualizado por tinción con Gel-Red® (Biotium Inc., USA). Como control positivo se utilizó ADN genómico de larvas L3 de A. simplex, A. pegreffii y P. decipiens, suministradas por el Dr. Hiroshi Yamasaki del Instituto Nacional de Enfermedades Infecciosas de Tokyo, Japón.
Este estudio fue aprobado por el Comité Institucional de Revisión de Ética con Animales en Experimentación de la Universidad del Valle. Numero de Referencia 004-015.
RESULTADOS
Se colectaron un total de 16 peces lisa (M. curema) de los cuales 15 se encontraban parasitados por nematodos anisakidos, para un porcentaje de infección del 94%. Las características morfológicas permitieron la identificación de los géneros Anisakis y Pseudoterranova, ambos de la familia Anisakidae, siendo el género Anisakis con un 90%, el más representativo.
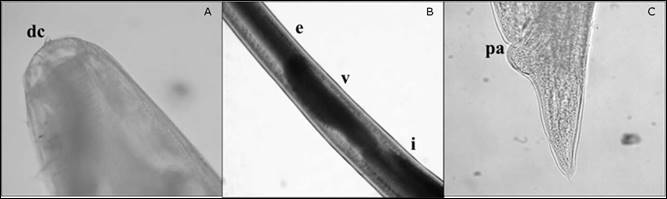
Figura 1 Larva (L3) tipo II de la familia Anisakidae. A. Extremo anterior, dc: diente cuticular. (40x) B. Parte media, e: esófago, v: ventrículo, i: intestino (20x). C. Extremo posterior con terminación cónica, pa: poro anal (40x).
Al microscopio óptico se lograron identificar larvas del género Anisakis en estadio (L3) con morfología de larva tipo II, larvas presentaron características propias del género Anisakis, como el color blanquecino con estrías transversales cuticulares a lo largo de todo el cuerpo más pronunciadas en el extremo posterior, con una boca bien formada compuesta por tres labios rodeando el diente cuticular (Figura 1A), el ventrículo se observó alargado con una unión directa al intestino y organización recta a lo largo del eje longitudinal del nematodo (Figura 1B) y con un extremo posterior en terminación cónica y ausencia de mucrón (Figura 1C).
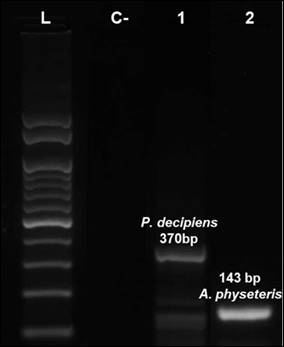
La identificación por PCR múltiplex permitió identificar las especies A. physeteris y P. decipiens parasitando el pez M. curema. Los partidores específicos fueron capaces de detectar P. decipiens con un producto de amplificación de peso esperado de 370 pb, y A. physeteris con un peso de 143 pb (Figura 2).
DISCUSIÓN
El pez Lisa (M. curema), de la familia Mugilidae se distribuye ampliamente en el Océano Pacífico, desde la costa de California en los Estados Unidos hasta el sur de Chile 22. Esta especie habita en aguas costeras y estuarinas; por su tipo de alimentación, varios autores la han clasificado como detritívora, iliófaga, herbívora, omnívora y fitófaga 23, comportamientos alimentarios que favorecen las infecciones por parásitos y es así como los Mugílidos constituyen la familia de peces con mayor número de reportes de anisakidos 17,21,22,23,24,25,26.
En el presente estudio hemos confirmado la presencia de larvas de tercer estadio (L3) de nematodos anisakidos en este tipo de pez capturado en aguas del Pacífico Colombiano; los peces presentaron un alto porcentaje de infección para nematodos de la familia Anisakidae. Las larvas L3 de Anisakis son consideradas el agente etiológico de la anisakiasis humana causada por el consumo de peces o mariscos poco cocidos e infestados por nematodos anisakidos 27.
La identificación de las larvas L3 fue realizada con base en las características estructurales del ventrículo y la forma de la porción terminal de las larvas 28. Estas mismas características morfológicas fueron observadas en otros estudios usando microscopia de luz, y confirmados por microscopía electrónica de barrido (SEM) 27,29,30.
Estudios recientes de anisakidos en peces del género Mugil en Colombia, en el año 2017 nuestro grupo registró nematodos del género Anisakis en peces de consumo en el Océano Pacifico 14,20,21; por otro lado, en la costa del Caribe Colombiano, se encontraron los géneros Contracaecum y Pseudoterranova en el pez M. incilis comercializado en aguas de la bahía de Cartagena en el Océano Atlántico 23,25,31; sin embargo, en estas investigaciones las larvas de anisakidos solo fueron identificadas a nivel de género, por lo que este estudio constituye la primera identificación a nivel de especie de los nematodos anisakidos presentes en peces de consumo en la costa Pacífica colombiana.
Para la identificación de las especies de anisakidos se han desarrollado varios métodos tales como, PCR-RFLP, la secuencia del gen rRNA o ADN mitocondrial. Estas técnicas se han utilizado con éxito para la identificación de especies hermanas de A. simplex. No obstante, requieren de equipo altamente especializado y de materiales y reactivos de alto costo; por lo tanto, para alcanzar el objetivo propuesto en esta investigación, se desarrolló la PCR multiplex propuesta por Umehara et al 22 la cual fue adaptada para la identificación diferencias de larvas de anisakidos, una alternativa a los métodos convencionales. Esta técnica puede ser utilizada en regiones que cuenten con laboratorio básico de biología molecular y así realizar un diagnóstico rápido de alta sensibilidad y especificidad para el reconocimiento de las especies de anisakidos, principalmente en muestras donde las larvas han sido cortadas o deterioradas y no es posible la identificación a nivel de genero mediante características morfológicas. Este método permitió identificar los nematodos A. physeteris, y P. decipiens parasitando el pez M. curema; sin embargo, se debe tener en cuenta que el uso de otras técnicas moleculares como la secuenciación pueden confirmar o variar estos resultados, ya que estos parásitos son un complejo de especies y su taxonomía cambia constantemente.
Identificar además del género, la especie de anisakido, en este caso A. physeteris y P. decipiens, posibilitan una mejor aproximación diagnóstica en los casos de infecciones de sistema gastrointestinal. Estudios previos reportados en Chile, Venezuela y en Perú, demostraron la presencia de P. decipiens en lisa (M. curema) asociados a casos de anisakidosis y la misma especie ( P. decipiens) en el pez Mugil sp. fue relacionada a casos de infección gástrica en Chile 3,8,10,19,24,32,33.
La distribución geográfica de los anisakidos está bien documentada; siendo el género Anisakis el más prevalente en el Mediterráneo y Pseudoterranova en el Atlántico nororiental. Sin embargo, no se conocen registro para el norte del Océano Pacífico 34,35, por lo tanto, estos resultados constituyen el primer reporte de las especies A. physeteris y P. decipiens en Colombia, contribuyendo de esta forma a complementar los estudios de distribución geográfica de estos nematodos a nivel mundial 34,35.
Con la confirmación de anisakidos en peces de consumo de Tumaco es importante llamar la atención sobre los factores de riesgo que tiene esta población frente a esta parasitosis poco reconocida por el personal de salud, ya que la pesca artesanal es la mayor fuente de alimentos y ocupa el tercer puesto como su fuente de ingresos. Factores como la condición de pobreza crítica con déficits en el sistema de salud, una tasa de analfabetismo del 16%, la falta de sistemas de acueducto y alcantarillado en los hogares de los pescadores contribuyen a los bajos niveles de higiene en estas poblaciones, afectando tanto su propia salud como los niveles de higiene en el manejo de los peces 36.
Al analizar la producción a gran escala, se deben garantizar instalaciones de procesamiento higiénicas selladas con servicios de muelle adecuados y sistemas de enfriamiento en el puerto de Tumaco para garantizar el envío higiénico de los productos de la pesca al interior del país. Si no se proporciona esta infraestructura, se favorece la supervivencia de los parásitos patógenos, como las larvas de anisakidos 14. Es probable que las prácticas antihigiénicas se reflejen en el registro de enfermedades para el departamento del Valle del Cauca en 2016, donde las enfermedades documentadas transmitidas por alimentos específicamente asociadas con el consumo de pescado y mariscos fueron del 3.5% 1. Sin embargo, ciertamente hay un subregistro significativo en relación con las causas específicas de muchas enfermedades gastrointestinales.
Apoyados en el presente estudio y en reportes anteriores para Colombia se hace evidente la necesidad de que las entidades de Salud en conjunto con la industria pesquera elaboren planes de capacitación, diagnóstico y planes de prevención para el control de enfermedades relacionadas con anisakidos en la región costera del Pacífico colombiano