INTRODUCCIÓN
Mycobacterium avium subsp. paratuberculosis (MAP) es un patógeno que afecta varias especies animales y que, en condiciones in vitro, es dependiente de micobactina, y de crecimiento extremadamente lento. La infección por MAP conduce a una enteritis granulomatosa crónica en animales susceptibles, conocida como paratuberculosis (PTB) o enfermedad de Johne 1. Los signos clínicos de la PTB incluyen diarrea, pérdida de peso, disminución de la producción de leche y carne, lo que lleva a importantes pérdidas económicas 2. Una de las principales preocupaciones acerca de la infección por MAP es la facilidad con que se propaga la bacteria, ya que los animales subclínicos o clínicamente infectados eliminan el agente en las heces y la leche, lo que permite su diseminación a animales jóvenes susceptibles, al medio ambiente y a alimentos para consumo humano 3. La leche y la carne que contienen MAP son especialmente preocupantes ya que se ha sugerido que la bacteria está posiblemente asociada con la enfermedad de Crohn en humanos 4.
La discriminación molecular de MAP a partir de los aislamientos en campo se convierte en una herramienta crucial para complementar el conocimiento general sobre la bacteria, su distribución, comportamiento y características 5,6. El uso de métodos de subtipado molecular de MAP ha aumentado en las últimas dos décadas 7,8. El subtipado de MAP es una herramienta útil en la investigación epidemiológica, que ofrece una mejor comprensión del origen de la infección por MAP, la dinámica, los factores de riesgo asociados, los perfiles de transmisión, la patogénesis, entre otras características relacionadas, lo que permite un diseño racional de medidas de control adecuadas, mejora del diagnóstico y desarrollo de vacunas 7,9. Sin embargo, el subtipado de cepas de MAP representa un desafío ya que son genéticamente monomórficas y las técnicas moleculares tradicionales tienen un poder discriminatorio limitado. Los avances y la disponibilidad de la secuenciación del genoma completo han ampliado las posibilidades para la caracterización de MAP, proporcionando un contexto filogenético que facilita los estudios epidemiológicos globales 10.
Las técnicas de subtipado incluyen técnicas de unidades micobacteriales repetitivas intercaladas-número variable de repeticiones en tándem (MIRU-VNTR), que se basan en el polimorfismo de elementos repetitivos y, técnicas de repeticiones de multilocus de secuencia corta (MLSSR), que consisten en la detección de segmentos más simples de repeticiones en tándem de 2-5 pb 11,12. Se ha reportado que la combinación de métodos dirigidos a diferentes estructuras genómicas de MAP (i.e. MIRU-VNTR, MLSSR) aumenta la capacidad discriminatoria de los métodos combinados en comparación con la capacidad de cada método utilizado por separado 5,13,14.
Con el tiempo se ha logrado cierto conocimiento sobre la PTB en Colombia, sin embargo, la información sobre el impacto y la distribución de la enfermedad, así como de su epidemiología molecular en el país aún es limitada, incluso siendo una enfermedad de reporte obligatorio en el desde 2015 15,16. Por lo tanto, el objetivo del presente estudio es determinar la diversidad molecular de MAP en aislamientos a partir de muestras ambientales de hatos lecheros ubicados en la región norte del departamento de Antioquia (Colombia) mediante técnicas de MIRU-VNTR y MLSSR.
MATERIALES Y MÉTODOS
Hatos de estudio. El presente estudio se realizó en 25 hatos lecheros previamente detectados como infectados por MAP mediante IS900-qPCR en muestras ambientales. Los hatos infectados se detectaron a partir de una población de 386 predios lecheros ubicados en 62 distritos de seis municipios diferentes en la región norte del departamento de Antioquia (Colombia), muestreados entre julio y octubre de 2016. Los 25 hatos de estudio se ubicaron en seis distritos diferentes en tres municipios diferentes. Cada hato participante fue visitado una vez durante el período de estudio para recolectar dos muestras ambientales compuestas. El primero contenía material de al menos seis sitios diferentes (sub-muestras) de concentración de ganado adulto y/o áreas de alto tráfico (e.g. potreros, áreas que rodean bebederos y comederos, callejones, canalones, áreas de espera de salas de ordeño). El segundo contenía material de la sala de ordeño colectada en el tanque estercolero, después de mezclar su contenido durante al menos 5 min. Las seis sub-muestras del segundo lugar se obtuvieron de diferentes lugares del perímetro de la laguna sumergiendo el recipiente de muestreo hasta 10 cm por debajo de la superficie. Las muestras compuestas definitivas fueron de aproximadamente 20 g, conservadas bajo refrigeración a 4°C durante el transporte de regreso al laboratorio y, en el laboratorio, se homogeneizaron y luego fueron congeladas a -20°C hasta la extracción de ADN. La extracción de ADN se llevó a cabo utilizando un kit comercial de preparación de ADN (ZR Fecal DNA Kit™, Zymo Research, CA, EE. UU.). El protocolo incluía un paso previo de disrupción mecánica (Disruptor Genie® 120V, Thomas Scientific, Swedesboro, NJ, EE. UU.). El ADN extraído se analizó usando un kit comercial de IS900-qPCR dúplex (Bactotype MAP PCR Kit®, Qiagen, Leipzig, Alemania).
Cultivo. Las muestras ambientales de los hatos positivos por IS900-qPCR se descontaminaron con solución de cloruro de hexadecilpiridinio (HPC) al 0.75% (p/v) durante 24 h, de acuerdo con los procedimientos estándar 15. Los inóculos fueron cultivados en medio de yema de huevo de Herrold (HEYM) con micobactina J por duplicado. Todos los medios de cultivo se incubaron a 37°C durante 24 semanas y se verificaron semanalmente para detectar crecimiento de micobacterias o contaminación con microorganismos indeseables. El crecimiento de MAP se monitoreó visualmente para determinar la tasa de crecimiento lenta típica y la morfología de la colonia de acuerdo con descripciones previas (colonias que se desarrollan después de ≥ 3 semanas de incubación, inicialmente redondas, lisas y blancas, que tienden a acumularse ligeramente y se vuelven de color amarillo claro opaco con arrugas en la superficie). Las colonias se sub-cultivaron en HEYM y aquellas que mostraran un crecimiento compatible con MAP, se consideraron como sospechosas. Todos los aislamientos se sometieron a IS900-qPCR confirmatorio (Bactotype MAP PCR Kit®, Qiagen, Leipzig, Alemania) para confirmar la identidad de los aislamientos. La descontaminación, así como los procedimientos de cultivo, se llevaron a cabo en la unidad de diagnóstico de la Facultad de Ciencias Agrarias, Universidad de Antioquia, en Medellín (Colombia).
Subtipado de MAP. Para la caracterización molecular de los aislamientos de MAP se aplicó una combinación de dos métodos de subtipado diferentes, ambos basados en la amplificación por PCR de elementos repetitivos del genoma de MAP.
MIRU-VNTR. El procedimiento se llevó a cabo mediante la amplificación de ocho loci MIRU-VNTR 3, 7, 10, 25, 32, 47, 292 y X3 (alias 1658), utilizando las condiciones de PCR reportadas previamente 12, con ligeras modificaciones en las condiciones del PCR. La mezcla de PCR estaba compuesta por 2 μL de una solución de ADN diluida diez veces, añadida a un volumen final de 50 μL que contenía 0.25 μL de ADN polimerasa GoTaq® (Promega; 5 U / μL), 2 μL de betaína (Sigma), dTTP (Qiagen, Leipzig, Alemania), 5 μL de tampón de PCR (suministrado por el fabricante), 1 μM de cebadores y 2 mM de MgCl2. Las reacciones se llevaron a cabo utilizando un termociclador SimpliAmp (Applied Biosystems, Darmstadt, Alemania). Las condiciones de PCR incluyeron 1 ciclo de 3 min a 95°C, 1 ciclo de 1 min a 95°C, 30 ciclos de 1 min s a 58°C, 1 ciclo de 1 min a 72°C y 10 min a 72°C. Para determinar el peso molecular de cada producto de PCR y estimar el número de repeticiones en tándem presentes en cada loci, se cargaron 10 μl de producto de PCR en un gel de agarosa al 2%, con una escalera de 50 pb. Para digitalizar el gel, se utilizó el generador de imágenes Gel Doc TM (BioRad). Los resultados se expresaron mediante un código octal y se determinó el patrón de genotipo (INMV) utilizando la base de datos en línea de acceso libre internacional (http://mac-inmv.tours.inra.fr/). Los genotipos MIRU-VNTR se expresaron como la combinación del número de repeticiones encontradas en cada locus. Se usó la cepa MAP K10 como control de referencia.
MLSSR. El procedimiento se llevó a cabo mediante la amplificación de cuatro loci de repeticiones de secuencia corta (SSR), locus 1 (repeticiones g), locus 2 (repeticiones g), locus 8 (repeticiones ggt) y locus 9 (repeticiones tgc), utilizando condiciones de PCR como se reportó previamente 11, con ligeras modificaciones en las condiciones del PCR. La selección se realizó seleccionando los loci con el índice discriminatorio más alto 11. La mezcla de PCR estaba compuesta de 2 μL de una solución de ADN diluida diez veces, añadida a un volumen final de 50 μL que contenía 0.5 μL de ADN polimerasa GoTaq® (Promega; 5 U/μL), dTTP (Qiagen, Leipzig, Alemania), 10 μL de tampón de PCR (suministrado por el fabricante), 1 LM de cebadores y 2 mM de MgCl2. Las reacciones se llevaron a cabo utilizando un termociclador SimpliAmp (Applied Biosystems, Darmstadt, Alemania). Las condiciones de PCR incluyeron 1 ciclo de 3 min a 95°C, 1 ciclo de 1 min a 95°C, 35 ciclos de 1 min a 60°C, 1 ciclo de 2 min a 72°C y 7 min a 72°C. Los productos de PCR se analizaron por electroforesis utilizando geles de agarosa al 1.5% (grado de electroforesis en agarosa; TransGen Biotech). Todos los amplicones de cada locus se purificaron utilizando el kit de purificación de PCR MinElute® (Qiagen, Leipzig, Alemania) y fueron secuenciados de forma independiente (Unidad de Genómica, Laboratorio de Biotecnología, Consejo Nacional de Investigaciones Científicas y Técnicas, Argentina). La calidad de la secuenciación y el número de unidades de repetición cortas para identificar los alelos se analizaron utilizando el software de análisis de secuencia v5.4 (Applied Biosystems). Los genotipos MLSSR se expresaron como la combinación del número de repeticiones encontradas en los cuatro loci amplificados por PCR. Si el número de repeticiones g en el locus 2 fue superior a 11, las repeticiones g para dicho locus se denotaron como >11g como se ha sugerido previamente 13. Los procedimientos de subtipado se llevaron a cabo en el Instituto de Agrobiotecnología y Biología Molecular (IABIMO) INTA-CONICET en Buenos Aires, Argentina.
RESULTADOS
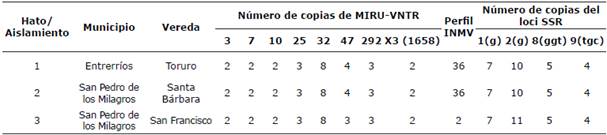
De las 25 muestras ambientales positivas a MAP por IS900-qPCR, 13 mostraron un crecimiento compatible con MAP en uno o ambos medios HEYM, seis de los cuales fueron confirmados como MAP por IS900-qPCR. Todos los aislamientos crecieron dentro de 8-15 semanas de incubación. En total, tres aislamientos de MAP recuperados de muestras ambientales recolectadas del tanque estercolero de tres hatos diferentes fueron adecuados para el subtipado de MAP. Los tres aislamientos revelaron dos genotipos diferentes por MIRU-VNTR [INMV 2 (código numérico: 32332228) e INMV 36 (código numérico: 32342228)]. MLSSR se llevó a cabo para aumentar el poder discriminatorio, pero no se observaron diferencias, como se puede ver en la Tabla 1. Sin embargo, el perfil MLSSR obtenido del predio 3 puede corresponder a MLSSR 50 (código numérico: 711555455455) de acuerdo con reportes anteriores 13.
DISCUSIÓN
En el presente estudio, se aplicaron las técnicas de subtipado MIRU-VNTR y MLSSR con el objetivo de lograr un análisis epidemiológico de MAP en una de las regiones lácteas más representativas de Colombia. Este país tropical tiene un sistema de producción animal y prácticas de cría que pueden variar en comparación con otras regiones del mundo. Por lo tanto, se espera que la epidemiología molecular de MAP en el país muestre patrones particulares de los de otros países estacionales y tropicales.
Trece de los cultivos mostraron un crecimiento compatible con MAP, siendo seis de ellos confirmados como MAP por IS900-qPCR, y de éstos, tres aislamientos diferentes fueron adecuados para el subtipado de MAP. La baja tasa de recuperación de la bacteria pudo deberse al hecho de que las muestras estuvieron en congelación a -20°C durante un máximo de 56 días, lo cual pudo afectar la sensibilidad de la detección 17. De acuerdo con las características reportadas por la literatura en cuanto a color, apariencia y velocidad de crecimiento diferencial de MAP 17, se consideraron aislamientos compatibles, aunque posteriormente no fueron confirmados a partir de la prueba molecular. Lo anterior se puede presentar debido a condiciones desfavorables relacionadas con la calidad del ADN, principalmente como consecuencia de los procesos de transporte y conservación de las muestras, así como de los procesos de extracción de ADN, considerando que las pruebas de tipado utilizadas requieren una calidad definida del ADN de origen 11. Adicionalmente, no se encontró poli-diversidad genética en ninguna de las muestras a partir de las técnicas utilizadas. Esto puede deberse, hipotéticamente, al azar al momento de realizar los lavados de los medios lo cual correspondería a la matriz de análisis.
Aunque las comparaciones con otros estudios son difíciles debido al uso de diferentes loci para el análisis, los perfiles MIRU-VNTR 1 (INMV 1) y 2 (INMV 2) han sido reportados previamente como los genotipos más comunes encontrados en aislamientos de otros países latinoamericanos 12,18,19,20, así como de aislamientos europeos 5,21,22,23. Sin embargo, nuestros hallazgos no se pueden comparar directamente con los reportados previamente 18, ya que consideramos ocho loci MIRU-VNTR y cuatro SSR y en el otro estudio utilizaron 11 loci [1, 3, 7, 4, 10, 25, 32, 47, 259, 292 y X3 -alias 1658] y tres SSR [1, 2 y 8], respectivamente.
Por otro lado, algunos reportes que utilizan los mismos loci/SSR se han publicado previamente. El perfil de INMV 2 fue reportado en un aislamiento a partir de materia fecal de ganado bovino 24. Se reportaron siete perfiles diferentes de INMV, incluido el INMV 2, en bovinos y caprinos de aislamientos argentinos y mexicanos 19. El INMV 2 se reportó como el segundo perfil más común encontrado en heces y/o mucosa intestinal de bovinos y humanos en Argentina, también concluyendo que INMV 2 fue el clon original del que derivan los otros 20. De acuerdo con los perfiles MLSSR reportados en el presente estudio, los subtipos aislados en nuestro estudio se encuentran comúnmente en bovinos y otras especies en diferentes países 13,18,25. Curiosamente, un aislamiento bovino del país vecino de Colombia, Venezuela, ha mostrado un genotipo diferente por SSR (11g-10g-5ggt-5ggt), lo que sugiere diversidad de cepas en la parte norte de América del Sur 13.
A una escala nacional, se reportó una caracterización molecular por MIRU-VNTR y MLSSR de ocho aislamientos de MAP (obtenidos de materia fecal, tejidos y tanques estercoleros) de cinco hatos lecheros en la región norte de Antioquia, ya definidos como infectados por MAP según pruebas directas e indirectas 18. Los autores revelaron dos perfiles de cepas combinadas diferentes (1A y 2B), siendo la primera caracterización molecular de MAP en Colombia hasta esa fecha. Los hallazgos presentados aquí no pueden compararse con los reportados previamente en el país 18, ya que consideramos ocho loci MIRU-VNTR y utilizaron doce [1, 2, 3, 4, 7, 10, 25, 32, 47, 259, 292 y X3 -alias 1658]. Sin embargo, los autores consideraron los mismos cuatro SSR, reportando el genotipo MLSSR B [7-g, 10-g, 5-ggt, 4-tgc], obtenido a partir de muestras de tejidos y de tanques estercoleros.
Como conclusión, y en base a los patrones de subtipado de los aislamientos de MAP obtenidos, a partir de 386 hatos lecheros ubicados en la región lechera del norte de Antioquia (Colombia), encontramos diferentes genotipos de MAP que circulan en la región de estudio: INMV 2 e INMV 36 según el análisis MIRU-VNTR. Los aislamientos con INMVs idénticos, provenientes de dos municipios distintos, no pudieron ser discriminados mediante MLSSR. Los hallazgos de este estudio conducen a importantes implicaciones epidemiológicas con respecto al control y prevención de PTB en Colombia. Se sugiere que los métodos de tipificación más nuevos, como el polimorfismo de un solo nucleótido (SNP), que es capaz de detectar diferencias entre los tipos principales, se pueden utilizar para obtener un mayor discernimiento de las características epidemiológicas de MAP en el país, incluida la influencia de los medios de cultivo, el papel desempeñado por la vida silvestre local, la diversidad de los agro-ecosistemas y el cruce de animales importados e indígenas a ser tomados en cuenta en el análisis como posibles fuentes de diversidad genómica de MAP.