INTRODUCCIÓN
Los roedores sinantrópicos constituyen especies dominantes, encontrándose en la mayoría de las regiones del mundo debido a su gran capacidad de adaptación 1. Así mismo, revisten de importancia en la cadena epidemiológica, pues son claves en la transmisión de diversos parásitos en animales silvestres y domésticos, incluido los seres humanos 1. Entre los agentes etiológicos transmitidos por roedores se encuentran varias especies de bacterias: Leptospira interrogans, L. kirschneri, Borrelia burgdorferi, Rickettsia sp., Bartonella sp.; protozoos: Entamoeba coli, E. muris, Trypanosoma cruzi, T. lewisi, Chilomastix intestinalis; nematodos: Calodium hepaticum, Syphacia sp., Trichuris sp. Strongyloides sp., y cestodos: Hymenolepis diminuta, H. nana, Taenia sp., entre otros 2,3. La mayoría de estos agentes infecciosos se transmiten por contacto con heces y orina de roedores infectados y/o a través de sus ectoparásitos como Xenopsilla cheopis y Nosopsyllus fasciatus2,3.
En Colombia, aunque los roedores han demostrado ser importantes en la trasmisión de microorganismos zoonóticos como T. cruzi, Leptospira sp., Rickettsia sp., Toxoplasma gondii, entre otros 4,5,6,7, los estudios con relación a la fauna parasitaria de estos animales y su rol como posibles transmisores de parásitos gastrointestinales con impacto en la salud pública y animal, son escasos 8,9. Algunos estudios con relación a esta temática sugieren una mayor positividad de parásitos gastrointestinales en roedores de áreas urbanas con una mayor disponibilidad de alimento y densidad de personas, demostrando el alto riesgo de infección en lugares con un mayor crecimiento urbanístico 8.
Actualmente, durante exámenes de medicina preventiva en el Zoológico de Barranquilla, se ha identificado la presencia de parasitismos intestinales asociados principalmente a familias de nematodos (Strongyloidae, Trichinellidae, Ascarididae, Toxocaridae, Trychostrongyloidae, Ranidae, entre otros), protozoos (Eimeriidae, Entamoebidae, Balantidiidae y Sarcocystidae) y cestodos (Taeniidae e Hymenolepididae) en algunos animales de la colección (datos no publicados); no obstante, el papel de los roedores sinantrópicos en la trasmisión de estos parásitos permanece sin ser evaluado. Con base en lo anterior, el objetivo del presente estudio fue describir la prevalencia y caracterizar los parásitos gastrointestinales en roedores sinantrópicos capturados en el Zoológico de Barranquilla, Colombia, con el fin de explorar el papel epidemiológico de estos hospederos en la transmisión de dichas infecciones hacia los animales y humanos.
MATERIALES Y MÉTODOS
Descripción del área de estudio. El presente estudio se realizó en el Zoológico de Barranquilla (FUNDAZOO), ubicado en el departamento del Atlántico dentro del área urbana del municipio de Barranquilla (11°00'39" N 74°47'52" O; 30 msnm), Colombia. Las condiciones ecológicas de esta zona se asemejan a las de un bosque seco tropical con una precipitación mensual entre 70 y 178 mm3 y una temperatura media de 29°C (24-34°C) 10.
Tipo de estudio y muestreo. Se realizó un estudio transversal, en el cual el universo de estudio fueron los roedores capturados durante el plan de control de roedores en las instalaciones del Zoológico de Barranquilla del 20 de junio a 09 de agosto del 2019. Para la captura de los roedores, se utilizaron trampas Tomahawk (medidas: 45 cm de largo x 13 cm de ancho y 13 cm de alto) con ayuda de cebos no tóxicos (mezcla de mazorca y mantequilla de maní) 2,8, las cuales se ubicaron al azar en 55 puntos de captura de los sectores A, B, y C durante un total de 168 horas/trampa (Figura 1). Dicho tiempo fue distribuido en un período máximo de 42 horas semanales y 14 horas al día, por lo cual las trampas fueron colocadas tres veces por semana (lunes, miércoles y viernes) entre las 5:00 pm y 7:00 am del día siguiente, con una semana de descanso alternado. Previo a la realización del estudio, las trampas fueron colocadas durante un periodo de dos semanas con el fin de generar una adaptación de los animales a la presencia de estas.
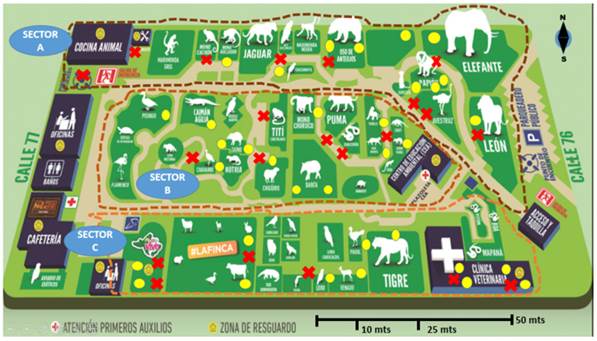
(Fuente: Tomado y modificado de FUNDAZOO https://www.zoobaq.org/info/mapa.php).
Figura 1 Distribución de los puntos de muestreo en el Zoológico de Barranquilla. Los círculos amarillos ( ) y las x rojas ( ), indican puntos de trampeo positivos y negativos a la captura de roedores. Las áreas de exhibición de los animales se encuentran en verde oscuro (
) y las x rojas ( ), indican puntos de trampeo positivos y negativos a la captura de roedores. Las áreas de exhibición de los animales se encuentran en verde oscuro (  ) y los senderos para los visitantes representados por el color beige (
) y los senderos para los visitantes representados por el color beige ( ). La diversidad de especies en los diferentes sectores corresponde a: sector A (aves y mamíferos), sector B (aves, mamíferos y reptiles) y sector C (anfibios, aves, mamíferos y reptiles)
). La diversidad de especies en los diferentes sectores corresponde a: sector A (aves y mamíferos), sector B (aves, mamíferos y reptiles) y sector C (anfibios, aves, mamíferos y reptiles)
Procesamiento de los roedores capturados. Luego de la captura, los animales eran trasladados vivos al área de necropsia para su manipulación según lo establecido en los estándares de bioseguridad y normas de procesamiento, acordes a los protocolos del centro de enfermedades infecciosas y prevención de Atlanta, Estados Unidos de América 11. Inicialmente, los roedores fueron anestesiados e insensibilizados en cámara anestésica, mediante inhalación de isoflurano al 5% (Baxter, Cali, Colombia). Durante el período de sedación, por cada animal se determinó el sexo y el peso en gramos (g) utilizando una balanza digital (Lexus, Nagoya, Japón). Para machos y hembras, la edad fue establecida según el peso vivo de los animales, mientras que la clasificación de las especies se realizó según los parámetros morfométricos: longitud total, largo de cola y longitud de las orejas 12.
Luego de obtener el plano de sedación e insensibilización, se realizó la eutanasia de los animales por sobredosis (60 mg/kg) de pentobarbital sódico intracardiaco (Euthanex, Bogotá, Colombia) 11. Al momento de la necropsia, se evaluó el tracto gastrointestinal en busca de endoparásitos adultos y lesiones macroscópicas compatibles con quistes parasitarios en hígado y peritoneo. Los helmintos de mayor tamaño fueron recolectados y preservados en formalina al 10% y trasladados al laboratorio clínico del zoológico para su identificación morfológica. Finalmente, un barrido del contenido intestinal presente en intestino delgado e intestino grueso fue realizado por cada animal y conservado en formalina al 10% hasta el diagnóstico parasitológico.
Diagnóstico parasitológico. Por cada barrido de contenido intestinal, las técnicas utilizadas para el diagnóstico de la infección e identificación de los parásitos gastrointestinales fueron el examen directo con solución salina fisiológica (NaCl 0.9%), flotación Sheather modificada y sedimentación Ritchie modificada 13,14. Cada animal se consideró positivo a la infección con parásitos gastrointestinales cuando se observaron huevos o larvas en al menos una de las técnicas anteriores. La identificación morfológica de cada clase, familia y género de los parásitos adultos, como de sus formas inmaduras se realizó según las claves morfológicas descritas en literatura científica 15,16,17,18.
Análisis de datos. La frecuencia de parásitos gastrointestinales se expresó en porcentajes, con su respectivo intervalo de confianza al 95% (IC 95%). Las diferencias entre las frecuencias de infección entre tipos de parásitos, edades y sector de captura de los roedores se exploraron mediante la prueba de chi-cuadrado (x2). El grado de concordancia entre las técnicas diagnósticas se determinó mediante un índice Kappa (K). Todos los análisis fueron realizados en el programa SPSS v.23.0. Un valor p<0.05 fue considerado significativo. Todas las gráficas fueron realizadas en el programa GraphPad Prism v.8.1.1.
Consideraciones éticas. Todos los procedimientos se realizaron bajo los lineamientos de las buenas prácticas clínicas y de ética establecidas en el código sanitario para los animales terrestres 19. El aval de bioética fue otorgado por el subcomité de bioética de la Universidad Cooperativa de Colombia, seccional Bucaramanga, bajo los principios éticos para el manejo de los animales, establecidos en el Estatuto Nacional de protección para los animales, Ley 84 de 1989 y la resolución No. 008430 de 1993 del Ministerio de Salud (Bogotá-Colombia).
RESULTADOS
Descripción del muestreo. Un total de 34 roedores (Rattus rattus) fueron capturados durante el período de estudio, de los cuales 53% (18/34) fueron clasificados como adultos y 47% (16/34) como sub-adultos. La mayoría de los animales fueron hembras (61.8%, 21/34) con un peso promedio de 181.3 g. Las frecuencias más altas de captura se observaron en los sectores B (35.2%, 12/34) y C (35.2%, 12/34), seguido por el sector A (29.4%, 10/34).
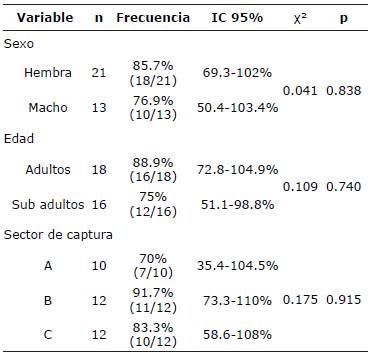
Descripción de la frecuencia de infección por parásitos gastrointestinales. Del total de animales analizados, 82.4% (IC 95% = 68.8%-95.8%, 28/34) fueron positivos a la infección con parásitos gastrointestinales en al menos una prueba diagnóstica. Las mayores frecuencias de infección se observaron en hembras (85.7%, IC 95% = 69.3%-102%, 18/21), adultos (88.9%, IC 95% = 72.8%-104.9%, 16/18) y animales del sector B (91.7%, IC 95% = 73.3%-110%, 11/12). No se observaron diferencias significativas entre las categorías analizadas (sexo, edad y sector de captura) (Tabla 1).
Tabla 1 Descripción de la frecuencia de parásitos gastrointestinales identificadas en roedores R. rattus entre las diferentes categorías analizadas.
Respecto a la caracterización de las infecciones en las muestras positivas, los parásitos encontrados con mayor frecuencia fueron los nematodos (63.2%, IC 95% = 49.2-77.2%, 31/49), seguido de los protozoos (20.4%, IC 95%= 8.7-32.1%, 10/49) y cestodos (16.3%, IC 95% = 5.6-27%, 8/49), con diferencias significativas entre los tres grupos (x2=20.7, p<0.01). Dentro de los nematodos, la familia encontrada con mayor frecuencia fue Strongylidae (77.4%, IC 95% = 61.8-93%, 24/31), seguida de Ascarididae (12.9%, IC 95% =0.4-25.4%, 4/31), Ancylostomatidae (3.2%, IC 95%=-3.3- 9.8%, 1/31), Oxyuridae (3.2%, IC 95%=-3.3-9.8%, 1/31) y Trichostrongylidae (3.2%, IC 95% = -3.3 9.8%, 1/31), respectivamente. Para el caso de los protozoos, fueron las familias Eimeriidae (60%, IC 95% = 23-96.9%, 6/10) y Entamoebidae (40%, IC 95% = 3-76.9%, 4/10), mientras que, para los cestodos, la única familia encontrada fue la Hymenolepididae (100%, IC 95% = 100-100%, 8/8) (Figura 2).
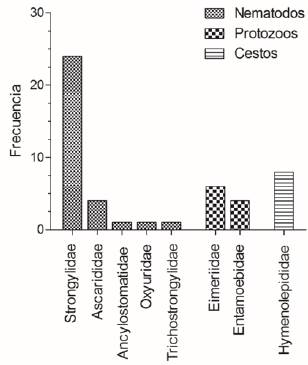
Figura 2 Frecuencia de las familias de parásitos gastrointestinales identificados en roedores sinantrópicos, capturados en el Zoológico de Barranquilla.
Al momento de la necropsia se observaron parásitos adultos en el 20.5% (IC 95% = 6.2 34.9%, 7/34) de los animales analizados, de los cuales el 14.7% (IC 95% = 2.1-27.2%, 5/34) correspondieron a quistes hidatídicos formados por larvas inmaduras de Hymenolepis sp., y el 5.8% (IC 95% = -2.4-14.2%, 2/34) a larvas de Strongylus sp., ubicadas en la luz del intestino.
Dentro de las técnicas utilizadas, la técnica de sedimentación fue la más eficaz detectando una frecuencia de infección del 76.5% (IC 95% = 61.4-91.4%, 26/34), seguido por la técnica directa (67.6%, IC 95% = 51-84.2%, 23/34) y de flotación (32.4%, IC 95% = 15.7-48.9%, 11/34). El mayor grado de concordancia, fue observado entre la técnica de sedimentación y directo con un K= 0.49 (IC 95% = 0.16 a 0.83) (Tabla 2).
DISCUSIÓN
El Zoológico de Barranquilla es uno de los principales centros recreacionales de la región Caribe colombiana donde asisten alrededor de 300 000 visitantes al año, y genera alrededor de 100 empleos directos e indirectos 20. En esta institución, los roedores sinantrópicos representan uno de los problemas de más difícil solución en el control de plagas, pues no solo provocan cuantiosas pérdidas económicas, si no también representan un riesgo de salud pública debido a su rol en la transmisión de enfermedades zoonóticas 1,2,8,9.
En este estudio, se pudo observar la presencia exclusiva de roedores sinantrópicos R. rattus con una frecuencia de infección por parásitos gastrointestinales de 82.4%. Estos resultados son similares a los reportados en centros urbanos de Perú y Cuba (64.1-77.4%) 1,2,21, pero considerablemente mayores a los observados en centros urbanos y rurales de México, en donde la prevalencia en estos mismos hospederos osciló entre el 42.7 y 52.2% 22,23. Considerando que, en América, la frecuencia de infección por parásitos gastrointestinales en roedores sinantrópicos provenientes de zoológicos, ha sido poco estudiada, la alta frecuencia de infección aquí observada puede ser explicada debido a la mayor densidad de hospederos definitivos e intermediaros presentes en el zoológico. En Brasil, algunos estudios realizados en carnívoros 24,25, llegaron a la conclusión que las condiciones de cautiverio pueden incrementar la prevalencia de infección por parásitos gastrointestinales, favoreciendo la diseminación hacia otros animales, inclusive el humano. En este sentido, mantener los programas de control de parásitos gastrointestinales, e intensificar el control de roedores, es importante para evitar la diseminación de estos parásitos a otras especies. Respecto a la presencia exclusiva de R. rattus (una especie arborícola) y su captura con trampas de piso, puede ser un indicador del nicho ecológico adecuado para esta especie, en donde la alta disponibilidad de alimento, los lugares de refugio, la falta de predadores naturales, y la capacidad de adaptación a las estrategias de control, puede generar una ventaja biológica frente a las demás especies 26. No obstante, el efecto del tipo de trampa empleada en el presente estudio la cual disminuye la probabilidad de captura de otras especies sinantrópicas 2,8, y el efecto de las estrategias de control de roedores en el zoológico, las cuales están enfocadas en roedores terrestres, también pueden explicar este resultado.
En cuanto a la caracterización de parásitos gastrointestinales, se observó que los nematodos fueron el grupo más prevalente, seguido por los protozoos y cestodos. Estos resultados son similares a los reportados en los animales de la colección del zoológico (datos no publicados), sugiriendo el papel de estos roedores como posibles reservorios en el área de estudio 1,2,8,9. Para el caso de los nematodos, la familia Strongylidae presentó una mayor frecuencia de infección, estos resultados son similares a los reportados en R. rattus, R. norvegicus y M. musculus de la isla de Cuba 21. Sin embargo, difieren de los observados en R. rattus y R. norvegicus del área metropolitana de Lima, Perú 1, en donde los nematodos identificados con mayor frecuencia pertenecieron a la familia Gongylonematidae. Esto indica que la prevalencia de cada familia varía dependiendo las condiciones ecológicas de la zona y de la diversidad de hospederos 26,27. La alta presencia de parásitos de la familia Strongylidae, puede estar asociada a las diversas vías de infección entre las que se incluye: la vía feco-oral, percutánea, y transmamaria 28, así como a una posible adaptación de estos parásitos al sistema inmune de R. rattus28. Este escenario, aunque es común en áreas urbanas, representa un riesgo de infección para las personas y animales en el zoológico, al considerarse una familia de interés zoonótico 2. Estos resultados motivaron intervenciones en el programa de control de roedores en el zoológico con el fin de reducir el riesgo de infección hacia los humanos.
La alta proporción de la familia Hymenolepididae dentro de los cestodos identificados en R. rattus, concuerdan con lo observado en otros países de América, en donde las especies R. norvegicus, M. musculus y Sigmodon hirsutus, también se han encontrado infectados con dicha familia 1,2,8,9. Aunque la transmisión directa e indirecta de estos parásitos es común entre animales silvestres, indicando la posible infección hacia animales de la colección, la importancia zoonótica de estos es baja, puesto que la infección hacía el humano solo se produce mediante el consumo accidental de hospederos intermediarios como escarabajos y pulgas de los géneros: Tenebrio, Tribolium, Ctenocephalides, Pulex y Xenopsilla, infectados con el cisticercoide 9. De otro lado, las altas prevalencia de protozoos de las familias Eimeriidae y Entamoebidae, son mayores a las observadas en países de Centro América en los cuales la prevalencia de estas familias no supera el 5% 21. Teniendo en cuenta que el consumo de agua contaminada con quistes de estos parásitos es considerado la principal vía de infección en animales y humanos 21, es importante que futuros estudios determinen si el agua utilizada en el zoológico es una fuente de infección.
Finalmente, aunque en el presente estudio empleando técnicas parasitológicas se determinó una alta frecuencia de infección por parásitos gastrointestinales, así como la presencia de algunas familias de importancia zoonótica, la falta de técnicas altamente sensibles y específicas dificultó conocer en detalle el papel de estos roedores en la trasmisión de especies de importancia en la salud pública y animal. Futuros estudios empleando técnicas diagnósticas como la PCR, PCR en tiempo real, entre otras técnicas moleculares, son necesarios para solucionar estas dificultades. En conclusión, la alta prevalencia de infección por parásitos gastrointestinales en R. rattus del Zoológico de Barranquilla evidencia la importancia de estos animales como fuentes de infección para otros animales y los seres humanos. La alta frecuencia de parásitos de la familia Strongyloidae en los roedores capturados en el sitio de estudio, sugiere un riesgo de salud pública, lo cual motivó a intensificar las medidas de control para disminuir el riesgo de infección y mejorar el estatus sanitario.















