Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Médica de Risaralda
Print version ISSN 0122-0667
Revista médica Risaralda vol.18 no.2 Pereira July/Dec. 2012
Reporte de caso
Sepsis por Acinetobacter baumannii multirresistente: a propósito de un caso
Javier Enrique Hernández Blanco*; Ana Milena Arrieta Aguilera**; Dewitt Fabian Arcón Medina**; Juan Enrique Castellano Orcasita**.
*Médico Internista, Gastroenterólogo y Epidemiólogo, Docente del Programa de Medicina, Hospital Universitario Fernando Troconis, Facultad de Ciencias de la Salud, Universidad del Magdalena, Santa Marta, Magdalena, Colombia.
**Estudiantes del XII semestre, Programa de Medicina, Hospital Universitario Fernando Troconis, Facultad de Ciencias de la Salud, Universidad del Magdalena, Santa Marta, Magdalena, Colombia. Correo electrónico: dfam24@hotmail.com
Recibido : 17-06-2012.
Aceptado : 27-08-2012.
Resumen
En este artículo se revisa el caso clínico de un paciente con cuadro de infección nosocomial por Acinetobacter baumannii multirresistente, quien a pesar del tratamiento instaurado presentó deterioro de su condición clínica. Se realiza una revisión bibliográfica en diversas bases de datos con el fin de mencionar actualizaciones en el tema y describir el mecanismo de acción antibiótica y resistencia bacteriana que ha dificultado en los últimos años el manejo de estos pacientes.
Palabras claves: Infección nosocomial; Multirresistencia; Acinetobacter baumannii; Colombia.
Sepsis due to multidrug resistant Acinetobacter baumannii
Abstract
In this article we describe a multidrug resistant (MDR) Acinetobacter baumannii nosocomial infection clinical case. This patient in spite of having received established medical treatment presented deterioration of his clinical condition. A deep research was made in several data bases in order to present updated information in the topic and to describe the mechanism of action of antibiotics and bacterial resistance that has made difficult the management of these patients.
Key Words: Nosocomial infection; Multidrug Resistant; Acinetobacter baumannii; Colombia.
Introducción
Las especies de Acinetobacter se encuentran distribuidas por toda la naturaleza, siendo encontradas en agua, suelo y vegetales (1). Existen condiciones que favorecen la infección por A. baumannii tales como, pacientes con comorbilidades graves, estancias hospitalarias prolongadas, en especial en unidad de cuidados intensivos (UQ), uso previo y extenso de multiterapia antimicrobiana, diversos procedimientos médicos y cirugías invasivas (2). La mortalidad de tales infecciones es elevada alcanzando el 52% asociado a bacteriemia y 23%-73% en neumonía. Acinectobacter baumannii puede actuar como fomite susbsistiendo con escasos nutrientes y a pH y temperaturas variables. se ha descrito que 31% del personal de salud porta la bacteria en su piel siendo la segunda más frecuente (7,5%) (3).
Acinetobacter baumanii se describió por primera vez en 1911, en el suelo, por Beijerinck, quien lo nombró Micrococcus calcoaceticus. La familia Acinetobacter, se ha catalogado en aproximadamente 10 especies géneros, ya que han sido descubiertas independientemente por diversos autores, sin características especificas, que llevaban a confusiones taxonómicas. A partir de la década de los 1950s, Brisou y Prévot, crean el grupo Acinetobacter, que reúne bacterias saprofitas y ubicuas, sin pigmento (Achromobactereae). Actualmente se conocen 32 especies genómicas, de esta especie.
Este grupo de bacterias, se caracteriza por los siguientes aspectos: oxidasa-negativo, catalasa positivo, estrictamente aeróbica, el metabolismo respiratorio estricto, sin flagelos, que son inmóviles, no forman esporas , y aparecen bajo el microscopio como cocos (fase estacionaria) o bacilos cortos, a menudo en pares o montados en cadenas más largas (4).
Su principal hospedador es el ser humano. Por sus características biológicas, el A. baumanii, es resistente al lavado de con desinfectantes y antisépticos; por tanto cabe la posibilidad que dicho microorganismo llegue a los equipos médicos, a través de la manipulación de éstos por parte del personal, configurando así una forma de contaminación del paciente (5).
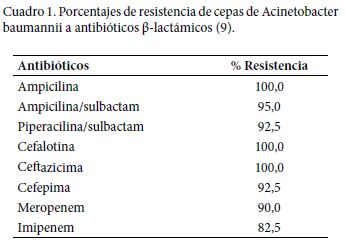
El término multirresistente se otorga a bacterias inmunes a más de tres familias de antibióticos (6), la aparición de estas cepas le ha atribuido el nombre de “naturalmente transformable” (7); en el Cuadro 1 se muestra el patrón de resistencia a betalactámicos de esta bacteria observándose la alta prevalencia de resistencia siendo las más baja la del imipenem. El Acinetobacter baumannii multirresistente posee mecanismos moleculares intrínsecos que vulneran los antibióticos, a continuación se revisaran brevemente algunos de ellos.
Se ha descrito que el gen AbaR1 codifica las beta-lactamasas VEB-1, AmpC y OXA 10, enzimas modificadoras de aminoglucósidos (AMEs) y bombas de eflujo contra tetraciclinas. La resistencia a los p-lactámicos está dada por la producción de p-lactamasas, las tipo A de clase de espectro extendido (ESBLs), la clase B son metalo-betalactamasas (MBLs) que hidrolizan carbapenems y otros betalactámicos exceptuando el aztreonam, las tipo C o cefalosporinasas derivadas de Acinetobacter(ADCs) que hidrolizan penicilinas y cefalosporinas de amplio espectro excepto el cefepime y carbapenemes, y las clase D denominadas OXAs (oxacilinasas) que inhiben carbapenemes, (OXA-23 y OXA-58). Existen otras vías de resistencia: la inhibición de las proteínas ligadoras de penicilina (PBP), esto se produce mediante la formación de canales de 29kDa, quienes lo configuran para la inhibición y poco acoplamiento de las penicilinas al germen, y así evita la destrucción de la pared bacteriana, además fallas en la estructura y numero de las porinas disminuyendo la permeabilidad del antibiótico al microorganismo (8).
Adicionalmente, existen los sistemas de bombas de eflujo, el más representativo es AdeABC, quien controla la expresión de esta bomba depende de dos genes: regulador (ade R) y sensor (ade S), una mutación aumenta estas proteínas conllevando a la eyección de aminoglucósidos, cefotaxime, tretracilinas, eritromicina, cloranfenicol, trimetropim y fluoroquinolonas (9).
Los aminoglucósidos se ven inhibidos también por las AMEs por mecanismos no bien detallados, de igual forma las quinolonas sufren resistencia por la acción de los genes gyrA y parC de DNA girasa impidiendo la unión del fármaco a esta proteína. Últimamente se ha descrito un nuevo modo de resistencia contra tetraciclinas mediadas por los genes Tet A y Tert B los cuales median la eyección de este antibiótico al ambiente extra bacteriano. Ninguna de estas estrategias afecta a la tigeciclina aunque ya se han reportado algunos casos (9).
Caso
Masculino de 83 años de edad, con cuadro clínico de 3 horas de evolución, caracterizado por dolor súbito en hemitórax izquierdo, dolor abdominal en hipocondrio derecho intenso, irradiado a región infraescapular ipsilateral atenuándose en posición genupectural. Al examen físico presión arterial (sistólica/diastólica): 85/70 mmHg, frecuencia cardíaca: 120 por minuto, frecuencia respiratoria: 19 por minuto, palidez mucocutánea generalizada, fascies álgica, matidez, abolición de murmullo vesicular y disminución de las vibraciones vocales bibasales, ruidos cardiacos taquicárdicos, no soplos. Hay dolor a la palpación abdominal, con predominio en hemiabdomen derecho, además defensa involuntaria a la palpación profunda.
Se realizan paraclínicos, encontrándose: leucocitosis de 18.000/mm3, bilirrubina total sérica de 75 umol/L, y amilasas séricas de 912 ul/L, por sospecha de abdomen agudo quirúrgico se decide realizar laparotomía exploratoria y terapéutica, en la cual se evidenció pancreatitis aguda necrotizante severa secundaria a colelitiasis, por lo cual se realizó necrosectomía pancreática. Fue trasladado a UCI, con diagnóstico de bacteriemia por gram negativos.
Al ingreso a UCI paciente en monitoreo continuo, con ventilación asistida, soporte vasopresor con norepinefrina y dobutamina, se canaliza vía femoral, con nutrición parenteral. En su día 17 de estancia presentó deterioro de condición clínica, leucocitosis 33.980 blancos/mm1, inestabilidad hemodinámica, alteración del sensorio, hemocultivo reportó Pseudomonas aeruginosa sensible a meropenem, se inició manejo antibiótico con este a dosis de 0,5 g IV c/24 horas.
Los cultivos de secreciones del tubo endotraqueal y punta de catéter resultaron positivos para Acinetobacter baumannii multirresistente sensibilidad intermedia a tigeciclina, instaurándola a dosis de 50 mg IV c/12 horas. A pesar del manejo empleado el paciente evoluciona hacia el deterioro, con mayor compromiso sistémico y sepsis de origen pulmonar, falleciendo 2 días después debido a falla multiorgánica.
Discusión
La sepsis se define como la instauración de un foco infeccioso, acompañado de un proceso sistémico, denominado síndrome de respuesta inflamatoria sistémica (SIRS: del inglés System Inflammatory Response Syndrome), el cual conlleva a una descompensación multiorgánica en sus fases ulteriores (10).
La sepsis por bacterias Gram negativas es un reto para el personal médico. En la actualidad las cepas de A. baumannii, han adquirido resistencia a innumerables antibióticos, por tal motivo se hace necesario el uso apropiado de éstos según los patrones de sensibilidad del antibiograma. Además se requiere la adecuada asepsia de las equipos médicos y del personal concientizándolos en la importancia de la normas de bioseguridad, para evitar la transmisión de diferentes gérmenes nosocomiales, incluido el A. baumannii.
Existen múltiples estudios, que exploran las alternativas de tratamiento para la infección por A. baumannii. Se han retomado antibioticoterapias que se descartaron por presentar altas tasas de toxicidad, como las polimixinas B y E (colistina). Se ha demostrado las bajas tasas de toxicidad, tal vez dado por las menores dosis administradas. Estos antibióticos han mostrado eficacia en el tratamiento de cepas multirresistente de este microrganismo. Las opciones son escasas, dada la poca eficacia de los medicamentos, sumado a los increíbles mecanismos de resistencia (11).
Cuando se presentan infecciones por microrganismos multirresistente, las alternativas son combinaciones de medicación, por tanto se ha usado la colistina en combinación con rifampicina, imipenem o azitromicina, esto como fruto de estudios de estos in vitro. Pero las respuestas han sido mejores en la combinaciones de colistina más rifampicina, esto platea una pregunta, ¿porqué no se usó en el caso actualmente en estudio? (11).
El caso clínico presentado fue el segundo caso detectado de infección por A. baumannii en la UcI de la institución de salud, y el primero que mostraba multiresistencia, que solo presentó sensibilidad en mediana cantidad a la tigeciclina. En contraste a múltiples estudios, donde se afirma que en muchas cepas estudiadas la mejor opción es la colistina. se consideran las posibilidades que el origen de la infección, haya sido por contaminación y condiciones precarias tanto del personal hospitalario, como de los instrumentos usados.
Finalmente lo importante para controlar las infecciones por A. baumannii es identificar la presencia de este microorganismo en el área asistencias médica correspondiente, aplicar medidas de estudios, seguimiento y control y realizar tratamientos antibióticos específicos basados en la sensibilidad del microorganismo reportado por antibiogramas para evitar el uso de medidas terapéuticas inespecíficas que puedan llegar a generar nuevos mecanismos de resistencia bacteriana. La aplicación de un correcto lavado de manos por parte del personal asistencial debería ser la principal medida preventiva para disminuir el riesgo de infecciones no solo para el A. baumannii, sino también para todo tipo de microorganismos.
Conflicto de intereses:
Los autores declaran no tener conflictos de intereses.
Referencias
1. Longo D, Fauci A, Kasper D, Hauser S, Jameson J, Loscalzo J. Diseases caused by Gram-Negative Bacteria. Acinetobacter Infections. In: Dan Longo Editor. Harrinson's Online Principles of Internal Medicine. 18° Edition USA: McGraw -Hill; 2011. [ Links ]
2. Hernández Torres A, García Vázquez E, Yagüe G. Acinetobacter baumanii multirresistente: Situación clínica actual y nuevas perspectivas. Rev Esp Quimioter 2010; 23(1):12-19. [ Links ]
3. Opazo A. Mella S. Domínguez M. Bello H. González G. Bombas de expulsión multidrogas en Acinetobacter baumannii y resistencia a antimicrobianos. Rev Chilena Infectol 2009; 26(6):499-503. [ Links ]
4. Barbe V, Vallenet D, Fonknechten N, Kreimeyer A, Oztas S, Labarre L, Cruveiller S, Robert C, Duprat S, Wincker P, Weissenbach J, Marlière P, Médigue C. Une bactérie hautement compétente pour la transformation naturelle. Octubre 28, de 2004. Disponible: http://www.genoscope.cns.fr/spip/Acinetobacter-baylyi-competente.html (Fecha de Acceso: 20-08-2012). [ Links ]
5. Garnacho-Montero J, Amaya-Villar R. Multiresistant Acinetobacter baumannii infections: Epidemiology and management. Curr Opin Infect Dis 2010; 23(4):332-339. [ Links ]
6. Cantón Moreno R. Gram Negativos Multirresistentes: Estado actual y soluciones. Curso pre-congreso de Resistencia Bacteriana Congreso Chileno de Infectología. 5 de noviembre de 2008; Departamento de Microbiología II. Universidad Complutense. Madrid. Pág. 1-44. [ Links ]
7. Giamarellou H, Antoniadou A, Kanellakopoulou K. Acinetobacter baumannii: A Universal Threat to Public Health. Int J Antimicrob Agents 2008; 32(2):106-19. [ Links ]
8. Hart M, Espinosa F, Halley M. Resistencia a antibióticos en cepas de Acinetobacter baumannii aisladas de Enero a Marzo del 2010 en el Hospital Clinicoquirúrgico "Hermanos Ameijeiras". Rev Cubana Med 2010; 49(3):218-227. [ Links ]
9. Perez F, Hujer AM, Hujer KM, Decker BK, Rather PN, Bonomo RA . Global Challenge of Multidrug- Resistant Acinetobacter baumannii. Antimicrob Agents Chemother 2007; 51(10):3471-3484. [ Links ]
10. Restrepo M, Dueñas C, González M, et al. Consenso colombiano en sepsis. Infectio 2007; 11(1):46-56. [ Links ]
11. Lee JY, Ko KS. Antimicrobial Resistance and Clones of Acinetobacter Species and Pseudomonas aeruginosa. J Bacteriol Virol 2012; 42(1):1-8. [ Links ]
Revista Médica de Risaralda
Vol 18 N°2 Diciembre de 2012