Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Médica de Risaralda
Print version ISSN 0122-0667
Revista médica Risaralda vol.21 no.1 Pereira Jan./June 2015
Artículo de Revisión
HER-2: Un marcador molecular usado en el diagnóstico, pronóstico y tratamiento del cáncer de mama
Colonia Ana1, Rivera Juliana2, Orozco Juan3, Marín Daniel3
1 Ingeniera Química, estudiante Maestría en Biología Molecular y Biotecnología, Centro de Biología Molecular y Biotecnología de Pereira (CENBIOTEP), Universidad Tecnológica de Pereira.
2 Bacterióloga, estudiante Maestría en Biología Molecular y Biotecnología, Centro de Biología Molecular y Biotecnología de Pereira (CENBIOTEP), Universidad Tecnológica de Pereira.
3. Estudiantes de Medicina, Universidad Tecnológica de Pereira, Centro de Biología Molecular y Biotecnología de Pereira (CENBIOTEP).
Correo electrónico: jporozco1994@hotmail.com
Fecha de Recepción: 6/09/2014
Fecha de Solicitud de Correcciones: 10/12/2014
Fecha de Aceptación: 02/05/2015
Resumen
Actualmente, la causa específica del cáncer de mama es desconocida, pero han sido identificados una gran variedad de genes implicados en su desarrollo. Uno de estos es el HER2, cuya sobreexpresión, y por ende la de sus receptores, está presente en cerca del 20 al 30% de los cánceres de mama como resultado de la amplificación de la región cromosómica 17q12-21, y está asociado con subtipos agresivos y con sobrevidas bajas. La expresión de receptores proporciona información fundamental para el diagnóstico, pronóstico y el tratamiento en pacientes con cáncer de mama. Un diagnóstico preciso del estado de HER2 es fundamental debido a su relación al tratamiento con Trastuzumab y otros medicamentos que mejoran la sobrevida de estos pacientes. Para el diagnóstico se han diseñado varias técnicas, las cuales determinan el estado de HER2 en tejidos tumorales, tales como Inmunohistoquímica (IHQ) e Hibridización In situ (ISH). Algunos de los resultados obtenidos por IHQ son catalogados como no concluyentes, por ello se ha planteado la IHQ como prueba de detección primaria seguida por una prueba ISH confirmatoria.
Palabras clave: Genes, erbB-2; Neoplasias de la Mama, Biología Molecular; Hibridización In situ, Fluorescencia
HER-2: A molecular marker used in the diagnosis, forecasting and treatment of breast cancer.
Abstract
Currently, the specific cause of breast cancer is unknown, but have been identified a variety of genes involved in its development. One of these is the HER2, whose overexpression, and hence their receptors, is present in about 20 to 30% of breast cancers as a result of amplification of the chromosomal region 17q12-21, and is associated with aggressive subtypes and with low survival. Receptor expression provides critical information for the diagnosis, prognosis and treatment in patients with breast cancer. Accurate diagnosis of HER2 status is essential because of its relationship to treatment with Trastuzumab and other drugs that improve survival in these patients For diagnosis have been designed several techniques, which determine HER2 status in tumor, such as immunohistochemistry (IHC) and in situ hybridization (ISH). Some of the results obtained by IHC are classified as inconclusive, so the IHC has emerged as a primary screening test followed by an ISH confirmatory test.
Keywords: Genes, erbB-2; Breast Neoplasms; Molecular Biology; In Situ Hybridization, Fluorescence
Introducción
En Colombia el cáncer de mama es la causa de muerte de aproximadamente 1.700 mujeres por año, lo que la posiciona como la segunda neoplasia maligna más frecuente, con una tasa de incidencia estimada de 30 por cada 100.000 mujeres, similar a la del cáncer de cuello uterino con una de 33 por cada 100.000 mujeres (1). En el eje cafetero se ha descrito una importante prevalencia de 4206 casos de cáncer de mama que consultaron entre los años 2001 al 2011, de los cuales el 37,9%, residen en Risaralda, lo cual lo hace el cáncer más prevalente en la región, con cifras anuales en aumento y seguido por el cáncer de cuello uterino con 1641 casos (2).
El cáncer es un proceso que ocurre en múltiples pasos y con alteraciones secuenciales en múltiples genes. Los oncogenes son vitales en las células pues son los encargados de codificar proteínas para controlar la proliferación celular y la apoptosis, y son sensibles a mutaciones, translocaciones o amplificaciones que lleven a su sobreactivación. Los productos de su activación pueden ser varios, entre ellos factores de crecimiento, de transcripción y receptores de factores de crecimiento (3). HER2 es un oncogén y su sobreexpresión se asocia con nodos positivos, alto grado histológico, alta tasa de proliferación y la falta de expresión de los receptores de estrógeno y progesterona, lo cual está asociado con un fenotipo más agresivo con disminución de la tasa de supervivencia (4, 5). HER2 hace posible establecer pronóstico, supervivencia libre de enfermedad y predecir la respuesta al tratamiento Anti-HER2 (6-9). Existen varios métodos para medir y cuantificar el estado de HER2, entre estos la Inmunohistoquímica (IHQ) y las técnicas de Hibridización In situ con Fluoresencia (FISH) y cromogénica con doble color (DISH).
Una revisión de historias clínicas en el eje cafetero encontró que el 49% de los resultados del análisis de HER2 mediante IHQ fueron inconcluyentes. El reporte inconcluyente exige la realización de pruebas confirmatorias para determinar el estado real de HER2, para precisar un tratamiento adecuado. Sin embargo, en Colombia sólo en el año 2012 se incluyó dentro del Plan Obligatorio de Salud (POS) la evaluación de gen HER2 mediante FISH para respaldar el manejo de los pacientes con cáncer de mama HER2 positivo, por lo que hasta el 2011 no se contó con las herramientas adecuadas para hacer un diagnóstico y tratamientos efectivos (10).
Este artículo pretende hacer énfasis en el cáncer de mama con HER2 sobreexpresado, sus características como biomarcador, los mecanismos de amplificación del gen, el tratamiento Anti-HER2, y las técnicas diagnósticas para su detección.
Cerca del 20-30% de los cánceres de mama están caracterizados por una amplificación de éste gen y por la sobreexpresión de su producto proteico (11-15). Una célula que produzca este receptor en niveles normales tiene dos copias del gen y 50.000 copias de la proteína. Sin embargo, en células cancerígenas con HER2 amplificado hay más de dos copias del gen y aproximadamente 1.000.000 de copias de la proteína (16).
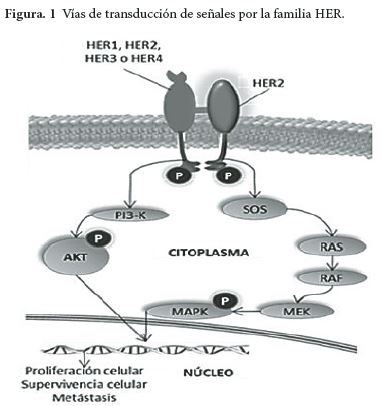
HER2 es un componente fundamental de complejas vías de señalización (Figura 1) que incluyen a los miembros de la familia de receptores del factor de crecimiento epidérmico humano (HER), muchos de los cuales también están involucrados en la formación de procesos oncogénicos (11). Su alteración en células normales puede dar lugar a una sobreexpresión, conduciendo a la proliferación y crecimiento. La existencia de varios receptores anormales de esta familia se ha vinculado al crecimiento del tumor, su supervivencia y metástasis (12, 16-19).
La dimerización es un requerimiento esencial de la funcionalidad y de las vías de señalización en las que participa HER2. Esta ocurre entre dos receptores iguales (homodimerización) o dos receptores distintos (heterodimerización). Sin embargo, en cánceres HER2 positivos la sobreexpresión de este receptor está asociada con la dimerización excesiva que contribuye a supervivencia celular, proliferación celular y carcinogénesis (18, 19).
Cada receptor de la familia HER (EGFR o HER1, HER3, y HER4) tiene 3 dominios: el dominio extracelular, el transmembrana y el intracelular. Los cuales son necesarios para la activación del receptor y la señalización intracelular. Con el fin de activar las vías de señalización interna, los receptores se deben dimerizar utilizando el sub-dominio de dimerización localizado en el dominio extracelular del receptor (19).
Estos receptores existen naturalmente en una conformación “cerrada” en la cual el sub-dominio de dimerización está oculto y, como resultado, el receptor es incapaz de formar dímeros. La unión del ligando a estos receptores genera un cambio conformacional que expone al sub-dominio de dimerización permitiéndole dimerizarse e iniciar la cascada de señalización interna. HER2 es el único receptor de la familia que existe en una conformación “abierta” listo para dimerizarse. Cuando los miembros de la familia HER se dimerizan, los residuos tirosina del dominio intracelular de HER2, por medio de fosforilación activan vías mitogénicas por Ras/Raf/MEK/MAPK o PI3K/AKT desencadenando diversos procesos celulares para la supervivencia sostenida de las células tumorales (12, 16-19). Uno de los muchos efectos consiguiente es la producción del factor de crecimiento endotelial vascular (VEGF) que mantiene la angiogénesis (11).
Mecanismos de amplificación del gen HER2
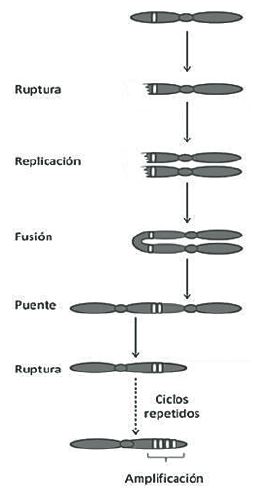
Existen por lo menos dos mecanismos genéticos que pueden generar un aumento en el número de copias del gen HER2. Uno es la amplificación que es un proceso que involucra la replicación preferencial de un segmento de un cromosoma sin que ocurra un incremento proporcional del genoma entero que lo contiene (13), lo cual se puede dar por acortamiento de telómeros, ciclos repetidos de rompimiento fusión puente (ciclos BFB, del inglés Breakage Fusión Bridge Cycles, ver Figura 2) (20, 21) y la incorporación de secuencias desde múltiples cromosomas (22).
El otro es la aneuploidia, un cambio en el número total de cromosomas que a veces se conoce como inestabilidad cromosómica. Estos cambios son por lo general el resultado de una segregación anómala durante la mitosis. La aneuploidia del cromosoma 17, que usualmente ocurre como un aumento en el número de copias cromosómicas (polisomía), es encontrada en casi un tercio de los cánceres de mama. Ésta provoca un incremento en el número de copias del gen HER2, aunque no significa amplificación ya que los tumores con polisomía del cromosoma 17 sin amplificación del gen HER2 son patológicamente indiferenciables de los tumores HER2 negativos. Los tumores con copias extras del gen HER2 como resultado de la polisomía son diferentes de los tumores con copias extras resultantes de la amplificación del gen (22-24).
Figura 2. Ciclo BFB. La fuerza del movimiento de los dos centrómeros a los polos opuestos del huso durante la división celular rompe el cromosoma dicéntrico en una ubicación variable. La replicación de un cromosoma roto genera una estructura de fusión de cromátides hermanas por su extremo roto. El cromosoma resultante (con dos centrómeros) sufre otra ruptura cuando los centrómeros segregan hacia los dos núcleos hijos. La fusión de estos extremos rotos de ADN lleva al inicio de otra ronda de rupturas y fusiones que resultan en deleciones o amplificaciones genéticas (14, 20) que resultan en una acumulación de segmentos genómicos dentro del cromosoma.
Tratamiento del cáncer de mama HER2 positivo
La importancia clínica de determinar el estado de HER2 radica en que aquellos tumores que exhiben su amplificación presentan una mayor resistencia a los tratamientos convencionales de quimioterapia y terapia hormonal, con una menor tasa de supervivencia. No obstante, responden mejor al tratamiento combinado de quimioterapia con trastuzumab (11, 25), lo cual aumenta la tasa media de supervivencia (1, 26) . De igual manera se ha desarrollado nuevos medicamentos para este tipo de pacientes (Figura 3). Los ensayos clínicos de estas terapias se pueden revisar en otros lugares (27).
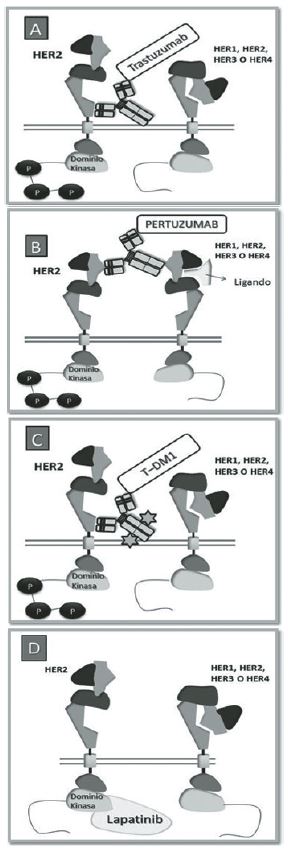
Trastuzumab (Herceptin®) es un anticuerpo monoclonal humanizado que ha mejorado la sobrevida global y libre de enfermedad de pacientes con cáncer de mama HER2 positivo (11, 25). Se dirige al dominio extracelular del receptor HER2 y previene la activación de su dominio tirosina cinasa por medio de varios mecanismos. Entre éstos están el bloqueo directo de la dimerización de HER2, el clivaje de su dominio extracelular, el aumento de la destrucción del receptor mediado por endocitosis y la activación del sistema inmune. Se ha sugerido que su porción Fc conservada permite el reclutamiento de células inmunes efectoras responsables de la citotoxicidad dependiente de anticuerpos, y se cree también que puede inhibir la angiogénesis (11, 28). Sin embargo, al ser una molécula grande, su paso a través de la barrera hemato-encefálica puede no ser eficiente y por esta razón el sistema nervioso central parece ser una zona propicia para la metástasis(11). Se ha reportado efectos cardiotóxicos debido al uso de este medicamento (29-31).
La FDA aprobó recientemente el Pertuzumab (Perjeta®) (32), un anticuerpo monoclonal humanizado que, en comparación con trastuzumab, se une a un epítopo diferente del dominio extracelular de HER2 e impide su dimerización principalmente con HER3, relacionado a mal pronóstico en pacientes con cáncer de mama(33). El Pertuzumab ha demostrado gran utilidad como tratamiento de primera línea para cáncer de mama metastásico combinado con trastuzumab y docetaxel sin incremento en los efectos cardiotóxicos(34).
Lapatinib (Tykerb®), una molécula pequeña que actúa como inhibidor de la actividad tirosina cinasa de los receptores de HER2 y del HER1(35), surgió como una terapia alternativa para pacientes con cáncer de mama metastásico HER2 positivo en donde hubo progresión del cáncer luego de tratamientos basados en trastuzumab (debido al desarrollo eventual de resistencia a este medicamento); para estos casos, el Lapatinib usado en terapia combinada ha logrado buenos resultados (36, 37).
Trastuzumab Emtansine (Kadcyla®); también llamado T-DM1 por sus siglas en inglés Trastuzumab - derivative of maytansine) (38), un conjugado fármaco-anticuerpo para casos de resistencia a terapias basadas en trastuzumab en cáncer de mama metastásico, ha dado muy buenas expectativas (39). Su mecanismo de acción se basa en el uso de trastuzumab unido a la actividad citotóxica del inhibidor de microtúbulos DM1, lo que resulta en la detención del ciclo celular y la muerte por apoptosis (40). Estos tratamientos van dirigidos a las células cancerosas con HER2 sobreexpresado, por lo que tienen un buen índice terapéutico con poca exposición al tejido normal, dando pocas reacciones adversas, generalmente trombocitopenia y elevación de transaminasas (39, 41). Se están realizando 14 ensayos clínicos actualmente con estos medicamentos para evaluar sus beneficios en combinaciones (39). Otras terapias como el Afatinib, Neratinib, MM-11, vacunación, entre otras están en estudio (27, 42).
Figura 3. Unión a epítopos de los tratamientos para cáncer de mama HER2 positivos. A) Trastuzumab. B) Pertuzumab. C) Trastuzumab emtansine (T-DM1). D) Lapatinib. Se representan los sub-dominios de los receptores de la familia HER. Trastuzumab se une el subdominio IV de HER2. Pertuzumab se une al sub- dominio II, la activación del receptor HER3 por unión de su ligando puede activar el dominio kinasa de HER2 por efecto alostérico. T-DM1 se une al subdominio IV al igual que trastuzumab; las estrellas indican el agente citotóxico unido a trastuzumab DM1. Lapatinib se une al dominio tirosina cinasa e impide la activación de las vías de señalización de HER2 (11, 26, 27, 34, 37, 40, 41).
Técnicas para la determinación del estado de HER2
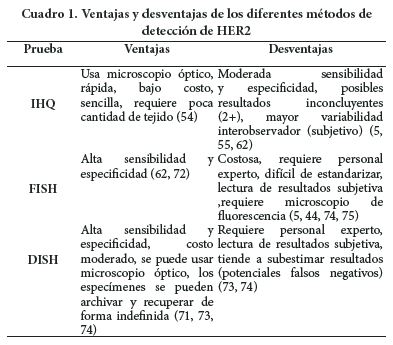
Existen diversas técnicas enfocadas en la medición de las copias del gen, el ARN mensajero o la expresión proteica, pero sólo tres han sido aprobadas por la FDA para diagnóstico In vitro: análisis de IHQ, hibridización In situ (43) y ensayo por inmunoabsorción ligado a enzimas (44, 45). Estas han mostrado buena correlación en estudios comparativos, pero existen discrepancias y cada una presenta sus propias ventajas y desventajas. Hasta el momento, no hay una verdadera técnica que pueda ser catalogada como el estándar de oro, aunque la prueba FISH para HER2 es actualmente el procedimiento ISH más utilizado (46) dado que es la menos dependiente de la técnica de IHQ que las otras técnicas ISH (47).
En la actualidad IHQ y FISH son las técnicas recomendadas para la evaluación del estado de HER2 en muestras clínicas (18, 48-50). La técnica IHQ es rápida, sencilla y económica. Consiste en someter las placas a incubación con anticuerpos dirigidos a HER2 y marcados con cromógenos, que pueden ser visualizados por la tinción de las membranas celulares del tejido tratado (26). Los casos en los que hay una fuerte tinción de la membrana con una calificación IHQ de 3+ muestran buena concordancia con la amplificación del gen HER2 por FISH y son estos pacientes los que más se benefician de la terapia con trastuzumab. Los casos que resultan en una calificación IHQ de 0 a 1+ se correlacionan con la ausencia de amplificación del gen HER2 (evaluado por FISH) y se les considera HER2 negativos (HER2-) (25, 51). Sin embargo, la puntuación IHQ 2+ que es la más frecuente se asocia a resultados inconcluyentes respecto al estado de HER2 (48, 52-61), lo que restringe la confiabilidad de esta técnica por sí sola y ha dado lugar a diferentes recomendaciones(62).
FISH es una técnica de alta precisión con excelente sensibilidad y especificidad para la detección de la amplificación del gen HER2 cuando el análisis por IHQ ha resultado inconcluyente (55). Además, la determinación de la amplificación del gen HER2 mediante FISH se considera el mejor indicador para iniciar el tratamiento con trastuzumab en pacientes con carcinoma de mama invasivo (50, 63-66). La eliminación de los falsos positivos en los resultados para HER2 es igualmente relevante, debido al riesgo de disfunción cardíaca asociada al trastuzumab (11, 13, 29, 31, 67) y al alto costo de este medicamento (13, 26, 51, 65, 68).
Principio de detección de la técnica FISH
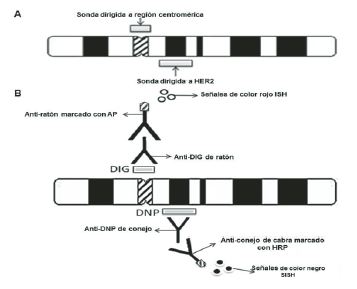
La técnica FISH de dos colores que utiliza dos sondas, una específica de gen y otra dirigida a la región centromérica de un cromosoma (Figura 4), es ampliamente utilizada para el estudio In situ de número de copias de un gen. El resultado final es una relación entre el número de señales del gen y el número de señales centroméricas. Dicha relación es de gran importancia para distinguir entre polisomía y amplificación de gen (62). Para el diagnóstico In vitro de HER2 en cáncer de mama se define como célula normal a la que contiene 2 copias del gen HER2 o hasta 4 copias cuando la célula se encuentra en división. La célula que sufre amplificación del gen posee más de 4 copias o tiene una tasa de la relación HER2/cromosoma 17 mayor a 2 (69). Los resultados se visualizan con un microscopio de fluorescencia como señales fluorescentes de color naranja y verde.
Principio de detección de la técnica DISH
DISH se basa en el uso de anticuerpos reporteros etiquetados con peroxidasa o fosfatasa alcalina que son detectados mediante una reacción enzimática (43, 70). El sistema emplea dos tipos de sondas de ADN, una para la detección del gen HER2 y otra para el cromosoma 17 (Chr17). Su especificidad está parcialmente garantizada por el uso de segmentos de ADN idénticos a los usados en FISH (71). Las sondas hibridizadas se visualizan con ayuda del microscopio óptico como puntos discretos negros y rojos en los núcleos de las células del tumor que representan el gen HER2 y el cromosoma 17, respectivamente.
El reporte de resultados se presenta de la siguiente forma:
HER2/Chr17<2,0 y,
HER2/Chr17>2,0
Figura 4. A) FISH con dos sondas. La primera está dirigida al locus del gen HER2. La segunda sonda es específica para el satélite alpha de la región centromérica del cromosoma 17 (17p11.1-q11.1 (72). B) DISH con dos sondas y dos anticuerpos. La sonda dirigida a HER2 está etiquetada con el hapteno dinitrofenilo (DNP) y la sonda específica para las secuencias del satélite alpha del cromosoma 17 está etiquetada con el hapteno digoxigenina (DIG). A la primera se le une el anti-DNP y a éste se une anticuerpo no específico anti-conejo marcado con peroxidaxa del rábano (HRP, del inglés horseradish peroxidase) que da una coloración negra . A la segunda se le une el anti-DIG y a éste se une el anticuerpo anti-ratón conjugado con la enzima fosfatasa alcalina (AP, del inglés alkaline phosphatase) que da una coloración roja.
Comparación entre las técnicas de medición de HER2
En el Cuadro 1 se presentan los parámetros de desempeño reportados las distintas técnicas de detección. La IHQ se realiza de forma rápida en menos de 1 día, mientras que FISH tarda ~ 3 días, sin embargo se ha optimizado esta última para duraciones mucho menores. Además, la IHQ genera resultados inconcluyentes en aproximadamente el 1520% de los casos, mientras que FISH en ~ 5%. (73, 74).
Conclusiones
Un diagnóstico preciso y confiable de HER2 es crucial a la hora de dirigir el tratamiento y establecer el pronóstico clínico correcto. Los resultados indeterminados (2+) del estado de HER2 obtenidos por inmunohistoquímica deben ser esclarecidos por técnicas de hibridización In situ para así evitar sobrecostos e inefectividad del tratamiento con trastuzumab y otros medicamentos en pacientes con resultados falsos positivos.
Hasta la fecha, las técnicas de inmuhistoquímica e hibridización In situ con fluorescencia (FISH) son las más utilizadas para el diagnóstico In vitro de HER2. Las técnicas de hibridización In situ se han destacado por su alta especificidad y sensibilidad para determinar el estado de HER2, siendo sugeridas por el Colegio Americano de Patólogos como pruebas confirmatorias para la evaluación de casos no concluyentes por IHQ.
Conflictos de interés
Los autores declaramos que no tenemos ningún conflicto de interés.
Referencias
1. González L, Ávila A, Echeverri C, Jaramillo S, Salazar RD, Aristizábal BH. Cáncer de mama: HER2/neu, métodos diagnósticos y consideraciones clínicas. Revista Colombiana de Cancerología 2007;11(1):40-57. [ Links ]
2. Martínez JW, Moreno GA, Londoño de Los Ríos PA. Tendencia en el reporte de casos de cáncer en Oncólogos del Occidente, Pereira, Colombia. Revista Médica de Risaralda. 2012;18:116-21. [ Links ]
3. Croce CM. Oncogenes and Cancer. New England Journal of Medicine. 2008;358(5):502-11. [ Links ]
4. Hanna WM, Kahn HJ, Pienkowska M, Blondal J, Seth A, Marks A. Defining a test for HER-2/neu evaluation in breast cancer in the diagnostic setting. Modern Pathology. 2001;14(7):677-85. [ Links ]
5. Makroo RN, Chowdhry M, Fauzdar A, Mishra M, Srivastava P, Bhaudauria P, et al. Her2/neu gene amplification in breast carcinoma patients: Our experience with fluorescence in situ hybridization (FISH) technique. Apollo Medicine. 2012;9(2):146-50. [ Links ]
6. Cole KD, He HJ, Wang L. Breast cancer biomarker measurements and standards. Proteomics Clinical applications. 2013;7(1-2):17-29. [ Links ]
7. Weigel MT, Dowsett M. Current and emerging biomarkers in breast cancer: prognosis and prediction. Endocrine-related cancer. 2010;17(4):R245-62. [ Links ]
8. Yong E. Cancer biomarkers: Written in blood. Nature. 2014;511(7511):524-6. [ Links ]
9. Roulston JE, Bartlett, J. M. , editor. Molecular Diagnosis of Cancer. Methods and Protocols. Second Edition ed. Totowa, New Jersey2004. [ Links ]
10. MinSalud. Listado completo de procedimientos y servicios del POS 2011 [cited 2013 Mayo 30]. Available from: http://www.pos.gov.co/Paginas/Plan-Obligatorio-de-Salud-Unificado.aspx. [ Links ]
11. Hudis CA. Trastuzumab - Mechanism of Action and Use in Clinical Practice. New England Journal of Medicine. 2007;357(1):39-51. [ Links ]
12. Sahlberg KK, Hongisto V, Edgren H, Makela R, Hellstróm K, Due EU, et al. The HER2 amplicon includes several genes required for the growth and survival of HER2 positive breast cancer cells. Molecular Oncology. 2012. [ Links ]
13. Marotta M, Chen X, Inoshita A, Stephens R, Thomas Budd G, Crowe JP, et al. A common copy-number breakpoint of ERBB2 amplification in breast cancer colocalizes with a complex block of segmental duplications. Breast Cancer Research. 2012;14(6):R150. [ Links ]
14. Jones RL, Constantinidou A, Reis-Filho JS. Molecular Classification of Breast Cancer. Surgical Pathology Clinics. 2012;5(3):701-17. [ Links ]
15. Perou CM, Sorlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature. 2000;406(6797):747-52. [ Links ]
16. Gutierrez C, Schiff R. HER2: biology, detection, and clinical implications. Archives of Pathology & Laboratory Medicine. 2011;135(1):55-62. [ Links ]
17. Eroles P, Bosch A, Perez-Fidalgo JA, Lluch A. Molecular biology in breast cancer: intrinsic subtypes and signaling pathways. Cancer Treatment Reviews. 2012;38(6):698-707. [ Links ]
18. Yamamoto T, Saito, Makoto., Oyama, Masaaki., Kumazawa, Kentaro., Semba, Kentaro., Doi, Ayano., Matsui, Atsuka., Takebe, Shiori., Amari, Takuya. ErbB2/HER2: Its Contribution to Basic CancerBiology and the Development of Molecular Targeted Therapy. In: Gunduz E, Gunduz, M., editor. Breast Cancer -Carcinogenesis, Cell Growth and Signalling Pathways2011. [ Links ]
19. Woods KM. HER-2 Signaling in Human Breast Cancer. In: Gunduz PM, editor. Breast Cancer - Carcinogenesis, Cell Growth and Signalling Pathways2011. [ Links ]
20. Jones RN. McClintock's controlling elements: the full story. Cytogenetic and Genome Research. 2005;109(1-3):90-103. [ Links ]
21. Myllykangas S, Knuutila S. Manifestation, mechanisms and mysteries of gene amplifications. Cancer Letters. 2006;232(1):79-89. [ Links ]
22. Rosenberg CL. Polysomy 17 and HER-2 Amplification: True, True, and Unrelated. Journal of Clinical Oncology. 2008;26(30):4856-8. [ Links ]
23. Torrisi R, Rotmensz N, Bagnardi V, Viale G, Curto BD, Dell'Orto P, et al. HER2 status in early breast cancer: Relevance of cell staining patterns, gene amplification and polysomy 17. European Journal of Cancer. 2007;43(16):2339-44. [ Links ]
24. Vanden Bempt I, Van Loo P, Drijkoningen M, Neven P, Smeets A, Christiaens MR, et al. Polysomy 17 in Breast Cancer: Clinicopathologic Significance and Impact on HER-2 Testing. Journal of Clinical Oncology. 2008;26(30):4869-74. [ Links ]
25. Daidone M, Cappelletti V, Paradiso A, Gion M, Harbeck N, Sweep F, et al. Biomarkers for Breast Cancer: Towards the Proposition of Clinically Relevant Tools. In: Bombardieri E, Gianni L, Bonadonna G, editors. Breast Cancer: Springer Berlin Heidelberg; 2008. p. 15-32. [ Links ]
26. Moelans CB, de Weger RA, Van der Wall E, van Diest PJ. Current technologies for HER2 testing in breast cancer. Critical Reviews in Oncology/Hematology. 2011;80(3):380-92. [ Links ]
27. Recondo G, Diaz Canton E, de la Vega M, Greco M, Recondo G, Valsecchi ME. Therapeutic options for HER-2 positive breast cancer: Perspectives and future directions. World journal of clinical oncology. 2014;5(3):440-54. [ Links ]
28. FDA. Clinical Review. Herceptin® (Trastuzumab): U. S. Food and Drug Administration; 1998 [cited 2013 Junio 4]. Available from: http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/ HowDrugsareDevelopedandApproved/ApprovalApplications/ TherapeuticBiologicApplications/UCM307496.pdf . [ Links ]
29. Guglin M, Hartlage G, Reynolds C, Chen R, Patel V Trastuzumab-induced cardiomyopathy: not as benign as it looks? A retrospective study. Journal of Cardiac Failure. 2009;15(8):651-7. [ Links ]
30. McArthur HL, Chia S. Cardiotoxicity of Trastuzumab in Clinical Practice. New England Journal of Medicine. 2007;357(1):94-5. [ Links ]
31. Suter TM, Cook-Bruns N, Barton C. Cardiotoxicity associated with trastuzumab (Herceptin) therapy in the treatment of metastatic breast cancer. Breast. 2004;13(3):173-83. [ Links ]
32. FDA. Perjeta® (Pertuzumab): U. S. Food and Drug Administration 2012 [cited 2013 5 de Septiembre]. Available from: <http:// www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ ucm307592.htm> [ Links ].
33. Chiu CG, Masoudi H, Leung S, Voduc DK, Gilks B, Huntsman DG, et al. HER-3 overexpression is prognostic of reduced breast cancer survival: a study of 4046 patients. Annals of surgery. 2010;251(6):1107-16. [ Links ]
34. Baselga J, Cortés J, Kim S-B, Im S-A, Hegg R, Im Y-H, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. New England Journal of Medicine. 2012;366(2):109-19. [ Links ]
35. Wood ER, Truesdale AT, McDonald OB, Yuan D, Hassell A, Dickerson SH, et al. A unique structure for epidermal growth factor receptor bound to GW572016 (Lapatinib) relationships among protein conformation, inhibitor off-rate, and receptor activity in tumor cells. Cancer Research. 2004;64(18):6652-9. [ Links ]
36. Di Leo A, Gomez HL, Aziz Z, Zvirbule Z, Bines J, Arbushites MC, et al. Phase III, double-blind, randomized study comparing lapatinib plus paclitaxel with placebo plus paclitaxel as first-line treatment for metastatic breast cancer. Journal of Clinical Oncology. 2008;26(34):5544-52. [ Links ]
37. Geyer CE, Forster J, Lindquist D, Chan S, Romieu CG, Pienkowski T, et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. New England Journal of Medicine. 2006;355(26):2733-43. [ Links ]
38. FDA. Kadcyla® (Trastuzumab Emtansine): U. S. Food and Drug Administration 2013 [cited 2013 10 de Septiembre]. Available from: <http://www.accessdata.fda.gov/scripts/cder/drugsatfda/ index.cfm?fuseaction=Search.DrugDetails> [ Links ].
39. Sadeghi S, Olevsky O, Hurvitz SA. Profiling and targeting HER2-positive breast cancer using trastuzumab emtansine. Pharmacogenomics and personalized medicine. 2014;7:329-38. [ Links ]
40. LoRusso PM, Weiss D, Guardino E, Girish S, Sliwkowski MX. Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clinical Cancer Research. 2011;17(20):6437-47. [ Links ]
41. Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. New England Journal of Medicine. 2012;367(19):1783-91. [ Links ]
42. Hurvitz SA, Shatsky R, Harbeck N. Afatinib in the treatment of breast cancer. Expert opinion on investigational drugs. 2014;23(7):1039-47. [ Links ]
43. Lambros MBK, Natrajan R, Reis-Filho JS. Chromogenic and fluorescent in situ hybridization in breast cancer. Human Pathology. 2007;38(8):1105-22. [ Links ]
44. Yeh IT. MeasuringHER-2 in breast cancer. Immunohistochemistry, FISH, or ELISA? American Journal of Clinical Pathology. 2002;117 Suppl:S26-35. [ Links ]
45. FDA. Medical Devices: Databases: U. S. Food and Drug Administration; [cited 2013 8 de Mayo]. Available from: http://www.accessdata.fda.gov/scripts/cdrh/devicesatfda/index.cfm. [ Links ]
46. Nahta R, Esteva FJ. HER-2-targeted therapy: lessons learned and future directions. Clinical Cancer Research. 2003;9(14):5078-84. [ Links ]
47. Cianciulli AM, Botti C, Coletta AM, Buglioni S, Marzano R, Benevolo M, et al. Contribution of fluorescence in situ hybridization to immunohistochemistry for the evaluation of HER-2 in breast cancer. Cancer Genetics and Cytogenetics. 2002;133(1):66-71. [ Links ]
48. Diaz NM. Laboratory testing for HER2/neu in breast carcinoma: an evolving strategy to predict response to targeted therapy. Cancer Control. 2001;8(5):415-8. [ Links ]
49. Jain KK. The Handbook of Biomarkers2010. [ Links ]
50. Ross JS, Fletcher JA. The HER-2/neu oncogene in breast cancer: prognostic factor, predictive factor, and target for therapy. Stem Cells. 1998;16(6):413-28. [ Links ]
51. Koseoglu RD, Muslehlddlnoglu, A., & Erkorkmaz, U. An analysis of HER-2 / neu gene status in invasive ductal carcinomas using immunohistochemistry and fl uorescence in situ hybridization. Turkish Journal of Medical Sciences. 2011;41(5):809-19. [ Links ]
52. Tsuda H, Akiyama F, Terasaki H, Hasegawa T, Kurosumi M, Shimadzu M, et al. Detection of HER-2/neu (c-erb B-2) DNA amplification in primary breast carcinoma. Interobserver reproducibility and correlation with immunohistochemical HER-2 overexpression. Cancer. 2001;92(12):2965-74. [ Links ]
53. Dybdal N, Leiberman G, Anderson S, McCune B, Bajamonde A, Cohen RL, et al. Determination of HER2 gene amplification by fluorescence in situ hybridization and concordance with the clinical trials immunohistochemical assay in women with metastatic breast cancer evaluated for treatment with trastuzumab. Breast Cancer Research and Treatment. 2005;93(1):3-11. [ Links ]
54. Lebeau A, Deimling D, Kaltz C, Sendelhofert A, Iff A, Luthardt B, et al. Her-2/neu analysis in archival tissue samples of human breast cancer: comparison of immunohistochemistry and fluorescence in situ hybridization. Journal of Clinical Oncology. 2001;19(2):354-63. [ Links ]
55. Pauletti G, Dandekar S, Rong H, Ramos L, Peng H, Seshadri R, et al. Assessment of methods for tissue-based detection of the HER-2/neu alteration in human breast cancer: a direct comparison of fluorescence in situ hybridization and immunohistochemistry. Journal of Clinical Oncology. 2000;18(21):3651-64. [ Links ]
56. Seidman AD, Fornier MN, Esteva FJ, Tan L, Kaptain S, Bach A, et al. Weekly trastuzumab and paclitaxel therapy for metastatic breast cancer with analysis of efficacy by HER2 immunophenotype and gene amplification. Journal of Clinical Oncology. 2001;19(10):2587-95. [ Links ]
57. Tubbs RR, Pettay JD, Roche PC, Stoler MH, Jenkins RB, Grogan TM. Discrepancies in clinical laboratory testing of eligibility for trastuzumab therapy: apparent immunohistochemical false-positives do not get the message. J Clin Oncol. 2001;19(10):2714-21. [ Links ]
58. Hoang MP, Sahin AA, Ordonez NG, Sneige N. HER-2/neu gene amplification compared with HER-2/neu protein overexpression and interobserver reproducibility in invasive breast carcinoma. American Journal of Clinical Pathology. 2000;113(6):852-9. [ Links ]
59. Jimenez RE, Wallis T, Tabasczka P, Visscher DW Determination of Her-2/Neu status in breast carcinoma: comparative analysis of immunohistochemistry and fluorescent in situ hybridization. Modern Pathology. 2000;13(1):37-45. [ Links ]
60. Ridolfi RL, Jamehdor MR, Arber JM. HER-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hybridization approach. Modern Pathology. 2000;13(8):866-73. [ Links ]
61. Thomson TA, Hayes MM, Spinelli JJ, Hilland E, Sawrenko C, Phillips D, et al. HER-2/neu in breast cancer: interobserver variability and performance of immunohistochemistry with 4 antibodies compared with fluorescent in situ hybridization. Modern Pathology. 2001;14(11):1079-86. [ Links ]
62. Wolff AC, Hammond MEH, Schwartz JN, Hagerty KL, Allred DC, Cote RJ, et al. American Society of Clinical Oncology/ College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. Journal of Clinical Oncology. 2007;25(1):118-45. [ Links ]
63. Press MF, Slamon DJ, Flom KJ, Park J, Zhou JY, Bernstein L. Evaluation of HER-2/neu gene amplification and overexpression: comparison of frequently used assay methods in a molecularly characterized cohort of breast cancer specimens. Journal of Clinical Oncology. 2002;20(14):3095-105. [ Links ]
64. Goldhirsch A, Glick JH, Gelber RD, Coates AS, Senn HJ. Meeting highlights: International Consensus Panel on the Treatment of Primary Breast Cancer. Seventh International Conference on Adjuvant Therapy of Primary Breast Cancer. Journal of Clinical Oncology. 2001;19(18):3817-27. [ Links ]
65. Hicks DG, Kulkarni S. HER2+ breast cancer: review of biologic relevance and optimal use of diagnostic tools. American Journal of Clinical Pathology. 2008;129(2):263-73. [ Links ]
66. Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. Journal of Clinical Oncology. 2002;20(3):719-26. [ Links ]
67. Chen J, Long JB, Hurria A, Owusu C, Steingart RM, Gross CP Incidence of heart failure or cardiomyopathy after adjuvant trastuzumab therapy for breast cancer. Journal of the American College of Cardiology. 2012;60(24):2504-12. [ Links ]
68. Ellsworth R, Ellsworth D, Patney H, Deyarmin B, Love B, Hooke J, et al. Amplification of HER2 is a marker for global genomic instability. BMC Cancer. 2008;8(1):297. [ Links ]
69. FDA. Summary of Safety and Effectiveness Data: PathVysion™ HER-2 DNA Probe Kit: U. S. Food and Drug Admnistration; 2001 [cited 2013 8 de Mayo]. Available from: http://www.accessdata.fda.gov/cdrh_docs/pdf/P980024S001b.pdf. [ Links ]
70. Rosa FE, Santos RM, Rogatto SR, Domingues MA. Chromogenic in situ hybridization compared with other approaches to evaluate HER2/neu status in breast carcinomas. Brazilian Journal Of Medical and Biological Research. 2013;46(3):207-16. [ Links ]
71. FDA. Summary of safety and effectiveness data: INFORM® HER2 Dual ISH DNA Probe Cocktail: U. S. Food and Drug Administration; 2011 [cited 2013 Mayo 8]. Available from: http://www.accessdata.fda.gov/cdrh_docs/pdf10/P100027b.pdf. [ Links ]
72. AbbottMolecular. PathVysion HER-2 DNA Probe Kit 2010 [cited 2013 Mayo 23]. Available from: http://www.abbottmolecular.com/static/cms_workspace/pdfs/US/PathVysion_PI_30-608377_V4.pdf. [ Links ]
73. Gao FF, Dabbs DJ, Cooper KL, Bhargava R. Bright-field HER2 dual in situ hybridization (DISH) assay vs fluorescence in situ hybridization (FISH): focused study of immunohistochemical 2+ cases. Am J Clin Pathol. 2014;141(1):102-10. [ Links ]
74. Mansfield AS, Sukov WR, Eckel-Passow JE, Sakai Y, Walsh FJ, Lonzo M, et al. Comparison of fluorescence in situ hybridization (FISH) and dual-ISH (DISH) in the determination of HER2 status in breast cancer. Am J Clin Pathol. 2013;139(2):144-50. [ Links ]
75. Bis hop R. Applications of fluorescence in situ hybridization (FISH) in detecting genetic aberrations of medical significance. Bioscience Horizons. 2010;3(1):85-95. [ Links ]