Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Médica de Risaralda
Print version ISSN 0122-0667
Revista médica Risaralda vol.21 no.2 Pereira July/Dec. 2015
Artículo de Revisión
Músculo esquelético y lesión por reperfusión. Ultraestructura, alteración y regeneración: Revisión sistemática
Doris H. Rosero1, Liliana Salazar2, Maria Ana Tovar2
1 Enfermera, MSc en Ciencias Biomédicas. Profesora del Departamento de Ciencias Básicas, Universidad Icesi. Profesora del Departamento de Morfología, Universidad del Valle. Cali, Colombia.
2 Fisioterapeuta, MSc en Morfología. Grupo de investigación Tejidos Blandos y Mineralizados, Profesora del Departamento de Morfología, Universidad del Valle. Cali, Colombia.
3 Médica, cirujana, especialista en Medicina Física y Rehabilitación, especialista en Docencia Universitaria. Profesora del Departamento de Medicina Física y Rehabilitación, Universidad del Valle. Cali, Colombia.
Correo: doris.rosero@correounivalle.edu.co
Fecha de Recepción: 01/03/2015
Fecha de Solicitud de Correcciones: 30/07/2015
Fecha de Aceptación: 30/09/2015
Resumen
Introducción: La función tisular se basa en la asociación celular y la comunicación mediante uniones intercelulares o la matriz extracelular, que compone el tejido conectivo. La isquemia conlleva a cambios de lesión a los cuales las células responden según duración e intensidad del estímulo de lesión. En periodos cortos de isquemia y prolongados de reperfusión, el tejido muscular estriado esquelético presenta cambios en la predominancia de los tipos de fibras musculares y en los componentes de la matriz extracelular intramuscular. Objetivo: Establecer los cambios que se presentan en el músculo esquelético durante la reperfusión prolongada, tanto en las fibras musculares como en su matriz extracelular. Métodos: Se realizó una revisión sistemática mediante la búsqueda de artículos en inglés y español publicados en revistas indexadas en las bases de datos Ovid Medline, PubMed, Wiley y Science Direct. Los descriptores MESH utilizados fueron skeletal muscle, ischemia, reperfusion, fiber type fast twitch, fiber type slow twitch, sarcomere and myoblast. Se acoplaron los términos histology y tissue. Resultados: Se seleccionaron 81 publicaciones y se complementó con imágenes de músculos esqueléticos provenientes de muestras procesadas en el Laboratorio de Histología de la Universidad del Valle, Colombia. Conclusión: La recuperación del músculo durante la reperfusión seguida de isquemia, tiende hacia el patrón histológico y funcional normal. En algunos casos es un proceso lento y que aún después de varios meses no ha finalizado. Así mismo, pueden persistir alteraciones leves o moderadas en la contracción muscular, dados los cambios que se presentan en la matriz extracelular intramuscular.
Palabras clave: músculo esquelético, isquemia, reperfusión, angiogénesis, mioblastos.
Skeletal muscle and reperfusion injury: ultra structure, disease and regeneration: systematic review
Abstract
Introduction: The tissue function is based on the cell association and communication through junctions or the extracellular matrix, which comprises connective tissue. Ischemia injury leads to changes to which the cells respond and it depends on duration and intensity of stimulus injury. In short periods of prolonged ischemia and reperfusion, skeletal striated muscle tissue shows changes in the predominance of muscle fiber types and components of the extracellular matrix intramuscular. Objective: To determine the changes which occur in skeletal muscle during prolonged reperfusion in both muscle fibers in its extracellular matrix. Methods: A systematic review was performed by searching for articles in English and Spanish published in journals indexed in databases Ovid Medline, PubMed, Science Direct and Wiley. MeSH descriptors used were skeletal muscle, ischemia, reperfusion, fast twitch fiber type, slow twitch fiber type, sarcomere and myoblast. The terms tissue and histology were coupled. Results: 81 relevant publications were selected and supplemented with images of skeletal muscles from samples processed at the Laboratory of Histology of the Universidad del Valle, Colombia. Conclusion: The recovery of muscle during ischemia followed by reperfusion, tends toward the normal histological and functional pattern. In some cases it is a slow process and even after several months has not been completed. Likewise, they may persist mild or moderate alterations in muscle contraction, given the changes that occur in the intramuscular extracellular matrix.
Keywords: skeletal muscle, ischemia, reperfusion, angiogenesis, myoblasts.
Introducción
La asociación celular que se requiere para que un tejido realice sus procesos moleculares y fisiológicos adecuadamente, implica no sólo la integridad de las células que lo conforman, sino también la organización con su matriz extracelular. Tal constitución puede verse afectada por factores medioambientales inducidos o no, que generan cambios inicialmente de lesión y luego de adaptación o de muerte celular, según sea el tiempo de exposición al daño. En el caso de las lesiones reversibles, las respuestas que se generan para modificar en el tejido algunas de sus características normales, aseguran de manera eficiente su sobrevivencia al mecanismo de alteración.
Las células en el tejido muscular estriado esquelético son los miocitos esqueléticos y asociados con el conectivo intramuscular, se adaptan a lesiones reversibles inducidas como la isquemia, frente a la cual genera cambios durante la reperfusión. Se considera que la capacidad de regeneración del tejido mediante la diferenciación celular a partir de las células satélites, permite su recuperación en las primeras dos semanas después de la exposición al daño; sin embargo, se ha visto que esta recuperación es parcial y que aún en períodos más prolongados hasta cuatro semanas, aún se presentan cambios tanto de regeneración celular, como de aumento en la proporción de la matriz extracelular intramuscular o el espacio que esta ocupa, de acuerdo con el tiempo de isquemia al que el músculo fue expuesto.
En este orden de ideas, el objetivo del presente artículo fue llevar a cabo una revisión completa del tejido muscular estriado esquelético, desde su origen embrionario, pasando por su histología normal y definiendo los cambios de lesión y adaptación que tienen lugar durante la reperfusión. Para ello, se reportan los hallazgos de una revisión bibliográfica sistemática sobre los tres aspectos y que provee hallazgos sobre las perspectivas de recuperación posterior a los procedimientos quirúrgicos o situaciones que requieren el uso de un torniquete.
Búsqueda de la información
Se llevó a cabo la revisión sistemática de los artículos publicados en las bases electrónicas Ovid Medline, PubMed, Wiley y Science Direct entre los años 1980 a 2015. Los criterios de búsqueda y selección se limitaron a publicaciones originales en inglés y en español, relacionados con las características histológicas normales del tejido muscular, diseños experimentales sobre isquemia y reperfusión y la recuperación del músculo durante los periodos prolongados de reperfusión. Se incluyeron los artículos de revisión con información relevante sobre la histología normal del músculo esquelético y sus cambios de lesión o adaptación en relación con los procesos de isquemia y reperfusión.
Los descriptores MeSH utilizados para la búsqueda fueron skeletal muscle, ischemia, reperfusión, fiber type fast twitch, fiber type slow twitch, sarcomere and myoblast. Se acoplaron los conceptos tissue and histology. Para el almacenamiento e inclusión de las referencias se contó con el software de acceso libre EndNote Web (Thomson Reuters, Nueva York-Estados Unidos).
Obtención de las imágenes
Las imágenes que complementan esta revisión fueron obtenidas de biopsias musculares de biomodelos, procesadas en el Laboratorio de Histología de la Universidad del Valle; el software de toma de imágenes que se utilizó fue LASV3.8 (Leica Microsystems, Wetzlar, Alemania) adaptado a microscopio de luz Leica DM750 (Leica Microsystems, Wetzlar, Alemania), con cámara digital Leica DFC295 (Leica Microsystems Wetzlar, Alemania).
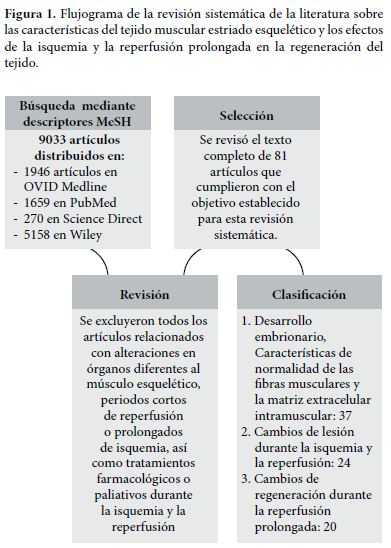
ResultadosAl utilizar los descriptores MeSH, la búsqueda permitió identificar un total de 9033 artículos, distribuidos en: 1659 artículos en PubMed, 1946 en OVID Medline, 270 en Science Direct y 5158 en Wiley. Se descartaron 8953 artículos que hacían referencia a isquemia con efectos en órganos diferentes al músculo esquelético, períodos prolongados de isquemia, períodos cortos de reperfusión y resultados de tratamientos farmacológicos o paliativos durante los períodos de isquemia y reperfusión. Se revisó y seleccionó el texto completo de 81 publicaciones que mencionaron características morfológicas y funcionales de normalidad en el músculo esquelético, así como efectos de la reperfusión tanto en las fibras musculares como en la matriz extracelular intramuscular (Figura 1).
Discusión
Desarrollo embrionario
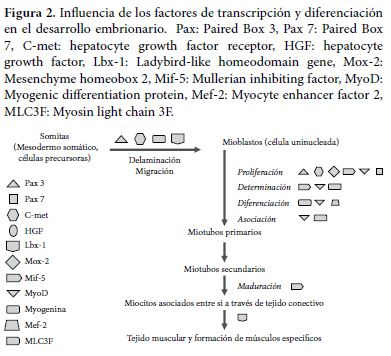
A finales de la tercera semana del desarrollo intrauterino, durante el proceso de gastrulación, células mesoblásticas migran hacia las crestas laterales de la notocorda y se agrupan en dos columnas longitudinales para dar origen al mesodermo para-axial; simultáneamente, otro grupo de células migra hacia la región medial generando el mesodermo intermedio y otras, se ubican en la región más periférica formando el mesodermo lateral. El mesodermo para-axial da lugar a los somitas y en su interior, las células migran hacia los bordes dorsomedial y ventrolateral del somita, formando los precursores de las células musculares o mioblastos. Por otra parte, las células ubicadas en la región medial forman el dermatoma. Las células precursoras de músculo dan lugar a células mesenquimales nuevamente, que migran bajo el dermatoma para generar el dermomiotoma. De acuerdo con Buckingham et al. en el año 2008 (1), la diferenciación de los mioblastos durante la cuarta semana, depende de la activación de los factores determinantes miogénicos MyoD y Myf5 a través de señales provenientes de los tejidos circundantes como la presencia de Miogenina y factores de transcripción, como el factor potenciador de los miocitos 2-Mef2 (2, 3).
Durante la diferenciación celular, los mioblastos se fusionan y forman fibras musculares largas y multinucleadas. Se desarrollan las miofibrillas en el citoplasma y, hacia el final del tercer mes de gestación, las estriaciones características del músculo esquelético se hacen evidentes. Estas se definen como fibras musculares primarias o miotubos primarios. Por otra parte, algunos mioblastos no se fusionan para formar fibras primarias, sino que, continúan proliferando y diferenciándose para dar lugar a las fibras secundarias al fusionarse entre ellas; al inicio estas fibras son más pequeñas, delgadas, de longitud corta y se ubican rodeando las fibras primarias (4).
En estudios in vitro (5) se observó que los mioblastos se desprenden del miotoma y migran hacia el lugar en el que van a dar lugar a fibras primarias y secundarias. Este estado se conoce como delaminación y migración, procesos dados por la expresión de los factores paired box 3-Pax3 y el Protooncogen c-met, entre otros (Figura 2). Durante la formación del componente muscular esquelético de una extremidad, los mioblastos migran a diferentes velocidades; aquellos que migran, se fusionan primero y forman las fibras primarias, contribuyen a formar los músculos en los que predominan las fibras de contracción lenta u oxidativas; las fibras secundarias conformarán los músculos en los que predominan las fibras de contracción rápida o glucolíticas. Los músculos distales se desarrollan primero que los músculos proximales y las extremidades superiores, o anteriores en el caso de los roedores, se desarrollan primero que las inferiores, o posteriores (5).
A medida que se desarrollan las fibras primarias y secundarias, células mesenquimales migran y se diferencian a fibroblastos por acción del factor de crecimiento transformante beta (TGF B) y el factor de crecimiento de los fibroblastos (FCF) principalmente. Los fibroblastos contribuyen a la formación del tejido conectivo que asocia cada fibra muscular, el endomisio; delimita los fascículos musculares, el perimisio y, rodea totalmente el músculo, el epimisio. Las tres estructuras constituyen la matriz extracelular o tejido conectivo intramuscular (6).
En la duodécima semana gestacional, las estriaciones características de este tipo de músculo, se hacen evidentes, debido al desarrollo de las miofibrillas en el sarcoplasma y gradualmente se tienen miotubos secundarios que se diferenciarán a miocitos esqueléticos. Un proceso similar ocurre en la diferenciación celular a partir de células satélite, influenciado por el factor MLC3F (7).
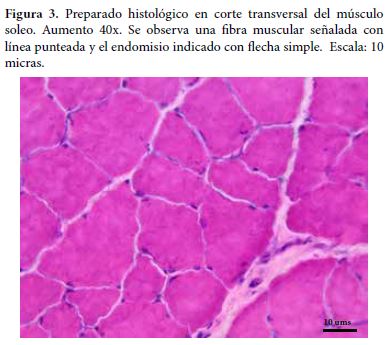
Matriz extracelular intramuscular o tejido conectivo intramuscularEstá conformado por los componentes fibrilares y no fibrilares que están en íntima relación con los miocitos, los fascículos musculares y el músculo, los cuales presentan un balance dinámico entre síntesis, remodelación y degradación, de acuerdo con los requerimientos funcionales y los estímulos mecánicos o de lesión al que el tejido muscular estriado esquelético se encuentra expuesto (6). Entre las funciones que cumple el tejido conectivo se describen, dar soporte mecánico para los vasos sanguíneos y nervios, facilitar la transmisión de fuerza desde la fibra muscular a las fibras adyacentes, al fascículo y a la unión miotendinosa - hueso y, proveer respuesta elástica al músculo esquelético (8). Tanto el endomisio como el perimisio juegan un papel importante en el desarrollo de masa muscular durante el crecimiento y en la estabilidad mecánica y química. El endomisio (Figura 3) consiste en una red delgada y continua de fibras colágenas que se distribuyen en varias direcciones e histológicamente se clasifica como tejido conectivo laxo. Mediante esta estructura se da la relación del tejido conectivo con la lámina basal que se relaciona con el sarcolema, así como entre células y con los capilares continuos adyacentes a cada miocito esquelético. La presencia del tejido conectivo que asocia los miocitos entre sí, el endomisio, se observa principalmente en cortes transversales como una delgada capa de tejido conectivo laxo, formado principalmente por fibras reticulares. Allí se localizan los capilares más pequeños y las ramificaciones neuronales finas, paralelos a la fibra muscular.
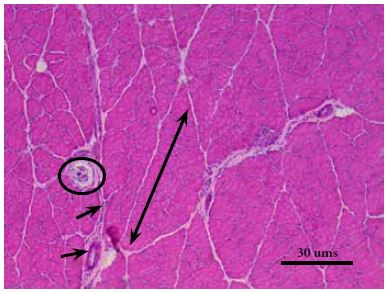
El perimisio consiste en fibras que siguen un patrón de ondulación uniforme observado por microscopía electrónica de superficie, cuya organización le permite adaptaciones a los cambios de longitud de las fibras, así como resistencia dado por la proporción de colágeno tipo I que presenta. Los fascículos musculares que constituye se clasifican como primarios, si son pequeños, indivisibles y rodeados por tejido conectivo laxo también denominado perimisio primario; y, fascículos secundarios, al estar formados por dos o más fascículos primarios y organizados mediante tejido conectivo moderadamente denso o denso irregular, conocido como perimisio secundario (Figura 4). Este se detalla como una capa de un espesor mayor, con aumento de fibras colágenas rodeando la agrupación de fibras musculares que forman el fascículo (6, 9).
El epimisio rodea el músculo estriado esquelético en su totalidad y permite el ingreso de las ramificaciones de los grandes vasos sanguíneos hacia las fibras musculares. Está constituido por una doble capa de fibras colágenas dispuestas de manera entrecruzada, que continúa con la fascia muscular superficial y a nivel de la unión musculo-tendinosa con el paratenon y el epitenon. Esta disposición le provee estabilidad mecánica para la transmisión de las fuerzas que recibe del perimisio hacia el resto del músculo y los tendones. A su vez, al formar el límite con el músculo adyacente, el conectivo permite no sólo que los vasos sanguíneos y nervios transcurran en este espacio para ingresar a cada músculo, sino que les provee la capacidad de adaptarse y deformarse frente a los cambios que ocurren en los músculos durante el movimiento (6, 9, 10). Ambos, el perimisio y el epimisio, en términos generales se conforman por tejido conectivo denso irregular. La sustancia intercelular, producida por los fibroblastos, además de mantener la estructura del músculo esquelético, permite la migración, proliferación y diferenciación de las células que soporta. Los tipos de colágeno que se han identificado en mayor concentración en el epimisio y el perimisio, son los tipo I y III o colágeno reticular y, colágeno tipo IV en la lámina basal (11). El Cuadro 1 resume los componentes moleculares de la matriz extracelular intramuscular.
Los estímulos mecánicos asociados a reguladores moleculares del tipo factores de crecimiento, por ejemplo, el factor de crecimiento similar a la insulina-IGF, influyen en la regulación de la síntesis, degradación y homeostasis de las fibras colágenas (12). Los cambios biogénicos en la matriz extracelular conducen a degradación proteolítica a partir de las metaloproteinasas presentes en el conectivo, que hacen parte de la familia de las proteasas dependientes de zinc, conocidas como metaloproteinasas de la matriz extracelular (MMPs) y que generan cambios especialmente en la concentración de colágeno tipo IV, proporcionales al grado de lesión o adaptación de las fibras musculares. De la misma manera, la movilidad y el ejercicio actúan como reguladores de los niveles del colágeno presentes en la lámina basal, siendo diferentes entre grupos musculares (13).
Relación con el sistema nervioso periférico y microcirculación
El tejido muscular estriado esquelético requiere de las unidades motoras y la microvascularización para mantener un funcionamiento adecuado. Las placas motoras o uniones neuromusculares, son un tipo especializado de sinapsis formada por motoneuronas derivadas de un nervio periférico en contacto con las fibras musculares esqueléticas, en las que un neurotransmisor liberado hacia la hendidura sináptica que genera excitación y contracción muscular, es la acetilcolina. Factores como la molécula Wnt y el factor de crecimiento transformante Beta (FGF-B), los componentes de la lámina basal y proteínas de unión presentes en la matriz extracelular, entre otros, participan en el desarrollo de la unión neuromuscular, tanto de la diferenciación presináptica como en el ensamblaje de los receptores postsinápticos (17).
En el estadío embrionario múltiples motoneuronas inervan la misma fibra muscular; sin embargo, disminuyen en cantidad progresivamente a partir del nacimiento hasta conseguir que una terminal nerviosa inerve a una determinada fibra muscular. Cada motoneurona tiene la posibilidad de ramificarse en muchas terminales nerviosas, con el fin de proveer inervación a muchos miocitos en los músculos relacionados con motricidad gruesa. Por otra parte, a nivel de las fibras de los músculos altamente activos y especializados como los músculos extraoculares, una motoneurona inerva muy pocas fibras musculares (18).
Asociados a la placa motora y ubicados dentro del músculo en paralelo a las fibras musculares, se encuentran los husos neuromusculares (Figura 4), receptores de estiramiento que tienen en su interior dos tipos de fibras musculares conocidas como células del huso o intrafusales, que se dividen en fibras de bolsa nuclear y fibras de cadena nuclear. Están rodeadas por una cápsula interna y una cubierta externa de tejido conectivo laxo. Las fibras de bolsa nuclear contienen agregados de núcleos en su región media; en contraste, las fibras de cadena nuclear poseen núcleos dispuestos en hilera. Ambas fibras están rodeadas a nivel de la región media por las terminales nerviosas aferentes a manera de espiral; así mismo, reciben estímulos de las terminales eferentes provenientes del sistema nervioso central. Su organización, proporción y tamaño varían con el tipo de músculo en el que se localicen (19). Por otra parte, el órgano tendinoso de Golgi es un mecanorreceptor encapsulado inervado únicamente por fibras sensitivas aferentes para transmitir información sobre propiocepción y tensión o fuerza muscular generada durante la contracción. Las fibras colágenas que lo sostienen se encuentran adheridas en un extremo hacia la aponeurosis y en el otro por fibras musculares dispuestas en serie y la cantidad presente varía según el tipo de músculo (20).
Los capilares arteriales y venosos en el endomisio se relacionan longitudinalmente con las fibras musculares a lo largo de su trayecto, constituyendo la microvascularización del tejido muscular estriado esquelético. Murakami et al., en el año 2010 (21), encontraron diferencias en la irrigación capilar de los músculos predominantemente oxidativos como el sóleo y glucolíticos como el extensor longo de los dedos. Las áreas del músculo en las que se encuentran las fibras de contracción lenta, poseen elevada densidad capilar en comparación con aquellas en las que la proporción de fibras de contracción rápida es más alta. Así mismo, múltiples anastomosis conectan los diferentes capilares, evidenciando diámetros superiores en los capilares y sus anastomosis que rodean las fibras tipo I; por ende, factores reguladores como el factor de crecimiento vascular endotelial (VEGF) son producidos en mayor concentración en los músculos predominantemente oxidativos que en los glucolíticos. El diámetro entre las fibras es variable, por lo cual el consumo de oxígeno y su distribución no es homogéneo, incluso en condiciones de adaptación (21, 22).
Ultraestructura de las fibras musculares esqueléticasLa fibra muscular esquelética es una célula multinucleada altamente especializada en producir contracción, característica que permite a través de la asociación entre fibras dada por el tejido conectivo, transmitir fuerza y generar movimiento por el desplazamiento de segmentos corporales. Los miocitos esqueléticos son cilíndricos, longitudinalmente observados, con un diámetro entre 10 y 100 µ y longitud variable que puede ir desde cinco milímetros hasta 35 centímetros, según el tamaño del músculo que conforman. El diámetro determina la fuerza y la longitud, la velocidad de contracción, así como, el desplazamiento de la fibra muscular, entendido como la distancia capaz de acortarse. Los miocitos se clasifican de acuerdo con el tipo de contracción que generan, tipo de metabolismo e isoforma de la cadena pesada de miosina; mientras que las fibras tipo I o de contracción lenta, poseen la isoforma MCH I, generan contracciones prolongadas y de menor fuerza, las fibras tipo IIa o de contracción intermedia, poseen la isoforma MHC IIa; por otra parte, las fibras tipo IIx (Ilb) o de contracción rápida, descrita en seres humanos que poseen la isoforma MHC IIx, las cuales generan contracciones cortas y de mayor fuerza (23).
Al observar la fibra desde la periferia hacia el centro, se encuentra rodeada por el sarcolema o membrana plasmática; si bien su estructura básica es similar a otras membranas plasmáticas, en el miocito esquelético se encuentran modificaciones en diferentes regiones, en especial a nivel de unión miotendinosa y neuromuscular. Está compuesta por el sarcolema, la membrana más interna en contacto con el sarcoplasma, cuyas invaginaciones dan lugar a los túbulos transversos; externa a ella y rodeándola se ubica la lámina basal, compuesta principalmente por colágeno tipo IV y laminina, así como proteoglucanos y glucoproteínas (24).
Entre el sarcolema y la lámina basal, se encuentran las células satélites, importantes en la regeneración de las fibras musculares en lesión reversible. Son células mono nucleadas que aparecen en las extremidades hacia el día 17 después de la fecundación una vez las fibras primarias se han formado (25).
Actualmente, se establecen dos posibles alternativas sobre el origen de las células satélites. El primer origen potencial es el somita; durante el desarrollo embrionario células precursoras miogénicas migran hacia el compartimiento de formación de músculo esquelético las cuales permanecen inactivas en lugar de diferenciarse. El segundo origen potencial es vascular; células de origen hematopoyético migran hacia los vasos sanguíneos, las cuales pueden permanecer en el endotelio o diferenciarse hacia células satélite y trasladarse hasta el sarcolema (26).
Durante la vida postnatal, las células satélites se desarrollan a una tasa más lenta. Muchas de ellas se fusionan a la fibra muscular adyacente contribuyendo a incrementar el tamaño de la misma. Al finalizar la etapa de crecimiento del ciclo vital del individuo, estas células permanecen inactivas y se activan en caso de daño muscular (4). En su estado inactivo, su núcleo contiene mayor proporción de heterocromatina que eucromatina. Si son activadas, cambian su morfología desarrollando prolongaciones citoplasmáticas, aumento en el volumen del citoplasma, cambio en la proporción heterocromatina/ eucromatina y, organelas como el aparato de Golgi, mitocondrias y ribosomas, aumentan en tamaño y número (27).
Se ha observado que la distribución de las células satélites no es equitativa entre los diferentes grupos de fibras musculares. Holterman et al, en el año 2005 (27), observaron que las fibras de contracción lenta poseen mayor número de células satélite en relación a las fibras de contracción rápida. Se cree que la concentración de capilares a lo largo de la fibra muscular y la unión neuromuscular influye en la elevada densidad de células satélites. Así mismo, es probable que el flujo sanguíneo provea células precursoras miogénicas (MPC) que contribuyen a mantener la concentración de células satélites inactivas alrededor de las fibras musculares.
En el sarcoplasma, se encuentran las miofibrillas formadas por grupos de sarcómeros dispuestos en serie. El total de sarcómeros depende de la longitud y el diámetro de la fibra muscular. Un músculo puede acortarse varios centímetros, a pesar de que cada sarcómero se acorta aproximadamente 1 um, esto se debe a los filamentos gruesos de miosina, filamentos delgados de actina y proteínas de sostén importantes en la sarcomerogénesis como la titina, nebulina, alfa actinina, miomesina, proteína C y tropomodulina.
Los túbulos transversos, extensiones de la membrana plasmática que envuelven las miofibrillas, están en contacto con el retículo sarcoplásmico a través de sus cisternas terminales formando la tríada. Este, se constituye como un retículo endoplasmático liso formado por un conjunto de membranas dispuestas rodeando cada miofibrilla y anclado a los túbulos transversos a través de sus cisternas terminales (28). De esta manera, se hace posible el contacto del miocito con el espacio extracelular y la propagación de los cambios en el potencial de membrana a lo largo de las fibras musculares para dar lugar al acople excitación-contracción. La propagación de la excitación iniciada por la placa motora, se distribuye de manera uniforme en todas las fibras musculares, inclusive si el diámetro de los túbulos T es mayor que el de las fibras de contracción rápida (29, 30).
Este retículo está dividido en dos regiones, una longitudinal y otra de unión. A nivel del retículo sarcoplásmico longitudinal se encuentra la ATPasa de calcio cuya función es el bombeo de calcio del citoplasma al interior del retículo sarcoplásmico durante la relajación muscular y el mantenimiento de la concentración citosólica en reposo. Se han identificado dos isoformas para el músculo estriado esquelético y cardíaco; la isoforma SERCA 1 está presente en mayor proporción en las fibras de contracción rápida y la isoforma SERCA 2, se encuentra en las fibras de contracción lenta y en los cardiomiocitos. La región de unión consta del canal sensible a voltaje conocido como receptor de dihidropirimidina, el canal de liberación de calcio conocido como receptor de rianodina y la calsecuestrina. A través del canal sensible a voltaje se activa la vía de fosforilación que tiene como intermediario el cAMP y la fosfocinasa A. La fosforilación del receptor de rianodina disocia la calstabina, proteína inhibidora de receptor y en consecuencia se da la liberación del calcio al sarcoplasma el cual participa en el acople excitación-contracción. La calsecuestrina también es fosforilada para permitir la salida del calcio al sarcoplasma (31).
Una de las propiedades de los túbulos T es la plasticidad, que radica por una parte, en su capacidad para deformarse durante la contracción y regresar a su forma inicial durante el reposo y por otra, en la regeneración e hipertrofia en respuesta a la lesión por denervación y posterior reinervación (32). Esta característica provee estabilidad a la fibra y permite su recuperación después de la lesión. Por otra parte, se ha observado en estudios in vitro que el túbulo T es capaz de englobar sustancias presentes en el medio externo, aspecto que ha dado lugar al estudio de funciones adicionales, entre ellas el balance hídrico y la regulación del volumen celular, la recuperación durante la fatiga muscular, el paso de sustancias como el ácido láctico hacia el intersticio y el transporte de moléculas a través de los mecanismos de endocitosis y exocitosis, aspectos aún en investigación (33, 34).
La síntesis de ATP que tiene lugar en las mitocondrias, es activada, entre otros factores, por la concentración de ADP en el citoplasma, lo que sugiere que la fibra glucolítica es más sensible al ADP que la oxidativa (35). Estas organelas se encuentran localizadas a nivel subsarcolémico e intermiofibrilar y su densidad depende del tipo de fibra muscular. En fibras musculares con capacidad oxidativa pueden llegar a ocupar un 20% del volumen citoplasmático. Las mitocondrias de localización subsarcolémica constituyen alrededor del 15% del volumen mitocondrial en un miocito funcionalmente activo y cambia el número de su población con las variaciones del uso o desuso del músculo esquelético. Son aptas para aumentar su capacidad de oxidación de lípidos como respuesta al aumento en la actividad contráctil, como sucede en el entrenamiento físico; por otra parte, las mitocondrias intermiofibrilares contienen mayor proporción de enzimas de la cadena respiratoria (36).
La membrana externa mitocondrial contiene los receptores de comunicación con el sarcoplasma, mientras que en la membrana interna mitocondrial, se encuentran los complejos proteicos que hacen parte de la cadena de transporte de electrones, entre los que se encuentran NADH, coenzima Q, FADH, GADPH y citocromos. La densidad mitocondrial depende del tipo de fibra muscular; en fibras musculares con capacidad oxidativa puede llegar a ocupar un 20% del volumen citoplasmático. Durante el proceso de fosforilación oxidativa se producen radicales libres de oxígeno, en especial anión superóxido a nivel de los complejos FADH y coenzima Q (37). La matriz mitocondrial contiene el ADN mitocondrial y las enzimas que oxidan piruvato y ácidos grasos en Acetil CoA que ingresa a la cadena de transporte de electrones.
Cambios en las fibras y la matriz extracelular intramuscular causados por isquemia
La evidencia refiere que los músculos esqueléticos toleran bien períodos de isquemia hasta de seis horas cuyo factor determinante en el grado de lesión, es el tipo de fibras que predomine (38). Entre los estudios sobre cambios secundarios a isquemia en periodos menores a seis horas se pueden mencionar los realizados por Rácz & Illyés en 1997 (39), en los que describen los cambios que se presentan en las fibras sometidas a dos y tres horas de isquemia. Posteriormente, Carmo-Araujo y colaboradores en el año 2007 (40), muestran evidencias sobre cambios secundarios a periodos de isquemia menores a seis horas, mientras que Walters TJ, et al. en el año 2008 (38), describen los cambios que se presentan 14 días después de reperfusión en cada tipo de fibra.
La oclusión puede provocar vasoespasmo intenso distal, seguido de trombosis; según el grado de inmovilización y pérdida de la función endotelial, se extiende y obstruye la circulación lo que agrava la isquemia. Al mismo tiempo, una trombosis venosa profunda puede ocurrir como resultado de la hipoxia y el flujo venoso lento. La intensidad de la lesión isquémica depende del nivel de oclusión, la circulación colateral y el grado de la demanda tisular de oxígeno. Así, el tiempo de isquemia es un factor crucial en la determinación de la intensidad de las lesiones y la viabilidad del tejido. Las células muestran diferentes tiempos de sobrevida a la isquemia. Las neuronas mueren luego de cinco (5) minutos, los miocitos cardiacos pueden resistir hasta 30 minutos, las células renales hasta 1 hora y las células musculares esqueléticas entre 3 y 6 horas (40).
Los efectos funcionales de la isquemia incluyen alteraciones en la contracción muscular después de 2 horas de isquemia seguido de 2 horas de reperfusión en ambos tipos de fibras; así mismo, después de 3 horas de isquemia los niveles de ATP descienden en un 48% en los músculos con predominio oxidativo más que en los de predominio glucolítico (41).
Entre las patologías que causan isquemia se encuentran la enfermedad arterial periférica oclusiva, la deformación por presión prolongada que conlleva a úlceras, la cirugía ortopédica que implica la utilización de un torniquete y durante los trasplantes que contienen tejido muscular esquelético. En las primeras horas de isquemia, los cambios bioquímicos de las funciones celulares básicas son reversibles. Sin embargo, cuando la isquemia se prolonga por un período mayor a cinco horas, otra secuencia de reacciones se produce y conlleva a la disminución excesiva de la energía de la célula y muerte celular (42). Carmo-Araújo et. al en el año 2007, describen que el músculo esquelético sometido a cuatro horas de isquemia, presenta cambios en el diámetro de las fibras musculares y diferentes intensidades de reactividad a las pruebas de NADH-TR y ATP asa, según el tipo de fibra muscular (40).
Cambios en las fibras y la matriz extracelular intramuscular causados por reperfusión
La reperfusión ocurre cuando el flujo sanguíneo retorna a un tejido después de un periodo de isquemia. Aunque permite la recuperación del tejido, al limitar la necrosis post-isquémica, se ha descrito que la reperfusión puede en sí misma lesionar los tejidos, ocasionando la “lesión por reperfusión” y en ocasiones la necrosis por reperfusión. Los vasos sanguíneos de mediano calibre se encuentran dilatados mientras que en la microcirculación hay vasoconstricción, lo que tiende a aumentar la isquemia y los cambios de lesión (43). Los efectos de la lesión por reperfusión dependen, entre otros, de los daños causados por la isquemia y del grado de sensibilidad de cada tejido. Se conoce que el daño se debe en parte a la respuesta inflamatoria que se produce en los tejidos afectados por la isquemia. De acuerdo con el estudio realizado por Ghaly & Marsh en el año 2010 (44) se genera un aumento en la concentración de neutrófilos, de su actividad mieloperoxidasa y los factores quimiotácticos, durante las primeras horas posteriores a isquemia, con disminución gradual en los siguientes tres días; la infiltración leucocitaria aumenta así como la actividad oxidativa de los macrófagos. Los leucocitos que entran al tejido durante la reperfusión liberan interleuquinas y radicales libres (hidroxilo, superóxido, entre otros) en respuesta al daño tisular producido por la isquemia. Las interleuquinas promueven la respuesta inflamatoria y los radicales libres tienden a dañar las proteínas celulares, el ADN y la membrana plasmática de las células que sobrevivieron a la isquemia (45). La muerte celular induce la liberación de más radicales libres. La inflamación, si se vuelve crónica, puede finalmente reproducir la isquemia, por extravasación de fluidos y estasis sanguíneo (46). Esta inflamación se hace evidente en microscopía óptica por edema tanto de las fibras musculares como a nivel del conectivo, aumento de los espacios que ocupan el endomisio y perimisio, alteración en el patrón histológico normal e infiltración celular (47).
En relación con los monocitos, estos se diferencian hacia uno de dos tipos de macrófagos en el tejido conectivo; los macrófagos tipo I inducidos por interferón gamma (IFN-D) con funciones proinflamatorias, los cuales se encargan de la producción de radicales libres de oxígeno, interleuquina 1 y 6 (IL-1 y 6), factor de necrosis tumoral (TNF) y se asocian a necrosis muscular. Por otra parte, los macrófagos tipo II producen IL 4, 10 y 13, promueven la reparación celular y se relacionan con los procesos de regeneración del tejido muscular estriado esquelético lesionado. En roedores se ha evidenciado que los macrófagos tipo I promueven la proliferación de células precursoras miogénicas, mientras que los macrófagos tipo II estimulan la diferenciación celular y la fusión de mioblastos (48, 49). Además del daño de la membrana celular, edema, disfunción microvascular y necrosis muscular asociados con procesos de morbilidad y disfunción definitiva del tejido muscular (50) que pro duce la reperfusión, a nivel metabólico se ha descrito una reducción gradual de los depósitos energéticos intracelulares de trifosfato de adenosina (ATP), de fosfocreatina, de glucógeno muscular, con aumentos en las concentraciones intracelulares de hidrogeniones y de lactato (51). El estrés oxidativo evidenciado mediante biopsias musculares humanas, se presenta también en el retículo sarcoplásmico por disminución en la fosforilación de la molécula 4E-BP1 por AKT, ambas involucradas en la síntesis de proteínas, en las alteraciones en la movilidad de calcio, la entrada de glucosa al tejido y la glucolisis, así como la activación de caspasa 3, principalmente durante la reperfusión (52, 53). Se ha reportado que este fenómeno induce en el músculo esquelético condiciones de hipoxia, hipercapnia y acumulación a nivel extracelular de metabolitos como ATP, adenosina, protones, lactato, hipoxantina y colina, entre otros (54, 55). Se da la expresión de genes como HIF1B (factor 1B inducible por hipoxia), CASP-8 (caspasa 8) para la activación de la vía extrínseca de la apoptosis, IL-8 (interleuquina 8), mediador de la respuesta inflamatoria y PLAUR (receptor de uroquinasa activado por plasmina), en la reorganización tisular durante los cambios de lesión que ocurren tanto en las fibras musculares como en el conectivo (56, 57).
En condiciones normales la NADPH (nicotinamida adenina dinucleotido fosfato), funciona como un aceptor de electrones en el proceso de respiración celular mediado por la xantina deshidrogenasa. Durante la reperfusión, la xantina se convierte en oxidasa y utiliza iones oxígeno para la síntesis de radicales libres. La formación de altas concentraciones de radicales libres a través del sistema xantina oxidasa en los neutrófilos que migran al tejido lesionado por quimiotaxis, produce un daño mayor de la membrana plasmática, incremento de la respuesta inflamatoria y el consecuente edema tisular, generando alteraciones locales y sistémicas (42, 58).
Las características histológicas del músculo esquelético sometido a cuatro horas de isquemia y una hora de reperfusión corresponden a edema, disminución en el diámetro de las fibras o hipercontractilidad y necrosis; sometidas a pruebas de NADH-TR (nicotinamida adenina dinucleótico tetrazolium reductasa) y mATPasa (miosina adenosin trifosfatasa), varias de las fibras evidenciaron reactividad moderada o débil (40).
Mars y Gregory en 1991 evidenciaron que después de 90 minutos de isquemia inducida con torniquete y 3 horas de reperfusión, el 29% de fibras tipo I presentaron aumento en el tamaño en relación con el 7% de fibras tipo IIa y 5% de fibras tipo IIb; la distancia entre las fibras aumentó durante la reperfusión en el 48% de las fibras analizadas (59). Estudios en donde se comparó la respuesta del músculo vasto y del sóleo sometidos a 2 horas de isquemia y 0 a 6 horas de reperfusión mediante el uso de marcadores inmunohistoquímicos para IgM y C3 mostraron que el depósito de C3 predomina en las fibras de contracción rápida del músculo vasto presentando el 28% +/- 12.4 de fibras lesionadas comparado con el sóleo, el cual presentó el 17.3 +/-11.8 de fibras alteradas (60).
Walters, et al., en el 2008, afirman que el tipo de fibras que predomina en el músculo influye en la recuperación de la lesión inducida por isquemia y reperfusión. Los músculos con predominancia de fibras glucolíticas (plantar) sometidos a dos horas y cuatro horas de isquemia y 14 días de reperfusión evidenciaron al inicio entre el 45% y 69% de pérdida de su capacidad contráctil. El sóleo no perdió su capacidad contráctil en el grupo de 2 horas de isquemia, sin embargo, en el de cuatro horas perdió el 30% de su capacidad, presentando recuperación el día 14 (38).
Isquemia de tres horas es un periodo crítico en el que el músculo sufre daño, sin afectar severamente su capacidad de regeneración. En las isquemias de cuatro horas, el tejido muscular estriado esquelético es susceptible a necrosis en un 30% y puede llegar a ser un 90% si la isquemia se prolonga hasta cinco horas. La denervación previa sea química o quirúrgica aumenta en cierto grado la tolerancia a isquemia de cuatro horas y reperfusión (61), al igual que la administración de medicamentos antes de la colocación del torniquete.
Los cambios que se generan en la matriz extracelular intramuscular secundarios a lesión, implican la degradación y síntesis tanto del componente fibrilar (fibras colágeneas y elásticas) como no fibrilar (glucosaminoglucanos, proteoglucanos y glucoproteínas), en los que el incremento en la concentración de metaloproteinasas (MMP) es uno de los principales aspectos. Estas proteínas, así como sus inhibidores tisulares (TIMP), presentan un aumento en la expresión por parte de células miogénicas in vitro, tales como MMP 1, 2, 3, 7, 9, 10, 14 y 16, relacionadas con la migración de mioblastos y en la formación de los miotubos, por tanto, en la regeneración del tejido muscular. La MMP 8 está relacionada con los procesos y cicatrización y las metaloproteinasas 2 y 9 (MMP-2 y MMP-9), también denominadas gelatinasas, presentan mayores concentraciones en la inflamación, por ejemplo, en las miopatías de tipo inflamatorio, como las polimiositis y dermatomiositis (62).
Angiogénesis y regeneración tisularLos procesos de angiogénesis requieren de migración celular, la presencia de factores de transcripción como el de crecimiento vascular endotelial (VEFG), iones calcio, anclaje del endotelio a la matriz extracelular y síntesis de uniones laterales y basales así como, de una membrana basal que lo relacione con el tejido conectivo (63). Se cree que la concentración de capilares a lo largo de la fibra muscular y la unión neuromuscular influye en la elevada densidad de células satélites y puede deberse a la liberación de factores desde la unión neuromuscular o los capilares adyacentes. Myf5 y Pax7 son factores reguladores miogénicos presentes en estas células, fundamentales en la regeneración del tejido muscular estriado esquelético (64). Estos están mediados por la expresión de factores producidos por los mioblastos durante el ensamblaje de las fibras musculares y su componente contráctil. En los hallazgos descritos por Degenfeld et. al. en el año 2003 (65), se evidenció la expresión de factores de crecimiento y maduración como el factor de crecimiento vascular endotelial-VEGF, la molécula de adhesión vascular celular-VCAM, el factor de crecimiento derivado de las plaquetas-PDGF, angiopoyetina-1 y TGF-B, estos productos contribuyen a la generación de un vaso sanguíneo maduro por medio de inducción de la proliferación, migración y adhesión de las células endoteliales, así como el equilibrio entre ellas para la formación de ramificaciones que dan lugar a los capilares.
La capacidad de regeneración del músculo esquelético, aunque limitada, está dada por las células satélites, de modo que las lesiones a nivel de la lámina basal o de la relación de las fibras con el conectivo, ocasiona cambios progresivos cuya evidencia clínica inicial es la debilidad muscular y el dolor (66, 67). Camillo et. al, en el año 2004 (68), describieron que la vascularización y la inervación en el músculo sóleo, por ejemplo, son determinantes en su concentración de células satélite. La denervación es un factor que incrementa la migración de células satélite, así como su diferenciación en miocitos que se fusionan y forman nuevas fibras musculares. El estímulo nervioso es requerido para que la función continúe, por lo que seis meses posterior a la denervación, tanto la migración como la diferenciación disminuyen y desaparecen.
Sassoli et. al en el año 2014 (69), en cultivos de células mesenquimales estromales (MSC), evidenciaron mediante técnicas de inmunofluorescencia entre otras, el aumento en la expresión de MMP-2 y MMP-9, la regulación en la diferenciación miogénica de células indiferenciadas a células satélite, de células satélite a mioblastos y la diferenciación de fibroblastos esqueléticos que producen los elementos que constituyen la matriz y pueden generar o no fibrosis por exceso en la síntesis del componente fibrilar. De la misma manera, se describe una interacción dinámica y coordinada entre células satélite y los fibroblastos presentes en el tejido conectivo durante la regeneración del tejido muscular estriado esquelético. Esta interacción consiste en la regulación entre sí, de la producción de factores de transcripción como Tcf4, el cual influye en la función tanto de los fibroblastos como en la diferenciación de las células satélite (70).
Otro de los estudios en los que se evalúa la recuperación de ambos tipos de fibras en períodos prolongados de reperfusión es el realizado por Woitaske MD et al. en el año 1998 (71), observaron que la recuperación morfológica en las fibras tipo II se da a un ritmo más lento que en las fibras tipo I después de 7 y 14 días de isquemia. Corona y Rathbone en el año 2014 (2), evidenciaron que los músculos tibial anterior y extensor longo de los dedos sometidos a dos horas de isquemia, reperfusión de 0, 1, 3, 7, 14, 21 y 28 días, e inyección intravenosa de células mesenquimales dos días después de la lesión, presentaron resultados positivos en cuanto a regeneración tisular y disminución en un 40% de miocitos con núcleos centrales a los 14 días. Al administrarse vía intravenosa células indiferenciadas derivadas de médula ósea, también se dio un incremento en la vascularización a un nivel cercano a lo observado en los músculos control (72), donde al día 28 el patrón histológico fue similar al normal.
Durante la regeneración muscular tienden a aumentar los niveles de la cadena pesada de la miosina en mayor proporción en las ratas jóvenes que en las mayores; en ambos grupos, los músculos pueden adaptarse frente a estímulos de carga o contracción frecuentes, para este caso, generando hipertrofia muscular (73). Al comparar los cambios histológicos de músculos sometidos a 2 horas de isquemia y 7 a 14 días de reperfusión, en ratas jóvenes y mayores, se observó en ambos alteraciones en el patrón normal, con mejor capacidad de regeneración en los biomodelos jóvenes (74). Por otra parte, en procedimientos en músculos de ratas sometidas a isquemia de una hora inducida mediante oclusión arterial directa, con reperfusión de 5 días, son evidentes los núcleos centrales en tinción de hematoxilina-eosina, los cuales disminuyeron progresivamente hacia el día 14 donde ya no se observaron (75). En isquemia de tres horas con reperfusión de 24 y 32 días, se observó en el extensor radial longo del carpo de ratas Wistar, núcleos centrales y recuperación parcial del área que ocupó la matriz extracelular intramuscular, la cual presentó aumentos importantes en períodos previos como una hora y ocho días (76).
Finalmente, la fibrosis es una consecuencia relacionada con la severidad de lesión; factores como el de crecimiento transformante β1 (TGF β1) y el interferón gamma (IFN-D ), mediadores de fibrosis, se encuentran elevados frente a isquemia de dos horas con reperfusión de ocho horas y sus niveles se reducen tres días después; por el contrario, en el caso de contusión asociada, en el que el grado de lesión tiende a ser mayor, las concentraciones de ambos factores son mayores en los siguientes tres días. v
En tinciones específicas para el tejido conectivo como Sirius red y con técnicas de inmunohistoquímica, al ser aplicadas en las muestras obtenidas a los 21 días después de la lesión, se observa aumento en el depósito de colágeno tipo I, el cual es indicador de respuesta fibrótica, asociado a destrucción de las fibras musculares (44). A mayor grado de lesión, los procesos de regeneración se ven afectados negativamente en lo cual influye el estrés oxidativo que se presenta concomitante a los procesos de inflamación aguda (77,78). En la reparación de hombro, Mazzoca et. al, (79) lograron aislar y cultivar células precursoras de tejido conectivo, que si bien se asocian a una mejor cicatrización del área operada, siendo este el eje central del estudio, pueden conllevar a un aumento en los fibroblastos y en la proporción de este tejido en la región intervenida. La rigidez y la limitación en la movilidad secundarias a artrofibrosis post artroscópicas, han sido descritas como complicaciones de las artroscopias (80) y este corresponde a uno de los factores por los cuales la recuperación del tejido muscular puede no ser completa, sin embargo, un buen proceso de rehabilitación posterior a la cirugía y un seguimiento cercano a cada caso puede tener un papel importante en la prevención de ambos aspectos (81).
ConclusionesEl movimiento muscular, la transmisión de fuerza y la conservación de la estructura del tejido muscular estriado esquelético requieren de una estrecha relación con el tejido conectivo, su irrigación e inervación, factores que influyen en la recuperación durante la reperfusión seguida de periodos cortos o prolongados de isquemia, en especial, si se presenta un aumento en la proporción del conectivo, lo que conlleva a fibrosis y limitación funcional moderada.
La artrofibrosis es una de las complicaciones que debe tenerse en cuenta durante el postquirúrgico mediato y prolongado, así como al implementar los ejercicios de rehabilitación, puesto que la evidencia muestra que existe un riesgo de que a lo largo de la reperfusión no se llegue al patrón histológico y funcional normal de la región afectada.
RecomendacionesFuturas investigaciones requieren la caracterización de la matriz extracelular intramuscular a lo largo de la reperfusión, teniendo en cuenta periodos prolongados frente a periodos cortos de isquemia hasta tres horas.
AgradecimientosLos autores agradecen a la Sección de Histología del Departamento de Morfología de la Universidad del Valle, y a las profesionales del Laboratorio de Histología por su disposición y colaboración en la realización de este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en la realización de este artículo.
Referencias1. Buckingham M, Montarras D. Skeletal muscle stem cells. Curr Opin Genet Dev. 2008;18(4):330-6. [ Links ]
2. Fong AP, Tapscott SJ. Skeletal muscle programming and reprogramming. Curr Opin Genet Dev. 2013;23(5):568-73. [ Links ]
3. Lo KW, Jiang T, Gagnon KA, Nelson C, Laurencin CT. Small-molecule based musculoskeletal regenerative engineering. Trends Biotechnol. 2014;32(2):74-81. [ Links ]
4. Cossu G, Biressi S. Satellite cells, myoblasts and other occasional myogenic progenitors: possible origin, phenotypic features and role in muscle regeneration. Semin Cell Dev Biol. 2005;16(4-5):623-31. [ Links ]
5. Buckingham M, Bajard L, Chang T, Daubas P, Hadchouel J, Meilhac S, et al. The formation of skeletal muscle: from somite to limb. J Anat. 2003;202(1):59-68. [ Links ]
6. Purslow PP. Muscle fascia and force transmission. J Bodyw Mov Ther. 2010;14(4):411-7. [ Links ]
7. Zammit PS, Partridge TA, Yablonka-Reuveni Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. J Histochem Cytochem. 2006;54(11):1177-91. [ Links ]
8. Gao Y, Kostrominova TY, Faulkner JA, Wineman AS. Age-related changes in the mechanical properties of the epimysium in skeletal muscles of rats. J Biomech. 2008;41(2):465-9. [ Links ]
9. Fang SH, Nishimura T, Takahashi K. Relationship between development of intramuscular connective tissue and toughness of pork during growth of pigs. J Anim Sci. 1999;77(1):120-30. [ Links ]
10. Turrina A, Martínez-González MA, Stecco C. The muscular force transmission system: role of the intramuscular connective tissue. J Bodyw Mov Ther. 2013;17(1):95-102. [ Links ]
11. Elashry MI, Collins-Hooper H, Vaiyapuri S, Patel K. Characterisation of connective tissue from the hypertrophic skeletal muscle of myostatin null mice. J Anat. 2012;220(6):603-11. [ Links ]
12. Heinemeier KM, Mackey AL, Doessing S, Hansen M, Bayer ML, Nielsen RH, et al. GH/IGF-I axis and matrix adaptation of the musculotendinous tissue to exercise in humans. Scandinavian Journal of Medicine & Science in Sports. 2012;22(4):e1-e7. [ Links ]
13. Koskinen SO, Wang W, Ahtikoski AM, Kjaer M, Han XY, Komulainen J, et al. Acute exercise induced changes in rat skeletal muscle mRNAs and proteins regulating type IV collagen content. Am J Physiol Regul Integr Comp Physiol. 2001;280(5):R1292-300. [ Links ]
14. Kjaer M. Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. Physiol Rev. 2004;84(2):649-98. [ Links ]
15. Laing N, et al. Molecular diagnosis of Duchenne muscular dystrophy: past, present and future in relation to implementing therapies. Clin Biochem Rev. 2011;32:129-34. [ Links ]
16. Alexander M, Casar J, Motohashi N, Myers J, Eisenberg I, Gonzalez R, Estrella E, Kang P, Kawahara G, Kunkel L. Regulation of DMD pathology by an ankyrin-encoded miRNA. Skeletal muscle Journal. 2011;1(27):1-17. [ Links ]
17. Wu H, Xiong W, Mei Lin. To build a synapse: signaling pathways in neuromuscular junction assembly. Development. 2010;137:1017-33. [ Links ]
18. Wilson MH, Deschenes M. R. The neuromuscular junction: anatomical features and adaptations to various forms of increased, or decreased neuromuscular activity. Intern J Neuroscience. 2005;115:803-28. [ Links ]
19. Wicke W, Wasicky R, Brugger PC, Kaminski S, Lukas JR. Histochemical and immunohistochemical study on muscle fibers in human extraocular muscle spindles. Exp Eye Res. 2007;84(4):670-9. [ Links ]
20. Treffort N, Picquet F, Petit J, Falempin M. The structure and response properties of Golgi tendon organs in control and hypodynamia-hypokinesia rats. Exp Neurol. 2005;195(2):313-21. [ Links ]
21. Murakami S, Fujino H, Takeda I, Momota R, Kumagishi K, Ohtsuka A. comparison of capillary architecture between slow and fast muscles in rats using a confocal laser scanning microscope. Acta Med Okayama. 2010;64(1):11-8. [ Links ]
22. Poole D, Barstow T, Mc Donough P, Jones A. control of oxygen uptake during exercise. Med Sci Sports Exerc. 2008;40(3):462-74. [ Links ]
23. Rosero-Salazar DH, Salazar-Monsalve L, Tovar-Sánchez MA. Histoquímica enzimática en el diagnóstico de miopatías: revisión sistemática. Medicina & Laboratorio. 2015;20(9-10):467-88. [ Links ]
24. Sanes JR. The basement membrane/basal lamina of skeletal muscle. J Biol Chem. 2003;278(15):12601-4. [ Links ]
25. Morgan JE, Partridge TA. Muscle satellite cells. Int J Biochem Cell Biol. 2003;35(8):1151-6. [ Links ]
26. Fano G, Di Tano G, Parabita M, Beltramin A, Mariggiô MA. Stem cells in adult skeletal muscle tissue: more than a working hypothesis. Basic Appl Myol. 2004;14(1):13-5. [ Links ]
27. Holterman CE, Rudnicki MA. Molecular regulation of satellite cell function. Semin Cell Dev Biol. 2005;16(4-5):575-84. [ Links ]
28. Kaisto T. Special features of vesicle trafficking in skeletal muscle cells. Finland: University of Oulu; 2003. [ Links ]
29. Edwards J, Cully T, Shannon T, Stephenson G, Launikonis B. Longitudinal and transversal propagation of excitation along the tubular system of rat fast-twitch muscle fibres studied by high speed confocal microscopy. J Physiol. 2012;590(3):475-91. [ Links ]
30. Al-Qusairi L, Weiss N, Toussaint A, Berbey C, Messaddeq N, Kretz C, Sanoudou D, Beggs A. H, Allard B, Mandel JL, Laporte J, Jacquemond V, Buj-Bello A. T-tubule disorganization and defective excitation-contraction coupling in muscle fibers lacking myotubularin lipid phosphatase. Proc Natl Acad Sci U S A. 2009;106(44):18763-8. [ Links ]
31. Reyes-Juárez JL, Zarain-Herzberg Á. Función del retículo sarcoplásmico y su papel en las enfermedades cardíacas. Arch Cardiol Méx. 2006;76(4):18-32. [ Links ]
32. Takekura H, Tamaki H, Nishizawa T, Kasuga N. Plasticity of the transverse tubules following denervation and subsequent reinnervation in rat slow and fast muscle fibres. J Muscle Res Cell Motil. 2003;24(7):439-51. [ Links ]
33. Al-Qusairi L, Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skeletal muscle Journal. 2011;1(26):2-11. [ Links ]
34. Hallerdei J, Scheibe RJ, Parkkila S, Waheed A, Sly WS, Gros G, Wetzel P, Endeward V. T tubules and surface membranes provide equally effective pathways of carbonic anhydrase-facilitated lactic acid transport in skeletal muscle. PLoS One. 2010;5(12):e15137. [ Links ]
35. Gueguen N, Lefaucheur L, Fillaut M, Herpin P. Muscle fiber contractile type influences the regulation of mitochondrial function. Mol Cell Biochem. 2005;276(1-2):15-20. [ Links ]
36. Gueguen N, Lefaucheur L, Ecolan P, Fillaut M, Herpin P Ca2+-activated myosin-ATPases, creatine and adenylate kinases regulate mitochondrial function according to myofibre type in rabbit. J Physiol. 2005;564(Pt 3):723-35. [ Links ]
37. Sivitz WI, Yorek MA. Mitochondrial dysfunction in diabetes: from molecular mechanisms to functional significance and therapeutic opportunities. Antioxid Redox Signal. 2010;12(4):537-77. [ Links ]
38. Walters TJ, Kragh JF, Baer DG. Influence of fiber-type composition on recovery from tourniquet-induced skeletal muscle ischemia-reperfusion injury. Appl Physiol Nutr Metab. 2008;33(2):272-81. [ Links ]
39. Racz IB, Illyés G, Sarkadi L, Hamar J. The functional and morphological damage of ischemic reperfused skeletal muscle. Eur Surg Res. 1997;29(4):254-63. [ Links ]
40. Carmo-Araujo EM, Dal-Pai-Silva M, Dal-Pai V, Cecchini R, Anjos Ferreira AL. Ischaemia and reperfusion effects on skeletal muscle tissue: morphological and histochemical studies. Int J Exp Pathol. 2007;88(3):147-54. [ Links ]
41. Carvalho AJ, McKee NH, Green HJ. Metabolic and contractile responses of fast and slow twitch rat skeletal muscles to ischemia and reperfusion. Plast Reconstr Surg. 1997;99(1):163-71. [ Links ]
42. Da Silveira M, Bonneti W Ischemia and reperfusion in skeletal muscle: injury mechanisms and treatment perspectives. J Vasc Br. 2004;3(4):367-78. [ Links ]
43. Saltzman DJ, Kerger H, Jimenez JC, Farzan D, Wilson JM, Thompson JE, et al. Microvascular changes following four-hour single arteriole occlusion. Microsurgery. 2013;33(3):207-15. [ Links ]
44. Ghaly A, Marsh DR. Ischaemia-reperfusion modulates inflammation and fibrosis of skeletal muscle after contusion injury. Int J Exp Pathol. 2010;91(3):244-55. [ Links ]
45. Ma A, Qi S, Chen H. Antioxidant therapy for prevention of inflammation, ischemic reperfusion injuries and allograft rejection. Cardiovasc Hematol Agents Med Chem. 2008;6(1):20-43. [ Links ]
46. Carden DL, Granger DN. Pathophysiology of ischaemia-reperfusion injury. J Pathol. 2000;190(3):255-66. [ Links ]
47. Loerakker S, Manders E, Strijkers GJ, Nicolay K, Baaijens FP, Bader DL, et al. The effects of deformation, ischemia, and reperfusion on the development of muscle damage during prolonged loading. J Appl Physiol (1985). 2011;111(4):1168-77. [ Links ]
48. Saclier M, Cuvellier S, Magnan M, Mounier R, Chazaud B. Monocyte/macrophage interactions with myogenic precursor cells during skeletal muscle regeneration. FEBS J. 2013; 280(17):4118-30. [ Links ]
49. Brunelli S, Rovere-Querini P The immune system and the repair of skeletal muscle. Pharmacol Res. 2008;58(2):117-21. [ Links ]
50. Blaisdell FW The pathophysiology of skeletal muscle ischemia and the reperfusion syndrome: a review. Cardiovasc Surg. 2002;10(6):620-30. [ Links ]
51. Carvalho AJ, McKee NH, Green HJ. Metabolic and contractile responses of fast- and slow-twitch rat skeletal muscles to ischemia. Can J Physiol Pharmacol. 1996;74(12):1333-41. [ Links ]
52. Hocker AD, Boileau RM, Lantz BA, Jewett BA, Gilbert JS, Dreyer HC. Endoplasmic Reticulum Stress Activation during Total Knee Arthroplasty. Physiol Rep. 2013;1(3):e00052. [ Links ]
53. Deldicque L, Hespel P, Francaux M. Endoplasmic reticulum stress in skeletal muscle: origin and metabolic consequences. Exerc Sport Sci Rev. 2012;40(1):43-9. [ Links ]
54. Korth U, Merkel G, Fernandez FF, Jandewerth O, Dogan G, Koch T, et al. Tourniquet-induced changes of energy metabolism in human skeletal muscle monitored by microdialysis. Anesthesiology. 2000;93(6):1407-12. [ Links ]
55. Mense S. Algesic agents exciting muscle nociceptors. Exp Brain Res. 2009;196(1):89-100. [ Links ]
56. Wiendl H, Hohlfeld R, Kieseier BC. Immunobiology of muscle: advances in understanding an immunological microenvironment. Trends Immunol. 2005;26(7):373-80. [ Links ]
57. Dragu A, Schnürer S, Surmann-Schmitt C, von der Mark K, Stürzl M, Unglaub F, et al. Gene expression analysis of ischaemia and reperfusion in human microsurgical free muscle tissue transfer. J Cell Mol Med. 2011;15(4):983-93. [ Links ]
58. Chondrogianni N, Petropoulos I, Grimm S, Georgila K, Catalgol B, Friguet B, et al. Protein damage, repair and proteolysis. Mol Aspects Med. 2014;35:1-71. [ Links ]
59. Mars M, Gregory MA. A histometric analysis of skeletal myofibers following 90 min of tourniquet ischemia and reperfusion. J Surg Res. 1991;50(2):191-5. [ Links ]
60. Chan RK, Austen WG, Ibrahim S, Ding GY, Verna N, Hechtman HB, et al. Reperfusion injury to skeletal muscle affects primarily type II muscle fibers. J Surg Res. 2004;122(1):54-60. [ Links ]
61. Küçüker I, Tuncer S, Sencan A, Bircan F, Caglar E, Elmas C, et al. The effect of surgical and chemical denervation on ischaemia/ reperfusion injury of skeletal muscle. J Plast Reconstr Aesthet Surg. 2012;65(2):240-8. [ Links ]
62. Alameddine HS. Matrix metalloproteinases in skeletal muscles: friends or foes? Neurobiol Dis. 2012;48(3):508-18. [ Links ]
63. Scianna M, Bell CG, Preziosi L. A review of mathematical models for the formation of vascular networks. J Theor Biol. 2013;333:174-209. [ Links ]
64. Zammit P, Beauchamp J. The skeletal muscle satellite cell: stem cell or son of stem cell? Differentiation. 2001;68:193-204. [ Links ]
65. von Degenfeld G, Banfi A, Springer ML, Blau HM. Myoblastmediated gene transfer for therapeutic angiogenesis and arteriogenesis. Br J Pharmacol. 2003;140(4):620-6. [ Links ]
66. Morgan JE, Partridge T. A. Muscle satellite cells. The International Journal of Biochemistry & Cell Biology. 2003;35:1151-6. [ Links ]
67. Scharner J, and Zammit P. The muscle satellite cell at 50: the formative years. Skeletal muscle Journal. 2011;1(28):1-13. [ Links ]
68. Camillo AC, Rocha ReC, Chopard RP. Structural and microvascular study of soleous muscle ofWistar rats after section of the sciatic nerve. Arq Neuropsiquiatr. 2004;62(3B):835-8. [ Links ]
69. Sassoli C, Nosi D, Tani A, Chellini F, Mazzanti B, Quercioli F, et al. Defining the role of mesenchymal stromal cells on the regulation of matrix metalloproteinases in skeletal muscle cells. Experimental Cell Research. 2014;323(2):297-313. [ Links ]
70. Murphy MM, Lawson JA, Mathew SJ, Hutcheson DA, Kardon G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 2011;138(17):3625-37. [ Links ]
71. Woitaske MD, McCarter RJ. Effects of fiber type on ischemia-reperfusion injury in mouse skeletal muscle. Plast Reconstr Surg. 1998;102(6):2052-63. [ Links ]
72. Corona BT, Rathbone CR. Accelerated functional recovery after skeletal muscle ischemia-reperfusion injury using freshly isolated bone marrow cells. J Surg Res. 2014;188(1):100-9. [ Links ]
73. Cutlip RG, Baker BA, Hollander M, Ensey J. Injury and adaptive mechanisms in skeletal muscle. J Electromyogr Kinesiol. 2009;19(3):358-72. [ Links ]
74. Hammers DW, Sarathy A, Pham CB, Drinnan CT, Farrar RP, Suggs LJ. Controlled release of IGF-I from a biodegradable matrix improves functional recovery of skeletal muscle from ischemia/reperfusion. Biotechnol Bioeng. 2012;109(4):1051-9. [ Links ]
75. Itoh M, Kudoh Y. Morphologic changes in rat skeletal muscle after anterior tibial muscle and artery ligation2011; 8: [56-63 pp. [ Links ]].
76. Rosero Salazar DH, Salazar Monsalve L. Digital image analysis of striated skeletal muscle tissue injury during reperfusion after induced ischemia. Proc. of SPIE. 2015. 9287:1-9. [ Links ]
77. Kjaer M. Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. Physiol Rev. 2004;84:649-98. [ Links ]
78. Fang SH, Nishimura T, Takahashi K. Relationship between development of intramuscular connective tissue and toughness of pork during growth of pigs. J Anim Sci. 1999;77:120-30. [ Links ]
79. Mazzocca AD, McCarthy MB, Chowaniec DM, Cote MP, Arciero RA, Drissi H. Rapid isolation of human stem cells (connective tissue progenitor cells) from the proximal humerus during arthroscopic rotator cuff surgery. Am J Sports Med. 2010;38(7):1438-47. [ Links ]
80. Oro AB, Gigante F, Lapera M. Artrolisis artroscopica en el reemplazo total de rodilla. [ Links ]
81. Vaquero J, Vidal C, Medina E, Baena J. Arthroscopic lysis in knee arthrofibrosis. Arthroscopy. 1993;9(6):691-4. [ Links ]