Introducción
El término “regeneración” se refiere a la capacidad que tiene el organismo humano de tratarse y curarse a sí mismo. Los tres grandes componentes de la medicina regenerativa son las células madre, los factores de crecimiento encargados de estimular a las células madre y de potenciar la regeneración del tejido, y la matriz extracelular (conocida como andamiaje o scaffold), que sirve de soporte para la proliferación de las células madre y generación de tejido, abriendo las puertas a lo que se vislumbra como una nueva fuente de órganos a ser trasplantados. En este artículo dedicaremos la mayor atención a la revisión de los fundamentos científicos y biotecnológicos de las células madre, así como a su potencial terapéutico en medicina.
¿Qué son las células madre?
Son células especiales capaces de dar origen a cualquier otra célula del cuerpo y reemplazar a las que se van muriendo, o liberar al entorno moléculas que contribuyen en la reparación de daños provocados por enfermedades, traumas y el mismo fenómeno de envejecimiento. Estas células madre poseen al menos dos características principales: tienen la capacidad de diferenciarse en cualquier tipo de célula especializada, si reciben el estímulo adecuado (diferenciación), al tiempo que pueden conservarse como tales y producir indefinidamente células madre (auto-renovación). Este comportamiento biológico de las células madre se da en forma natural a lo largo de la vida, pero también se puede provocar en el laboratorio: a partir de una pequeña muestra de tejido de un donante se pueden aislar in vitro células madre, las cuales pueden multiplicarse en grandes cantidades y diferenciarse en el tipo de célula que se necesite, para luego ser trasplantadas en la misma persona de la cual proceden o en otro individuo [1].
Es decir, un individuo puede recibir células madre provenientes de él mismo (trasplante autólogo) o de otra persona (trasplante heterólogo o alogénico). La fuente autóloga es desde luego la más compatible y segura, pero hasta ahora no se ha demostrado que sea superior en resultados al trasplante alogénico, el cual tiene la ventaja de que se puede obtener de donantes jóvenes y saludables, y sus células madre pueden almacenarse en bancos, en cantidades suficientes para su uso inmediato.
Con respecto a las dosis a aplicar, se sabe que para algunas indicaciones es suficiente la cantidad que ha sido extraída del tejido donante, purificada y concentrada. En muchas otras aplicaciones médicas, sin embargo, se requieren concentraciones tan altas que es preciso cultivarlas, expandirlas y potenciarlas; de este modo son más evidentes los beneficios terapéuticos, pero hay mayores riesgos de contaminación del cultivo y mutación o transformación maligna de las células [2]. Esta es una de las razones por las cuales los centros que ofrecen estos servicios deben tener sus procedimientos sometidos a rigurosos controles de calidad.
Clasificación y fuentes de las células madre
En forma sencilla las células madre se pueden clasificar según su origen en las que provienen del embrión, del feto o de un organismo adulto. También se pueden categorizar según su capacidad de diferenciación, en células madre totipotentes, pluripotentes o multipotentes, según que tengan la capacidad de diferenciarse en cualquier tipo de célula, en células del mismo origen embrionario, o sólo en células de tejidos específicos. Sin embargo, en la actualidad los límites entre estas categorías se han ido perdiendo, gracias al desarrollo de nuevas técnicas que permiten “reprogramar” genéticamente o “desdiferenciar” un tipo de célula para convertirlo en otro tipo con nuevas propiedades; por ejemplo, hoy en día es posible obtener células madre con los potenciales de las embrionarias, pero que, en lugar de provenir de un embrión, se originaron de células madre adultas que han sido genéticamente manipuladas. Dichas células se conocen como iPSCs (células madre pluripotentes inducidas) y todo indica que van a catapultar la investigación en medicina regenerativa, al poseer todas las virtudes de las células embrionarias, pero sin los dilemas de carácter ético y las restricciones de orden legal que ha tenido la investigación en células de origen embrionario.
En este potencial de diferenciación se basa su clasificación en tres grupos principales: células madre embrionarias (ESCs), fetales (FSCs) y adultas (ASCs). Hasta el estado de blastocisto las ESCs son totipotentes, es decir, capaces de diferenciarse en cualquier tipo de célula; sin embargo, la investigación con células embrionarias genera grandes dilemas de tipo ético-legal, problemas técnicos y un inaceptable riesgo oncogénico (teratomas). En los siguientes estados de desarrollo ontogénico las células madre pierden su pluripotencia y se vuelven multipotentes, lo que significa que, en general, sólo son capaces de diferenciarse en un solo tipo de células de la misma capa germinal. Entre las células madre adultas (ASCs) se incluyen las de médula ósea (BMSCs), las neurales, las hematopoyéticas (HSCs) y las derivadas del tejido adiposo (Adipose-Derived Stem Cell, ADSCs) (figura 1) [3,4]. Esta última fuente ha tenido un gran desarrollo en los años recientes, debido a que tienen algunas ventajas con respecto a otras células madre adultas [1,4-6]: 1) se extraen del tejido adiposo, un tejido de fácil acceso a través de procedimientos mínimamente invasivos y relativamente seguros (como el lipoaspirado subdérmico); 2) cada gramo de tejido tiene concentraciones de células madre hasta mil veces superiores a otros tejidos, incluyendo médula ósea; 3) tienen alto grado de plasticidad, es decir, se pueden diferenciar en células de origen mesodérmico (adipocitos, osteoblastos, condrocitos, miocitos y cardiomiocitos), ectodérmico (células nerviosas) y endodérmico (células hepáticas, pancreáticas y epiteliales); 4) tienen mayor estabilidad genética que otras células madre y, por tanto, es menor el riesgo de que sufran mutaciones cuando se cultivan.
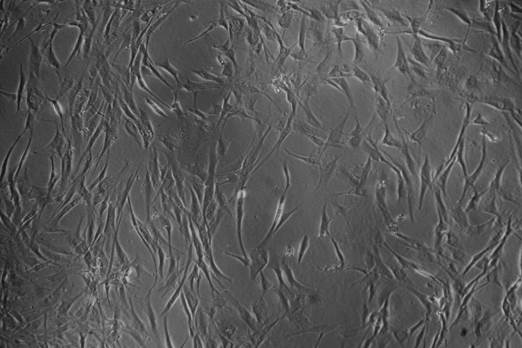
Figura 1 Células madre expandidas, extraídas de tejido adiposo (vista en microscopio invertido a 10x). Fuente: programa de Medicina Regenerativa UTP-CeMaB.
Un tipo de célula madre que se encuentra “a mitad del camino” entre las embrionarias (totipotentes) y las adultas (multipotentes) son las que provienen de los tejidos placentarios, en particular del cordón umbilical (figura 2), capaces de diferenciarse en células del ectodermo, mesodermo y endodermo (pluripotentes). Por su naturaleza primitiva (coexisten en ellas marcadores de células madre embrionarias y adultas), las llamadas células madre mesenquimales perinatales superan muchas de las limitaciones de las adultas, pero sin los inconvenientes ético-legales de las embrionarias. Las células madre aisladas de la gelatina de Wharton, por ejemplo, se mantienen en una fase embrionaria temprana (llamada “pre-mesenchymal stem cells”), se aíslan y cultivan con alta eficacia, se diferencian en una gama mucho más amplia de tipos celulares y no son tumorigénicas ni inmunogénicas; por el contrario, son células “inmunoprivilegiadas” por su falta de expresión de HLA-DR, su inhibición de la activación de linfocitos alogénicos y de la producción de citoquinas proinflamatorias, su estimulación de citoquinas antiinflamatorias, su protección contra el rechazo de órganos y prevención de la enfermedad injerto contra huésped, en caso de trasplantes alogénicos. Si se agrega el hecho de que estas células son fáciles de obtener (sin causar dolor, sin mayores costos, de tejidos que son rutinariamente desechados y sin las restricciones éticas de otras fuentes), de cultivar y de conservar en dosis óptimas para trasplantes, las convierte en fuertes candidatos para terapia celular autóloga y alogénica [7-12].
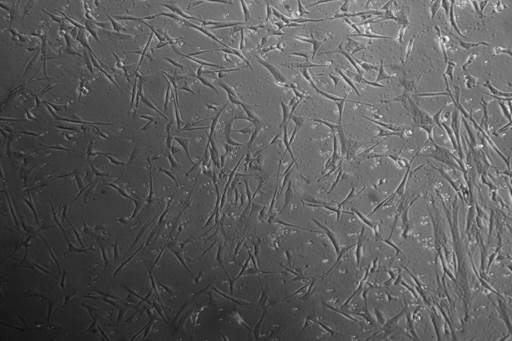
Figura 2 Células madre expandidas, extraídas de la gelatina de Wharton (vista en microscopio invertido a 10x). Fuente: programa de Medicina Regenerativa UTP-CeMaB.
Mecanismos de acción de las células madre
Prácticamente desde el momento en que se demostró la existencia de las células madre y su potencial terapéutico, se ha intentado clarificar cómo actúan estas células en el organismo que las recibe y cómo interaccionan con los tejidos del receptor. Hay dos hipótesis que no son necesariamente excluyentes; la primera sostiene que las células madre trasplantadas se transforman en células nativas del tejido que las recibe, y lo renuevan; la segunda hipótesis, conocida como “el paradigma paracrino”, afirma que los beneficios de las células madre se deben a que ellas estimulan mecanismos de auto-reparación, preservan y revitalizan el tejido, al liberar factores que inducen el crecimiento, la maduración y la función de las células nativas del tejido. Precisamente para mejorar esta última función, las células madre se aplican acompañadas de factores de crecimiento plaquetarios, ya que las plaquetas son una auténtica fábrica de producción de moléculas que potencian la regeneración del tejido.
Después del trasplante las células madre inician un proceso llamado “homing”, que se refiere a la retención de las células madre en la vasculatura del tejido blanco y su posterior migración transendotelial. Dicho proceso involucra un paso inicial denominado “rolling”, en el que las células madre ruedan a lo largo de las vénulas postcapilares, hasta que se enganchan a las células del endotelio vascular, se adhieren a él y transmigran al sitio blanco, a través o entre las células endoteliales, guiadas por mediadores biológicos tipo quimiocinas, citoquinas y moléculas de adhesión. Ya en su “nicho” las células madre interaccionan con otras células y con la matriz extracelular y liberan factores que reducen el daño local y recuperan el funcionamiento normal del tejido [1,13-15].
Plasma rico en plaquetas (PRP) y factores de crecimiento
Como se sabe, las plaquetas son células sanguíneas que no solo intervienen en la coagulación de la sangre, sino también en la reparación tisular, ya que están repletas de los llamados “factores de crecimiento”, entre los cuales se han descrito más de 100, cada uno de ellos con actividad muy específica, encaminada a promover la regeneración de los tejidos.
El PRP se utiliza con propósitos regenerativos en humanos desde hace más de 30 años. Su popularidad se debe a que sus propiedades terapéuticas se basan en moléculas naturales, autólogas y seguras, por lo que se considera un producto biológico, cuya actividad reparadora se ha dividido en tres fases: cuando la plaqueta se activa y libera citoquinas y factores de crecimiento, se inicia una respuesta inflamatoria que tarda algunos días, para dar paso a la fase proliferativa de la curación, que tarda varias semanas; finalmente aparece la fase de remodelación, que conduce a la formación del tejido natural y puede tardar cerca de seis meses.
El término “plasma rico en plaquetas” se refiere a una muestra de plasma con una concentración de plaquetas por encima de los valores basales. Con base en la concentración basal en sangre periférica, los PRP pueden ser de baja concentración (2,5 a 3 veces la concentración basal) o alta concentración (5 a 9 veces la concentración basal). Aunque todavía no se ha demostrado en forma categórica, todo apunta a que, a más concentración plaquetaria, mayor cantidad de factores de crecimiento y mejores resultados clínicos.
Los “factores de crecimiento” son los mismos principios activos del plasma rico en plaquetas, de las cuales se aíslan, purifican y concentran hasta lograr una potencia regenerativa 100 veces mayor que el PRP y sin el inconveniente de aplicar restos celulares inútiles o potencialmente lesivos. De esta manera se reproducen en forma más intensa los procesos fisiológicos de reparación de los tejidos dañados en el lugar anatómico que interesa; son por consiguiente moléculas endógenas sometidas a un procedimiento de concentración y bioestimulación, para incrementar su capacidad regenerativa. Entre ellas se pueden mencionar proteínas con propiedades inmunomodulatorias (TGF-b, HGF, PGE2, IL-6), vasculares (VEGF, HGF, TGF-b2, FGF-2, bFGF, GM-CSF), hematopoyéticas (HGF, GM-CSF, IL-6, 7, 8 y 11, TNF-a) y tróficas (BDNF, NGF, GDNF, IGF-1, EGF, TGF), entre otras [1,16].
No existen organismos gubernamentales que acrediten el desempeño del PRP y los factores de crecimiento, pero su aplicación debe ser considerada una práctica médica, ya que el éxito y la seguridad del procedimiento requiere conocimientos acerca del diagnóstico, beneficios, riesgos, precauciones, contraindicaciones, métodos de preparación y administración, manejo de las complicaciones, así como paraclínicos requeridos y otras alternativas terapéuticas [17,18].
Desafíos biotecnológicos de la medicina regenerativa
A raíz del descubrimiento del potencial terapéutico de las células madre, empresas biotecnológicas, organismos oficiales y centros académico-científicos han hecho grandes inversiones y aunado esfuerzos para avanzar en conocimientos y desarrollo tecnológico, en lo que sin duda constituye un nuevo paradigma de la terapéutica.
La muestra biológica del donante (tejido adiposo, médula ósea, cordón umbilical, etc) se somete en el laboratorio a una fase de lavado y filtración, para eliminar células y restos tisulares indeseables, antes de pasar al proceso de extracción, concentración y cuantificación de las células madre aisladas; para ello se utilizan dispositivos y reactivos especiales y se aplican protocolos validados internacionalmente [1]. Durante muchos años estos procedimientos se realizaron en forma manual, pero ya han sido sustituidos por sistemas controlados, que además deben funcionar en áreas estériles, de modo que se puedan garantizar las buenas prácticas de manufactura (BPM).
Se sabe que se pueden obtener células madre de cualquier órgano del cuerpo, pero no todos los tejidos tienen el mismo rendimiento como fuentes de células madre; en una muestra de médula ósea, por ejemplo, solo el 0.001 a 0.01% son células madre, mientras las ADSCs constituyen el 1-10% del tejido graso, lo cual significa que se pueden aislar entre 2 y 6 millones de células por ml de tejido. Estas diferencias también se encuentran entre las grandes cantidades de células madre obtenidas en la gelatina de Wharton y las relativamente escasas que se pueden aislar de la sangre del cordón umbilical [19-22]. Por otro lado, las células madre de individuos más viejos, con morbilidades crónicas o ciertas enfermedades genéticas, tienen menor capacidad biológica y de auto-renovación, comparadas con las aisladas de personas jóvenes y sanas, o de fuentes perinatales. Actualmente estas últimas se consideran la fuente más fácilmente asequible, segura y efectiva para la terapia celular alogénica [23].
Otro de los grandes desafíos biotecnológicos ha sido la producción in vitro de cantidades suficientes de células madre, que permitan la aplicación de dosis eficaces para los tratamientos de regeneración tisular. Las técnicas de cultivo para la expansión y diferenciación ex vivo de células madre tradicionalmente han sido lentas y dispendiosas, lo que aumenta los costos del procedimiento e incrementa significativamente los peligros de contaminación y de aberraciones cromosómicas, o inclusive de sufrir transformación maligna. En efecto, existe cierto grado de aberraciones cromosómicas en muestras biológicas de donantes, y se sabe que su porcentaje y severidad dependen de la edad, el género y el tabaquismo, entre otras variables; asimismo, en cultivos senescentes existe alto nivel de aneuploidía, pero su falta de capacidad replicativa sugiere que ellas no presentan riesgo de tumorigénesis. Durante la expansión in vitro de las células madre, aumenta la probabilidad de alteraciones cromosómicas, de ahí que la estabilidad genética de los cultivos es un aspecto crítico para establecer la seguridad y desempeño de las células madre en la práctica clínica. Por diferentes métodos de cariotipificación de células madre adultas provenientes de distintos tejidos se han encontrado aberraciones cromosomales que disminuyen a medida que se extienden los cultivos, lo cual se ha atribuido a la desaparición progresiva de las células cariotípicamente anormales y a mayor apoptosis provocadas por mutaciones genéticas deletéreas. Otros estudios, sin embargo, han reportado un mayor riesgo de tumorigenicidad en algunos tipos de células madre, de modo que el tema de la estabilidad genética de dichas células no se ha dilucidado del todo, así que buena parte de la investigación científica actual en el campo de la medicina regenerativa está enfocada en la búsqueda de estrategias que permitan superar estos inconvenientes y lograr cultivos más seguros y costo-efectivos [1,24].
También se busca optimizar la producción y la función de diferentes tipos de células madre, con nuevos métodos que mejoren la confluencia celular, disminuyan los tiempos de doblaje y aseguren un mayor número de pasajes antes de la senescencia, aumenten la migración celular hacia los tejidos dañados y mejoren su capacidad de instalarse en ellos (efecto homing) [25,26]. En el marco de la línea de investigación en medicina regenerativa, el grupo de investigación en Farmacogenética, de la UTP, hace parte de los múltiples grupos que buscan optimizar el potencial de expansión de células madre in vitro, ensayando fármacos que puedan disminuir los tiempos de doblaje, mejorar la confluencia celular y aumentar la migración celular hacia los tejidos dañados.
Pero no basta con la expansión in vitro de las células madre. La conservación de sus propiedades autocrinas/paracrinas también ha sido un escollo ya que, una vez trasplantadas, las células madre se exponen a un ambiente complejo que puede provocar reducción significativa de su potencial terapéutico; por ejemplo, la quimiocina SDF-1, clave en el fenómeno del homing, tiene muy corta vida media y las enzimas que la degradan están activadas en el tejido lesionado, mientras que la expresión de su receptor CXCR4 disminuye rápidamente en células madre cultivadas. Todo esto confabula contra la capacidad de las células madre para responder a señales quimiotácticas del tejido lesionado [27,28]. La búsqueda de estrategias dirigidas a aumentar la capacidad migratoria y la actividad autocrina/paracrina de las células madre ha sido uno de los mayores frentes de atención por parte de los investigadores y uno de los aspectos de más progreso en el campo de la medicina regenerativa.
Las dosis de células madre requeridas, su vía de administración y el tiempo de empleo deben ser definidas e individualizadas para cada uno de los procedimientos en los cuales estarían recomendadas [21]. Con respecto a las dosis a aplicar, se sabe que para algunas indicaciones es suficiente la cantidad de células madre que han sido extraídas del donante, purificadas y concentradas. En muchas otras aplicaciones médicas, sin embargo, la cantidad de células madre que se necesita exige que deban ser cultivadas y multiplicadas; en este último caso son más evidentes los beneficios terapéuticos, pero aumentan los riesgos ya mencionados. Aunque todavía no se han establecido las dosis óptimas de células madre en las diversas aplicaciones médicas, sólo como ejemplo se menciona que muchos ensayos clínicos han empleado 1-2x106 células madre por kg de peso corporal, o se aplican 150-300 millones de células, dos veces por semana durante dos semanas [28].
Sus rutas de administración comprenden principalmente inyección local y administración sistémica; la primera es un procedimiento invasivo que puede causar inflamación y multifocalidad, por lo que cada vez más se prefiere la administración sistémica (intravenosa o intraarterial). Se ha demostrado que la administración intravenosa puede conducir a acumulación de células madre en pulmón, hígado, corazón, cerebro, médula ósea y vejiga, entre otros órganos.
Estado actual de las investigaciones en humanos
Enfermedad cardiovascular. La mayoría de los ensayos clínicos encaminados a evaluar seguridad y efectividad de la medicina regenerativa en las enfermedades cardiovasculares se han enfocado en el infarto del miocardio, la insuficiencia cardíaca y la enfermedad arterial periférica. Si bien la evidencia actual de beneficios no es concluyente, sí pesa cada vez más la evidencia en favor de resultados favorables. Conviene mencionar que, por razones éticas, los pacientes con estas condiciones que reciben células madre ya han sido tratados favorablemente con los protocolos convencionales, de modo que para hallar diferencias entre quienes reciben terapia regenerativa y quienes no, se requieren números muy grandes de pacientes; estudios con estas características están actualmente en marcha [29].
Trastornos osteoarticulares . Los trastornos osteoarticulares han sido indiscutiblemente los más estudiados en la medicina regenerativa y entre los que más evidencia clínica tienen en estos momentos. En fracturas con pérdida de hueso, con respecto al gold estándar actual que consiste en la aplicación de bloques óseos autólogos, las células madre mezcladas con hueso desmineralizado y plasma rico en plaquetas es claramente superior, además que reduce a la mitad el tiempo de reparación. También existe suficiente evidencia de que en osteoartritis la inyección intraarticular de células madre con factores de crecimiento resulta en franca recuperación del cartílago y de los parámetros clínicos (dolor y limitación funcional), artroscópicos y de calidad de vida. En la degeneración discal, los estudios muestran respuesta óptima, varias veces superior a la alcanzada en los pacientes tratados sin medicina regenerativa [30,31].
Enfermedades oculares. El manejo de las quemaduras de córnea con células madre y factores de crecimiento es probablemente uno de los avances más importantes de la medicina regenerativa, al punto en que ya ha sido aprobado un producto comercial, como el primer medicamento basado en células madre, para ser usado en quemaduras de córnea [32].
Hepatopatías. La ingeniería de tejidos se perfila como un método más costo-efectivo que el trasplante de hígado en casos severos de cirrosis. Un reciente meta-análisis de ensayos clínicos controlados en pacientes con cirrosis terminal (hepatitis B, C y alcohólica) concluyó que “el trasplante de células madre mejoró significativamente la función hepática, convirtiéndose en este momento en el más promisorio abordaje terapéutico” [33].
Lesiones de la piel. Con resultados variables se ha explorado el potencial terapéutico de las células madre en una gran variedad de enfermedades cutáneas, aunque los siguientes son los casos en los cuales existe evidencia sólida y consistente de sus beneficios clínicos: 1) Prevención de cicatrices quirúrgicas y tratamiento de cicatrices. La administración de células madre es sencilla, segura y efectiva no solo en términos clínicos sino histológicos. La aplicación intradérmica evita la formación de cicatrices posquirúrgicas exageradas, con conservación de la estructura y las funciones normales de la piel. La prevención de cicatrices quirúrgicas da mejores resultados y es menos costosa que los intentos por mejorar la apariencia cosmética de la cicatriz ya formada. 2) Heridas cutáneas. Las heridas crónicas de la piel, a menudo asociadas con diabetes u obesidad, son difíciles de curar y se hacen más frecuentes a medida que la población envejece. Existe abundante evidencia científica que demuestra la efectividad de la terapia con células madre en la reparación y regeneración de estas heridas, por lo que actualmente muchas autoridades consideran la terapia celular como la más novedosa y efectiva alternativa de tratamiento [34].
Medicina estética. La piel es un tejido con alta capacidad de renovación, pero como está expuesta continuamente a condiciones ambientales adversas, con el tiempo su vitalidad va decayendo. La medicina regenerativa se ha venido convirtiendo en una nueva estrategia para el rejuvenecimiento facial y relleno de surcos y líneas de expresión no deseados, eliminación de cicatrices y señales de acné, aumento y embellecimiento de senos y glúteos, reconstrucción mamaria post-mastectomía, entre otros [23,35].
En resumen, existe buena evidencia acerca de la seguridad de la medicina regenerativa y, en muchos casos puntuales, acerca de sus beneficios. En muchas otras condiciones clínicas, es muy temprano para sacar conclusiones definitivas; aun así, la mayoría de los investigadores son optimistas acerca del potencial de esta nueva estrategia terapéutica y estiman que en los próximos 5 años habrá muchos productos y protocolos de tratamiento basados en la medicina regenerativa.
Criopreservación: bancos de células madre
Se pueden aislar células madre de cualquier tejido del cuerpo y en cualquier momento de la vida de una persona, pero su capacidad de reparar los daños va decayendo por el propio proceso de envejecimiento, o la presencia de enfermedades como la diabetes, la enfermedad cardiovascular, el cáncer o los trastornos que comprometen el sistema inmune. Por estas razones, suele ocurrir que las mismas personas llamadas a beneficiarse de la medicina regenerativa no se encuentran en condiciones óptimas para servir de donantes [36,37]
Los bancos de células madre han surgido como una magnífica alternativa para conservar en forma indefinida las células madre de una persona en cantidades adecuadas y con plena vitalidad. Se ha demostrado que el nacimiento es un momento único para obtener células madre capaces de conservar el mayor vigor biológico y el mayor potencial de diferenciarse en diferentes tejidos, con miras a que puedan ser utilizadas por el propio donante con propósitos terapéuticos o estéticos, en cualquier momento de su vida. Surgieron así los llamados “bancos de células madre de recién nacidos”, basados inicialmente en la recolección de sangre del cordón, y posteriormente de otros tejidos fetales como la gelatina de Wharton, a partir de los cuales se aislan y conservan las células madre del recién nacido, para el tratamiento de un número creciente de enfermedades y defectos físicos [21,38,39].
Adicionalmente, dado que las células madre derivadas de tejidos fetales tienen un carácter primitivo, no poseen riesgos tumorigénicos y exhiben mínima o ninguna inmunogenicidad [40], los usos clínicos de los bancos de células madre del cordón umbilical se han ido expandiendo y en estos momentos se perfilan como la fuente más promisoria de células madre para trasplantes alogénicos [41].














