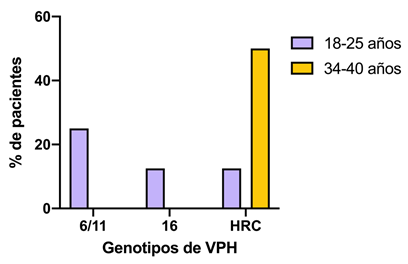Introducción
El Virus de Papiloma Humano (VPH) es un virus de gran interés mundial por estar relacionado con el desarrollo de cáncer. Aproximadamente el 50% de las mujeres son infectadas en los primeros 5 años de haber iniciado las relaciones sexuales, siendo el principal factor de riesgo el cambio constante de pareja sexual. Se estima que en el 10% de la población infectada persistirá la infección por varios años, lo que podría ocasionar la transformación de las células y desarrollo de cáncer 1,2. El cáncer cérvicouterino (CCE) es el cuarto cáncer más frecuente entre las mujeres a nivel mundial, con un estimado de 527.624 casos nuevos y 265.672 muertes para el año 2012 3. En Venezuela, con una población de 29.955.000 habitantes para el año 2014, se estiman 11.000 muertes producidas por cáncer, en las que 15,8% son causadas por CCE4.
Existen más de 100 tipos de VPH 5, de los cuales 40 presentan tropismo por el área cutánea y área mucosa de la vía anogenital en ambos sexos, y pueden ser agrupados en VPH de bajo riesgo oncogénico (VPH-BR) 6, 11, 40, 42, 43, 44, 54, 61, 72 y 81, entre los más frecuentes, y alto riesgo oncogénico (VPH-AR) 16, 18, 31, 33, 34, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 70, 73 y 82. El considerarlos de bajo o alto riesgo oncogénico depende de la caracterización según la presencia en Lesiones Escamosas Intraepiteliales de Alto Grado (LEIAG), y carcinomas invasores6) . En Venezuela, 53,6% de las LEIAG, y 67,7% de los CCE, se relacionan con el genotipo de VPH-AR 16 7. En relación a esto, el estudio realizado por Sánchez8 en una población de Málaga, España en el año 2012, y por Mijit et al. (9) , en Xinjiang, China en el año 2015, demostró que la infección por genotipos de alto riesgo está presente en 100% de los CCE, principalmente por el genotipo 16, mientras que 30% estuvo asociado al genotipo 18. De igual modo, Krishnan et al. 10, en un estudio realizado en el año 2015 en una población de Estados Unidos, señalan que el genotipo 16 y 18 son los más frecuentes.
La infección por VPH tiene un período de incubación de 6 semanas a 2 años, en la mayoría de la población este período latente o subclínico cura espontáneamente, pero un pequeño porcentaje puede perdurar y dar lugar a lesiones en la piel y mucosas11. La transformación de la célula hospedadora en una célula neoplásica con capacidad de infiltrar, se suele producir por la integración del genoma viral en el ADN de esta célula 12.
La relación existente entre la presencia de VPH y la aparición de algún cambio citológico se ha demostrado en diversas investigaciones, como en los estudios realizados en el año 2013 por Pérez et al. 13, y en el año 2015 por Kolawole et al.14 , en una población de México y Nigeria, respectivamente, encontraron que la prevalencia de VPH-AR es alta, entre 95% y 100% en las pacientes con resultados anormales de citología. Sin embargo, la presencia del virus no es suficiente para promover el desarrollo de LEIAG y CCE 14. En la transformación maligna intervienen otros factores como genotipo y carga viral, tabaquismo, multiparidad, hormonas, inmunodepresión, otras infecciones, nutrición y dieta, los cuales modulan el riesgo de progresión, pero no actúan con independencia del VPH. Wang et al. 15, concluyeron que las interacciones pueden explicar por qué la alta frecuencia de la infección por VPH, no se relaciona con una alta frecuencia de CCE.
El VPH no se puede cultivar in vitro; por lo que la detección del virus y los distintos genotipos dependen estrictamente de análisis moleculares de la secuencia de ADN 16. Las muestras celulares deben ser obtenidas del sitio anatómico, y fracasos en la detección del ADN del VPH no excluyen la infección en el paciente, como ocurre en casos con baja carga viral 17. Si se detecta VPH-AR en una paciente con un cambio citológico, la presencia viral es un elemento que diferencia el tratamiento y seguimiento 18. Por lo que la detección molecular permite mejor diagnóstico y manejo del tratamiento en los pacientes 19) .
Por tanto, en la siguiente investigación se evaluó la asociación de los genotipos de VPH, tipificados mediante la técnica de Reacción en Cadena de la Polimerasa (PCR) en muestras de hisopado de cuello uterino, con los cambios citológicos descritos en la citología cérvicouterina de pacientes que asistieron a la consulta de ginecología de un centro de salud privado del Estado Carabobo, en el período marzo-octubre 2017. Esto, con la finalidad de conocer los tipos virales circulantes en la población estudiada, lo que contribuiría a mejorar la data estadística, facilitando el desarrollo e implementación de programas de prevención y tratamiento de la enfermedad para disminuir la mortalidad asociada.
Materiales y métodos
Pacientes
El siguiente trabajo fue de tipo descriptivo y correlacional, no experimental y transeccional. La muestra estuvo conformada por 49 mujeres que asistieron a la consulta de ginecología de un centro de salud privado del Estado Carabobo, en el período marzo a octubre de 2017, con edades comprendidas entre 18 y 40 años, sexualmente activas. El médico seleccionó aquellas pacientes que reflejaban en la citología cambios citológicos en el cuello uterino, de acuerdo con el Sistema Bethesda 2001 12, a las pacientes se les informó acerca del estudio en el que participaron y firmaron un consentimiento informado.
Toma de muestras
El médico se encargó de la toma de la muestra mediante un raspado firme del endocervix y exocervix, sin producir sangrado con hisopo de algodón estéril, éste se colocó en un vial estéril y fue trasladado debidamente para ser preservado a 4 ºC, en el Laboratorio de Biología Molecular del Departamento de Microbiología, de la Escuela de Ciencias Biomédicas, Facultad de Ciencias de la Salud de la Universidad de Carabobo, donde fue procesado para extracción de ADN, amplificación y detección electroforética de VPH. Además de llenar la ficha epidemiológica de cada paciente, la cual suministraba datos de importancia para el estudio, como la edad, antecedentes de infección de transmisión sexual (ITS), el número de parejas sexuales y el cambio citológico presente, si se trataba de Células Escamosas Atípicas (ASC), Células Glandulares Atípicas (AGC), Lesión Intraepitelial Escamosa de Bajo Grado (LEIBG), Lesión intraepitelial Escamosa de Alto Grado (LEIAG).
Extracción y Amplificación del ADN de VPH
Se investigó la presencia de ADN viral del VPH y sus genotipos utilizando la técnica de PCR en las 49 muestras tomadas. Para la extracción del ADN se utilizó el kit RibospinTM vRD, siguiendo las instrucciones del fabricante 20.
En un tubo de microcentrifuga de 1,5 mL, se añadió 500 µL de buffer “VL”, y se introdujo el hisopo para que el buffer actuara sobre la muestra, luego se agitó en el vortex durante 3 segundos y se dejó reposar 10 minutos a temperatura ambiente. A continuación, se añadió 700 µL de buffer de unión “RB1” y se mezcló en el vortex 3 seg. Se transfirió 750 µL del contenido del tubo de microcentrifuga a una minicolumna. Se procedió a centrifugar a 17.217,14 g durante 30 seg. a temperatura ambiente, se descartó la solución que quedó en el fondo y se colocó la columna en el mismo tubo. Se Añadió 500 µL de tampón de lavado “RBW” a la columna y se centrifugó nuevamente a 17.217,14 g durante 30 seg. Se descartó la solución que quedó en el fondo y se colocó nuevamente la columna en el mismo tubo. Se Añadió 500 µL de tampón de lavado B “RNW” a la columna y se centrifugó a 17.217,14 g durante 30 seg., se descartó la solución que quedó en el fondo y se colocó la columna en el mismo tubo, se centrifugó a 17.217,14 g durante 1 min. a temperatura ambiente, para secar bien el etanol residual.
Se transfirió la columna a un nuevo tubo de microcentrifuga de 1,5 ml libre de RNAsas y se agregó 60µL de agua libre de nucleasa directamente sobre la membrana. Se incubó durante 1 min. a temperatura ambiente y luego se centrifugó a 17.217,14 g durante 1 min. Para la amplificación del ADN viral se utilizó la técnica de PCR múltiple con kit comercial SEEPLEXTM HPV4 ACE Screening de Seegene, siguiendo el protocolo del fabricante (21). En primer lugar se preparó la PCR mastermix con 200 µL 5X HPV4A ACE PM (primers o cebadores), 150 µL 8-MOP Solution y 500 µL 2X Multiplex Master Mix. Para la reacción se midieron 17 µL de la PCR mastermix y se pasaron a tubos de PCR 0.2 ml, se añadieron 3 µL del ADN de la muestra, para el control negativo se añadieron 3 µL de HPV4A ACE NC y para el control positivo 3 µL de HPV4A ACE PC en lugar de la muestra. Las amplificaciones se realizaron en un termociclador MiniCycler™ de MJ Research INC, se inició el ciclo con la desnaturalización, calentando a 95° C por 15 min, seguido de 94°C por 30 seg., 63°C 90 seg. para fijar los cebadores, seguido de 72°C 90 seg. para que actúe la taq-polimerasa, por 40 ciclos; por último, 72°C por 10 min.
Detección y genotipificación del VPH
Los productos amplificados fueron analizados mediante electroforesis en gel de agarosa 1,5%, conteniendo 0,8 µl de SYBR® Green I Nucleic Acid Gel Stain (SIGMA) a una concentración de 10000X DMSO y las corridas se realizaron utilizando una corriente eléctrica de 150 voltios por 30 minutos. Se visualizaron las bandas de ADN en un transiluminador de luz ultravioleta, la distancia recorrida por la banda de la muestra fue comparada con la distancia recorrida por las bandas del marcador de pares de base (1000 pb) para identificar el genotipo de VPH con base en el tamaño del producto amplificado.
Análisis de Datos
Para la demostración de la distribución de las variables y las asociaciones se realizaron análisis de Chi-cuadrado y se utilizaron los programas SPSS versión 18 y Prism 18 (GraphPad Software, Inc.). Un valor de P < 0,05 fue considerado estadísticamente significativo con un 95% de confianza.
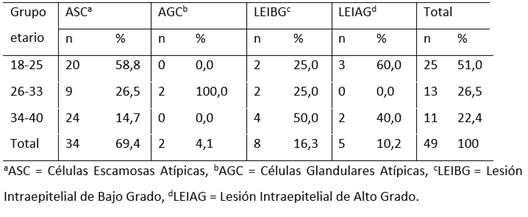
Resultados
Este estudio fue realizado en 49 mujeres que asistieron a la consulta ginecológica de un centro de salud privado, con edades comprendidas entre 18 y 25 años, la edad promedio fue de 27 años, se obtuvieron muestras de hisopado vaginal de la región endocervical y exocervical de las pacientes. Como resultado hallamos que la mayor prevalencia de cambios citológicos (51%) corresponden al grupo etario entre 18-25 años, en donde en el 58,8% presentó células escamosas atípicas (ASC) y representan el 60% de las pacientes con lesión intraepitelial de alto grado (LEIAG). Respecto a las pacientes con edades comprendidas entre 34-40 años, el 50 % presentó lesión intraepitelial de bajo grado, sin embargo al asociar estas variables no se encontró relación estadísticamente significativa (Chi 2 test P > 0.05), entre la edad y la aparición de cambios citológicos (TABLA 1).
Detección de ADN Viral y su relación con cambios citológicos
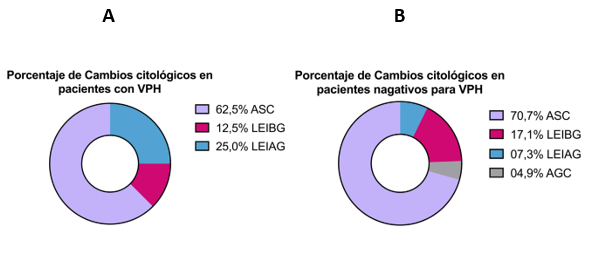
Las pacientes que asistieron a la consulta, bajo previo consentimiento informado, permitieron realizar la detección molecular mediante la técnica de Reacción en Cadena de la Polimerasa (PCR), en donde se logró realizar la detección de la presencia del Virus de Papiloma Humano en 16,3% (n = 8/49) de las pacientes (Figura 1). Dicha detección viral, permitió realizar la correlación con los cambios citológicos presentes (Figura 2 A), observándose que el 62,5% de las pacientes (n = 5/8) presentó células escamosas atípicas (ASC), un 25% (n = 2) presentó Lesión intraepitelial de alto grado (LEIAG), y un 12,5% (n = 1/8) presentó lesión intraepitelial de bajo grado (LEIBG), sin embargo al evaluar la relación entre los cambios citológicos con las pacientes que obtuvieron un resultado negativo para ADN viral (Figura 2 B), no se encontró relación estadísticamente significativa entre la presencia de VPH y la aparición de cambios citológicos.
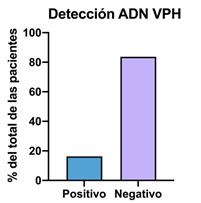
Figura 1 Detección de ADN del virus de Papiloma Humano en pacientes que asistieron a consulta ginecológica.
Del total de las 49 muestras de hisopados de mujeres en edades comprendidas entre 18 y 40 años, el 83,7% de las pacientes no presentó ADN viral (n = 41/49), mientras que se detectó el virus de VPH en el 16,3% de las pacientes (n = 8/49)
A) De las mujeres diagnósticadas con VPH, los resultados de la citología reveló un mayor porcentaje de cambios citológicos de ASC 62,5% (n = 5/8), LEIBG 12,5% (n = 1/8), LEIAG 25% (n = 2/8) y no se detectó ADN viral en pacientes con AGC. B) De las pacientes sin presencia viral, la mayoría de las pacientes presentó ASC en un 70,7% (n = 29/41), LEIBG 17,1% (n = 7/41), LEIAG 7,3% (n= 3/41) y ACG 4,9% (n= 2/41). No hubo diferencias significativas entre la presencia de VPH y los cambios citológicos ASC = Células Escamosas Atípicas (P =0,644), AGC = Células Glandulares Atípicas (P =0,524), LEIBG = Lesión Intraepitelial de Bajo Grado (P =0,749), LEIAG = Lesión Intraepitelial de Alto Grado (P =0,131), Análisis realizado mediante prueba del de Pearson, NS, no significativo (P > 0.05), 95% de confianza.
La genotipificación del virus (Figura 3), demostró que el 62,5% de las pacientes presentaron positividad para los genotipos de eran para el gen común de alto riesgo (HRC), el cual abarca los genotipo 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 26, 53, 69, 73, 82, mientras que 25% para el gen común de bajo riesgo, que incluye los genotipos 6 y 11, 12.5% para el genotipo 16, en las pacientes evaluadas no se detectó el genotipo 18. A pesar de no encontrar estadísticas significativas entre el genotipo de VPH y el cambio citológico, de las dos pacientes con lesión intraepitelial de alto grado presentaron el genotipo 6/11 y el gen común de alto riesgo, mientras que la paciente con lesión intraepitelial de bajo grado presentó el gen común de alto riesgo (12,5%), y las pacientes con células escamosas atípicas presentaron los genotipos de alto riesgo en un mayor porcentaje (37,5%).
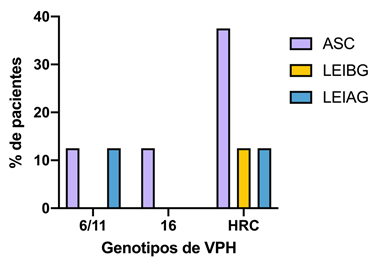
Figura 3 Correlación entre pacientes con cambios citológicos y la presencia de distribución de los genotipos de VPH.
El mayor porcentaje de genotipos detectados se detectó en las padientes que presentaron células escamosas atípicas ASC 62,5% (n= 5/8) ns P = 0.792, seguido de las pacientes con lesión intraepitelial de alto grado LEIAG 25% (n = 2/8) P = 0,885, y Lesión intraepitelial de bajo grado LEIBG 12,5% (n = 1/8) P = 0.215. Análisis realizado mediante prueba del de Pearson, NS, no significativo (P > 0.05), 95% de confianza. Genotipos de VPH 6 y 11, 16, y alto riesgo HRC, que abarcan los genotipos (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 26, 53, 69, 73, 82).
Genotipos de alto riesgo se distribuyen entre los distintos cambios citológicos y los distintos genotipos de VPH 6/11, 16 y de alto riesgo se encuentran en mayor proporción en pacientes con Células escamosas atípicas
Correlación entre los genotipos de VPH con la edad y número de parejas sexuales
Para evaluar la correlación existente entre los genotipos de VPH y la presencia de lesiones epiteliales de alto grado como factor de riesgo para la progresión de cáncer cérvico uterino, se detectó que las pacientes jóvenes de 18 a 25 años presentaron el 50% de los genotipos evaluados, mientras que el otro 50 % correspondió a genotipos de alto riesgo (Figura 4).
Al evaluar la edad como factor de riesgo, se pudo observar que las pacientes más jóvenes presentan una distribución del 50% de los distintos genotipos, mientras que el gen común de alto riesgo predominó en las pacientes de 24-40 años, no detectandose la presencia de VPH en las pacientes con edades de 26-33 años. Análisis realizado mediante prueba del de Pearson, NS, no significativo (P > 0.05), 95% de confianza. Genotipos de VPH 6 y 11, 16, y alto riesgo HRC, que abarcan los genotipos (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 26, 53, 69, 73, 82).
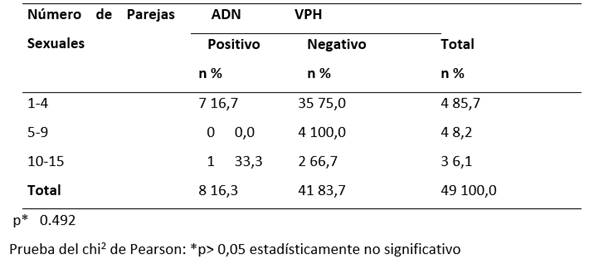
Al evaluar las interacciones entre el número de parejas sexuales y el contagio del virus en las pacientes, no se encontró relación estadísticamente significativa, se observa que 85,7% de las pacientes ha tenido entre 1 y 4 parejas sexuales, y 16,7% de ellas presentaba VPH (TABLA 2).
VPH como la enfermedad de transmisión sexual entre las pacientes que asistieron a la consulta ginecológica
Además de la búsqueda en la identificación de los genotipos predominantes en las pacientes que asistieron a la consulta ginecológica, fue relevante evaluar el historial clínico de cada una de las pacientes e identificar el diagnóstico de otra infección de transmisión sexual (TABLA 3), lo que nos permitió observar que el 8,2% presentó algún tipo de ITS, y que dentro de este porcentaje solo el 25%, correspondiente a 1 paciente. Además, se pudo observar que el mayor porcentaje de pacientes que no se les detectó presencia de VPH, solamente 3 de las 38 pacientes presentaron un agente infeccioso diferente al VPH.
Discusión
Las alteraciones citológicas presentes fueron según porcentaje de frecuencia, células escamosas atípicas (ASC), células glandulares atípicas (AGC), lesión escamosa intraepitelial de bajo grado (LEIBG) y lesión escamosa intraepitelial de alto grado (LEIAG). La detección molecular demostró que 16,3% de la muestra presentaba Virus de Papiloma Humano, 62,5% correspondían al gen común de alto riesgo (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 26, 53, 69, 73, 82), 25% a genotipos de bajo riesgo 6/11, 12,5% al genotipo 16 y no se detectó el genotipo 18
La presencia de ASC fue la alteración citológica predominante, esto se relaciona con el estudio realizado por González et al. 22, en la ciudad de Bogotá, en el que las ASC fueron la anormalidad citológica más frecuente en todos los grupos etarios, pero contrasta con otros estudios realizados por Mendoza et al. 23 (Tuluá, Colombia), Pérez et al. 13) (México), y Rojas et al. 24 (Barquisimeto, Venezuela) en los que predominaron las LEIBG y LEIAG, por lo que la prevalencia de anormalidades citológicas varía según el tipo de población en estudio y los factores de riesgos inherentes a la misma.
La detección molecular mediante la técnica de PCR, demostró que el porcentaje de positividad fue inferior al reflejado en investigaciones cuya población de estudio correspondía a mujeres venezolanas, tal es el caso de López et al. 25 (Mérida), Salazar et al. 26) (Cumaná) y Mena et al. 27) (Valencia).
De igual modo, en estudios internacionales como el de Pérez et al. 13) (México), Assoumou et al. 28) (Gabón), Jariene et al. 29) (Lituania) y Kolawole et al. 14) (Nigeria), se evidencia que la presencia de VPH en pacientes con cambios citológicos variaba entre 53,4% y 100%, en esta investigación los pacientes que presentaban lesiones, no necesariamente eran producidas por el VPH, puede deberse en parte, a que la mayoría de las pacientes estudiadas presentaban ASC, alteración citológica que puede ser ocasionada por otras razones como: irritación, infección vaginal por hongo; algunos tumores como los pólipos o quistes benignos; así mismo por cambios hormonales, y no exclusivamente debido a la presencia de VPH 30,31, esto se demuestra en un estudio realizado por Baptista et al. 32 en el que señala que la presencia de inflamación e infecciones moderadas o graves independientes del VPH se asocia con un mayor riesgo de anomalías citológicas cervicales.
En cuanto a la genotipificación del virus, aunque no fue posible detectar específicamente cuál genotipo presentaban las pacientes positivas al HRC, debido a que el kit de detección molecular utilizado determinaba un gen que presentan en común este grupo de genotipos de VPH-AR, se relacionan con un estudio realizado por Rivas et al. 33 en la ciudad de Caracas, donde de igual manera encontraron predominio de VPH-AR diferentes al genotipo 16 y 18; no obstante, otros estudios nacionales muestran una mayor prevalencia de genotipos de bajo riesgo como indican los estudios de Mena et al. 27) , Sanoja et al.34 y de Pulido et al. 35.
De las pacientes que presentaban LEIBG y LEIAG en este estudio solo 3 presentaron lesiones para VPH (2 VPH HR y 1 VPH 6/11), esto fue inferior al reflejado en otros estudios 26,36) , en donde detectaron que entre 50% y 98% de pacientes con lesión escamosa intraepitelial (LEI) presentaban VPH-AR, en algunos casos la detección molecular del virus se dificulta debido a características propias de la muestra, como baja carga viral o la presencia de interferencias, por ende la obtención de falsos negativos en los resultados. En diversos estudios se evidencia la presencia de VPH en un alto porcentaje de CCE 7,8) y demuestran la relación que existe entre la presencia del virus y la aparición de alteraciones del parénquima del cuello uterino, que pueden progresar a CCE.
La evolución de las LEIBG y LEIAG es variable, la sola presencia del ADN viral no es indicativa de una transformación maligna, puesto que son otros factores de riesgo las que apoyan la malignidad 15,37. De las 5 pacientes con LEIAG, solo una presentaba VPH, además de ser la única paciente en el estudio en quien se pudo evidenciar coinfección, siendo positiva para el HRC y genotipo 16.
En diversos estudios, como el de Salazar et al. 38) (Estados Unidos), señalan que 32,2% de las pacientes con infección por VPH y LEI presentaban coinfección. En este sentido, Tran et al. 39) (Vietnam), reportan que 20% de las pacientes a las que se les detectó VPH presentaban coinfección con genotipos de alto riesgo, ellos afirman que las infecciones por múltiples genotipos de VPH son comunes, y que está asociada con un mayor riesgo de CCE.
Es importante resaltar que existe la presencia de genotipos de alto riesgo oncogénico en esta población, lo que tiene importancia epidemiológica local, ya que puede traducirse en una mayor incidencia de CCE a futuro. El detectar la presencia del HRC, del genotipo 16 y del 6/11, en las pacientes entre 18-25 años indica que debe seguirse el tratamiento y evolución de estas pacientes y se relaciona con diversos estudios en los que se describe la presencia de genotipos de alto y bajo riesgo oncogénico en las pacientes menores de 25 años 25,34,35) . La presencia de únicamente el HRC en pacientes entre 34-40 años, concuerda con la historia natural del virus, en la que el contagio ocurre a edades tempranas y permanece en estado de latencia durante meses o años 41y42) .
En cuanto a la relación que existe entre el número de parejas sexuales y el contagio del virus, los resultados obtenidos contrastan con los señalados en el estudio realizado por Puente et al. 40 en adolescentes, en donde 52,5% de las pacientes que manifestaron haber tenido 2 parejas sexuales en los últimos 6 meses presentaban VPH, y por el estudio realizado por Rodriguez et al. 41) , quienes describieron que 9 de cada 10 mujeres que tuvieron 3 o más compañeros sexuales presentaban VPH, por lo que el riesgo de adquisición del virus está relacionado con el inicio temprano de las relaciones sexuales y con tener diferentes parejas sexuales (2 .
Para la paciente que presentó ITS e infección por VPH, el cambio citológico asociado era LEIBG, fue positiva para el HRC y en los antecedentes de ITS manifestó presentar herpes (VHS). Un estudio realizado por Atencio et al. 43, señala que las presencias de ambos agentes virales inducen la aparición de LEIBG, y Skeate et al. 44) , en su estudio demuestra que la infección por VHS provoca una mayor susceptibilidad a la infección por VPH, y que es un cofactor responsable de las alteraciones del parénquima del cuello uterino relacionadas con el desarrollo de CCE.
La frecuencia y la genotipificación del VPH obtenidos en la población estudiada, aún cuando no son extrapolables debido a lo pequeño de la muestra, y a las variaciones en los cambios citológicos, tienen relevancia dado la importancia del problema ya que proporciona información que permite el diseño de acciones permanentes de prevención primaria y secundaria del CCE en la población femenina.
Se recomienda para investigaciones futuras ampliar la muestra de estudio, así como evaluar otros factores de riesgo que pueden incidir en la infección por VPH, y el desarrollo de CCE, como la terapia hormonal, tabaquismo, uso de métodos anticonceptivos y paridad. De igual forma, sería de interés epidemiológico detectar específicamente los genotipos de alto riesgo diferentes al 16 y 18, lo cual no pudo realizarse en esta investigación.