Introducción
La Enfermedad Renal Crónica (ERC) es una de las enfermedades de mayor impacto en la salud pública a nivel global, con una incidencia y prevalencia en aumento debido a factores como el proceso natural de nefroenvejecimiento que dificulta el diagnóstico de la ERC y la aparición de enfermedades como la Diabetes Mellitus (DM), Hipertensión Arterial (HTA) y obesidad que actuán como agentes etiológicos de la ERC 1.
La prevalencia estimada a nivel mundial de ERC es del 13,4% (11,7-15,1%), con alrededor de seis millones de pacientes en estadios terminales con necesidad de terapia de reemplazo renal. En algunos países, la prevalencia es aún mayor, como el caso de Estados Unidos y España con prevalencias de 14% y 20,6% en la población adulta 2), (3. En Colombia, según la cuenta de alto costo a junio de 2019, la prevalencia de la ERC era de 1,84% 4.
La progresión de la ERC es definida por el descenso de la Tasa de Filtración Glomerular (TFG) > 5 ml/min/año o > 10 ml/min en cinco años 5 y contribuye a la aparición de complicaciones agudas y crónicas que conllevan a aumento de la morbimortalidad en este grupo de pacientes 7. Sin embargo, la progresión es muy variable ya que depende de múltiples factores, entre ellos, la presencia de Hipertensión Arterial (HTA), Diabetes Mellitus (DM) y proteinuria 6.
En Colombia, desde el año 2008, se creó la Cuenta de Alto Costo 4 que obliga a las empresas prestadoras de servicios de salud reportar las enfermedades con costo elevado para el sistema, entre ellas la ERC. Posteriormente, en el año 2013, se creó el programa de nefroprotección que hace seguimiento de las enfermedades precursoras (HTA, DM) y a los ya diagnosticados, para realizar acciones oportunas de detección y tratamiento 10-11.
Diversas investigaciones muestran que hay factores demográficos y clínicos asociados a la progresión de la ERC 6), (9, por tanto, el objetivo de este estudio fue determinar los factores demográficos y clínicos que explican la progresión de pacientes con ERC en el contexto de un programa de nefroprotección.
Materiales y métodos
Estudio observacional de cohorte retrospectiva con pacientes de un programa de nefroprotección de una entidad promotora de salud que atiende principalmente el régimen subsidiado en el departamento de Nariño, Colombia. De una población de referencia de 6.707, se analizaron todos los pacientes que cumplieron con los criterios de inclusión, para un total de 5872 participantes.
Los criterios de inclusión fueron: 1) ser mayor de edad; 2) tener diagnóstico de ERC en cualquier estadio; 3) pertenecer al programa desde el año 2016, como mínimo. Se excluyeron pacientes gestantes y pacientes sin medición de la TFG. La primera medición de las variables de interés fue hecha en los primeros 5 meses de 2016, la segunda medición se realizó 2 años después, en la que 835 pacientes no se incluyeron por no contar con la medición de la TFG.
Se realizó el contraste de los valores de la TFG en donde una disminución delta de 5ml/min/1.73m2 o más, indicaba progresión como variable dependiente (dicotómica si/no).
Las variables analizadas fueron de tipo demográfico y clínico, recolectadas de fuente secundaria (base de datos del programa de nefroprotección). La recolección de la información se hizo por personal médico del programa, previamente capacitado en los años 2016 y 2018.
Las variables independientes fueron:
a. Demográficas: sexo, edad (<de 60 años, > o igual a 60 años, parámetro tomado de cuenta de alto costo 2019), etnia, nivel de escolaridad, procedencia.
b. Clínicas:
Tabaquismo.
Exposición a biomasa.
Consumo de alcohol.
Actividad física.
Diagnóstico de HTA.
Compensación de tensión arterial (TA no compensada si es menor de 60 años: >140/90mmHg, >o igual a 60 años: >150/90mmHg) 5.
Recibe IECA.
Recibe ARA II.
Diagnóstico de DM.
Clasificación de DM y compensación de DM (se tomó de la base de datos, consideraron compensada si niveles de HbA1c menores de 7% si es menor de 60 años, y < o igual a 8% si es mayor o igual de 60 años).
Glucosa en ayunas (>126mg/dl, 110-126mg/dl, <110mg/dl).
Glucosa posprandial (> o igual a 200mg/dl, 140-199,9mg/dl, <139,9mg/dl) 3.
Compensación de HbA1C (<7% si es menor de 60 años, y < o igual a 8% si es mayor o igual de 60 años).
Diagnóstico de dislipidemias.
LDL (>o igual 100mg/dl, <100mg/dl).
HDL (si es hombre < o igual a 35 descompensado, si es mujer <o igual a 40 descompensada) 3.
Colesterol total (> o igual a 200mg/dl descompensado, <200mg/dl compensado) 3.
Triglicéridos (> o igual a 150mg/dl, descompensado, <150mg/dl compensado) 3.
Recibe estatinas.
IMC (obesidad 1,2,3: IMC >o igual a 30kg/m2; sobrepeso 25kg/m2-29.9 kg/m2, bajo peso <18,5kg/m2, peso normal 18,5kg/m2-24,9kg/m2) 3.
Perímetro abdominal (si es hombre > o igual a 102cm descompensado, si es mujer < o igual a 88cm descompensado) 3.
Adherencia al tratamiento (se tomó como variable de la base de datos, consideraron no adherencia si olvida tomar al menos una vez cualquiera de sus medicamentos de control de sus enfermedades).
Hb en metas (< o igual a 10 mg/dl baja, > a 10mg/dl en metas) 5.
PTH en metas (> a 110pg/ml alto, < o igual a 110pg/ml en metas) 5.
Fósforo en metas (>4,6mg/dl, 2,7mg/dl-4,6mg/dl, <2,7mg/dl en metas) 5.
Albumina (< o igual 4g/dl baja, > 4g/dl en metas) 9.
Potasio (> o igual a 5,5meq/l elevado, < 3,5meq/l bajo, 3,5-5,49meq/l en metas) 9.
Creatinina sérica (>1,5mg/dl elevada, 0,5-1,5mg/dl normal) 9,
Cociente albumina/creatinina (> o igual a 300mg/gr elevado, 31mg/dl-299mg/gr moderadamente elevado, 10mg/dl-30mg/gr levemente elevado, <10mg/gr normal) 9.
Albuminuria (>300mg/gr incremento severo, 30-300mg/gr moderado incremento, ˂30mg/gr normal o mínimo incremento) 9,
Etiología de la ERC
Estadio de la ERC.
Todas las variables cuantitativas se recodificaron a cualitativas, siguiendo los indicadores de nefroprotección para pacientes con ERC, nacionales e internacionales (kdigo y CAC). Se utilizaron medidas de frecuencia absoluta y relativa para el análisis de las variables cualitativas. El análisis bivariado se realizó utilizando chi cuadrado. Para estimar la fuerza de asociación se usó el riesgo relativo (RR), con su respectivo intervalo de confianza de 95% (IC95%) y se consideró significativo un valor p <0.005.
Los factores independientes fueron determinados mediante modelos lineales generalizados de regresión binomial con enlace logarítmico, con fines explicativos, y para controlar posibles variables confusoras como: HTA, sexo, edad, estadio de la ERC, se incluyeron al modelo multivariado. Los paquetes estadísticos utilizados fueron SPSS 21.0 (licencia Universidad CES) y Epidat 3.1.
Para el presente trabajo se tuvo en cuenta la declaración de Helsinki para salvaguardar la confidencialidad de los participantes, se clasificó como investigación sin riesgo según el artículo 11 de la resolución 8430 de 1993 para Colombia, además, fue aceptado por el comité de ética institucional de la Universidad CES de Medellín y de la Institución Prestadora de Servicios de Salud.
Resultados
1. Características demográficas y clínicas de los pacientes del estudio
Se analizaron un total de 5872 pacientes, encontrando para los factores demográficos, que el 72,2% fueron mujeres, el 75,1% tenían 60 años o más. Con respecto a la etnia, el 12,4% eran de raza negra siendo la mayoría mestizos con un total del 85%. A nivel de escolarización, el 88,5% de los pacientes cursó estudios de básica primaria. En cuanto a la procedencia, el 47% de los participantes eran de la ciudad de Pasto.
Con respecto a las características clínicas se encontró que la exposición a biomasa fue del 15,4% y más del 50% realizaba actividad física regular, con un 61,6%. La mayoría de los pacientes tenían HTA, con un 95%, el 78,5% la tiene compensada, la mayoría de pacientes reciben ARA II (71,5%), y solo el 17,6% recibe IECA. Más de la mitad de los pacientes tienen diagnóstico de dislipidemias (65,2%), con un 67,9% de pacientes con colesterol total compensado, con la mitad de los pacientes con descompensación del colesterol LDL. La DM se presentó en el 25,1% de los casos, con un 17% de pacientes compensada, la glucemia en ayunas estuvo dentro de rangos normales en un 56,4%, con respecto a la glucemia postprandial solo el 9,3% la tenía compensada. Los pacientes tuvieron una HbA1C descompensada en un 7,2% de los casos. En cuanto a los triglicéridos, el 44,3% tienen este parámetro elevado. Los pacientes que reciben estatinas del total de la población son el 48,5%. Con relación al IMC, el 68,4% tienen sobrepeso u obesidad en cualquiera de sus grados, con un perímetro abdominal elevado en un 65%.
Con respecto a la etiología del deterioro de la función renal, la mayoría de los pacientes tienen como factor causal la HTA o la DM con un 71,5% mientras que un 28,5% de los pacientes presentan otras causas. Con referencia al estadio de la ERC, más de la mitad (52,4%) tienen un estadio de 3-5. En cuanto a los electrolitos como potasio y fósforo, la mayoría de los pacientes los tenía dentro de rangos normales, 74,4%, y 47,1%. La creatinina estaba elevada en un 52,3% de los casos. Finalmente, el 49,2% tuvieron un deterioro de la función renal. En la Tabla1 se presentan las características demográficas y clínicas analizadas:
Tabla1. Características demográficas y clínicas de los pacientes del estudio.
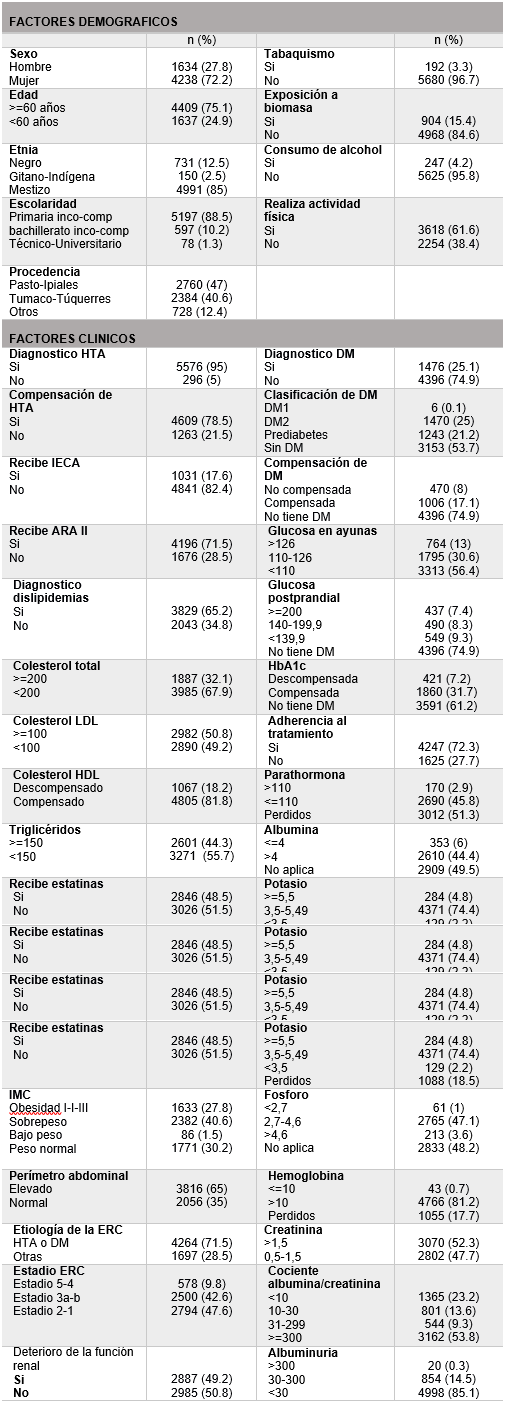
HTA: hipertensión arterial, DM: diabetes mellitus, IECA: inhibidor de la enzima convertidora de angiotensina, ARA II: antagonistas competitivos de los receptores de angiotensina II, LDL: lipoproteínas de baja densidad, HDL: lipoproteínas de alta densidad, IMC: índice de masa corporal, ERC: enfermedad renal crónica.
2. Características clínicas de los pacientes de estudio y su relación con la progresión de la ERC.
De los pacientes pertenecientes al programa de nefroprotección entre 2016 y 2018, se encontró que el 49,2% presentaban progresión de la ERC, correspondiente a la disminución de la TFG 5mL/min/1.73 m2 en o más. La progresión de la ERC es más alta al superar los 60 años con un riesgo relativo de 1,07 veces de presentar deterioro de la TFG, al comparar con pacientes de menos de 60 años RR: 1,07 (IC95% 1,00-1,14) valor p < 0,03.
Por su parte, la escolaridad, la exposición a biomasa y no realizar actividad física fueron variables que no tuvieron un valor significativo en la progresión de la ERC. Con relación a la procedencia, los datos indican que la mayoría de los pacientes participantes en el programa de nefroprotección son de la ciudad de Pasto y de Ipiales, con un riesgo relativo de 1,26 veces de presentar progresión de la ERC en comparación con pacientes procedentes de ciudades más pequeñas o municipios alejados RR: 1,26 (IC95% 08- 1 ,17) valor p<0,05.
De las variables clínicas se encontró explicación cruda con la compensación de la TA, glucosa posprandial, colesterol LDL, IMC, fósforo, potasio, creatinina, cociente albuminuria/creatinuria. La no adherencia al tratamiento tiene un riesgo relativo 1,18 veces de presentar progresión de la ERC, con respecto a un paciente adherente RR: 1,18 (IC95% 1,12 - 1,24), otra variable a analizar es el estadio de la ERC, de 3 a 5, donde hay un riesgo relativo de 1,23 y 1,21 veces de presentar progresión de la enfermedad que pacientes en estadios 1-2. La variable etiología de la ERC, presenta datos significativos, con RR: 1,08 (IC95%:1,05-1,11), de manera específica tener diagnóstico de HTA y/o DM, tiene un riesgo relativo de 1,08 veces de presentar deterioro crónico de la TFG, otras variables se presentan en la Tabla 2:
Tabla 2 Características clínicas de los pacientes de estudio y su relación con la progresión de la ERC.
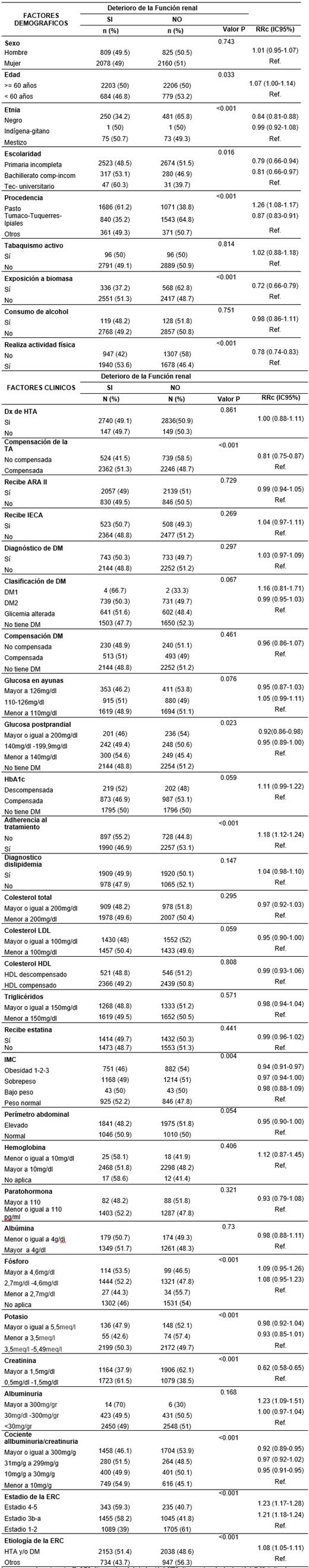
HTA: hipertensión arterial, DM: diabetes mellitus, IECA: inhibidor de la enzima convertidora de angiotensina, ARA II: antagonistas competitivos de los receptores de angiotensina II, LDL: lipoproteínas de baja densidad, HDL: lipoproteínas de alta densidad, IMC: índice de masa corporal, ERC: enfermedad renal crónica, TFG: tasa de filtración glomerular, HbA1c: hemoglobina glicosilada, TA: tensión arterial.
Por otro lado, se puede evidenciar que algunas variables en una comparación unicausal presentan valores protectores en su RR, como el caso de la compensación de TA: RR: 0,81 IC95%0,75-0,87, o el caso del valor de la glucosa posprandial > o igual 200mg/dl, RR 0,92 IC95%0,86-0,98.
En síntesis, se encontró que los factores que mejor explican la relación entre la progresión de la ERC y las distintas variables demográficas y clínicas fueron: ser hombre con un RR crudo de 1,01 IC95% (0,95-1,07), con un RR ajustado de 1,04 (IC95%:1,00-1,15), y tener un estadio de la ERC, de 4, 5 y 3a-b, con RR ajustado 1,62 (IC1,36-1,94) y 1,41 (IC1,21-1,63) respectivamente. En la Tabla 3 se presentan los factores más influyentes en la progresión de la ERC:
Tabla 3 Factores demográficos y clínicos que mejor explican la progresión de la ERC, en un programa de nefroprotección 2016-2018.
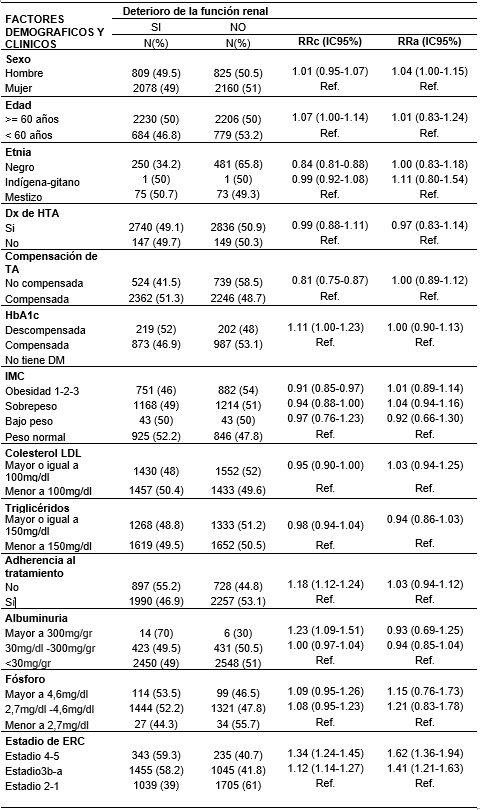
RRc: riesgo relativo crudo, RRa: riesgo relativo ajustado, DM: diabetes mellitus, Ref.: valor de referencia, IMC: índice de masa corporal, ERC: enfermedad renal crónica, RRc: riesgo relativo crudo, RRa: riesgo relativo ajustado, HTA: hipertensión arterial, TA: tensión arterial, DM: diabetes mellitus, mg/dl: miligramos por decilitro, HbA1C: hemoglobina glicosilada, IMC: índice de masa corporal, ERC: enfermedad renal crónica.
Discusión
Este estudio aporta información epidemiológica importante sobre la progresión de la ERC en cuanto a su asociación explicativa con factores demográficos y clínicos en una población adulta atendida en el programa de nefroprotección de la IPS Cooemssanar- Pasto.
Con respecto a los factores demográficos, en el presente estudio la mayoría de pacientes con ERC fueron mujeres, en relación con la presentación de la enfermedad desde hace varios años en Colombia, 4,8,12, debido posiblemente a que las mujeres acuden con mayor frecuencia a los servicios de salud que los hombres, además se debe tener en cuenta que la pirámide poblacional a partir de los 40 años es mayor en mujeres 4,13; pero se encontró similitudes con otros estudios en cuanto a reconocer al sexo masculino como un factor explicativo a la progresión de la ERC, como en un estudio de cohorte prospectiva en Netherlans, realizado a 40.856 pacientes, donde encontraron el aumento de TFG a lo largo del tiempo en hombres 0,55 ± 1,47 ml/min/1,73 m2/año, más que las mujeres que fue de 0,33 ± 1,41ml/min/1,73 m2/año (P<0,001 para hombres frente a mujeres) 9,14,15.
Con respecto a la edad, los hallazgos del presente estudio guardan estrecha relación con lo encontrado en la literatura mundial, siendo el mayor porcentaje de pacientes con deterioro crónico de la función renal en mayores de 60 años (75,1%), esto debido principalmente al deterioro funcional renal por el envejecimiento secundario a la esclerosis glomerular y al conocido deterioro de la TFG de 1mL/min/1.73 m2 a partir de los 40 años, como en estudios de Colombia, Perú, Chile, España y China 8),(16)(19.
Se encontró que la mayoría de la población con ERC proviene de área urbana con un 47%, que puede deberse a la facilidad de acceso a los servicios de salud de tercer nivel, a diferencia con los pacientes provenientes de municipios más alejados que no cuentan con programas de nefroprotección por lo que los pacientes deben recorrer largas distancias para ser atendidos, siendo similar en otras ciudades de Colombia como Bogotá, que tiene un 87,26% de pacientes con respecto su departamento, seguida de Medellín y Cali, según la Cuenta de Alto Costo 2019, donde además reporta que el 67,3% de toda la población con ERC en Colombia se ubica en las ciudades metropolitanas 4.
En relación a los factores clínicos es ampliamente conocido el papel de la HTA en la génesis y el deterioro crónico de la función renal por lo que se ha documentado su mayor prevalencia en este grupo poblacional, como en Colombia 2019 con un 92,43% de pacientes que tienen algún estadio de ERC, y son hipertensos 4. En el departamento de Nariño la situación no es diferente con un 95%, al igual que lo encontrado en un estudio realizado en el Hospital General de Medellín en 2015 20.
En otros lugares se ha documentado la presencia de la HTA no controlada y su asociación independiente con la progresión de la ERC 16), (19), (21), (22 si bien en el presente estudio no hubo asociación explicativa estadísticamente significativa, probablemente debido a que el 78,5% de los pacientes hipertensos estaban controlados. Se ha demostrado que el control de la presión arterial es la práctica más estudiada para prevenir el deterioro y las complicaciones de la ERC 15.
En relación a la variable compensación de la TA, esta tuvo un comportamiento protector en el RRc: 0,81 IC95%0,75-0,87 con p<0,001, pero al incluirla en el modelo multivariado y ajustando por múltiples variables este valor, aunque no es estadísticamente significativo por atravesar la unidad, se ajusta con un RRa 1,00 IC95%0,89-1; por lo que se puede deducir que al ajustarlo por otras variables no incluidas en el presente estudio, este puede llegar a comportarse como un factor explicativo asociado a la progresión, justificando la realización de otras investigaciones que exploren estos comportamientos.
Otro factor clínico de gran importancia en la progresión de la ERC es la DM. Se ha explicado ampliamente que este es un factor de riesgo potente para ERC terminal 24. La nefropatía diabética se presenta entre un 25 a un 40% de los pacientes diabéticos siendo causante de ERC 1, a su vez la proteinuria secundaria a la nefropatía es el principal predictor de progresión de la función renal 25. En Colombia se ha descrito que el 33,17% de la población tiene DM y ERC en cualquier estadio, datos similares se encontraron en el presente estudio, donde el 25,1% tuvieron DM. Aunque no se encontró asociación de este factor en la población estudiada (RRc: 1,03 IC95% 0,97-1,09 p 0,29), no se debe desestimar la información obtenida ya que cuando se analizó la variable HbA1c descompensada, se encontró ajuste de la misma, con la progresión de la ERC, medido por la TFG de 5mL/min/1.73 m2 o más. Siendo consecuente con lo reportado en la literatura en donde los niveles elevados de HbA1C > 7% (no compensada) es un factor de riesgo para ERC 26, por lo que recomiendan el control de la diabetes como un objetivo prioritario en la disminución del deterioro renal 6,27,28.
En concordancia con diversos estudios a nivel mundial, en el presente trabajo se encontró una prevalencia elevada de HTA y/o DM en pacientes con ERC en cualquiera de sus estadios, con un 98,2%, y 71,5%, en Colombia, y en Nariño respectivamente 4, siendo enfermedades causales en todas las fases de la ERC y de la Enfermedad Renal Terminal 29-30.
Otro de los factores clínicos asociados al deterioro crónico de la función renal es el exceso de peso, medido en la escala del índice de masa corporal (IMC), dado por sobrepeso y obesidad, en cierta medida como resultado de su aumento en la población en general, pero específicamente en pacientes con ERC genera hiperfiltración glomerular con el consiguiente daño renal, siendo la obesidad un fuerte factor de riesgo para la progresión de la ERC 31, como lo encontrado en un estudio multicéntrico en China, donde la obesidad y la hipertrigliceridemia estaban asociados a la mayor prevalencia de la ERC 19. Estudios que son similares a lo encontrado en Nariño, en donde la obesidad grado I.II-III, si bien no se asociaron significativamente con la progresión de TFG, de 5mL/min/1.73 m2 o más, se ajustaron con respecto al análisis crudo, esperando en investigaciones futuras poder ahondar en este campo.
Otro hallazgo importante del presente estudio fue el porcentaje un poco más elevado de deterioro de la función renal (49,2%), con respecto a lo documentado en un estudio realizado en el Hospital Militar Central de Bogotá en 2014, donde encontraron un deterioro de TFG, en un 40%, siendo además de 5mL/min/1.73 m2 o más en el primero y 2mL/min/1.73 m2 o más en el segundo 21.
Los estadios de la ERC clasifican a los pacientes según el grado de deterioro de la función renal, con un menor porcentaje en estadios superiores, como lo reportado en las guías KDIGO 2012, menor de 2% 1, en Colombia la proporción de ERC en los estadios 3a-b y 4-5, es de 50,9% y 11,2% respectivamente 4, datos similares a los encontrados en el presente estudio en estadios 4-5 con un 9,8%, pero superados en casi 5 veces lo encontrado a nivel mundial.
Otra variable que nos permite explicar el modelo es el estadio de la ERC, en donde a partir del estadio 3 en adelante, se asoció significativamente con la progresión de la ERC, (E3a-b: RRa:1,41 IC95% 1,21-1,63; E4-5: RRa:1,62 IC95%1,36-1,94), siendo similar a la literatura donde a partir de los estadios 3a-b, al 5, aumenta la velocidad del deterioro de la función renal 32, debido al nivel creciente de daño glomerular y a la proteinuria subsecuente.
Se encontró que aproximadamente el 50% de los pacientes del estudio tuvieron un deterioro significativo de la función renal, a pesar de estar en un programa de nefroprotección, esto puede deberse a que se hizo el seguimiento de 2 años, y que no está bien definida la velocidad de deterioro de la función renal en el tiempo, por ser multifactorial, aunque se considera que el periodo mínimo debe ser de 1 año y preferiblemente los seguimientos en esta patología deberían ser de 5 años en adelante, por tratarse de una enfermedad crónica. Otro factor que puede influir en la persistencia de un deterioro importante de la TFG, puede ser debido a que la mayoría de pacientes 88,5%, tienen escolaridad de primaria incompleta o completa, que pueda relacionarse con una menor adherencia al tratamiento complejo y por lo general polimedicado, esto será objeto de estudios posteriores que permitan aclarar estos fenómenos.
Financiación: la investigación fue autofinanciada.














