Introducción
La vancomicina es un antibiótico tricíclico producido a partir del Estreptococos orientalis. Tiene una vida media de 6 a 12 horas, un volumen de distribución de 0,4 a 1 L/K, una unión a proteínas de 50 a 55% 1. La distribución a los tejidos es variable y es afectada por la inflamación y los estados de enfermedad 1. La vancomicina es un compuesto con un peso molecular de 1450 Dalton, no tiene una absorción apreciable por vía oral y es eliminada primariamente por vía renal con un 89 a 90% de recuperación, sin cambios en la orina alrededor de 2 horas después de la administración de una sola dosis 2.
Por varias décadas, la vancomicina se ha utilizado para el tratamiento de infecciones por Staphillococcus aureus meticilino resistente, sin embargo, el uso de este medicamento es complejo debido a su comportamiento y a las condiciones propias del paciente, tales como la edad, el peso, las enfermedades concomitantes y la función renal 3, factores que hacen que las características farmacocinéticas varíen ampliamente la respuesta entre un paciente y otro. La vancomicina pertenece al grupo de los glicopéptidos, los cuales inhiben la fase tardía de la síntesis del peptidoglicano, al inhibir las reacciones de transglicosilación; el blanco primario de la vancomicina es la terminación primarias D-ala - D ala de los precursores 4.
El principal parámetro PK/PD, predictor de la actividad de la vancomicina, es el AUC/MIC mayor a 400 5; este se alcanza con concentraciones plasmáticas del fármaco de 15 a 20 mg/l en el contexto de un paciente con función renal normal y con una MIC menor a 15. El monitoreo de las concentraciones plasmáticas se debe obtener antes de la próxima dosis del estado estable, es decir, antes de la cuarta dosis. No está recomendada la monitoria de la dosis pico de vancomicina 5. La medición de la concentración plasmática de Vancomicina se realiza a pacientes que van a recibir tratamientos prolongados más de 3 días, pacientes con alto riesgo de nefrotoxicidad, pacientes con condiciones patológicas inestables y pacientes que reciben dosis altas del medicamento 5.
Los pacientes con patologías críticas, experimentan cambios corporales representados en variaciones en los compartimientos de agua, alteraciones en el trasporte de medicamentos y cambios en la depuración y el metabolismo de los fármacos, lo cual lleva a concentraciones inadecuadas del antimicrobiano con su respectivo impacto en la respuesta clínica. De igual forma, el uso inapropiado de antibióticos contribuye ampliamente a la resistencia bacteriana, llevando a complicaciones, eventos adversos, re-consultas y costos altos de la atención. Todas las intervenciones para mejorar la calidad de prescripción impactan positivamente en el manejo de los pacientes y en el sostenimiento de los sistemas de salud 3.
Esta investigación bibliométrica, busca conocer cuál es el mejor régimen de administración de vancomicina en los pacientes críticamente enfermos, con el objetivo de determinar los parámetros básicos de la prescripción del mismo en esta población.
Materiales y Métodos
Se realizó búsqueda bibliográfica en español e inglés con el objetivo de responder la siguiente pregunta: ¿Cuál es el régimen de administración óptimo de Vancomicina, para los pacientes críticamente enfermos? Los términos utilizados en la búsqueda fueron: dosificación de Vancomicina, críticamente enfermo, Vancomycin, vancomycin dose, critically ill. Se limitó la búsqueda de la literatura desde el año 2011 al año 2021 y se utilizaron los siguientes buscadores: OVID, SCOPUS, PUBMED, SCIELO y Oxford Academic. Se excluyeron de la búsqueda los artículos de revisión de tema, reportes de caso, metaanálisis, guías de práctica clínica, artículos en población pediátrica y embarazada y revisiones sistemáticas. Para la evaluación de los artículos que fueron seleccionados se utilizó la declaración de Strobe debido a que todos los estudios fueron observacionales. La totalidad de los estudios se almacenaron en un cuadro que contenía el tipo de estudio, la metodología utilizada y los resultados.
Resultados
Una vez realizada la búsqueda en las diversas bases de datos, se identificaron 1561 artículos. Al aplicar los criterios de exclusiónm se seleccionaron 55 artículos, de los cuales se excluyeron 3 artículos por estar duplicados y 33 artículos por no contener información que responda la pregunta planteada en esta investigación. A los artículos preseleccionados, se les realizó la evaluación crítica con las recomendaciones de la declaración de Strobe, obteniéndose un total de 19 artículos seleccionados para la revisión.
Los estudios seleccionados fueron descriptivos, observacionales, retrospectivos y prospectivos. Se identificaron tres aspectos importantes a evaluar en la forma de dosificar la vancomicina en pacientes críticamente enfermos: la primera, consistente en la forma de administración, ya sea en infusión continua o en infusión extendida o intermitente; la segunda, relacionada con la dosis de carga y de mantenimiento suministrada a este tipo de pacientes y, la tercera, el valor de las concentraciones plasmáticas óptimas para los pacientes críticamente enfermos.
Para la forma de administración se identificaron 4 estudios que compararon la infusión intermitente contra la infusión continua. En todos los cuatro estudios, la infusión continua fue superior para alcanzar más temprana y sostenidamente las concentraciones plasmáticas de vancomicina en el estado estable, con menor tasa de reacciones adversas comparada con la infusión intermitente (Tabla 1). En tres de los cuatro estudios, el tamaño muestral para el brazo de infusión continua fue superior, sin embargo, en el estudio de Wysocki et al 6 realizado en Francia, la distribución de pacientes fue más uniforme; en este estudio se enrolaron 119 pacientes de los cuales 58 fueron tratados con infusión intermitente y 61 con infusión continua; la concentración sérica de vancomicina meta fue de 10 - 15 mg/l para la infusión extendida y de 20 - 25 mg/l para la continua. La duración de la infusión extendida estuvo en promedio de 1 hora; la dosis de carga fue de 15 mg/k y la dosis de mantenimiento fue de 30 mg/K día para la infusión continua y de 15 mg/k cada 12 horas para la intermitente. La conclusión de este estudio es que la infusión continua se relacionó con mejores resultados dados en alcanzar más tempranamente los niveles de concentración de vancomicina planeados.
Tabla 1 Artículos comparativos entre infusión continua e intermitente.
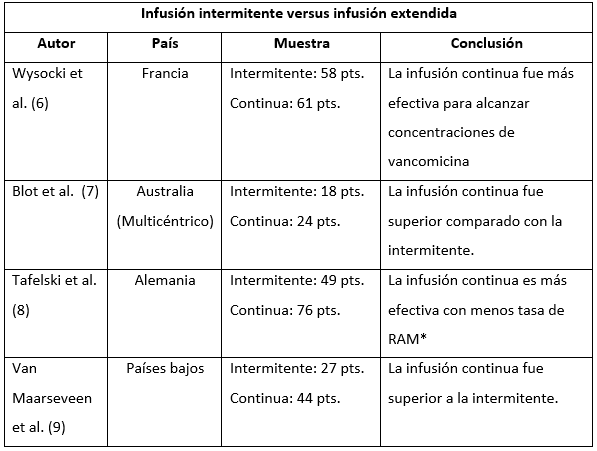
*RAM: Reacciones adversas a medicamentos; pts. Pacientes
Para la dosis de carga y de mantenimiento, se identificaron 7 artículos sobre infusión continua (Tabla 2). El tamaño muestral de los artículos es variable, oscilando entre 22 a 348 pacientes; la dosis de carga utilizada en estos estudios va desde 15 mg/k hasta 35 mg/k, siendo una dosis efectiva para alcanzar las concentraciones plasmáticas de vancomicina en la gran mayoría de los estudios, excepto en el de Commandeur et al 10, donde la dosis de carga administrada a 66 pacientes fue de 15 mg/k y no se logró el objetivo planeado.
En tres de los siete estudios, se usó una dosis de carga alta (mayor a 30mg/K), mostrando una alta efectividad para alcanzar tempranamente el estado estable. En el estudio de Spadaro 11 la carga fue mucho menor, comparada con las otras investigaciones, porque buscaron la dosis óptima en pacientes críticos con compromiso de la función renal, logrando demostrar que el normograma de dosis ajustado a depuración de creatinina, fue adecuado para alcanzar las concentraciones plasmáticas. La dosis de mantenimiento osciló entre 20 y 40 mg/k en los siete estudios, siendo estratificada con base en la función renal como lo muestra Spadaro 11; todas las investigaciones, excepto la de Commandeur et al 10, demostraron efectividad en las dosis usadas. El estudio de Jason y colaboradors 12 representó la muestra más grande con 206 pacientes sépticos, donde administraron dosis altas tanto de carga como de mantenimiento en infusión continua; encontrando que se alcanzó las concentraciones de estado estable de vancomicina de 20 mg/l de manera temprana.
Tabla 2 Artículos comparativos de la dosis de carga y de mantenimiento en pacientes que recibieron infusión continua de vancomicina.
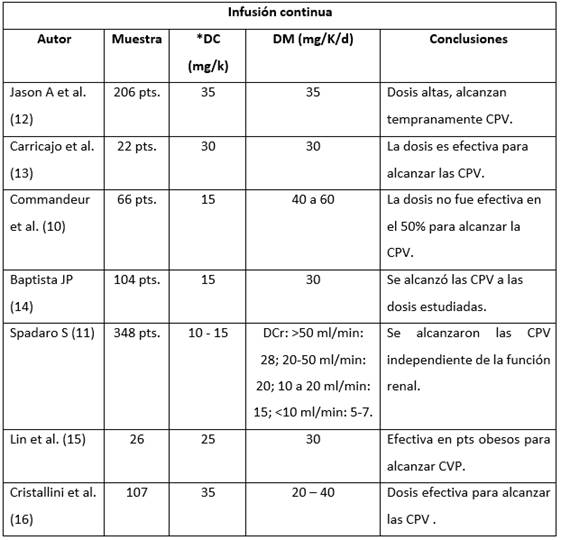
*DC: Dosis de carga; DM: Dosis de mantenimiento; Dcr: Depuración de creatinina; pts. Pacientes; CPV: Concentraciones plasmáticas de Vancomicina
En ocho estudios, se utilizó la infusión intermitente como forma de administración de vancomicina; el tamaño muestral de los estudios osciló entre 31 y 280 pacientes, con excepción del estudio de Setiawan et al.17 que analizó una base de datos pre-existente de 1000 muestras de pacientes críticos que recibieron vancomicina (Tabla 3). La dosis de carga usada estuvo en el intervalo de 15 a 30 mg/k, un poco menor a la que reportaron los estudios de infusión continua y la dosis de mantenimiento se dio en promedio entre 15 a 20 mg/K cada 12 horas. En siete de los ocho estudios se alcanzaron las concentraciones del estado estable con las dosis administradas, excepto en el estudio de Villanueva et al. 18 donde a una muestra de 197 pacientes con una dosis de carga de 25 mg/k y una dosis de mantenimiento de 15 a 20 mg/k cada 12 horas, no se lograron los objetivos planeados. El promedio de tiempo de la infusión del medicamento estuvo entre 60 a 120 minutos.
Tabla 3 Artículos comparativos de la dosis de carga y de mantenimiento en pacientes que recibieron infusión intermitente de vancomicina.
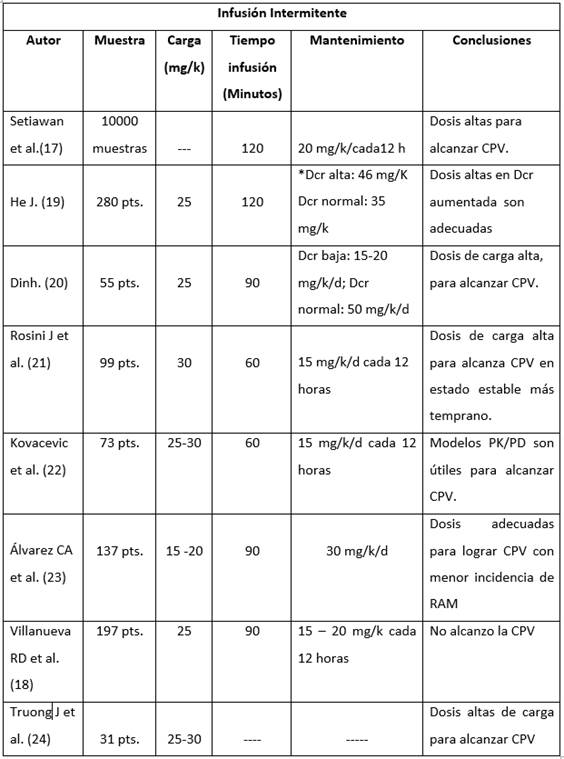
*Dcr: Depuración de creatinina; pts. Pacientes; CPV: Concentraciones plasmáticas de Vancomicina; RAM: Reacciones adversas a medicamentos.
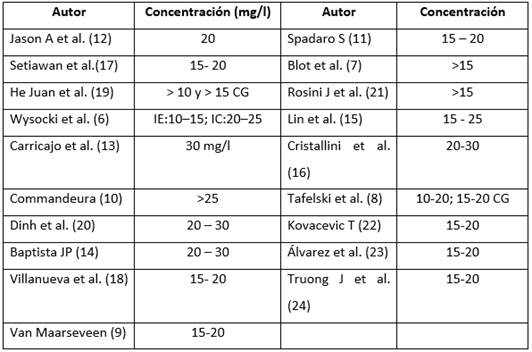
La concentración plasmática de vancomicina usada en la totalidad de los estudios oscila entre 15 y 20 mg/l (Tabla4), excepto en la investigación de Carricajo y colaboradores 13, donde se usó una meta alta de 30 mg/l; esta investigación estudió a 22 pacientes cuya depuración de creatinina se encontraba por encima de 50 ml/minuto, concluyendo que las dosis usadas alcanzan estas concentraciones en estado estable, en las 24 horas de administración del medicamento. De igual forma, para el estudio de Wysocki et al. 6 las concentraciones metas utilizadas fueron variables; para la infusión extendida fue de 10 a 15 mg/l, mientras que para la infusión continua fue más elevada (20 a 25 mg/l); estos pacientes fueron admitidos a cuidado intensivo con diagnósticos de neumonía en un 45 % y bacteriemia en un 35 %, el resto con otras condiciones infecciosas; sin embargo, ambas formas de administración fueron equiparables en lo que corresponde a eficacia clínica y seguridad.
En el estudio de Tafelski et al (8), se utilizaron metas más amplias de 10 a 20 mg/l para infecciones moderadas, bajo el riesgo de nefrotoxicidad; en los casos severos se amplió la meta de 15 a 20 mg/l. Ambos objetivos terapéuticos se alcanzaron con las dosis administradas y la vía de administración empleada.
Discusión
Los pacientes críticos tienen cambios farmacocinéticos que impactan en el efecto microbicida de la terapia antimicrobiana. El mejor parámetro para medir la vancomicina es el AUC/MIC mayor a 400, siendo las concentraciones plasmáticas de 15 a 20 mg/l, las que más se relacionan con ese valor y representan la concentración del fármaco en el estado estable, con menor riesgo de toxicidad. Concentraciones más bajas son aceptadas en pacientes con falla renal, sin embargo, no deben estar por debajo de 10 mg/l. No existe un consenso claro sobre la dosis a usar; en algunos casos se utilizan normogramas de ajuste dependiendo de las condiciones propias del paciente como de la función renal. La dosis recomendada de acuerdo a las guías de monitoreo de vancomicina 2)(25)(26 es de 15 a 20 mg/k cada 8 o 12 horas, ajustándose de acuerdo al resultado de los niveles plasmáticos; de igual forma, para los pacientes críticos se recomienda una dosis de carga de 25 a 30 mg/k.
Los pacientes con patologías de alta gravedad tienen cambios estructurales en los compartimentos de agua, en concentraciones de proteínas y en la capacidad de depuración tanto renal como hepática, generando cambios en las concentraciones del fármaco con impacto sobre el beneficio clínico y la presentación de reacciones adversas. Nuestra búsqueda encontró datos muy similares a lo recomendado previamente, las concentraciones plasmáticas de la mayoría de los estudios oscilan entre 15 a 20 mg/l; algunas investigaciones utilizan metas de concentraciones plasmáticas más elevadas 6)(13)(10)(20)(14)(15)(16, debido a los cambios farmacocinéticos del paciente crítico y a la susceptibilidad de los gérmenes en unidades de cuidado intensivo.
La dosis de carga es necesaria para alcanzar el estado estable más tempranamente; en promedio, antes de la quinta vida media. Dosis de carga mayores a 20 mg/k se encontraron en nuestra búsqueda; decisión médica sustentada en los cambios que presentan los pacientes críticos en la función renal. La depuración de creatinina, se encuentra elevada, llevando a niveles plasmáticos bajos de los medicamentos que se eliminan por esta vía; la vancomicina, en condiciones de hiperfiltración lleva a disminución de los niveles plasmáticos.
Estudios como el de Kuti et al. 27 y Pate et al.28, soportan el uso de la vancomicina en infusión intermitente, a dosis de 4 gramos al día para Staphillococcus aureus meticilino resistente (MRSA) con MIC elevadas; dato que contrasta con nuestros resultados, donde se recomienda el uso en infusión continua. La vancomicina tiene un comportamiento farmacocinético / farmacodinámico (PK/PD) mixto, es decir, es concentración dependiente del tiempo, lo que hace que tenga características similares a la de los betalactámicos, sin pertenecer a este grupo, teniendo mejor optimización de su acción bactericida al estar en concentraciones plasmáticas altas por encima de la MIC, lo cual explica los resultados de las diversas investigaciones encontrados en nuestra búsqueda.
La dosis de mantenimiento encontrada fue en promedio de 30 mg/ k día dividida en dos o tres administraciones; lo que se relaciona con lo recomendado en las guías de manejo 2)(25)(26; sin embargo, dosis altas como las usadas en el estudio de Dinh et al. 20) son soportadas por los cambios de hiperfiltración y aumento en el gasto cardiaco que presentan estos pacientes. El estudio de Fernández de Gatta y colaboradores 29 reclutaron pacientes con neoplasias hematológicas con infección por diferentes especies de Staphillococcus y diferentes estadios de la función renal; concluyeron que según la simulación de Montecarlo se requiere dosis altas de vancomicina de hasta 4 gramos/ día, con depuraciones de creatinina mayores a 120 ml/minuto. Las dosis altas del glicopéptido deben ser consideradas en los casos de infecciones por Staphillococcus aureus con MIC mayor de 1, lo que se correlaciona en el estudio de Canut y colaboradores 30, donde tomaron pacientes de España, Bélgica y Reino unido, con sepsis por MRSA, encontrando que el 25% de estas infecciones tenían una MIC de 2, y la dosis de vancomicina requerida para tratamiento fueron 4 gramos día, administrados 1 gramo cada 6 horas.
La depuración renal aumentada en pacientes críticos fue descrita en el estudio de He Juany colaboradores 19, donde utilizaron dosis de 46 mg/k día con el fin de alcanzar niveles terapéuticos bajos, de 10 mg/l y 15 mg/l para los casos severos. En este estudio, se usaron dosis altas de vancomicina con valores bajos de concentraciones plasmáticas; esto es explicado por el incremento en la eliminación del medicamento dado por el fenómeno de hiperfiltración. Este dato es similar con el estudio de Udyy colaboradores 31 donde muestran que el 65% de los pacientes que ingresan a unidad de cuidado intensivo tienen depuración de creatinina elevada, con subsecuente bajas concentraciones de vancomicina (p <0,01) cuando se usan dosis diarias menores a 30 mg/k. Para el estudio de Ocampo Martínez y colaboradores 32 se reportó una proporción alta de concentraciones de vancomicina insuficiente, debido a la rápida eliminación y una disminución en la vida media del medicamento, secundaria a la hiperfiltración. Sumado a esto, las bajas concentraciones de vancomicina, llevan a una disminución del área bajo la curva como parámetro farmacocinético de absorción y a una pobre respuesta farmacodinámica del medicamento; el estudio recomienda dosis altas de vancomicina para contrarrestar este fenómeno. Para los casos de falla renal con depuración de creatinina disminuida, el estudio de Spadaro y colaboradores 11, muestra un ajuste de dosis acorde con los valores de la depuración de creatinina, sin incremento en las reacciones adversas. La concentración plasmáticas meta usada en esta investigación, fue de 15 a 20 mg/l, sin embargo, en pacientes con caída del filtrado glomerular, la meta se puede ampliar hasta 10 mg/l 2.
El riesgo de nefrotoxicidad está asociado a niveles altos de vancomicina, sin embargo, en nuestra revisión no se encontró incremento de los de las reacciones adversas a medicamentos, incluso usando dosis altas, como lo muestra el estudio de Jason y colaboradores 12. Los regímenes intermitentes de administración de vancomicina muestran incremento lineal en el riesgo de toxicidad renal comparado con la dosis continua, como lo muestra el estudio de Patel 28, donde se administraron dosis de vancomicina de 1, 2, 3 y 4 gramos día en intervalos de 12 horas, encontrándose compromiso de la función renal en el 10, 16, 25 y 34%, respectivamente.
Las estrategias de ajuste de dosis acorde a los principios PK/PD y la simulación de Montecarlo, son mecanismos efectivos para alcanzar las concentraciones planeadas de vancomicina en pacientes críticamente enfermos. Kovacevic y colaboradores 22, estudiaron pacientes que recibieron vancomicina en infusión extendida de 1 hora, aplicando modelos PK/PD, para alcanzar concentraciones plasmáticas de 15 a 20 mg/l; concluyeron que esta estrategia fue efectiva y la dosis promedio calculada fue de 1 gramo cada 12 horas. Las estrategias PK/PD, en el momento, son ampliamente utilizadas para el abordaje de pacientes que reciben cualquier tipo de antimicrobiano dentro del contexto del uso seguro de medicamentos.
Conclusiones
La forma de administración en infusión continua, muestra mejor resultado, comparada con la administración intermitente; las dosis altas tanto en carga como en mantenimiento fueron recomendadas, sin incrementar el riesgo de nefrotoxicidad. Las estrategias PK/PD, son útiles para el ajuste de la dosis de los pacientes críticamente enfermos, con óptimos resultados