Introducción
La brucelosis, también conocida como 'fiebre ondulante', 'fiebre mediterránea' o 'fiebre de Malta' es una infección zoonótica producida por bacterias del género Brucella, el cual se encuentra dentro de la familia de las Alphaproteobacterias 1
Los miembros del género Brucella son pequeños cocobacilos gram negativos aerobios, intracelulares facultativos, no encapsulados, no esporulados ni móviles. Clásicamente se reconocían 6 especies dentro del género Brucella: B. melitensis, B. abortus, B. suis, B. canis, B. ovis y B. neotomae, cuyo nombre proviene según el tipo de hospedador (ganado, ovejas, cabras, camellos, cerdos u otros animales) 2; solo las tres primeras son perjudiciales para el hombre y presentan una patogenicidad propia que es transmitida a los humanos a través del consumo o ingestión de productos alimenticios de animales infectados (como productos lácteos no pasteurizados) o por contacto con tejidos o fluidos 1) (2) .
Actualmente, la brucelosis se considera una enfermedad reemergente y representa un problema de salud pública en muchos países en vías de desarrollo 3), ( 13, puesto que la prevalencia de brucelosis ha aumentado debido al creciente turismo internacional y la migración 1.
Se han encontrado distintas áreas endémicas para esta enfermedad, entre las que se incluyen los países de la cuenca mediterránea, Medio Oriente, Asia Central, China, el subcontinente Indio, África Subsahariana y partes de México y América Central y del Sur 4.En todo el mundo, se reportan aproximadamente 500.000 casos anualmente y se estima que hay 2.4 billones de personas en riesgo 2), (5) ,(12.
El objetivo del siguiente manuscrito es presentar el caso clínico de un paciente con fiebre de Malta (Brucelosis) atendido en el Hospital San Rafael De Tunja.
Caso clínico
Hombre de 34 años residente del área rural de Sotaquirá (Boyacá). Ingresó al servicio de urgencias del centro asistencial de segundo nivel por presentar cuadro clínico de 15 días de evolución consistente en picos febriles no cuantificados asociados a escalofríos, astenia, adinamia y mialgias, refiere que había consumido amoxicilina 500 mg cada 8 horas, clorfeniramina 4mg cada 8 horas y ácido ascórbico 500 mg día por 7 días sin presentar mejoría.
El paciente refería antecedentes laborales importantes de contacto con ganado vacuno y sus fluidos sin los adecuados elementos de bioseguridad. Los signos vitales de ingreso fueron temperatura 37,9 ºC, frecuencia cardíaca 117 latidos por minuto, presión arterial de 110/70 mmHg, frecuencia respiratoria de 20 respiraciones por minuto, destacándose taquicardia y fiebre, en el examen físico general no reveló alteraciones aparte de las descritas.
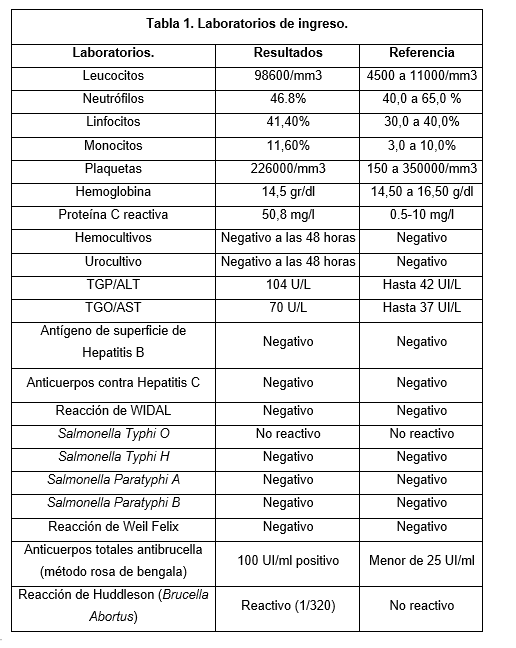
Por los antecedentes laborales y el cuadro clínico del paciente se decidió realizar paraclínicos (Tabla 1). Las pruebas de seroaglutinación confirmaron el diagnóstico de brucelosis, ante esto, se recetó doxiciclina 100 mg vía oral cada 12 horas y rifampicina 300 mg vía oral cada 8 horas por 6 semanas, con lo cual se obtuvo mejoría de cuadro, y se indicó al paciente seguimiento ambulatorio.
Una vez completado el tratamiento, el paciente es valorado nuevamente por consulta externa, el servicio de infectología consideró que el tratamiento dual (doxiciclina y rifampicina) era adecuado, sin embargo, el paciente persistía con serología positiva para infección por Brucella (Reacción de Huddleson -Brucella abortus- técnica de aglutinación en placa positiva), por lo cual se modificó el manejo indicado así: ciprofloxacina 500mg tableta cada 12 horas por 20 días, doxiciclina 100 mg cada 12 horas por 20 días y laboratorios de control.
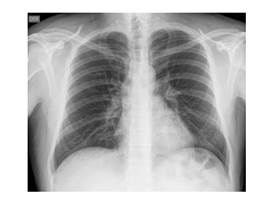
Después de 10 meses, el paciente ingresó nuevamente al servicio de urgencias por cuadro sintomatológico similar al anteriormente presentado, esta vez asociado a mialgias y artralgias, los laboratorios mostraban aumento leve de transaminasas, la ecografía abdominal evidenciaba hepatoesplenomegalia y la radiografía de tórax no indicaba alteraciones, la tráquea en posición central, a nivel de los campos pulmonares no se observaron condensaciones ni datos sugestivos de atelectasias anormales, hilos sin alteración silueta cardíaca dentro de los límites normales, ángulos cardio y costo frénicos libres, mineralización ósea dentro de los parámetros normales (Figura 1).
Ante los resultados obtenidos en la ecografía y la radiografía de tórax, se decidió hospitalizar al paciente, indicando manejo por sospecha de recaída por Brucella con Doxiciclina 100mg cada 12 horas más gentamicina 240 mg endovenosa por día. El paciente completó 6 días de manejo antimicrobiano intrahospitalario presentando mejoría de los síntomas indicando egreso con seguimiento ambulatorio.
Discusión
En América Latina, México presenta la mayor incidencia anual de casos de brucelosis. En América del Sur, Perú y Argentina tienen las mayores incidencias de 34,9 y 8,4 casos anuales por millón de habitantes. En Colombia, la incidencia es de 1,85 casos anuales por millón de habitantes. La enfermedad en áreas no endémicas es de origen ocupacional y la población más afectada son los varones adultos 6.
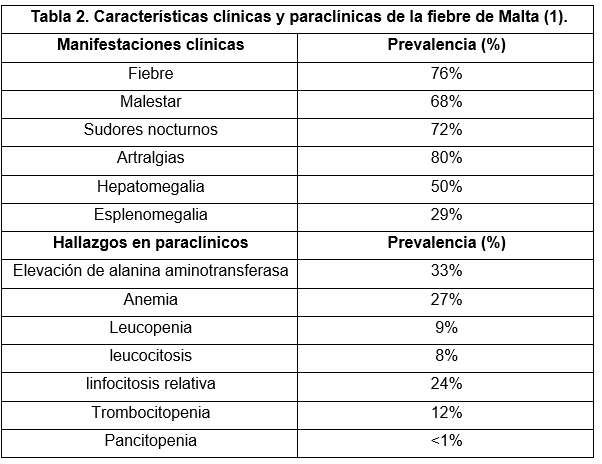
En la tabla 2 se enumeran las principales manifestaciones clínicas y hallazgos de laboratorio más frecuentes y su prevalencia 14.
Es importante tener en cuenta que en los pacientes con fiebre de origen desconocido se debe realizar el panel de antígenos antifebriles para descartar otras patologías infecciosas, dentro de los cuales se puede realizar hemocultivos que tiene una sensibilidad baja para brucelosis (15 a 60%) (1), es por este motivo que para este caso se prefirió realizar las pruebas serológicas que permiten la detección de anticuerpos contra el lipopolisacárido u otros antígenos de la bacterias como la ELISA IgM e IgG (sensibilidad 94%, especificidad 97%), prueba de aglutinación de Rose Bengal (sensibilidad 87%, especificidad 100%) y el ensayo de flujo lateral inmunocromatográfico (sensibilidad 92%, especificidad 97%) 1)( 6)(7, los cuales fueron positivos en el caso presentado.
El objetivo del tratamiento es controlar la enfermedad, prevenir complicaciones, recaídas y secuelas 8) ( 15, por lo cual se incluyen antibióticos combinados con actividad en entornos intracelulares ácidos, a altas dosis con duración prolongada ya que disminuye el riesgo de recaída 7. Dentro de los regímenes de manejo para la población en general, se pueden combinar la doxiciclina con un aminoglucósido (estreptomicina o gentamicina) o la combinación de doxiciclina con rifampicina durante 6 semanas; siendo la primera combinación más eficaz y con menor riesgo de recaída 8. En casos de recaída o falla terapéutica se deben adicionar las fluoroquinolonas 9.
En el caso de las mujeres en estado de gestación el tratamiento es incierto, puesto que las tetraciclinas están contraindicadas 10, sin embargo, en embarazos de menos de 36 semanas, se puede dar manejo con trimetropim-sulfametozaxol con rifampicina durante seis semanas, y en caso de más de 36 semanas se prefiere dar monoterapia con rifampicina hasta el parto, esto último por el riesgo de kernicterus neonatal con el uso de trimetropim-sulfametozaxol. Después del parto, se da manejo con la terapia combinada como en adultos no embarazadas 11.
Entre el 5 al 15% de los pacientes pueden presentar recaída después del tratamiento, inlcuso hasta 12 meses después (1), dentro de los factores que pueden predecir la recaída están la temperatura ≥38.3 ° C, duración de los síntomas <10 días antes del tratamiento y hemocultivos positivos al inicio del estudio. Las causas de recaída incluyen un régimen antibiótico inadecuado, duración inadecuada de la terapia con antibióticos, falta de adherencia o focos localizados de infección 1) (7) .