1. Introducción
El carcinoma de mama es el cáncer más frecuente en el sexo femenino, independiente de la raza o grupo étnico 1 y lidera las muertes por cáncer en Latinoamérica 2. Anualmente, se reportan cerca de 1,2 millones de nuevos casos y aproximadamente 500.000 muertes debido a esta entidad a nivel global. El último análisis de la Subdirección de Enfermedades No Transmisibles (ENT) del Ministerio de Salud y Protección Social de Colombia reporta un aumento del número de casos de cáncer de mama en el país y más de 2.500 fallecimientos por esta causa 3. Por lo anterior, esta patología se considera actualmente un problema de salud pública.
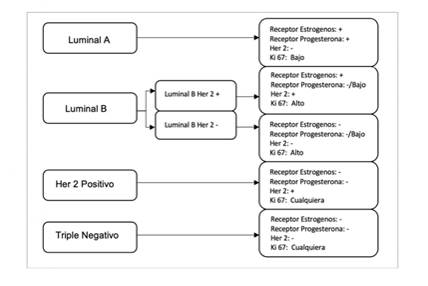
A nivel molecular, el carcinoma de mama es heterogéneo, con patrones inmunofenotípicos variables que a su vez llevan a diferencias en el comportamiento del tumor y su pronóstico. Respecto al carcinoma infiltrante de mama (CIM), la subclasificación molecular más frecuentemente utilizada, debido a su fácil implementación y accesibilidad a nivel mundial, se basa en el patrón de expresión de las células tumorales de marcadores de receptor de estrógenos (RE), receptor de progesterona (RP), el factor de crecimiento epidérmico humano 2 (HER2 por sus siglas en inglés) y el marcador de proliferación celular Ki67; todos ellos se analizan mediante estudios inmunohistoquímica y/o hibridación in situ en el caso del HER2, este último en caso de tener un patrón equívoco en la inmunohistoquímica. La figura 1 muestra dicha clasificación.
Respecto al pronóstico de estos grupos moleculares, los luminales presentan mejores tasas de sobrevida libre de enfermedad, sobrevida total y sobrevida libre de metástasis a distancia. Sin embargo, el subtipo luminal B se comporta peor que el luminal A con sobrevidas menores, estadísticamente significativas 4)(5. El subtipo triple negativo se ha caracterizado por tener el peor comportamiento de todos, con alto riesgo de recurrencia y muerte temprana debido a la enfermedad, al igual que mala respuesta al tratamiento. El subtipo HER-2 positivo no luminal, a pesar de tener un mal comportamiento biológico, tiene tratamiento farmacológico dirigido, lo que hace que los pacientes tengan opciones de manejo relativamente optimas que se traducen en mejores sobrevidas al igual que mayor porcentaje de respuesta patológica completa, en comparación con los triples negativos (Glück et al. 2013).
La mayoría de reportes de la literatura, que provienen de Norteamérica y Europa, consistentemente indican una mayor prevalencia del subtipo Luminal A con rangos aproximados entre 40 y 60 % 6)(7. La distribución del resto de los subtipos es heterogénea entre estas poblaciones. Estudios latinoamericanos en México, Perú, Argentina, Venezuela y Cuba muestran una tendencia similar 8)(9)(10)(11)(12 y estudios en población colombiana, muestran una distribución variable entre los diferentes grupos; a pesar de que los subtipos luminales siguen predominando, algunos estudios son consistentes con los reportes mundiales (prevalencia de Luminal A), mientras que otros, indican predominio de subtipo luminal B.
El Instituto Nacional de Cancerología, centro de referencia nacional, en unión con el Hospital Universitario del Caribe, condujo un estudio liderado por Serrano y Colaboradores 13, en el cual se incluyeron 301 pacientes con diagnóstico de CIM, de los que 37.2 % correspondían al subtipo Luminal B, mientras que 26.2 % al Luminal A. Por otro lado, en Antioquia, Bonilla-Sepúlveda y colaboradores 14 analizaron una cohorte de 114 pacientes, encontrando un predominio de subtipo Luminal A con 38.5 % seguido de pacientes Luminal B con 32.4% de la población estudiada; paralelamente, Gómez y colaboradores 15 analizaron un grupo de 328 pacientes, también de Antioquia, de los cuales más de la mitad correspondían al grupo Luminal B. Más recientemente, Jaramillo 16 analizó una población del magdalena de 162 pacientes encontrando una distribución igual entre los grupos Luminal A y B (34.5 % cada uno).
Dada la importancia de la subtipificación molecular debido al impacto tanto pronóstico como terapéutico que esta tiene en los individuos afectados por CIM, aunado a la heterogeneidad en los diferentes reportes a nivel nacional, se decidió realizar un estudio retrospectivo en una población colombiana del eje cafetero, con el fin de establecer un perfil de prevalencia de los diferentes subtipos moleculares del CIM, determinados a través de técnica de inmunohistoquímica e hibridización in situ (para HER2, cuando fuese requerido).
2. Materiales y Métodos
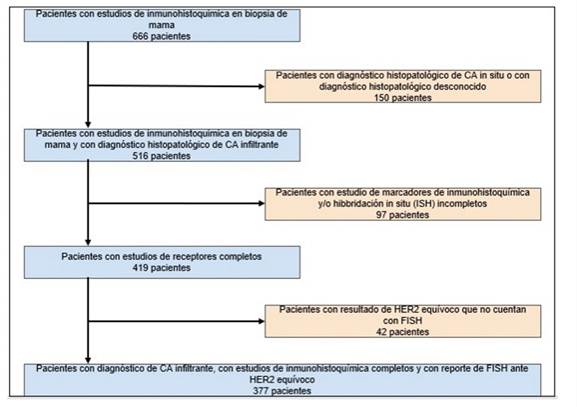
El presente trabajo corresponde a un estudio retrospectivo descriptivo transversal, en el cual se incluyeron pacientes con diagnóstico histológico de CIM entre los años 2015 a 2018. El diagnóstico fue realizado en un laboratorio de patología que procesa especímenes provenientes del eje cafetero colombiano; el Instituto Caldense de Patología, ubicado en la ciudad de Manizales, Colombia. Los criterios de inclusión de los pacientes fueron:
Disponibilidad de datos personales (año del diagnóstico y edad) Carcinoma infiltrante de mama
Diagnóstico entre 2015 y 2018
Estudio de marcadores de inmunohistoquímica y/o hibridación in situ (ISH) completos
El diagrama de flujo de selección de los pacientes se muestra en la figura 2.
El diagnóstico histopatológico rutinario de las muestras evaluadas se realizó en biopsias o especímenes quirúrgicos del archivo del laboratorio, y se tuvieron en cuenta las guías del ASCO/CAP (Sociedad americana de oncólogos clínicos/Colegio Americano de Patólogos) y los criterios diagnósticos de la Organización Mundial de la Salud. Las láminas histopatológicas con tinción de Hematoxilina y Eosina fueron nuevamente revisadas por dos patólogos expertos para fines de este trabajo. Los estudios de RE, RP, HER2 y proliferación celular con KI67 se realizaron usando técnica de inmunohistoquímica. La positividad de los receptores hormonales (ER/PR) se determinó teniendo en cuenta los criterios establecidos por las guías del ASCO/CAP según la cual una reactividad de 1% o más se considera positivo. Para establecer la presencia o no de sobreexpresión del HER2, se tuvo en cuenta la guía de práctica clínica del CAP y de la asociación americana de oncología clínica 17 en donde una positividad fuerte y completa membranosa en 10% o más de células tumorales se considera positiva; en caso de obtener una sobreexpresión equívoca, se realizó estudio de Hibridación fluorescente in situ (FISH). El índice de proliferación celular, estudiado con el marcador KI67, se determinó teniendo en cuenta las guías del Grupo de trabajo internacional de Ki67 en cáncer de mama 18 en donde se establece que una proliferación menor o igual al 14% corresponde a índice bajo, y mayor a 14% a un índice alto de proliferación. Todos los estudios de inmunohistoquímica fueron realizados por técnica automatizada, usando el equipo BenchMark GX del laboratorio Roche Diagnostics con los marcadores Receptores de estrógenos (clone SP1), Receptores de progesterona (clone 1E2), Ki67 (clone MIB-1) y HER 2 (clone PATHWAY HER2 4B5). Finalmente, a cada paciente se le asignó un grupo molecular por técnica de inmunohistoquímica.
Las variables estudiadas para cada individuo fueron:
1) edad al diagnóstico,
2) género,
3) diagnóstico histológico,
4) año del diagnóstico y
5) clasificación molecular por inmunohistoquímica.
Después de la recolección, la información fue filtrada e introducida en una base de datos protegida para su posterior almacenamiento y análisis. Para cada parámetro se identificó el promedio de cada subgrupo.
En el presente trabajo no se publican nombres, registros hospitalarios o cualquier información que viole la privacidad de los pacientes. La investigación se presentó al comité de bioética de la Universidad de Manizales, el cual dio el aval para el trabajo Los estudios histopatológicos realizados al igual que la técnica de inmunohistoquímica y FISH, corresponden a procedimientos de rutina.
3. Resultados
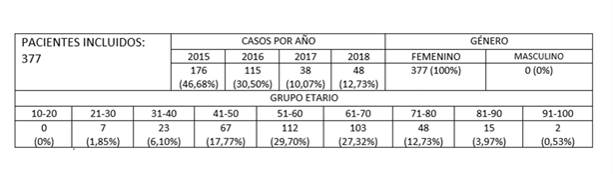
Los datos relacionados con edad, casos diagnosticados por año, género y grupo etario se describen en la figura 3.
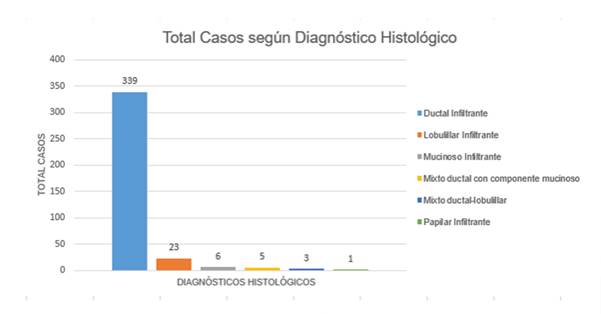
Los diagnósticos encontrados fueron los siguientes: Carcinoma Ductal infiltrante, NOS (339 casos; 89.9 %), Carcinoma lobulillar infiltrante (23 casos; 6.1 %), Carcinoma mucinoso infiltrante (6 casos; 1.5 %), Carcinoma papilar infiltrante (1 casos; 0.2 %) y patrones mixtos: ductal lobulillar (3 casos; 0.7 %) y carcinoma ductal con componente mucinoso (5 casos; 1.3 %) como muestra la figura 4.
El porcentaje de receptores obtenidos en las muestras fueron los siguientes: Receptor de estrógenos positivo 296 casos (78.5 %), Receptor de estrógenos negativos 81 casos (21.5 %), receptor de Progesterona positivo 244 casos (64.7 %), receptor de progesterona negativo 133 casos (35.3 %). El porcentaje de receptor HER2 obtenidos en las muestras fueron los siguientes: 0 (138 casos; 36.6 %), 1+ (157 casos; 41.6 %), 2+ (18 casos; 4.7 %), 3+ (63 casos; 16.9 %).
De los casos que presentaron inicialmente HER-2 equivoco, que posteriormente fueron analizados mediante la técnica de FISH resultaron: negativos 16 casos (86.8 %), positivos 2 casos (13.2 %). Esto eleva el número total de casos que son HER2 positivos a un total de 65 casos (17.5 %), e incluye tanto a los que son receptores de estrógenos positivos (40 casos) como a los receptores de estrógenos negativos (25 casos). Los HER2 negativos en total son 311 casos (82.5 %), incluidos todos los 0, 1+ y 2+ que hayan sido negativos para el FISH. El índice de proliferación Ki67 mostró los siguientes resultados: Ki67 igual o menor a 14 % son 107 casos (28.3 %). Ki67 mayor a 14 % son 270 casos (71.7 %). En esta estadística están incluidos además todos los casos HER2 positivos y triple negativos.
Los subtipos moleculares definidos por técnica de inmunohistoquímica se distribuyeron de la siguiente manera (ver figura 5):
Luminal B (212 casos; 56.2 %).
Luminal A (84 casos; 22.3 %)
HER2+ (25 casos; 6.6 %).
Triple negativo (56 casos; 14.9 %)
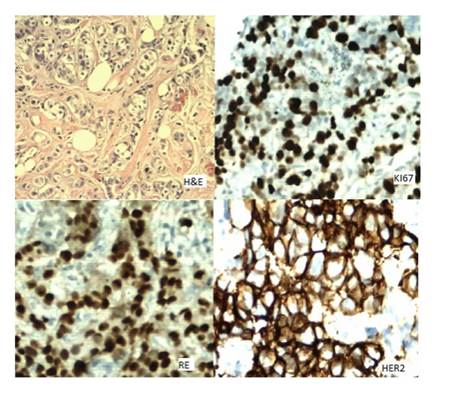
Fiqura 5: Ejemplo de un caso de subtipo molecular Luminal B por la técnica de inmunohistoquímica. HE= Hematoxilina y Eosina, a 200x. KI67= índice de proliferación celular. RE= Receptores de estrógeno. HER2= Factor de crecimiento epitelial epidérmico 2 por sus cifras en inglés.
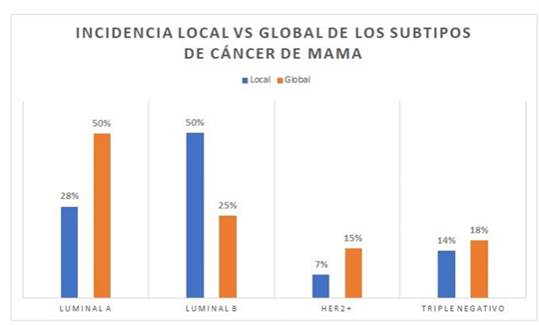
La Figura 6. muestra la distribución de los subgrupos moleculares por técnica de inmunohistoquímica en la población estudiada comparado con la distribución a nivel mundial.
4. Discusión
El cáncer de mama es el cáncer más frecuente en el sexo femenino, independiente de la raza o grupo étnico. Constituye una de las principales causas de muerte por cáncer a nivel mundial, predominantemente entre mujeres latinas y afrodescendientes. Con el fin de determinar qué pacientes están en alto riesgo de morir debido a la enfermedad, así como de presentar recurrencia, recaída y/o metástasis a distancia, se han puesto a disposición algunas herramientas de histopatología y análisis moleculares que permiten una subtipificación del tumor a nivel molecular.
La clasificación molecular más ampliamente estudiada y aplicada a nivel mundial, gracias a su fácil implementación y disponibilidad sobre todo en países en vía de desarrollo, es la subclasificación molecular por inmunohistoquímica. Esta clasificación utiliza la expresión o no de receptores hormonales de estrógenos y progesterona por parte de las células tumorales, así como la sobreexpresión o no del factor de crecimiento epidérmico (HER2, por sus siglas en inglés) y el índice de proliferación celular con el marcador ki67. Todos estos parámetros son analizados rutinariamente en los laboratorios de anatomía patológica a través de la técnica de inmunohistoquímica y, en caso de obtener un resultado equívoco para HER2, se requieren posteriores análisis usando técnicas de hibridación in situ (FISH/CISH). Finalmente, los pacientes serán asignados a un grupo molecular dependiendo del perfil de expresión encontrado (ver Figura 1). Sin embargo, esta clasificación por inmunohistoquímica tiene algunas limitaciones como es la variabilidad interobservador de algunos marcadores como la expresión de ki67.
Esta subtipificación molecular aunada a otros parámetros como el tamaño tumoral y compromiso de ganglios linfáticos (T y N patológicos), permite al grupo de médicos tratantes conocer el pronóstico, incluyendo las probabilidades de recurrencia, tiempo de sobrevida total y sobrevida libre de enfermedad. Con lo cual, una terapia personalizada y dirigida puede ser planeada para cada uno de los pacientes.
En la población general, tal como muestra la figura 6, el subtipo molecular predominante es el Luminal A, caracterizado por tener un mejor pronóstico y respuesta al tratamiento en general. En Colombia, los reportes son heterogéneos y, aunque favorecen predominio de subgrupos luminales, algunos estudios indican mayoría de subtipo luminal A y otros de Luminal B. El subtipo luminal B tiene el peor pronóstico entre los luminales, acarreando no solo un peor comportamiento biológico, sino una pobre respuesta al tratamiento si los comparamos con el subtipo luminal A.
Nuestro estudio es el primero reportado en la población del eje cafetero colombiano. Después de aplicar los criterios de inclusión mencionados previamente, se analizó una cohorte de 377 pacientes diagnosticados con CIM entre los años 2015 a 2018 en un centro de referencia de anatomía patológica localizado en el eje cafetero colombiano. Se identificaron parámetros demográficos tales como edad y género, al igual que características histopatológicas como subtipo histológico tumoral y subclasificación molecular. El 100% de los pacientes que cumplieron los criterios de inclusión fueron mujeres, más de un cuarto de los pacientes se encontraron entre 51 y 60 años, aproximadamente un 90 % obtuvieron un diagnóstico histológico de CIM ductal infiltrante de tipo no especial (NOS) y la mitad fueron clasificados como Luminal B. Esto implica que, en comparación a la mayoría de los pacientes reportados en literatura mundial y nacional que reportan mayor prevalencia de pacientes del subtipo Luminal A 6)(7, nuestras pacientes tendrán probablemente peor pronóstico a expensas de sobrevidas estadísticamente menores (general y libre de enfermedad) 4)(5 y, por tanto, deben ser sometidas a un régimen de seguimiento y tratamiento estricto y personalizado.
Futuros estudios deben incluir la identificación de patrones de expresión molecular según raza y ancestralidad, realizar estudios únicamente en pacientes que tengan los estudios moleculares en la biopsia inicial, así como estudiar por separado pacientes sometidos a neoadyuvancia vs aquellos que no fueron sometidos a neoadyuvancia, con el fin de identificar o descartar selección clonal por el tratamiento, analizar pacientes diagnosticadas en otros centros de diagnóstico de patología y complementar los estudios moleculares basados en inmunohistoquímica con estudios complementarios basados en datos genómicos y transcriptómica.
En conclusión, nuestro estudio es el primero reportado en la literatura en pacientes del eje cafetero colombiano, en el cual identificamos una prevalencia del subtipo luminal B por técnica de inmunohistoquímica entre las pacientes afectadas por CMI. Estos hallazgos contrastan con los reportados a nivel mundial, los cuales consistentemente han reportado prevalencia del subtipo luminal A.
Esto debe ser tenido en cuenta por el cuerpo médico tratante, no solo para llevar a cabo planes de tratamiento acordes y personalizados, sino también para implementar medidas de prevención más estrictas, acordes a la población.