Introducción
La Enfermedad de Chagas es generada por el parásito protozoario Trypanosoma cruzi (T. cruzi), descubierto por el médico brasileño Carlos Justiniano Ribeiro Chagas en el año 1909 1. Este parásito se transmite principalmente de forma vectorial a los huéspedes mamíferos mediante un grupo de insectos hemípteros y hematófagos pertenecientes a la familia Reduviidae, subfamilia Triatominiae2 comúnmente llamados “Chinches”, “Pitos” o “Barbeiros”, según la zona geográfica 3. Existen formas alternas de infección como, la transfusión sanguínea, donación de órganos, la transmisión oral causada por la ingestión de alimentos contaminados con el parásito, la transmisión accidental en trabajadores de salud e investigadores y la forma vertical 4.
De acuerdo a la Organización Mundial de la Salud (OMS), se estima que 70 millones de personas se encuentran en riesgo de infección por el parásito T. cruzi en todo el mundo, ubicando a América Latina como el principal afectado 5, la trasmisión madre a hijo se estima entre 1 a 12% en áreas endémicas 4, en Colombia la transmisión ha oscilado entre 1 a 4% 4, en Bolivia en un 4%, un porcentaje similar en población de Argentina y 4,3% provenientes de Portugal 6. Además, se han reportado casos de esta infección en zonas no endémicas como Estados Unidos, España, Suiza y Suecia por la migración de mujeres infectadas de áreas de Sudamérica a dichos países 7.
Esta infección en mujeres en edad fértil predispone a una presentación congénita 2; donde el 60 a 90% de los neonatos son asintomáticos con una progresión a una enfermedad crónica grave, que supone un subregistro y una limitante para el diagnóstico. Cuando se desarrolla una presentación sintomática, esta suele aparecer en los primeros 30 días de vida sin un cuadro patognomónico 3, teniendo manifestaciones clínicas variadas que incluyen bajo peso al nacer, prematuridad, distrés respiratorio, hepatoesplenomegalia, ictericia 2)(8, edema generalizado e incluso hidrops fetalis y muerte 3)(8, razón por la cual, la Enfermedad de Chagas congénito es considerado como un problema de salud pública 6.
En cuanto al diagnóstico de la enfermedad es necesario contar con los datos clínicos del paciente, datos epidemiológicos como la incidencia y prevalencia de Chagas en la zona geográfica donde habita y la confirmación mediante pruebas de laboratorio, cuya técnica dependerá de la fase clínica 9. Las pruebas comúnmente usadas en la fase aguda incluyen la demostración del parásito presente en la sangre por microscopia y la Reacción en Cadena de la Polimerasa (PCR) 10, mientras que, en la fase crónica se suele utilizar técnicas de diagnóstico serológico para determinación de anticuerpos de tipo IgG 5)(10.
Se sabe que las técnicas moleculares pueden ofrecer un diagnóstico temprano de la infección congénita que los métodos actuales 6, especialmente la PCR en tiempo real (qPCR) por sus características de sensibilidad 3, resultado cuantitativo (carga parasitaria) e información de interés epidemiológico en la determinación de linajes del parásito 11 en áreas endémicas como no endémicas 12, además que la inclusión de esta técnica en el algoritmo diagnóstico en zonas endémicas podría reducir el periodo de seguimiento del recién nacido y supondría un tratamiento oportuno 7.
Ante lo expuesto anteriormente el objetivo de la revisión consiste en presentar la epidemiología, y técnicas diagnósticas para detección de la Enfermedad de Chagas congénito.
Metodología
Se realizó la búsqueda de producción científica relacionada con la etiología, epidemiología, sintomatología, diagnóstico convencional y molecular, además del desarrollo de nuevas técnicas para la Enfermedad de Chagas congénito. En la revisión se emplearon las bases de datos bibliográficas Science direct, PubMed, Plos One, SciELO, entre otras, tomando un periodo de tiempo comprendido entre el año 2013 a enero de 2022 y se seleccionaron publicaciones en idioma español e inglés.
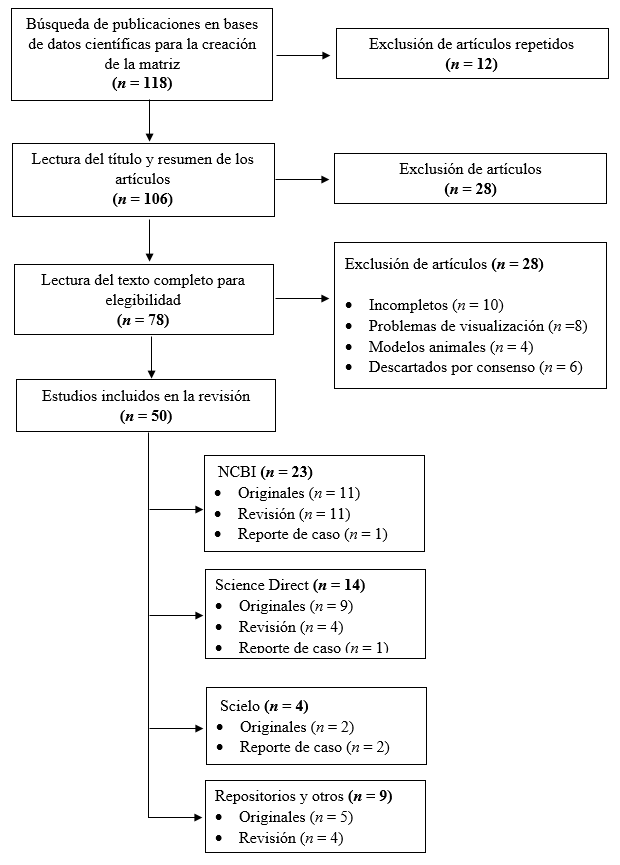
Se emplearon los descriptores DeCs (Descriptores de ciencias de la salud) Y Mesh (Medical Subject Headings), aplicando las palabras “Chagas Disease”, “Epidemiology”, “Congenital”, “Molecular Diagnostic Techniques” asociado a varias combinaciones de indicadores booleanos “And” y “Or”. Se incluyeron todos los tipos de estudios (Artículos de revisión, originales, reportes de caso, consensos, entre otros), no se incluyeron investigaciones donde se medía el grado de infección de T. cruzi in vivo en ratones u otro modelo animal, artículos que presentaban problemas en su visualización y tenían un desarrollo incompleto del tema, así mismos artículos repetidos en la matriz de búsqueda y aquellos que por consenso no aportaban al objetivo de la revisión del tema. De acuerdo a la Figura 1 se obtuvo un total de 78 artículos para la lectura completa de los cuales se seleccionaron 50 manuscritos para el desarrollo del documento.
Resultados
Epidemiología
De acuerdo a la Organización Mundial de Salud (OMS) la enfermedad de Chagas es considerada una “enfermedad tropical desatendida” la cual afecta principalmente a poblaciones de bajos ingresos que viven en condiciones tropicales y subtropicales 11. La transmisión congénita de Chagas se ha presentado como un problema cada vez mayor de salud pública en zonas donde la transmisión vectorial ha sido interrumpida y en las zonas no endémicas 9, sumado al desconocimiento de la enfermedad, el diagnóstico tardío y escaso seguimiento del paciente puede llevar a que los neonatos infectados desarrollen fases crónicas 13 de la patología con manifestaciones cardiacas o gastrointestinales 12.
Se estima que en Estados Unidos anualmente 40 mil mujeres en edad fértil presentan una infección por T. cruzi11 reportando 60 a 315 casos de Enfermedad de Chagas congénito 14, lo cual se ha asociado con el turismo a regiones endémicas 13 y la migración de mujeres infectadas con el parásito 15. Así mismo, en países como Canadá, Australia, Nueva Zelanda, España y Japón 4 han informado la migración alrededor de 14 millones de personas de áreas endémicas, llegando a considerar a la Tripanosomiasis Americana como una enfermedad emergente 16, lo cual ha llevado al desarrollo de programas de tamizaje en embarazadas y recién nacidos 4 junto con la aplicación de nuevas pruebas diagnósticas como la amplificación isotérmica mediada por bucle (T. cruzi- LAMP) 17.
En cuanto a regiones endémicas, aproximadamente dos millones de mujeres presentan una serología positiva frente al parásito T. cruzi siendo transmisoras potenciales de Chagas congénito 15 con un 5% de riesgo promedio de infectar a sus recién nacidos 4. Se ha reportado una tasa de transmisión materno infantil variable en países como Paraguay (10 %), Bolivia (3,4 - 8,6%), Chile (2,3%), Brasil (1,4%) 18, Argentina (6,6-11%) y México (6,3%) 18)(19, dicha variabilidad depende de la subregión donde se presenta la exposición al vector, la falta de acceso al sistema de salud por el estigma social 20, las condiciones de salubridad 4)(16)(20 y vivir en construcciones elaboradas a partir de adobe, paja, barro o caña 21.
Por otra parte, en estudios realizados en Colombia se ha estimado que 166.221 mujeres de edades comprendidas entre los 15 a 44 años se encuentran infectadas con el parásito 16, llegando a presentar anualmente 1.046 casos nuevos congénitos 21. En zonas como Boyacá se estableció una prevalencia de 2,4% de mujeres en gestación seropositivas para T. cruzi22; haciendo imprescindible comprender la dinámica de transmisión del parásito para el desarrollo estrategias apropiadas como cribado y controles médicos 23)(24, garantizar entornos saludables 21, asegurar la cobertura y atención médica debido al limitado acceso de recursos e intervenciones en ciertas regiones del país 25 junto con el tratamiento de la enfermedad de Chagas en Colombia 22.
Pese a que la estimación de la carga de enfermedad de Chagas reportada en el país es baja (0.956%) 14, Páez menciona que el 10% de la población colombiana que habitan zonas endémicas se encuentran en riesgo 26 de trasmisión vectorial 27. Por otro lado, Parra et al., determinaron que en Colombia las poblaciones principalmente expuestas corresponden a las tribus indígenas de la Sierra Nevada de Santa Marta 25, puesto que, presentan deficientes condiciones de vida y contacto con el vector; en los asentamientos Manzanal, Kasakumake, Umandita y Gumake se obtuvieron serologías positivas en un 34% sin diferencias significativas de la infección de hombres y mujeres 28 esto se asoció con las condiciones sociales 5, ecológicas, ambientales y culturales propias de su entorno, además de tener cercanía con una gran diversidad de animales domésticos 21 y silvestres y tener poca disponibilidad a un diagnóstico y terapia adecuada 25, 29.
Por otra parte, Carlier et al., 30 mencionan que además de intervenir mujeres embarazadas, es necesario evaluar el estado serológico de 4 grupos como lo son niñas y adolescentes, mujeres en edad fértil que no se encuentren en embarazo, familiares y todos los hijos nacidos de mujeres infectadas con el parásito y recién nacidos además de niños con riesgo de presentar la infección. Para esto, gracias a la aplicación del subprograma nacional de promoción- prevención y control de la enfermedad de Chagas el Ministerio de Salud de Colombia logró tamizar un total de 27.334 personas provenientes de 106 municipios de Arauca, Boyacá, Casanare, Norte de Santander, Santander, Vichada; se estableció una seropositividad en 21,15% de niños menores de 5 años, el 66,9% comprendían edades entre 5 a 14 años y el 11,9% restante eran mayores de 15 años 21.
Enfermedad de Chagas congénito
Los primeros casos descritos de enfermedad de Chagas congénito se remontan al año 1911 donde dos recién nacidos de madres con la enfermedad, presentaron convulsiones y fallecieron entre los 6 a 8 días de vida, hallándose en sus autopsias la presencia del parásito T. cruzi9. La transmisión congénita ocurre comúnmente durante el segundo o tercer trimestre del embarazo 8; se debe sospechar de la infección en los nacimientos de una madre con serología positiva para T. cruzi, además que la transmisión puede darse tanto en la fase aguda como en fase crónica de la materna y puede tener lugar en múltiples embarazos 9)(11.
Por otra parte, la infección se desarrolla cuando el estadio infeccioso (Tripomastigote metacíclico) ingresa a circulación sanguínea 30 y se moviliza hasta alcanzar la placenta e invade las células de Hofbauer 31, una vez allí se multiplica y atraviesa el trofoblasto 25; dicha invasión combinada con una alta carga parasítica puede causar placentitis y villitis en las áreas donde se ha destruido la capa celular 9. Cabe resaltar que la transmisión temprana del parásito aumenta el riesgo de aborto espontáneo 32.
Ahora bien, algunos de los factores de riesgo documentados que podrían influir en la patogenia de la enfermedad incluyen la parasitemia, genética del huésped, respuesta inmune 7)(33, edad gestacional y edad de la madre 18, el conocimiento junto con la exposición con el insecto vector 2, presentar antecedentes familiares de Chagas 9, haber tenido múltiples embarazos o parto gemelar 34, el genotipo o cepa con el que cursa la infección 23 teniendo en cuenta que, TcI es la unidad de tipificación discreta (DTU) más prevalente 12 mientras que, TcII y TcVI 14)(18 presentan mayor capacidad infectiva y patogenicidad 14)(36. De igual manera, se ha documentado que las condiciones sociales y demográficas de la población 31 junto con la presencia de coinfecciones especialmente por virus de la inmunodeficiencia humana (VIH) podría agravar la Enfermedad 7)(9)(11)(33.
En cuanto a las principales alteraciones en el recién nacido estas son variables, desarrollando un amplio espectro de manifestaciones que van desde neonatos aparentemente sanos y de peso adecuado a la edad gestacional hasta cuadros graves que pueden conducir a la muerte 32. En el cuadro sintomático, las manifestaciones de la enfermedad pueden incluir bajo peso al nacer, prematuridad, puntaje de Apgar bajo 29, anemia 33, ictericia 25, trombocitopenia, síndrome de dificultad respiratoria 15)(18, hepatoesplenomegalia y fiebre 32; síntomas que se pueden confundir con infección por Citomegalovirus, Herpes simple 34, Toxoplasmosis, entre otros agentes infecciosos 25.
Por otro lado, los recién nacidos con infección congénita asintomática suelen ser dados de alta sin evaluación, pero después de años de infección silenciosa alrededor de un 20 al 30% desarrollan manifestaciones graves y potencialmente mortales 8 como miocarditis, meningoencefalitis, mega síndromes gastrointestinales 35, anasarca, neumonitis 33 y 5% presentan una afectación a nivel de sistema nervioso central y miocardio 9)(34.
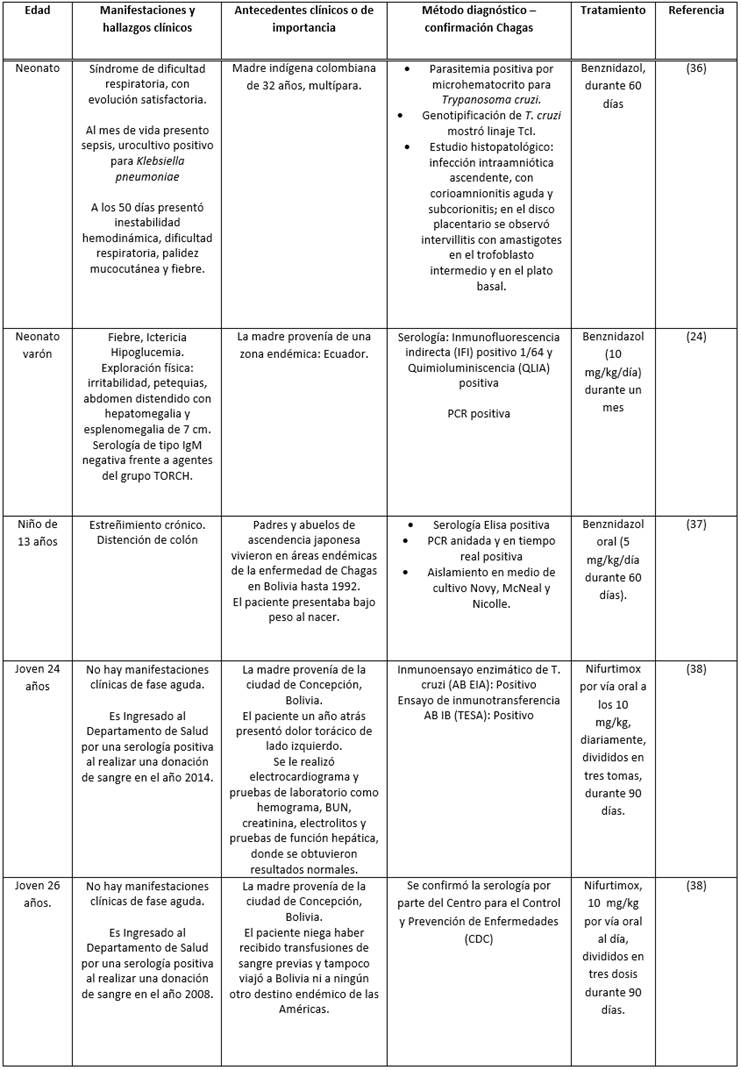
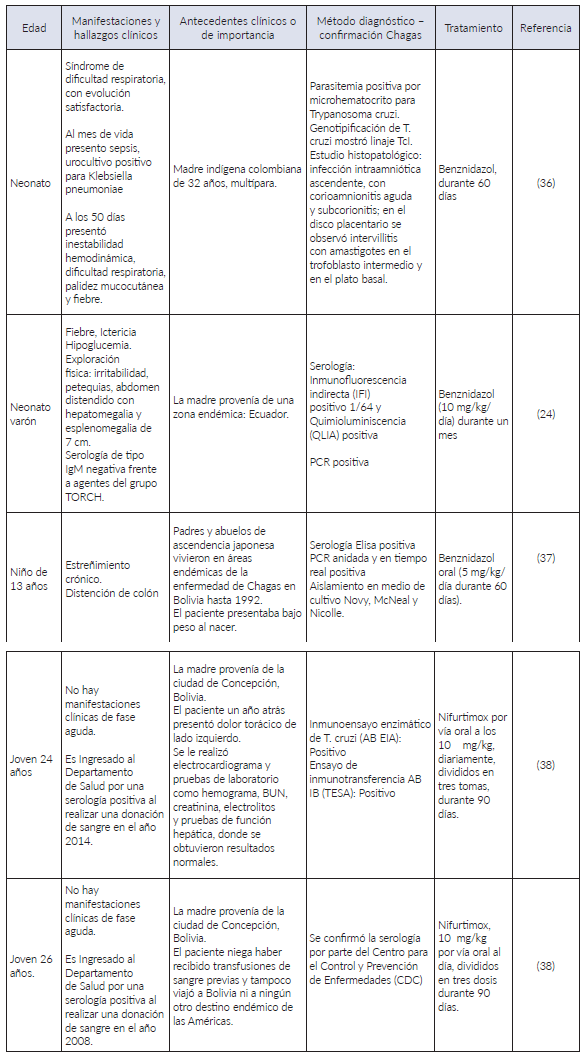
De acuerdo a las publicaciones consultadas, se encontraron cinco reportes de caso correspondientes a Enfermedad de Chagas congénito (ver Tabla 1), el primer caso corresponde a un neonato producto del séptimo embarazo de una mujer indígena proveniente de un área rural del occidente de Colombia, que al día 50 de vida presento falla hemodinámica y sepsis indeterminada, se identificó parasitemia positiva para T. cruzi con diagnóstico de meningoencefalitis chagásica al observar parásitos en líquido cefalorraquídeo (LCR) 36, se instauro tratamiento y evolución favorable, el nexo epidemiológico se relacionó con serología positiva para T. cruzi en ambos padres.
El segundo caso correspondió a un neonato varón sintomático que cursaba con hepatoesplenomegalia. Se le realizó un perfil básico infeccioso de anticuerpos de tipo IgG e IgM contra: Citomegalovirus, VIH, Virus del Herpes simple tipo I y II, Toxoplasma, Virus de Epstein Bar, Parvovirus, junto con la determinación de reagina plasmática rápida (RPR) y anticuerpos treponémicos totales con resultados negativos. El diagnóstico se facilitó debido a la indagación del origen geográfico y la presencia de resultados positivos en la determinación serológica contra Tryapanosoma cruzi de la madre 24.
Posteriormente, se encontraron tres casos, en los cuales se presentó una sintomatología tardía logrando el diagnóstico de la Enfermedad de Chagas en una edad avanzada: 13 años 37, 24 y 26 años 38; algunas de las causas asociadas incluían presentar un estado aparentemente “sano” en los primeros años de vida, la falta de un adecuado control prenatal y no realizar un seguimiento adecuado del neonato. Cabe resaltar que, en los tres casos, las madres provenían de una zona endémica y años después se establecieron en zonas no endémica donde se ignoró la Enfermedad de Chagas como diagnóstico diferencial 33. En dos hermanos el diagnóstico se dio de manera accidental 38 al presentar una serología positiva en una jornada de donación de sangre; al indagar sobre el estado de los donantes se descartaron todas las formas de infección alternas incluyendo la picadura del vector, considerando los casos como Chagas congénito asintomático con progreso a fase crónica de la enfermedad evidenciando los primeros rasgos de afectación cardíaca.
Ciertamente el tratamiento etiológico de la enfermedad en fase aguda y congénita consiste en la administración de dos fármacos Benznidazol o Nifurtimox, cuyo periodo de ingestión es determinante para la eficacia del mismo, considerando que en pacientes menores de 15 años que han tenido un menor tiempo de exposición al parásito presentan una mejor respuesta ante los antitripanosómicos 1, permitiendo una curación hasta del 100% 18 además de tener un buen perfil de tolerancia y seguridad 33, mientras que, en adultos se ha reportado la presentación de efectos adversos como como anorexia, alteraciones gastrointestinales, trastornos neurológicos, fiebre y erupción cutánea, provocando la interrupción o el abandono del tratamiento en un 75% de los casos 39.
En todos los reportes se administró el tratamiento a los pacientes y a los padres (en caso de requerirlo) presentando una mejoría clínica significativa, además no se reportaron efectos adversos en los niños ni en los adultos 24)(36)(37)(38. Como se mencionó previamente, la tasa de curación disminuye con la edad 40, siendo necesario la implementación de estrategias que faciliten el diagnóstico oportuno evitando la afectación de diversos sistemas por el progreso de la enfermedad a una fase crónica 41)(42; adicionalmente en 3 de los 5 casos 24)(36)(37 se empleó la técnica PCR en el seguimiento y diagnóstico de la enfermedad.
Diagnóstico Chagas congénito
El diagnóstico está basado en métodos directos e indirectos (ver tabla 2). Los métodos directos hacen referencia a la búsqueda del parásito T. cruzi, ya sea empleando muestras en fresco o coloreadas, o bien realizando la concentración de las mismas como el micrométodo o método de Strout para ser observadas mediante microscopía 14)(43, mientras que, los métodos indirectos están clasificados como parasitológicos, serológicos y moleculares 1)(44, para los cuales se requiere el crecimiento del microorganismo en un medio de cultivo específico en el caso de hemocultivo 33, la determinación de anticuerpos en el suero del paciente (serología) como respuesta a la infección 39 o la amplificación de un fragmento específico 45 del parásito en la muestra del paciente pasando primero por un paso de extracción de ADN 43.
Por otra parte, la detección de la enfermedad de Chagas congénita, en las regiones endémicas se basa en un algoritmo complejo 8)(33, el cual inicia con la detección serológica materna que confirme la infección por T. cruzi29, cabe resaltar que ante la falta de una única prueba serológica lo suficientemente sensible y específica es necesario emplear 2 o más con diferente principio antigénico 13. Posteriormente, se realiza la evaluación del recién nacido mediante microhematocrito empleando muestra de cordón umbilical o sangre periférica 14, los estudios serológicos 46 se recomiendan después de los 9 meses de edad 17 contando con el tiempo suficiente para la eliminación de los anticuerpos maternos 3)(47.
Sin embargo, Benatar et al., consideran que al incorporar métodos de amplificación de ácidos nucleicos al algoritmo se reduciría la constante toma de muestras, se permitiría una detección precoz de una mayor proporción de casos que no son detectados mediante métodos parasitológicos y se reduciría la pérdida del seguimiento de los pacientes 17, además de que esta técnica cuenta con diversos blancos de amplificación de ADN como satélite de 195 pb 17)(18)(20)(24, el elemento repetitivo E13, el dominio D7 del gen codificantes subunidad 24s del ADN ribosomal, la secuencia de la proteína flagelar F29, el gen codificante para la histona H2A 27 y las secuencias conservadas de los mini círculos del cinetoplasto (ADNk) 46)(48.
Igualmente, Cura et al., mencionan que la elección del tipo de PCR (convencional, multiplex, en tiempo real, entre otras), el origen biológico de la muestra y la diana biológica para la amplificación, ha demostrado un papel predictivo en el diagnóstico congénito, encontrando una mayor sensibilidad clínica cuando se amplificó el ADNk pero menor especificidad por la presencia de falsos positivos con Trypanosoma rangeli49 requiriendo de la estandarización de la técnica junto con la investigación de nuevas tecnologías moleculares isotérmicas 46 que permitan una entrega oportuna y certera de resultados acortando el periodo diagnóstico 6)(50.
En Sudamérica aún no hay un flujograma unificado sobre el diagnóstico de la infección por T. cruzi y las técnicas diagnósticas a usar.
Conclusiones
El diagnóstico oportuno de la enfermedad de Chagas gestacional y en mujeres de edad fértil es vital para el control de la enfermedad, dado que esto permitiría un seguimiento y control tanto de los neonatos como de las madres infectadas.
De igual manera, es indispensable avanzar en la generación de nuevas técnicas de diagnóstico que puedan servir como apoyo en el algoritmo de la enfermedad de Chagas en zonas endémicas y no endémicas, puesto que, se han desarrollado ensayos que han mostrado tener una buena sensibilidad y especificidad, pero su mayor limitante es la infraestructura, la capacitación del personal de laboratorio y el costo para el desarrollo del mismo.
Adicionalmente, en Colombia se debe garantizar el seguimiento de las mujeres en edad fértil o gestación en todo el territorio nacional que se encuentren en riesgo de presentar enfermedad de Chagas para evitar el progreso a una fase crónica y minimizar la incidencia de casos, así mismo, fortalecer las estrategias de prevención y la instauración de vigilancia de los familiares en mujeres gestantes seropositivas y con neonatos confirmados, dado que la transmisión congénita puede presentarse en todos los hijos y posiblemente los hijos mayores no hayan sido diagnosticados.