Introducción
En los estudios microbiológicos se pretenden obtener resultados precisos y en el menor tiempo posible, esto permite que los pacientes reciban el tratamiento adecuado y mejoren su calidad de vida. Específicamente en las micosis, los procedimientos de diagnóstico en el laboratorio se basan en la microscopía directa y el cultivo del microorganismo. Por lo tanto, la utilización de coloraciones para la identificación de estructuras micóticas tiene una alta importancia en el diagnóstico clínico, la identificación se fundamenta en las propiedades fisicoquímicas de estas sustancias y la reacción que desencadena sobre las células microbianas 1.
La técnica de hidróxido de potasio (en adelante KOH) es un método útil, simple, rápido y de bajo costo, el cual se fundamenta en la capacidad de digestión del KOH sobre la queratina disolviendo proteínas y lípidos 2. Mientras que la técnica del blanco de calcoflúor (en adelante BCF) es una tinción fluorescente con gran afinidad por la quitina y la celulosa de la pared celular 3)(4. Aunque es muy sensible y específica requiere el uso de un microscopio de fluorescencia.
Al utilizar la técnica de BCF se puede dar un diagnóstico presuntivo rápido en muestras clínicas lo que permite la visualización de las estructuras fúngicas y disminuye el tiempo para el observador, debido a que no requiere de experiencia para la visualización de las estructuras micóticas y el fondo de la tinción se colorea de negro y los hongos fluorescen; existen reportes de esta técnica que posibilitan la observación rápida desde candidiasis 5, pitiosis 6, esporotricosis 7 hasta aspergilosis 8. Incluso, estudios previos han sugerido que la microscopía directa con fluorescencia puede ser una técnica sensible, que podría aumentar las tasas de detección en comparación con KOH en el diagnóstico de infecciones fúngicas 9)(10)(11.
El objetivo de este trabajo fue evaluar la capacidad de identificación de estructuras micóticas en diferentes muestras biológicas de la coloración de BCF.
Materiales y métodos
Se realizó un estudio observacional, en el cual se incluyeron 36 muestras analizadas en el laboratorio clínico SYNLAB-Colombia (https://www.synlab.co/) entre junio y diciembre de 2021, de flujo vaginal, lavados broncoalveolares, escamas de uñas, líquido cefalorraquídeo, orina, sangre, córnea y tejido.
Cada muestra fue evaluada mediante examen directo usando BCF, KOH al 20% y cultivo micológico que determinó la cantidad de estructuras micóticas.
Se tomó como estándar de oro la siembra en medios de cultivo, con excepción de las muestras que fueron positivas para Pneumocystis jirovecii, las cuales tuvieron como estándar el método de reacción en cadena de polimerasa (en adelante PCR) debido a su imposibilidad de cultivar.
Durante el montaje de BCF se utilizaron dos cepas control (ATCC Candida albicans 14053 y ATCC Escherichia coli 25922) con el propósito de garantizar el buen funcionamiento de la técnica.
Evaluación mediante KOH al 20%
Se depositaron 40 uL de cada muestra liquida, o escamas de uñas, sobre una lámina portaobjetos y se agregaron 40 uL de KOH al 20%. Se homogeneizó y se cubrió con una laminilla, se dejó reposar por 1 minuto y posteriormente se observó al microscopio de luz (OLYMPUS CX31) en 10X y si se observaban estructuras micóticas se identificaban en 40X.
Evaluación mediante blanco de calcoflúor
Para todas las muestras se depositaron 40 uL de la muestra, o una cantidad representativa en las muestras sólidas, sobre una lámina portaobjetos. Posteriormente se agregaron 40 uL de KOH al 20% y 40 uL de BCF, se homogenizó y se cubrió con una laminilla, se dejó reposar por 1 minuto y luego se examina bajo luz ultravioleta (UV) en objetivo de 40X con el microscopio de fluorescencia (Nikon, Eclipse E400, serie: 672999).
Evaluación mediante cultivo micológico
El diagnóstico micológico por cultivo en muestras genitales, orina y sangre se realizó al utilizar el medio cromogénico y Sabouraud suplementado con cloranfenicol, en las muestras respiratorias, biopsias, escamas. En el caso de detritus de uñas y piel fue necesario cambiar el medio cromogénico por Mycosel, mientras que en los líquidos estériles fueron cultivados en medio Sabouraud dextrosa y Sabouraud suplementado con cloranfenicol.
Resultados
La cantidad de muestras analizadas y la presencia de estructuras fúngicas en relación a las técnicas de KOH al 20%, el BCF o el cultivo son mostradas en la tabla 1. El porcentaje de muestras positivas fue más alto al usar BCF (72.2%), seguido por el cultivo (69,4%), mientras que la tinción de KOH al 20% (58,3%).
Tabla 1 Tipo de muestras analizadas, estado de positividad por las técnicas de KOH al 20%, BCF y cultivo micológico.
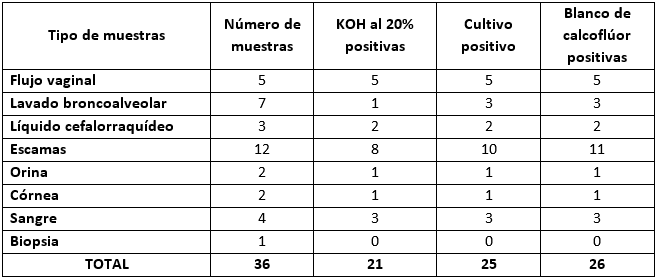
La sensibilidad del examen directo con el BCF fue del 95% y la especificidad del 67%, mientras que la sensibilidad del cultivo respecto al BCF fue del 100% y la especificidad del 91% (tabla 2).
Tabla 2 Comparación de las especificidades y sensibilidades del cultivo fúngico y el examen microscópico después de la tinción con hidróxido de potasio o BCF.

Observación macroscópica y microscópica de las muestras
Las 36 muestras clínicas se procesaron por las tres técnicas, en la figura 1 y 2 se muestran dos ejemplos de identificación con cada una de las metodologías empleadas para su evaluación.
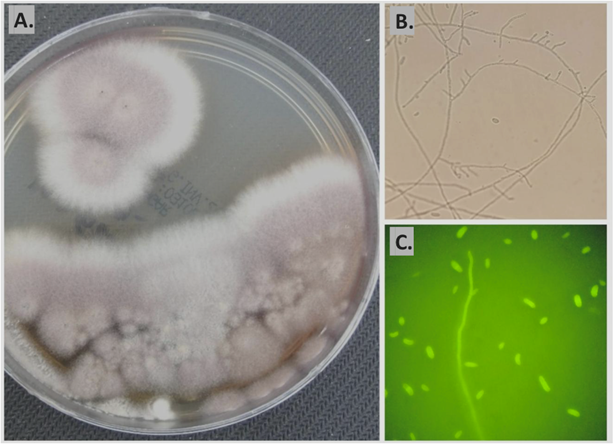
Figura 1 Comparación de las tres técnicas evaluadas en una muestra de sangre en la cual se obtuvo crecimiento de complejo Fusarium sp.
A) Cultivo micológico, se obtuvo crecimiento de hongo filamentoso en agar sabouraud. B) KOH al 20%, se observan hifas hialinas septadas y macroconidias. C) Blanco de calcoflúor, se observan hifas hialinas septadas y macroconidias en forma de media luna.
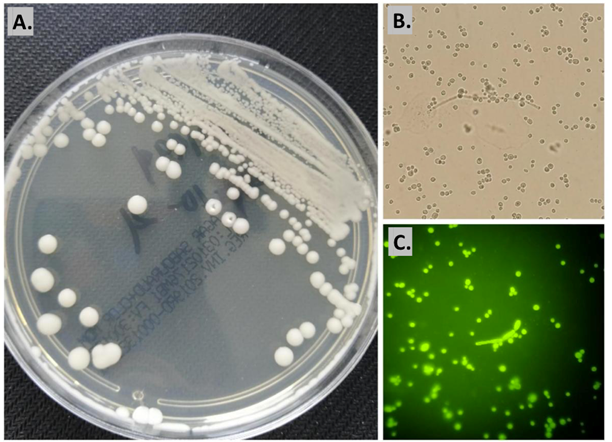
Figura 2 Comparación de las tres técnicas evaluadas en muestra de flujo vaginal con crecimiento positivo para Candida albicans.
A) Cultivo micológico, se obtuvo crecimiento de colonias cremosas, levaduriformes. B) KOH 20%, se observan blastoconidias y pseudohifas cantidad abundante. C) Blanco de calcoflúor, se observan blastoconidias y pseudohifas cantidad abundante.
Discusión
En la comparación entre la técnica de KOH al 20% frente la tinción de BCF, se observó un porcentaje de positividad del 58,3% (21 de 36 muestras), frente un 72,2% que se obtuvo mediante la técnica de BCF (26 de 36 muestras), lo que evidenció una mayor especificidad y sensibilidad el BCF (tabla 2). Resultados similares fueron reportados por Abdelrahman et al. 12 en 2006 y Sánchez Armendáriz et al. 4 en 2013. Sin embargo, un estudio realizado por Bonifaz et al. 9 en 2013 en muestras de 33 paciones con onicomicosis en la Ciudad de México no observaron que el diagnóstico al usar BFC (58% de las muestras fueron positivas) fuera mejor que KOH (67%) o cultivo (33%) 9.
En concordancia con los resultados del presente estudio Bao et al. 13 ratifican la importancia del uso de la fluorescencia debido a que mejora la sensibilidad y la especificidad del examen directo.
Si bien el KOH al 20% es una técnica útil y altamente utilizado para la identificación de hongos, presenta algunos problemas como la posibilidad de interpretar algunas estructuras no micóticas como hongos y producir falsos positivos 2, además de ser difícil la observación de estructuras fúngicas en muestras con recuentos bajos de microorganismos 2)(4; la microscopía constituye, por su bajo costo y disponibilidad, un método de diagnóstico accesible a los laboratorios de baja complejidad, pero podría mejorarse implementando la técnica de BCF 9. Pihet et al. 14 evidenciaron, como en el presente estudio, mejores resultados en el diagnóstico al usar la técnica de BCF para el procesamiento de muestras clínicas.
Uno de los mayores inconvenientes que se encuentran en esta última es la fluorescencia que se puede tener en muestras muy gruesas, principalmente en uñas, debido a que no permite visualizar bien las estructuras micóticas. Se ha reportado que la sensibilidad de BCF varía entre tres microbiólogos, debido a que es una prueba subjetiva y depende de la experiencia del observador 6, pero la fluorescencia en un campo oscuro permite que observadores que no cuenten con experiencia logren identificarlas con facilidad, lo que disminuye el porcentaje de resultados falsos negativos 10)(15)(16. Recientemente, fueron reportados dos casos pediátricos en los cuales se logró, mediante BCF, la detección en líquido de lavado broncoalveolar de una aspergilosis pulmonar invasiva, esto permitiótomar decisiones rápidas de tratamiento 8.
De otro lado, dado que cada hongo tiene requerimientos de crecimiento diferentes, las muestras clínicas deben ser cultivadas en medios sólidos (agar Sabouraud Dextrosa y Mycosel), algunos contienen cicloheximida y cloranfenicol para inhibir el crecimiento de hongos ambientales y bacterias 17. Sin embargo, períodos de crecimiento de 2 a 6 semanas y a pesar de una preparación de KOH al 20% positiva, el cultivo de patógenos puede no obtener crecimiento, especialmente si ya se ha iniciado el tratamiento antifúngico 18, y la identificación instantánea de un patógeno específico permite el inicio de una terapia adecuada en un corto período de tiempo 18, por lo tanto, es necesario implementar otras ayudas diagnósticas como el BCF.
Los resultados obtenidos del presente estudio evidencian un porcentaje de positividad en la técnica de BCF de 72,2% que corresponde a 26 muestras, frente al 69,4% de positivos obtenidos en los cultivos micológicos, resultados similares fueron reportados por Biao et al. 19. Incluso, con el avance de las tecnológicas, en los últimos años se ha intentado realizar microscopía de fluorescencia mediante teléfonos móviles para la identificación de patógenos fúngicos, lo cual podría ser útil con el propósito de realizar diagnósticos en lugares más apartados a bajo costo y de una manera simple 20.
Adicionalmente, se hallaron Pneumocystis jirovecii en algunas las muestras clínicas, estos pudieron observarse por medio de la técnica de BCF en donde se evidenciaron sus ascas, caso contrario ocurrió en la tinción de KOH al 20% donde no se observó ninguna estructura micótica. Esto demostró que la técnica a evaluar presenta un excelente rendimiento comparada con su prueba estándar la PCR, la cual identificó el patógeno en los biológicos analizados. Estos resultados concuerdan con el estudio realizado por Abastabar et al. 21 quienes lograron identificar las estructuras de Pneumocystis jirovecii por la técnica de BCF y luego por la técnica de PCR y concordaron perfectamente.
En conclusión, la técnica de BCF, aunque más costosa, se perfila como la más rápida y sensible para el diagnóstico de las micosis. Los costos de implementación resultan mínimos si son comparados con los del incremento de la hospitalización de los pacientes por retrasos en los reportes o ausencia de un diagnóstico micológico oportuno.















