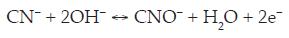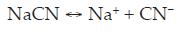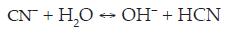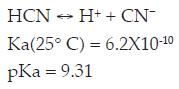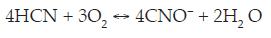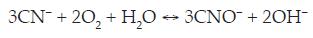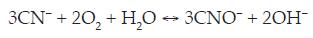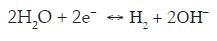Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Desarrollo
Print version ISSN 0122-3461On-line version ISSN 2145-9371
Ing. Desarro. no.24 Barranquilla July/Dec. 2008
Comportamiento electroquímico del cianuro
Electrochemical behaviour of cyanide
Julio César Pérez Domínguez*, Óscar Fabián Higuera Cobos**
* Ingeniero Metalúrgico, M. Sc. Ingeniería Metalúrgica-UIS. Ingeniero de integridad de ductos, Grupo CP2-ECP ECOPETROL. JulioCe.Perez@ecopetrol.com.co
** Ingeniero Metalúrgico, M. Sc. Ingeniería Metalúrgica-UIS. Grupo de Investigaciones en Materiales Avanzados (GIMAV-UTP), profesor asistente, Universidad Tecnológica de Pereira. osfahico@utp.edu.co
Correspondencia: Universidad Tecnológica de Pereira, Vereda La Julita, Facultad de Ingeniería Mecánica, Pereira (Risaralda).
Subvenciones y apoyos: Colciencias, Proyecto "Estudio fundamental del proceso de cementación con zinc y aluminio para la recuperación de oro y plata a partir de efluentes de pulimento químico en joyería".
Resumen
En este trabajo de investigación se estudió el efecto del pH, la concentración de cianuro y la concentración de oxígeno disuelto en solución sobre los fenómenos de adsorción y reducción de cianuro empleando un electrodo de carbón vítreo. Se observó que independiente de la concentración de cianuro en solución, cuando el pH de la solución es menor (soluciones aireadas) la corriente asociada a la onda en -0.95 V vs. SCE es más importante que a pH mayores (soluciones desaireadas), de modo que puede estar ocurriendo una competencia entre los iones cianuro e hidroxil cuando se adsorbe sobre la superficie del electrodo a pH mayores, y a bajas concentraciones de oxígeno disuelto.
Palabras claves: Cianuro, voltametría cíclica, electrodo de carbón de vítreo (GCE).
Abstract
In this work of investigation one studied the effect of the pH, the cyanide concentration and the oxygen concentration dissolved in solution on the adsorption phenomena and cyanide reduction using a glass coal electrode. It was observed that independent of the cyanide concentration in solution, the pH of the solution is smaller (aerated solutions) the current associated to the wave in - 0,95 V versus SCE is more important that to pH's majors (deaireated solutions), so that it can be happening a competition between ions cyanide and hidroxil when adsorbing itself on the surface of the electrode to pH's majors, and low dissolved oxygen concentrations.
Key words: Cyanide, Cyclic voltammetry, glass coal electrode (GCE).
INTRODUCCIÓN
Al igual que otros tipos de actividades industriales, algunos procesos electroquímicos a gran escala han sido y son, en algunos casos, causantes de importante impacto ambiental, que está fundamentalmente relacionado con la emisión de contaminantes al aire y/o fuentes de agua. La electroquímica aporta herramientas para estudiar, controlar, mitigar y tratar residuos generados por industrias químicas. Su estudio y control están relacionados con las posibilidades que brinda el electroanálisis, y la aplicación de técnicas electroquímicas para reducir, transformar o incluso eliminar residuos tóxicos. Debido a que los tratamientos electroquímicos implican una etapa de electrólisis, estos se pueden agrupar en función del tipo de eliminación que se produce: [1]
- Electrólisis directa: oxidación-reducción.
- Electrólisis indirecta: electrocoagulación, electroflotación y electrofloculación.
El ión cianuro es un residuo presente especialmente en efluentes de industrias dedicadas a la electrodeposición de metales. Para cumplir con las regulaciones ambientales es necesario disminuir al máximo la concentración de este anión en las aguas residuales. Para este propósito se lo debe oxidar como un compuesto menos tóxico. Desde el punto de vista químico es factible esta conversión utilizando oxidantes tipo gas cloro, o soluciones de ClO-; sin embargo, este procedimiento se justifica solo en casos de bajas concentraciones de CN-.
El tratamiento electroquímico, es decir, la oxidación sobre la superficie de un electrodo, presenta algunas ventajas características:
- No se requiere de reactivos extras: la reacción ocurre directamente sobre el electrodo.
- No se producen lodos, que implicarían tratamientos posteriores.
- Se obtienen altas eficiencias de corriente, es decir, se minimizan reacciones competitivas.
Un procedimiento utilizado frecuentemente, implica trabajar con soluciones alcalinas concentradas usando a manera de electrodos óxidos mezclas como RuO2 + TiO2 con un depósito de PbO2 en su superficie. La reacción correspondiente es:
A consecuencia de este tratamiento se produce como especie el ión cianato, que es unas 1000 veces menos tóxico que el ión cianuro. Por otra parte, es posible aumentar la conductividad de la solución añadiendo NaCl, lo que a su vez puede colaborar en la eliminación del cianuro al permitir un mecanismo indirecto de oxidación por la acción del Cl2 formado.
2. FUNDAMENTACIÓN TEÓRICA
Las sales simples de cianuro, como cianuros de sodio, potasio y calcio, pueden ser disueltas e ionizadas en agua para formar sus respectivos cationes metálicos e iones de cianuro libre:
La solubilidad en agua y el contenido de cianuro relativo del NaCN son 48 g/100cc a 25 °C y 53.1 %, respectivamente. Por otra parte, los iones de cianuro hidrolizados en agua forman HCN e iones hidroxilo (OH-), con un incremento correspondiente en el pH:
Siendo el cianuro de hidrógeno un ácido débil, el cual se disocia incompletamente en agua de la siguiente manera:
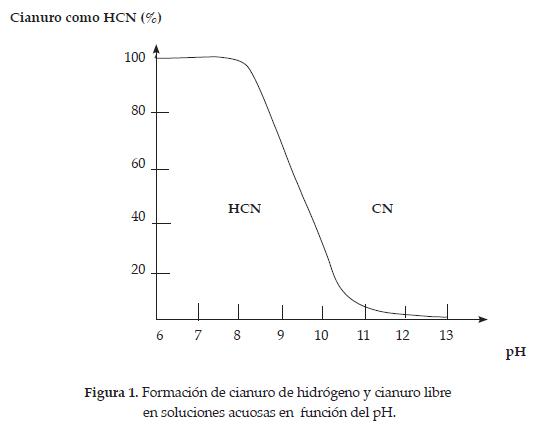
En la figura 1, se puede observar la extensión de esta reacción de equilibrio como una función del pH. A un valor de pH = 9.3 la mitad del cianuro total existe como HCN y la otra mitad como ión CN-. Del mismo modo, a pH mayores que 10.2, más del 90% del cianuro total se encuentra como ión CN-, y a pH menores que 8.4, como HCN. [2]
Es importante tener en cuenta que el cianuro de hidrógeno tiene una presión de vapor relativamente alta, 100 kPa a 26°C, por lo cual se volatiliza con rapidez en superficie líquida a condiciones ambientales, causando un decrecimiento de la concentración de cianuro en la solución. La velocidad de volatilización depende entonces de la concentración de HCN, en función de la concentración de cianuro total, del pH, del área superficial, de la profundidad de la solución, la temperatura y de los fenómenos de transporte asociados con la mezcla.
Por consiguiente, se prefiere que los sistemas de lixiviación con cianuro sean operados a pH que minimicen las pérdidas de cianuro, manteniéndose si es posible por encima de 10; esto es un factor importante a considerar en los procesos de recuperación de metales por cementación.
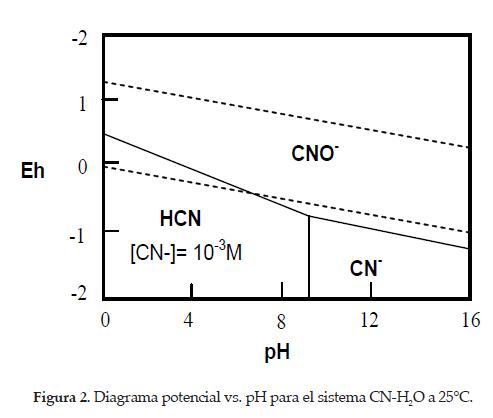
Por otra parte, se tiene que tanto el cianuro de hidrógeno como el cianuro libre pueden oxidarse formando cianato en presencia de oxígeno y bajo condiciones oxidantes adecuadas, tal y como se muestra en el diagrama potencial vs. pH para el sistema CN-H20, observado en la figura2:
Las reacciones correspondientes son:
Estas reacciones son indeseables durante la lixiviación ya que reducen la concentración de cianuro libre y las especies de cianuro que se forman no disuelven los metales básicos. [2]
MÉTODO
Se tomaron tres soluciones de concentraciones de NaCN iguales a 0.1, 0.24 y 0.61 M, que corresponden a 5, 12 y 30 g/l de solución, respectivamente; y se estudió el comportamiento voltamperométrico de la solución cianurada utilizando un electrodo de carbón vítreo GCE mediante aplicación de la técnica de voltametría de disco rotatorio. Se realizó un barrido de potencial a 25 mV/s, desde 2.0 V vs. SCE en la dirección catódica hasta -3.0 V vs. SCE (barrido directo), invirtiendo el barrido (con ese mismo potencial) hacia la dirección anódica para finalizar nuevamente en 2.0 V vs. SCE (barrido inverso). Los ensayos se realizaron, registrando los valores de pH de cada solución al inicio y al final de cada prueba y bajo condiciones de aireación y desaireación, con un monitoreo de la concentración de oxígeno disuelto en solución mediante el uso del oxigenómetro marca Handylab OX12-Schott. Esto con el objetivo de observar el efecto del pH y de la concentración de cianuro y oxígeno disuelto. Según lo anterior, se obtuvieron diferentes voltagramas que permiten analizar tanto el efecto individual como combinado de dichas variables.
Las pruebas de voltametría cíclica para la obtención de las curvas corriente vs. potencial se llevaron a cabo en un bipotenciostato modelo AFCBP1, Pine Instrument Company. Para la adquisición de datos se utilizó el software NIDAQ Pine Chemical. El montaje utilizado para este estudio se observa en la figura3.
Se utilizaron tres electrodos los cuales fueron dispuestos así: un electrodo de Calomel saturado (SCE) como electrodo de referencia, un electrodo de grafito como contraelectrodo y como electrodo de trabajo se utilizó un electrodo de carbón vítreo (GCE), de área geométrica 0.1963 cm2. Se prepararon soluciones de cianuro con concentraciones similares a las obtenidas en la caracterización fisicoquímica de los efluentes recolectados en taller. Se utilizaron para su preparación reactivos grado analítico de NaCN y agua desionizada.
RESULTADOS Y ANÁLISIS
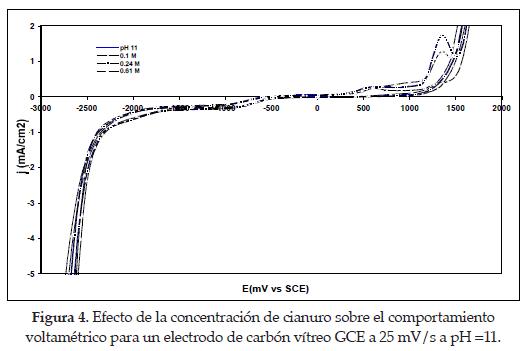
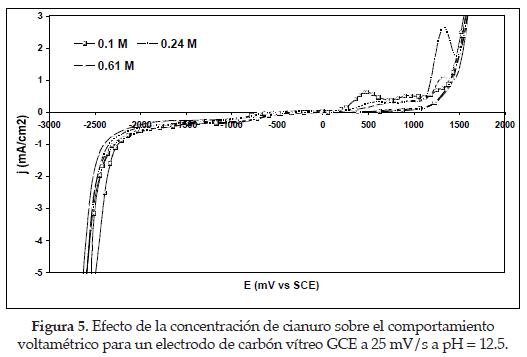
4.1. Efecto de la concentración de cianuro. Se obtuvieron voltagramas manteniendo el pH de la solución a un valor fijo para las diferentes concentraciones de cianuro, y realizando un barrido de pH, según el rango establecido de precipitación a partir del estudio termodinámico (pH entre 11 y 12.5).
Los diagramas obtenidos se presentan en las figuras 4 y 5 donde se observa que durante el barrido directo, se forma una onda (I) a -0.95 V vs. SCE de potencial, la cual puede asociarse a la adsorción de cianuro sobre la superficie del electrodo de carbón vítreo GCE, en razón a que no es posible atribuirla a un fenómeno de reducción faradaica del medio. [3]
Si se observan las densidades de corriente correspondientes a esta onda para todas las concentraciones de cianuro a pH fijo, esta es más importante a bajas concentraciones de cianuro (0.1 M y 0.24 M) que a altas (0.61 M). Lo anterior explica una posible competencia de los iones hidroxil con los iones cianuro libre a bajas concentraciones de NaCN cuando se adsorbe sobre la superficie del electrodo de carbón vítreo. En el caso de altas concentraciones de NaCN, la densidad de corriente correspondiente a la adsorción es menos negativa, pues existen iones CN- libres en exceso que no se adsorben sobre la superficie del electrodo a pH fijos. Sin embargo, puede dilucidarse que en un pH fijo, la influencia de la concentración de cianuro sobre la onda de adsorción es mínima, indicando una posible saturación de la monocapa electroquímica, que confirma lo encontrado en investigaciones anteriores a valores de pH entre 10 y 11[4].
Otra manera de confirmar la adsorción del cianuro es observando las altas densidades de corrientes capacitativas generadas durante el barrido directo, que se mueven hacia potenciales menos negativos a medida que la concentración de cianuro es aumentada desde 0.1 hasta 0.61 M. Es importante destacar que la reducción del medio, se ve incrementada hacia potenciales más negativos por efecto de la reducción del agua.
Si se tienen en cuenta las ondas correspondientes al comportamiento capacitivo (II) donde las curvas descienden hacia densidades de corriente más negativas a los diferentes pH puede observarse cómo a menor pH = 11 (figura 4), las curvas caen a potenciales cercanos a -2.3 V vs. SCE, mientras que a pH = 12.5 (figura 5) decaen a -2.1 V vs. SCE. Esto indica que a mayores pH, las densidades de corriente capacitivas son mucho más grandes que a pH menores; se atribuye este comportamiento a los cambios interfaciales fuertes sobre la superficie del electrodo. Lo dicho anteriormente puede confirmarse en los diagramas respecto a la línea (III); así se ubican en un potencial igual a -2.5 V vs. SCE a concentraciones de cianuro de 0.1 M, para el cual corresponden densidades de corriente capacitivas aproximadamente de -2.5 mA/cm2 en las curvas obtenidas a partir de las soluciones a pH = 11, y más negativas de -5.0 mA/cm2 en las curvas correspondientes a las soluciones de pH = 12.5. El mismo comportamiento se observa cuando se incrementan las concentraciones de NaCN en los valores de pH estudiados. [4]
De aquí en adelante se establecerá un valor de densidad de corriente para su uso como parámetro de comparación cada que se observa la influencia de la especie electroactiva durante el proceso de adsorción ó reducción faradaica. Este valor de densidad de corriente corresponderá al potencial con el cual la curva comience a declinar súbitamente, que será aproximadamente igual a -0.4 mA/cm2, llamándose al potencial correspondiente E-0.4mA/cm2. En los diagramas estudiados recientemente, se estableció este potencial aproximadamente igual o menor que -1.6 V vs. SCE.
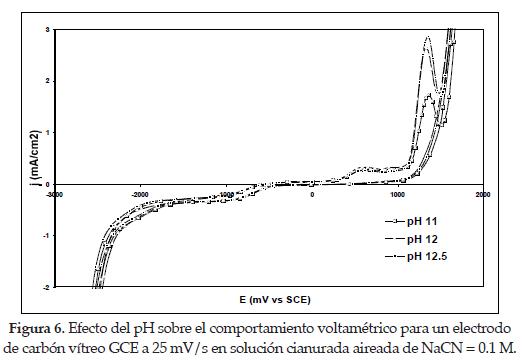
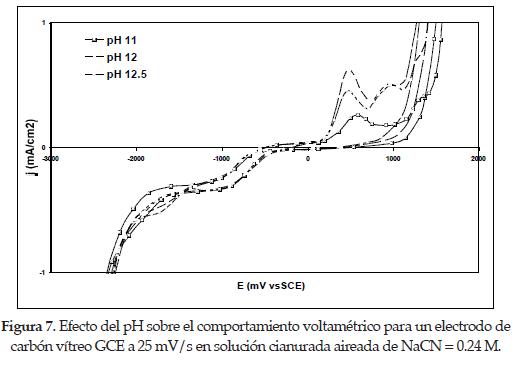
4.2. Efecto del pH. para estudiar el efecto del pH se obtuvieron voltagramas manteniendo fijas las concentraciones de NaCN en solución y variando el pH desde valores entre 11 y 12.5. Estos diagramas se presentan en las figuras 6 y 7.
Como se observó en los voltagramas anteriores, a potenciales cercanos a -0.95 V vs. SCE se presenta la onda de adsorción típica para las diferentes concentraciones de cianuro. En este caso se espera que el efecto del pH sea predominantemente marcado, debido a la competencia de los iones cianuros libres con los iones hidroxil cuando se adsorbe sobre la superficie del electrodo a concentraciones de cianuro constante, tal y como fue demostrado en estudios anteriores a pH 10 y 11[1]. Sin embargo, si se observa detalladamente, a medida que el pH se incrementa desde 11 hasta 12.5, las densidades de corriente correspondientes al potencial donde comienza la adsorción del cianuro se vuelven menos negativas; esto indica que cuando aumenta el pH, está ocurriendo una competencia de adsorción de los iones ya mencionados sobre la superficie del electrodo de carbón vítreo GCE. [5]
Otros investigadores [5] han encontrado que la corriente correspondiente a la onda de adsorción es más importante a pH 10 que ha pH 11, para concentraciones muy bajas de cianuro, con potenciales cercanos a -1.0 V vs. SCE, que manifiestan densidades de corriente más negativas a bajos valores de pH.
En la mayoría de las curvas de las figuras 6 y 7 se observa que al realizar el barrido inverso la curva se regresa por debajo, cruzando a la curva ya obtenida durante el barrido directo en un potencial cercano a -2.0 V vs SCE; esto indica que ha ocurrido un cambio interfacial en la superficie del electrodo carbón vítreo-solución. Se observa, además, que si continúa el barrido hacia potenciales más negativos, la reducción del medio se incrementa gracias a la reducción del agua, aumentándose las densidades de corriente capacitivas. [6]
Por otra parte, si se tiene en cuenta el diagrama potencial vs. pH construido en la figura 2 para sistema CN-H2O, se observa que a las condiciones de pH establecidas entre 10.5 y 12.5, los iones CN- se oxidarán a cianatos con un incremento de los potenciales hacia valores más positivos, según las reacción:
Estos potenciales corresponden a los picos observados durante el barrido inverso con densidades de corriente positivas y aproximadamente mayores para los valores de pH y concentración de cianuro más altas según se determinó en los diagramas anteriores. Así, para los casos de la figura 6 las densidades de corriente anódicas en las concentraciones de NaCN iguales a 0.1 M (I') fueron mucho mayores que para las de concentraciones iguales a 0.24 M (II') en la figura 7, dándose comienzo a la oxidación de los cianuros libres hacia potenciales cercanos y mayores a 0.5 V vs. SCE en la primera, y en la segunda a 0.6 V vs. SCE. El pico máximo de oxidación para cada pH aparece con potenciales más positivos uno respecto al otro a medida que el valor de pH de trabajo es reducido. En conclusión, para todos los casos, a medida que el pH de la solución se disminuye a una concentración fija de cianuro, su oxidación ocurrirá con potenciales más positivos.
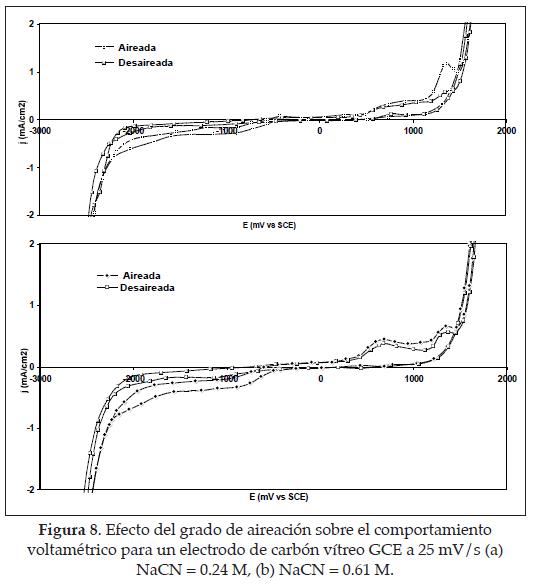
4.3. Efecto de la concentración de oxígeno disuelto. Para estudiar su efecto, se obtuvieron voltagr amas manteniendo fijas las concentraciones de NaCN en solución y variando el pH y las condiciones de aireación con burbujeo de nitrógeno hasta concentraciones de oxígeno disuelto menores a 0.05 ppm. Los diagramas correspondientes a estos voltagramas se presentan en la figura 8.
Para las dos concentraciones de NaCN, con las condiciones de aireación y desaireación, se observa una onda a -0.95 V vs. SCE (i) mucho más pronunciada cuando la solución tiene mayor concentración de oxígeno disuelto y un valor de pH más bajo. [7]
Si se tiene en cuenta lo expuesto anteriormente en el análisis del efecto del pH y la concentración de cianuro, la onda presente puede asociarse a la adsorción de cianuro sobre la superficie del electrodo con un efecto combinado de la desaireación y el pH, pues la experimentación muestra que al desairearse una solución, el pH se incrementa por disminución del oxígeno disuelto en el agua y por reducción de la misma en H2 y OH-, según la reacción:
En conclusión, se observa que independiente de la concentración de cianuro en solución, cuando el pH de la solución es menor (soluciones aireadas), la corriente asociada a la onda en -0.95 V vs. SCE es más importante que a pH mayores (soluciones desaireadas); así, puede estar ocurriendo una competencia entre los iones cianuro e hidroxil cuando se adsorbe sobre la superficie del electrodo a pH mayores y a bajas concentraciones de oxígeno disuelto. [8]
Si se observan las curvas correspondientes a las soluciones aireadas, el potencial E-0.4 mA/cm2 es igual a -1.27 V vs. SCE, para la solución con concentración de cianuro igual 0.24 M, mientras que para la solución 0.61 M dicho valor es -1.72 V vs. SCE, lo que indica que a mayor concentración de cianuro en solución, la reducción del medio electrolítico ocurre a potenciales más negativos. Ahora, teniendo en cuenta el comportamiento de las soluciones desaireadas, puede verse que para los potenciales mencionados anteriormente las densidades de corriente capacitivas correspondientes son menores que aquellas dadas para las soluciones aireadas, pues son aproximadamente de -0.15 mA/cm2, y se comportan de la misma forma que las curvas obtenidas para las soluciones aireadas en función del incremento de la concentración de cianuro. El efecto de la concentración de oxígeno disuelto puede ser más importante que el mismo pH, dado que afecta los procesos adsortivos sobre la superficie del metal precipitante.
5. CONCLUSIONES
Se observó que independiente de la concentración de cianuro en solución, cuando el pH de la solución es menor (soluciones aireadas) la corriente asociada a la onda en -0.95 V vs. SCE es más importante que a pH mayores (soluciones desaireadas); de este modo puede estar ocurriendo una competencia entre los iones cianuro e hidroxil cuando se adsorbe sobre la superficie del electrodo a pH mayores, y a bajas concentraciones de oxígeno disuelto.
Se encontró que el comportamiento electroquímico de las soluciones cianuradas en cuanto a procesos de oxidación-reducción guardan coherencia con los potenciales termodinámicos obtenidos para las concentraciones del ión de referencia CN- y O2, que son función directa del pH.
En soluciones aireadas de cianuro, el potencial E-0.4 mA/cm2 es igual a -1.27 V vs. SCE para la solución con concentración de cianuro igual 0.24 M, mientras que para la solución 0.61 M dicho valor es -1.72 V vs. SCE, lo que indica que a mayor concentración de cianuro en solución, la reducción del medio electrolítico ocurre a potenciales más negativos.
AGRADECIMIENTOS
Agradecemos el apoyo del grupo de investigación en Minerales, Biohidrometalurgia y Ambiente de la Universidad Industrial de Santander en la realización de este proyecto.
REFERENCIAS
[1] VAN PARYS, H., et al., "Modeling of mass and charge transfer in an inverted rotating disk electrode (IRDE) reactor", Journal of Electroanalytical Chemistry 622 (2008) 44-50. [ Links ]
[2] IBÁÑEZ, J.G., GONZÁLEZ. I., Construction of multicomponent pourbaix diagrams using generalized species, Universidad Iberoamericana, UAM, México, 1991. [ Links ]
[3] LUNA, R.M, RAMÍREZ, M.T. GONZÁLEZ, I. "Limitations for the use of evans diagrams to describe hydrometallurgical redox phenomena", Hydrometallurgy 2003. [ Links ]
[4] VILCHIS, S. -CARBAJAL, I. GONZÁLEZ, G.T. LAPIDUS, An electrochemical study of gold cementation with zinc powder at low cyanide concentration in alkaline solutions, Universidad Autónoma Metropolitana- Iztapalapa, México, 1999. [ Links ]
[5] LUNA SÁNCHEZ, R.M., GONZÁLEZ, I. LAPIDUS, G.T., An Integrated approach to evaluate the leaching behavior of silver from sulfide concentrates, Universidad Autónoma Metropolitana de Iztapalapa, México, 2002. [ Links ]
[6] SOBRAL, L.G.S., Rotating Disk Technique Appiled to an Environmentally Sound Extraction Metallurgy, CETEM, Universidad Industrial de Santander, 1995. [ Links ]
[7] KONDOS, P., GRIFFITH, F., JARA. J. "The use of oxygen in gold cyanidation", Canadian Metallurgical Quarterly. 1995 [ Links ]
[8] PALOMAR M. and GONZÁLEZ I., "New Insights into evaluation of kinetic parameters for potentiostatic metal deposition with underpotential and overpotential deposition processes", Journal Physic Chemical 2000 [ Links ]