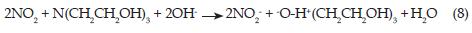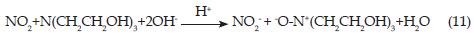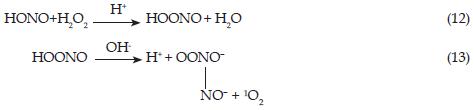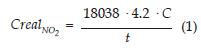Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Desarrollo
Print version ISSN 0122-3461On-line version ISSN 2145-9371
Ing. Desarro. no.25 Barranquilla Jan./June 2009
Determinación de NO2 atmosférico mediante captadores pasivos y cromatografía de intercambio iónico
Measurement of atmospheric NO2 by passive samplers and ion interchange chromatography
Harol de Jesús Torres Noreña*, Paula M. Montoya Izquierdo**, Juan Guillermo Castaño González***
Grupo de Corrosión y Protección, Facultad de Ingeniería, Universidad de Antioquia.
* Ing. Químico de la Universidad de Antioquia. Estudiante de maestría
en Ingeniería. harolsmith@gmail.com** Química de la Universidad de Antioquia. Estudiante de doctorado en Ciencias Químicas. Opami634@gmail.com
*** Ph. D. Ciencias Químicas, Universidad Complutense de Madrid, docente e investigador Universidad de Antioquia. jcasta@udea.edu.co
Correspondencia: Universidad de Antioquia. Sede de Investigación Universitaria, Calle 62 N°52-59, Torre 2, Lab. 330, Medellín (Colombia).
Subvenciones y apoyos: Comité para el Desarrollo de la Investigación (CODI), Universidad de Antioquia
Resumen
En el presente trabajo se realiza un análisis comparativo de la determinación de NO2 presente en la atmósfera empleando IC y espectrofotometría. Se realizó un muestreo del contaminante empleando captadores pasivos en un ambiente urbano e industrial de la ciudad de Medellín. En una primera etapa, se hicieron muestreos de 1 a 3 meses, mientras que en una segunda etapa los muestreos fueron de 2, 5 y 7 días. Además, se estudiaron 2 tipos de sustancias empleadas en el análisis mediante IC para la extracción del NO2. Particularmente se encontró que la técnica IC tiene un límite de detección más bajo que la técnica de espectrofotometría. Además, se presenta una revisión bibliográfica que incluye la química del NO2, las técnicas empleadas para su cuantificación, ventajas y desventajas de emplear captadores pasivos y los tiempos de exposición y almacenamiento de los mismos.
Palabras claves: Cromatografía iónica, captadores pasivos, espectrofo- tometría, NO2.
Abstract
In the present work a comparative analysis of the determination of NO2 in the atmosphere using IC and spectrophotometry was carried out. A sampling of the pollutant using passive sensors in an urban environment and industrial city of Medellin was made. In a first stage, samplings of 1 to 3 months were realized, while in a second phase sampling of 2, 5 and 7 days were made. In addition, two types of substances used in the analysis by IC for the extraction of NO2 were studied. It was found that the IC technique has a detection limit lower than the spectrophotometry technique. The chemistry of NO2, the techniques used for quantification, advantages and disadvantages of using passive samplers and exposure and storage times are included in the literature review.
Key words: Ion chromatography, NO2, passive samplers, spectro- photometry.
Fecha de recepción: 20 de octubre de 2008
Fecha de aceptación: 24 de marzo de 2009
1. INTRODUCCIÓN
Los óxidos de nitrógeno son un importante indicador de la contaminación del aire, ya que la concentración del NO2 ha sido bien correlacionada con la concentración de monóxido de carbono, partículas de hidrocarburos aromáticos policíclicos y otros contaminantes[1-3]. Además, ha sido demostrado el efecto negativo del NO2 sobre los elementos del patrimonio artístico, pigmentos y fachadas de interiores y exteriores, y su incidencia directa o indirecta en la corrosión atmosférica de algunos metales [4-6]. También está comprobado que cuando las personas son expuestas a este contaminante por un tiempo determinado, pueden contraer graves enfermedades respiratorias [7]. El 88.7% de los óxidos de nitrógeno en la atmósfera son de origen natural y el 11.3% restante es de origen antropogénico. El NO2 es el compuesto más tóxico de los óxidos de nitrógeno. Sus principales fuentes de emisión naturales corresponden a fenómenos de combustión a alta temperatura, mientras que las principales fuentes antropogénicas son automóviles, incineradores, plantas eléctricas y otras actividades industriales que involucran combustión [8].
En la ciudad de Medellín se han reportado concentraciones de NO2 en zonas residenciales de 34 a 53 µg/m3 y de 54 a 90.17 µg/m3 en zonas comerciales e industriales [9], lo que coincide con los rangos de NO2 presentes en atmósferas urbanas que van desde 1.2 a 121.0 µg/m3 [4]. Además, se cree que la concentración mínima que induce corrosión en los metales es alrededor de 30 µg/m3 y los niveles de NO2 relacionados con problemas de salud están cercanos a 9400 µg/m3 [4].
En muchas regiones su concentración relativa ha venido en aumento, por lo cual, desde el punto de vista del deterioro, es importante cuantificar su concentración en diferentes atmósferas para correlacionarla con su incidencia en procesos de corrosión de metales y degradación de materiales poliméricos y pétreos. Para su cuantificación se pueden emplear dos clases de captadores: activos y pasivos. Los captadores activos son empleados para tomar medidas puntuales in situ, mientras que los captadores pasivos son empleados para realizar un monitoreo del contaminante por un período de tiempo determinado. La captación de los mostradores pasivos se basa en la transferencia de masa por difusión o permeación de los contaminantes del aire sobre un medio absorbente. La fuerza impulsora es el gradiente de la concentración entre el aire circundante y la superficie absorbente donde la concentración del contaminante es inicialmente cero [10].
Las técnicas más empleadas y reportadas en la literatura para la determinación del NO2 atmosférico son la espectrofotometría, quimioluminiscencia, conductimetría y fluorescencia ultravioleta [1, 11-13]. Sin embargo, pocos reportes involucran la determinación del NO2 mediante Cromatografía de Intercambio Iónico (IC), a pesar de que presenta algunas ventajas interesantes con respecto a las demás técnicas [14-17].
Por lo anteriormente expuesto, se llevó a cabo este trabajo de investigación con el propósito de optimizar los parámetros involucrados en la determinación de NO2 empleando captadores pasivos e IC, comparar los resultados con los obtenidos por la técnica de espectrofotometría y establecer cuál de las dos técnicas tiene un menor límite de detección. Por otro lado, se estudiaron dos prototipos de sustancias empleadas para la extracción del NO2 con el fin de establecer las ventajas y desventajas que cada una presentaba, para lo cual se emplearon ácido fosfórico y agua. Además, se evaluó el efecto del tiempo de exposición sobre los captadores pasivos.
Principio de funcionamiento de los captadores pasivos
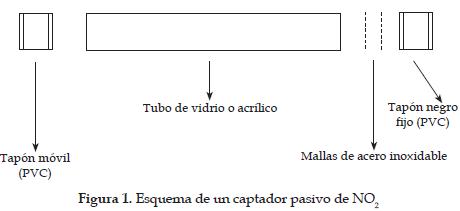
El método de captadores pasivos fue descrito por Palmes y colaboradores en 1973 [18]. El tubo de difusión o captador consiste en un tubo de vidrio (silicato de calcio o potasio) o acrílico (polimetilmetacrilato), abierto por ambos extremos y con las siguientes características: longitud: 0.079 m, diámetro interior: 0.01 m y diámetro exterior: 0.0122 m. Se usa un tapón de PVC fijo (poli vinil cloruro) para sellar uno de los lados del tubo y un tapón móvil en el otro extremo, que se retira durante la exposición, como se muestra en la figura 1. Entre el tapón fijo y el tubo se colocan dos mallas de acero inoxidable BS410 no. 4, de 0.011 m de diámetro.
Para la preparación de los tubos de difusión, las mallas son impregnadas directamente con 0.04 mL de una solución de TEA (trietanolamina) y Brij 35 (polioxietileno-23-lauril éter) al 10% y 0.04%, respectivamente. La trietanolamina actúa como absorbente y el Brij 35 como surfactante encargado de mantener humectado el captador. Inmediatamente termina la impregnación, se coloca el tapón móvil sobre el extremo libre del tubo [19].
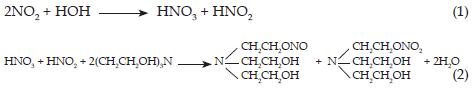
El producto de la reacción de la TEA ha sido tema de múltiples investigaciones a través de los años y todavía no se ha llegado a un acuerdo. En 1972 Leveaggi y colaboradores [20] indicaron que la absorción no tiene que ver con la superficie alcalina de la TEA, pero sí posiblemente respecto a la formación de un ester nitrito, y nitrato y propusieron que la reacción entre el NO2 con la TEA da como resultado trietanolamina nitrito y trietanolamina nitrato mediante el siguiente esquema de reacción:
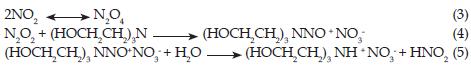
En 1977 Gold y colaboradores [21] encontraron que con altas concentraciones de NO2, el producto de reacción es nitrito y nitrato de trietanolamonio (1:1) y propusieron el siguiente esquema de reacción:
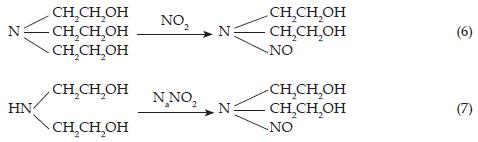
Los resultados de Leveaggi y Gold [20, 21], sin embargo, muestran un factor de conversión de dióxido de nitrógeno a iones nitrito de únicamente 0.5, que es contrario al factor de conversión de 1, observado por Palmes en 1976 [10]. Aoyama y Yashiro en 1983 [22] detectaron nitrosodietanolamina como producto de la reacción, pero no hicieron ningún comentario sobre la falta del grupo trietanol y propusieron el siguiente esquema de reacción:
Palmes y Johnson en 1987 [23] demostraron que la hidratación de la TEA es importante para cuantificar el NO2 presente en la muestra, tal como fue corroborado 12 años después por Glasius y colaboradores [1]. En 1993 Haue-Pedersen y colaboradores [24] también mostraron que al adicionar nitrato a los tubos de difusión pasiva antes del muestreo no se interfiere sobre la reacción TEA-NO2, puesto que el pico correspondiente al NO2 en los cromatogramas de IC no aumenta por la presencia de nitrato. En 1999 Glasius y colaboradores [1] monitorearon el dióxido de nitrógeno en Dinamarca empleando captadores pasivos, y mostraron que los niveles de concentración eran menores a 20 ppb. Ellos propusieron tentativamente que el producto de la reacción entre el dióxido de nitrógeno y la trietanolamina es trietanolamina N-óxido, que está de acuerdo con la estequiometría 1:1 en la conversión de NO2 a iones nitrito. Con base en lo anterior, propusieron el siguiente esquema de reacción:
Los iones hidroxilo en la reacción probablemente provienen de la disociación de la TEA en agua y la reacción, por consiguiente, no toma lugar en aire completamente seco. Esta teoría es soportada por lo observado por Palmes y Johnson en 1987 [10]. Hasta la actualidad este es el esquema de reacción más aceptado por los diferentes autores [1, 11, 25].
Entre las ventajas más relevantes del empleo de captadores pasivos se pueden resaltar [9, 25, 26]: ofrecen flexibilidad (pueden ser ubicados en postes, túneles, parques, etc., dependiendo del objetivo de las medidas); no requieren una fuente de energía ni tampoco calibración o mantenimiento; pueden ser transportados fácilmente antes y después de ser expuestos; presentan bajo costo en su fabricación; son fáciles de operar y todas las partes del captador son reutilizables. Además, son ambientalmente limpios.
Por otro lado, algunas de las desventajas a considerar son: no proveen valores de NO2 en tiempo real; se logran resultados confiables con un período de exposición de una semana, pero no se debe exceder su uso a períodos de más de un mes; la turbulencia inducida en la entrada del tubo disminuye la eficiencia de difusión [27, 28]; hay una sobreestimación a temperaturas menores de 10°C; es menos exacto comparado con los análisis de quimiluminiscencia y las medidas pueden verse afectadas por altos niveles de O3 y NO.
Técnicas para la cuantificación del NO2
Para medir la concentración de NO2 captada por el muestreador in situ se emplean los análisis de quimiluminiscencia (cuyo método se describe en la norma ISO 7996 [29]), que es una técnica de alta sensibilidad y respuesta rápida. Estos análisis son costosos, su funcionamiento es complejo, se requiere de un alto consumo de energía y, además, exige el mantenimiento continuo de un especialista [28]. La determinación se basa en la reducción catalítica del NO2 a NO con la subsiguiente reacción con el ozono, seguido por la detección por quimiluminiscencia [11]. Otro método extensamente empleado, capaz de detectar bajos niveles de concentración de NO2 (ppt), es la reacción de quimiluminiscencia entre el NO2 gaseoso y el Luminol. El sistema es complejo y la instrumentación requerida es costosa debido a la estabilidad limitada del reactivo Luminol. Además, el sistema necesita ser recalibrado constantemente [12]. Una buena alternativa a la quimiluminiscencia son los captadores pasivos, que en teoría proveen una medida acumulativa del NO2 sobre un período de exposición de 1 a 4 semanas.
Sin embargo, la utilización de los captadores ha estado sujeta a algunos debates. En los tubos de difusión se muestra una tendencia a sobreestimar el NO2 cuando se compara con el correspondiente monitoreo continuo por quimiluminiscencia. Se ha sugerido que esto se debe a efectos meteorológicos. Shooter [30] afirma que las mediciones realizadas con tubos de difusión presentan desviaciones del orden del 15% respecto a los métodos convencionales de medición de NO2 atmosférico y que el límite de detección corresponde al equivalente de un muestreo de una semana en una atmósfera que contenga 0.2 ppb del compuesto. Por otra parte, enumera varios factores que pueden incidir en la medición, entre los cuales se incluyen la temperatura, la humedad relativa y la velocidad del aire.
Otras técnicas empleadas para la determinación del NO2 ex situ cuantifican el NO2 como ion nitrito. Entre ellas se destacan: espectrofotometría, cromatografía de intercambio iónico (CI) y fluorescencia.
Cromatografía de intercambio iónico
La cromatografía de intercambio iónico es un método de medida cualitativo y cuantitativo, basado en la separación de los diferente iones; contiene una determinada disolución y los hace pasar a través de una columna de intercambio de iones para medir la señal en los diferentes tiempos de respuesta característicos de cada ión. En CI de alta resolución, la separación de los iones tiene lugar gracias al proceso de intercambio iónico entre la fase móvil y los grupos de cambio enlazados covalentemente a la fase estacionaria. La fase estacionaria es típicamente una resina de baja capacidad con un grupo funcional que posee una carga fija (grupos amonio cuaternario para aniones) y un contraión que la hace eléctricamente neutra [26, 31, 32]. El eluente o fase móvil corresponde a una disolución de carbonato/bicarbonato de sodio.
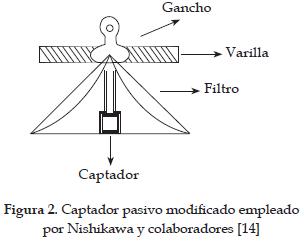
En 1987 Nishikawa y colaboradores [14] emplearon por primera vez la técnica CI. El eluente empleado fue una solución 8 mM de carbonato de sodio y 3 mM de bicarbonato de sodio, a un flujo de 1.7 mL/min. Como supresor emplearon ácido sulfúrico 25 mM. Ellos encontraron que por esta técnica la determinación de NO2 puede verse afectada por otros compuestos como el NO3 o material particulado atrapado en el captador. Para minimizar dichos efectos, los captadores se taparon con papel filtro, como se muestra en la figura 2. Además, los mismos autores realizaron un estudio de cómo afecta la humedad relativa a la velocidad de muestreo, en donde encontraron una relación directamente proporcional.
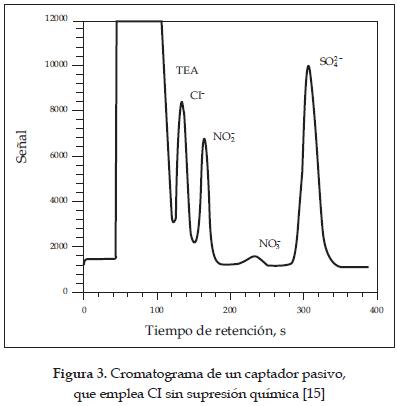
En 1997 Krochmal y colaboradores [15] emplearon CI con y sin supresión química para la determinación simultánea de SO2 y NO2 en el ambiente, con el fin de saber con cual se obtenía un límite de detección más bajo. La extracción de la muestra se efectuaba durante 10 minutos, empleando dos mililitros de agua ultrapura. La mayor diferencia encontrada entre las dos técnicas es que la CI con supresión química tenía límites de detección más bajos. Un serio problema encontrado por los autores fue el largo pico de la trietanolamina que aparece en los cromatogramas (figura 3) cuando no se empleaba supresión química; esto daba como resultado que la señal correspondiente al ion nitrito se situaba en el declive del pico de la TEA, haciendo casi imposible la determinación de nitritos. Finalmente, concluyeron que la reacción alcalina del extracto con la TEA (pH cercano a 10) previene la oxidación de nitrito a nitrato.
Un procedimiento común para obtener la muestra que ha de ser ingresada al cromatógrafo iónico es el siguiente [19]: se coloca el muestreador en posición vertical, de manera que las mallas queden en el extremo inferior. Apoyando adecuadamente el tubo, se le retira el tapón móvil y se adicionan 2.2 mL de agua desionizada, seguida de 2.0 mL de una solución al 6% de H3PO4, que es la especie encargada de realizar la extracción del NO2 de la TEA. Por último, se vuelve a colocar el tapón y se agita varias veces; el contenido del tubo es transferido a la jeringa del cromatógrafo y se lee la concentración de NO2- en partes por millón (ppm).
Espectrofotometría
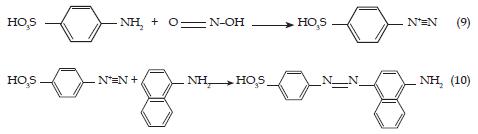
El análisis del NO2 como ion nitrito puede también ser realizado espectrofotométricamente utilizando una variante de la reacción de Griess-Salzman, descrita en la norma ASTM D-1607 [33] y que tiene su equivalente en la norma ISO 6768 [34]. Para el caso del contenido de óxidos de nitrógeno combinados (NO, NO2), se aplica la norma ASTM D-3608-95 [35] que sigue el mismo principio de análisis. El nitrito extraído del captador se hace reaccionar con el ácido sulfanílico para que se produzca la diazotización. La sal de diazonio se mezcla con ∝-Naftilamina para formar el colorante azoico rojo-violeta mediante un mecanismo de complejación, de acuerdo con los reacciones 9 y 10. La determinación espectrofotométrica se realiza con un longitud de onda de 537 nm y la absorbancia obtenida se relaciona con los niveles de NO2 en el ambiente [26].
Algunos de los trabajos publicados sobre este tema emplean esta técnica para la cuantificación del NO2.[1, 36].
Otro método para cuantificar el NO2 mediante la técnica espectrofotométrica se basa en los resultados obtenidos por Glasius y colaboradores [1], como se muestra a continuación [11]:
En la etapa de luminiscencia, el ácido nitroso (HONO) reacciona con el peróxido de hidrógeno para formar el ácido peroxinitroso (HOONO) en medio de ácido sulfúrico, que es inestable, y subsecuentemente es transformado en medio básico a nitrito y oxígeno. El O2 es una especie que emite luz y, por ende, se produce la quimiluminiscencia:
Tratamiento de los resultados
Las concentración de NO2- obtenida bien sea por cromatografía de intercambio iónico o bien por espectrofotometría, se debe someter al siguiente cálculo para así obtener la concentración real de NO2 en la atmósfera evaluada (µg/m3 ) [19].
Donde:
C: concentración en ppm obtenida por CI o espectrofotometría.
4.2: es el volumen total de solución (en mL) empleado en la extracción.
18038: constante que tiene relación con el coeficiente de difusión del NO2 y el cambio de unidades.
t: tiempo de exposición del captador en horas.
Tiempo de exposición
De acuerdo con la literatura consultada, no existe un consenso en cuanto al tiempo de exposición de los captadores pasivos. Leveaggi y colaboradores [20] propusieron que el tiempo de exposición de los captadores pasivos debería ser de máximo 150 horas, es decir, 6.25 días debido al tiempo de vida relativamente corto que tiene el absorbente. Arroyave [3] propuso una semana como tiempo normal de exposición, pero 2 o 3 días pueden ser suficientes en áreas urbanas, mientras que en áreas rurales y remotas es necesario muestrear por más tiempo. Además, propone que modificando la longitud del tubo captador se puede evitar el problema de agotamiento de la sustancia captadora en atmósferas de alta contaminación o durante períodos de exposición prolongados. Varshney et ál. [25] consideran como un tiempo prudente de exposición de 1 a 4 semanas y en otros trabajos, hechos en diferentes países donde se monitorea el NO2 como contaminante, se toma esta misma cantidad de tiempo [1, 3, 15, 16, 28].
Los tubos de difusión deben siempre ser almacenados en un refrigerador para minimizar la difusión del NO2 a través de los tubos, mientras que el tiempo de almacenamiento debe ser menor a un año antes de la exposición y menos de cinco meses después de haber sido expuestos [25].
En los apartados siguientes se presentan los resultados obtenidos en la cuantificación del NO2 empleando captadores pasivos en dos puntos de la ciudad de Medellín que representan una atmósfera urbana y otra industrial. La determinación del contaminante se hizo mediante espectrofotometría y cromatografía de intercambio iónico para evaluar la correlación entre los resultados obtenidos por ambas técnicas y valorar las ventajas y desventajas de cada una.
2. METODOLOGÍA
Los captadores pasivos se expusieron en dos sitios de la ciudad: la Universidad de Antioquia (U. de A.), cuyo entorno corresponde a una atmósfera urbana, y la universidad EAFIT, que corresponde a una atmósfera industrial.
La exposición en campo se hizo durante 3 meses de la siguiente manera: se prepararon 36 captadores pasivos, de los cuales 18 se colocaron en la U. de A. y 18, en EAFIT. Pasado el primer mes, se retiraron 6 captadores de cada estación (12 en total). De los 6 captadores retirados de cada estación, 4 se analizaron por CI y 2 por espectrofotometría. Igual procedimiento se hizo pasados el segundo y tercer mes. Es decir, los tiempos de exposición evaluados fueron 720, 1440 y 2160 horas, respectivamente.
En este trabajo en particular, la cuantificación del NO2 se llevó a cabo usando CI y espectrofotometría; la extracción para la determinación por CI fue realizada empleando 4.2 mL de agua desionizada, con un período de extracción de una hora. La reacción alcalina del extracto debido a la presencia de la trietanolamina (pH cercano a 10) previene la oxidación de nitritos a nitratos [15, 37]. Para el análisis del nitrito (NO2-) se empleó un cromatógrafo iónico Metrohm IC 761, con una columna 6.1006.100 Metrosep Anion Dual 2 cuyo relleno es de metil metacrilato con grupos amonio cuaternario y un detector conductimétrico. Como supresor químico se empleó una solución 50 mM de H2SO4 y como fase móvil, una solución buffer de carbonato/bicarbonato (2 mM NaHCO3/1,3 mM Na2CO3). Se empleó un flujo de 0.8 mL/min.
Con base en los resultados obtenidos en el estudio preliminar, se decidió evaluar la efectividad de los captadores en períodos de tiempo más cortos, por lo cual se expusieron captadores pasivos durante 2, 5 y 7 días. Para este ensayo se ubicaron 12 captadores pasivos en la Universidad de Antioquia y se retiraron captadores en grupos de 4 durante los períodos mencionados.
3. RESULTADOS Y DISCUSIÓN
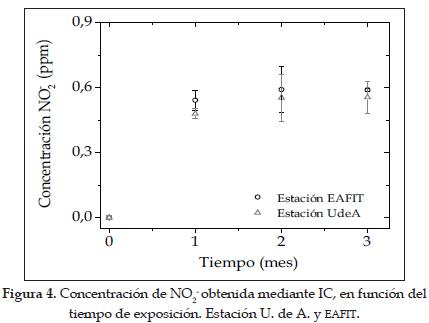
Exposición de captadores hasta 3 mesesEn la figura 4 se ilustra la concentración de ion nitrito (NO2-) en función del tiempo de exposición de los captadores pasivos obtenida mediante CI. Para ambas estaciones (EAFIT, U. de A.) se puede observar que la concentración de nitrito aumenta rápidamente durante el primer mes, pero luego tiende a estabilizarse.
Además, se puede apreciar que la concentración de nitrito encontrada en la estación industrial (EAFIT), no es significativamente mayor que en la estación urbana (U. de A.), aunque tiende a ser ligeramente mayor.
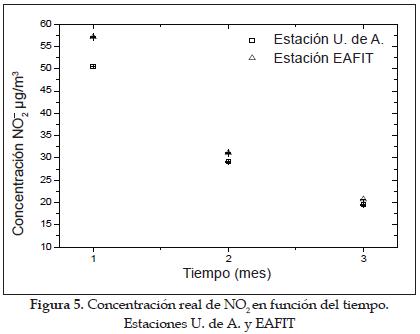
La figura 5 muestra el comportamiento de la concentración real de dióxido de nitrógeno en función del tiempo. En ambas estaciones se observa que la concentración de NO2 está disminuyendo con el tiempo, cuando se esperaba que esta aumentara o permaneciera aproximadamente constante, pues los tiempos estudiados son acumulativos.
Este comportamiento se debe a que cuando se emplea la ecuación (1) para transformar la concentración del ion NO2- a concentración real de NO2, dicha expresión está dividida por el tiempo y este valor se incrementa considerablemente de un mes a otro, mientras que la concentración de NO2- experimenta pocas variaciones, haciendo que la concentración de NO2 tenga un valor cada vez más pequeño.
De acuerdo con lo anterior se puede inferir que el método de captadores pasivos utilizado es sólo válido para establecer comparaciones entre tiempos de exposición iguales. Sin embargo, no es válido para comparar la deposición de NO2 en, por ejemplo, 3 meses, con la suma de las deposiciones medidas mes a mes durante el mismo período. Al parecer, en tiempos de exposición mayores que un mes el captador se satura y la solución absorbente tiende a agotarse, por lo cual el dispositivo ya no capta más el NO2 presente en el ambiente. Entonces se deduce que en ambientes urbanos e industriales con contenidos de NO2 significativos, este método debe ser empleado solo para tiempos de exposición cortos, y que si se quiere hacer un muestreo para un período mayor, se debe modificar la construcción del captador (es decir, variar la longitud y el diámetro del mismo y la cantidad de solución absorbente empleada), de acuerdo con lo recomendado por Arroyave y otros [3, 25].
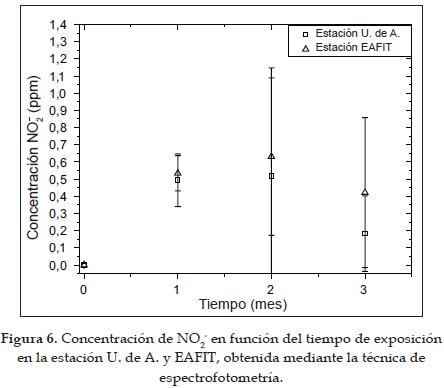
Los resultados obtenidos por la técnica de espectrofotometría para ambas estaciones se muestran en la figura 6. Tanto para la estación U. de A. como para la estación EAFIT la concentración del NO2 en el tercer mes tiende a disminuir. Como se mencionaba anteriormente, se esperaría que la concentración de nitritos aumente y luego tienda a estabilizarse cuando el captador se satura o la solución absorbente se agota. En las dos estaciones, los datos obtenidos a partir del segundo mes presentan una alta dispersión.
Según los resultados anteriores, con la técnica de cromatografía de intercambio iónico se obtuvo una menor dispersión que con la técnica de espectrofotometría, aunque cabe anotar que esta dispersión no necesariamente puede ser debida a la técnica, sino, también, a factores meteorológicos tales como la turbulencia del viento en la entrada del captador, el material particulado presente en el ambiente y/o la posición del captador, que pueden influir en la llegada de más o menos NO2.
Exposición de captadores hasta 7 días
Con base en lo anterior se decidió evaluar la efectividad de los captadores en períodos de tiempo cortos, para lo cual se expusieron captadores pasivos durante 2, 5 y 7 días. Para este ensayo se ubicaron 12 captadores pasivos en la terraza del bloque 20 de la Universidad de Antioquia y se retiraron grupos de 4 captadores en los períodos de tiempo mencionados.
Además, con el fin de analizar la influencia del tipo de sustancia que se utiliza para la extracción del ion nitrito (NO2-) en el captador, así como las ventajas y desventajas del uso de una u otra, se emplearon dos clases de sustancias diferentes: ácido fosfórico (H3PO4) y agua, seleccionadas según lo reportado por la literatura [15, 19].
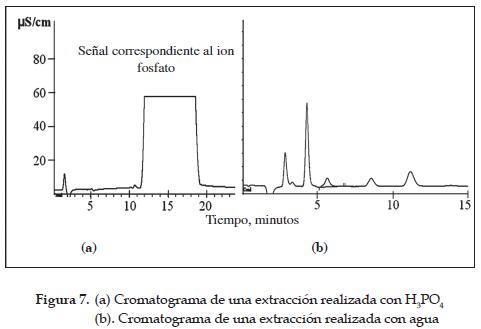
De los 4 captadores retirados a los dos días, a dos de ellos se les realizó la extracción con H3PO4 y a los dos restantes con agua. Igual procedimiento se hizo en el quinto y séptimo día. En los casos en los que se realizó la extracción de la muestra con H3PO4, no se pudo llevar a cabo la lectura por cromatografía de intercambio iónico, ya que la señal correspondiente al ion fosfato es demasiado grande y con una alta concentración. Esto no es recomendable para la columna de separación cromatográfica, debido al deterioro que puede sufrir al trabajar con muestras ácidas tan concentradas. Para poder realizar la lectura de la muestra sin que la columna se viera afectada, sería necesario diluirla, pero cada que se realizare una dilución, el error en la medida se incrementaría notoriamente en un orden similar al de las variaciones que se esperaban en la concentración del ion NO2- y esto haría que las concentraciones halladas tuviesen un margen de error grande, debido a que las variaciones en las medidas son demasiado pequeñas. En la figura 7(a) se muestra un cromatograma típico de un blanco donde la extracción se realizó con H3PO4. Se observa claramente el problema mencionado anteriormente. En la figura 7(b) se muestra el cromatograma de una extracción realizada con agua, en el cual los picos se diferencian adecuadamente.
Con base en lo anterior se puede decir que la extracción del NO2 con ácido fosfórico no es conveniente y es mejor emplear el agua para llevar a cabo este proceso. Además, el uso del agua representa menores costos y riesgos, así como menor contaminación.
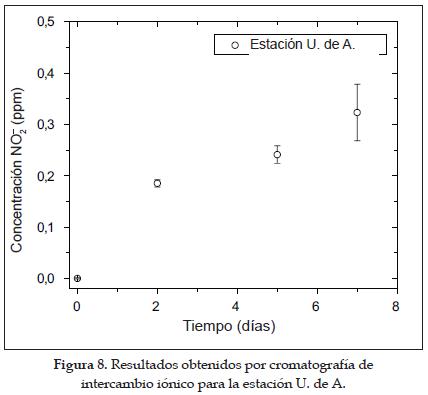
Los resultados obtenidos para los períodos de exposición de 2, 5 y 7 días por la técnica de cromatografía iónica empleando agua para la extracción se muestran la figura 8. Como se puede observar, en un período de hasta una semana todavía no se ha alcanzado la saturación del captador en la estación estudiada, ya que la concentración de NO2- va aumentando, aunque tiende a estabilizarse. Así se puede concluir que en un ambiente urbano con una contaminación de NO2 entre media y alta (de 34 a 53 µg/m3 en zonas residenciales y de 54 a 90.17 µg/m3 en zonas comerciales e industriales [9]), como es el caso de Medellín, una semana de exposición es un período de tiempo prudente para el muestreo con base en las características de construcción actuales del captador y para garantizar también que la concentración de NO2 captada es confiable.
4. CONCLUSIONES
La técnica de cromatografía de intercambio iónico presenta algunas ventajas sobre la de espectrofotometría para el análisis de captadores pasivos, ya que los reactivos empleados en IC son mucho más económicos que los empleados en espectrofotometría; además, se requiere una menor cantidad de muestra.
El método de captadores pasivos de NO2 es solo útil para establecer comparaciones en un mismo rango de tiempo. No es efectivo para realizar análisis en tiempos acumulativos a partir de una semana de exposición en atmósferas con un nivel de contaminante entre medio y alto.
A medida que se incrementa el tiempo de exposición, el error en los datos también se incrementa considerablemente; esto puede obedecer a una mayor variabilidad en los resultados obtenidos, causada por factores meteorológicos tales como la turbulencia del viento en la entrada del captador, el material particulado presente en el ambiente, la ubicación del captador, entre otros.
Comparando los resultados obtenidos para la estación EAFIT y para la estación U. de A., se observa que no hay una diferencia significativa en cuanto a la concentración del contaminante (NO2) en estos dos sitios de la ciudad de Medellín, aunque para la estación EAFIT es un poco mayor.
La extracción del nitrito (NO2-) es más efectiva y menos costosa empleando agua que ácido fosfórico; así mismo es menos contaminante porque genera menos residuos.
Si se quiere cuantificar el dióxido de nitrógeno atmosférico en ambientes urbanos e industriales con contenidos de NO2 significativos en tiempos mayores que una semana, se debe modificar la construcción del captador, variando su longitud y diámetro y la cantidad de solución absorbente empleada.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al CODI y al Grupo de Corrosión y Protección por la financiación de este proyecto.
REFERENCIAS
[1] M. Glasius, M. F. Carlsen, TS Hansen, C. Lohse, "Measurements of nitrogen dioxide on funen using diffusion tubes", Atmospheric Environment, vol. 33, pp. 1177-1185, 1999. [ Links ]
[2] J.G. Castaño, "Efecto del NO2 en la corrosión atmosférica del zinc". Tesis doctoral, 2001. [ Links ]
[3] C. Arroyave, "Importancia del NOX en la corrosión atmosférica del acero". Tesis doctoral, 1994. [ Links ]
[4] C. Arroyave, M. Morcillo, "The effect of nitrogen oxides in atmospheric corrosion of metals", Corrosion Science, vol. 37, pp. 293 - 305, 1995. [ Links ]
[5] F. Mansfeld, SL Jeanjaquet, MW Kendig, DK Roe, "A New atmospheric corrosion rate monitor - development and evaluation", Atmospheric Environment, vol. 20, pp. 1179-1192, 1986. [ Links ]
[6] S. Oesch, M. Faller, "Environmental effects on materials: The effect of the air pollutants SO2, NO2, NO and O3 on the corrosion of copper, zinc and aluminium. A short literature survey and results of laboratory exposures", Corrosion Science, vol. 39, pp. 1505-1530, 1997. [ Links ]
[7] C.Y.H. Chao, A. Law, "A study of personal exposure to nitrogen dioxide using passive samplers", Building and Environment, vol. 35, pp. 545-553, 2000. [ Links ]
[8] X. Domenech, Química de la contaminación. Maraguano ediciones, 1999, pp. 158-159. [ Links ]
[9] C. Arroyave, F. Echeverría, F. Herrera, J. Delgado, D. Aragón, M. Morcillo, "NO2 Measurements in atmospheric corrosion studies", Outdoor atmospheric corrosion, pp. 88-101, 2001. [ Links ]
[10] E. Palmes, A. Gunnison, J. DiMattio, C. Tomczyk, "Personal sampler for nitrogen dioxide", American Industrial Hygeine Association Journal, vol. 37, pp. 570-577, 1976. [ Links ]
[11] Y. Wang, S-H. Fan, S-L. Wang, "Chemiluminescence determination of nitrogen oxide in air with a sequential injection method", Analytica Chimica Acta. vol. 541, pp. 129-134, 2005. [ Links ]
[12] M.J. Navas, A.M. Jiménez, G. Galán, "Air analysis: determination of nitrogen compounds by chemiluminescence", Atmospheric Environment, vol. 31, pp. 3603-3608, 1997. [ Links ]
[13] X-Q. Zhan, D-H. Li, H. Zheng, J-G. Xu, Y-Q. Zhou, "Fluorimetric determination of nitrogen oxides in the air by a novel red-region fluorescent reagent", Talanta, vol. 58, pp. 855-860, 2002. [ Links ]
[14] Y. Nishikawa, K. Taguchi, "Ion chromatographic determination of nitrogen dioxide and sulphur dioxide in the atmosphere using tri- ethanolaminepotassium hydroxide-coated cartridges", Journal of Chromatography, vol. 396, pp. 251-259, 1987. [ Links ]
[15] D. Krochmal, A. Kalina, "A method of nitrogen dioxide and sulphur dioxide determination in ambient air by use of passive samplers and ion chromatography", Atmospheric Environment, vol. 31, pp. 3473-3479, 1997. [ Links ]
[16] D. Krochmal, A. Kalina, "Measurements of nitrogen dioxide and sulphur dioxide concentrations in urban and rural areas of poland using a passive sampling method", Environmental pollution, vol. 96, pp. 401-407, 1997. [ Links ]
[17] H. Plaisance, A. Piechocki-Minguy, S. García-Fouque, JC. Galloo, "Influence of meteorological factors on the NO2 measurements by passive diffusion tube", Atmospheric Environment, vol. 38, pp. 573-580, 2004. [ Links ]
[18] E. Palmes, A. Gunnison, "Personal monitoring device for gaseous contaminants". American Industrial Hygeine Association Journal, vol. 34, pp. 78-81, 1973. [ Links ]
[19] J. Rocha, Productos electro-electrónicos en ambientes tropicales. CYTED, 2003. [ Links ]
[20] D. Levaggi, W. Siu, M. Feldstein, "Quantitative separation of nitric oxide from nitrogen dioxide at Atmospheric Concentration Ranges", Environmental Science and Technology vol. 6, pp. 250-252, 1972. [ Links ]
[21] A. Gold, "Stoichiometry of nitrogen dioxide determination in triethanolamine trapping Solution", Analytical Chemistry, vol. 49, pp. 1448-1450, 1977. [ Links ]
[22] T. Aoyama, T. Yashiro, "Analytical Study of low concentration gases, IV. Investigation of the reaction by trapping of nitrogen dioxide in Air Using the Triethanolamine Method", Journal of Chromatography, vol. 265, pp. 69-78, 1983. [ Links ]
[23] E. Palmes, E. Johnson, "Explanation of pressure effects on a nitrogen dioxide sampler". American Industrial Hygiene Association Journal, vol. 48, pp. 73-76, 1987. [ Links ]
[24] H. Haue-Pedersen, U. Hansen, CL Knudsen, KU Skov, "Measurements of NO2 by Passive Sampling", 6th European Symposium. Physico-Chemical Behaviour of Atmospheric Pollutants Congress Centre Villa Ponti, Varese, Italy, 18-22, Oct. 1993. [ Links ]
[25] C.K. Varshney, A.P. Singh, "Passive Samplers for NOx Monitoring: A Critical Review". The Environmentalist, vol. 23, pp. 127-136, 2003. [ Links ]
[26] J.M.D. Saborit, J. María, "Validación e implementación de técnicas de captación pasiva para el estudio de los niveles y efectos de ozono troposférico y dióxido de nitrógeno en un área costera mediterránea". Universitat Jaume I, 2005. [ Links ]
[27] G.W. Campbell, J.R. Stedman, K. Stevenson, "A survey of nitrogen dioxide concentrations in the United Kingdom using difusion tubes, July-December 1991", Atmospheric Environment, vol. 28, pp. 477-486, 1994. [ Links ]
[28] M.R. Heal, M.A. O Donoghue, J.N. Cape, "Overestimation of urban nitrogen dioxide by passive diffusion tubes: a comparative exposure and model study", Atmospheric Environment, vol. 33, pp. 513-524, 1999. [ Links ]
[29] International Organization for Standardization-ISO 7996:1985 I, Ambient air, Determination of the mass concentration of nitrogen oxides -Chemiluminescence method. Chicago: Thomson, 1985. [ Links ]
[30] D. Shooter, "Nitrogen Dioxide and its determination in the atmosphere: A simple method for surveying ambient pollution concentrations", Journal of Chemical education, vol. 70, pp. 133-140, 1993. [ Links ]
[31] P. Montoya, J.G. Castaño, "Validación de un método cromatográfico y determinación de sulfatos en productos de corrosión atmosférica del zinc expuesto en ambientes de SO2 y NO2", Revista Facultad de Ingeniería, vol. 33, pp. 84-96, 2005. [ Links ]
[32] P. Montoya, "Validación de un método cromatográfico para la determinación de sulfatos en productos de corrosión atmosférica del zinc expuestos en ambientes de SO2 y NO2", Tesis de pregrado, 2003. [ Links ]
[33] ASTM, D. 1607 Standard test method for nitrogen dioxide content of the atmosphere Griess-Saltzman reaction, 2005. [ Links ]
[34] International Organization for Standardization-ISO 6768:1998 I: Ambient air - Determination of mass concentration of nitrogen dioxide - Modified Griess-Saltzman method. Chicago: Thomson, 1998. [ Links ]
[35] ASTM, D3608 Standard Test Method for Nitrogen Oxides (Combined) Content in the Atmosphere by the Griess-Saltzman Reaction, 2005. [ Links ]
[36] K. Carolin, "Reliability of nitrogen dioxide passive diffusion tubes for ambient measurement: in situ properties of the triethanolamine absorbent". Journal of Environmental Monitoring, pp. 307-312, 2000. [ Links ]
[37] D. Krochmal, L. Gorski, "Determination of nitrogen dioxide in ambient air by use if a passive sampling technique and triethanolamine as absorbent", Environmental Science and Technology, vol. 25, pp. 531-535, 1991. [ Links ]