Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería y Desarrollo
Print version ISSN 0122-3461On-line version ISSN 2145-9371
Ing. Desarro. no.27 Barranquilla Jan./June 2010
ARTÍCULO CIENTÍFICO / RESEARCH ARTICLE
Remediación de suelos contaminados con mercurio utilizando guarumo (Cecropia peltata)
Remediation of contamined soil with mercury using the guarumo (Cecropia peltata) trees
Jhon Víctor Vidal Durango*
Universidad de Sucre (Colombia)
José Luis Marrugo Negrete**
Universidad de Córdoba (Colombia)
Beatriz Jaramillo Colorado ***
Universidad de Cartagena (Colombia)
Libia María Perez Castro****
Universidad de Sucre (Colombia)
* Ingeniero Químico, Universidad del Atlántico. MsC Ciencias ambientales, Universidad de Cartagena. Docente Universidad de Sucre (Colombia), Facultad de Educación y Ciencias. johnvidavi@yahoo.com
Correspondencia: Carrera 24H N.° 9A-35, Sincelejo (Colombia).
** Ph.D Ciencias Químicas, Universidad de Córdoba (Colombia), Docente de planta, Universidad de Córdoba. jlmarrugon@yahoo.com
*** Ph.D Ciencias Químicas de la UIS. Docente de planta, Universidad de Cartagena (Colombia). beatrizjaramilloc@yahoo.com
**** Bióloga con énfasis en Biotecnología. Estudiante Maestría Ciencias ambientales, SUE Caribe. libiamariaperez@hotmail.com.
Fecha de recepción: 17 de julio de 2009
Fecha de aceptación: 07 de mayo de 2010
Resumen
La contaminación de suelos por el mercurio resultante de la explotación aurífera puede ser remediada mediante la utilización de plantas que lo acumulan en sus tejidos, disminuyendo su impacto sobre los ecosistemas y la salud humana. En este trabajo se determinó la influencia del grado de contaminación, la aplicación de ácido cítrico y tiempo de crecimiento del guarumo, sobre la tasa de remoción de mercurio en suelo. Después de 4 meses de crecimiento, los porcentajes de remoción estuvieron entre 15.7% y 33.7% debido a la capacidad del guarumo para acumular grandes cantidades del metal sin presentar efectos tóxicos considerables, así como al alto contenido de mercurio biodisponible en los suelos contaminados, lo que conllevó también a que el ácido cítrico no tuviera una influencia significativa sobre la recuperación de Hg; por lo cual se concluyó, que el guarumo es una especie con capacidad fitorremediadora.
Palabras clave: Cecropia peltata, fitorremediación, acido cítrico, hiperacumuladoras, metales pesados.
Abstract
Soil pollution by mercury resulting from gold mining, can be remedied by using plants that accumulate this metal in their tissues, reducing their impact on ecosystems and human health. In this study, the influence of the degree of contamination, the application of citric acid and growth time of Cecropia peltata, on the rate of removal of mercury in soil was determined. After 4 months of growth, removal rates were between 15.7 and 33.7%, due to the capacity of Cecropia peltata to accumulate large quantities of metal without substantial toxic effects and to the high content of bioavailable mercury present in contaminated soils, which also caused that the citric acid had no significant influence on the Hg recovery which led to the conclusion that the guarumo is a species with phytoremediation capacity.
Keywords: Citric acid, Cecropia peltata, phytoremediation, phytotoxicity, hyperaccumulator, heavy metals
1. INTRODUCCIÓN
Los metales pesados como el mercurio (Hg) son un problema creciente de contaminación ambiental a nivel mundial [1]; este puede encontrarse en suelos de forma natural o debido a actividades antrópicas, como la explotación aurífera [2]. En Colombia, la cantidad de Hg liberado al ambiente, en este tipo de actividad minera, se ha estimado entre 80 y 100 toneladas al año [3] y por ello existe una gran cantidad de zonas altamente contaminadas que necesitan ser rehabilitadas. Una vez en el suelo, este contaminante puede transformarse en especies más tóxicas [4], [5], ingresar a la cadena trófica y, finalmente, llegar al hombre [6] y generar graves problemas neurológicos y de teratogénesis [7]-[9].
Para remediar suelos contaminados con mercurio se han diseñado tecnologías físicas de tratamiento como la excavación, fijación y lixiviación, pero presentan costos elevados y además contribuyen con el deterioro del sitio tratado [10]. En contraste existen plantas que en forma natural pueden establecerse en medios contaminados con metales pesados y acumularlos en sus tejidos o transformarlos a especies químicas menos tóxicas [11]-[13]. Estas propiedades se vienen aprovechando en una técnica llamada fitorremediación, que es la utilización de plantas para remover, acumular e inactivar contaminantes [14]-[16].
El mercurio en el suelo se encuentra fuertemente asociado a la materia orgánica, especialmente a los grupos SH- contenidos en esta; de igual forma, con los ligandos OH- y Cl- y los minerales arcillosos [17], por lo tanto la captación por parte de las raíces de las plantas depende de su disponibilidad en el suelo, que se encuentra determinada por factores fisicoquímicos como temperatura, humedad, pH, permeabilidad y presencia de aceptores de electrones [18]. Para aumentar la disponibilidad del mercurio en el suelo se utilizan una serie de sustancias químicas que lo liberan, sea por formación de complejos o debido a atracción intermolecular, entre las cuales están los agentes quelantes, como el ácido cítrico y EDTA [19] y sustancias que pueden competir con la materia orgánica por el mercurio, como el tiosulfato de sodio y de amonio [2].
A pesar de que los pastos son el género más utilizado para fitorremediación [20], [21], también se pueden emplear especies maderables debido a que pueden disminuir la concentración de mercurio en suelos contaminados y reforestar zonas erosionadas con historial minero, donde se desarrollan pocas plantas debido a la alta toxicidad generada por este metal pesado [22]. En tal sentido, en la franja de explotación aurífera colombiana, ubicada entre el norte de Antioquia y sur de Bolívar [23], es abundante la presencia de árboles de guarumo (Cecropia peltata), que es un árbol pionero que nace en suelos poco fértiles, es de rápido crecimiento y genera una considerable biomasa en corto tiempo [24]; características que pueden ser útiles para su empleo como planta remediadora.
El objetivo de este estudio es evaluar la capacidad del guarumo (Cecropia peltata) como planta fitorremediadora de suelos contaminados con mercurio del municipio de Barrranco de Loba, sur de Bolívar, y se tiene como variables independientes: el grado de contaminación del suelo, el tiempo de crecimiento de la planta y la aplicación de ácido cítrico como agente quelante.
2. METODOLOGÍA
Sitio y tipo de estudio. Esta investigación se desarrolló en un invernadero de la ciudad de Sincelejo, en las instalaciones de la Universidad de Sucre.
Diseño experimental. Se trabajó en condiciones controladas sobre un diseño factorial que tenía como variable de respuesta la concentración de mercurio total (HgT) en suelo y tejidos, y como factores: el grado de contaminación del suelo (3 niveles: suelo más contaminado, suelo menos contaminado, suelo control), la aplicación de un agente quelante (ácido cítrico) para liberar Hg del suelo (2 niveles: aplicación y no aplicación) y el tiempo de crecimiento de la planta (4 niveles: mes 1, mes 2, mes 3 y mes 4). El tratamiento control consistió en las plantas sembradas en un suelo sin historial minero (muy baja concentración de Hg), con el propósito de establecer las diferencias en los rasgos fitotóxicos con las plantas expuestas a altas concentraciones de Hg, puesto que en las plantas sembradas en el suelo control no se generan tasas considerables de acumulación ni remoción del metal del suelo. El número de repeticiones (plantas) por combinación de niveles de factores fue de 5, por lo que se sembraron 40 plántulas de guarumo en cada uno de los suelos de manera aleatoria.
Las muestras vegetales fueron tomadas mensualmente hasta cumplir 4 meses de crecimiento y llevadas al laboratorio para la determinación de Hg T. Asimismo, se determinó la concentración de HgT y biodisponible en los suelos, antes y después del crecimiento de las plantas en el periodo establecido para determinar el porcentaje de remoción del contaminante del suelo.
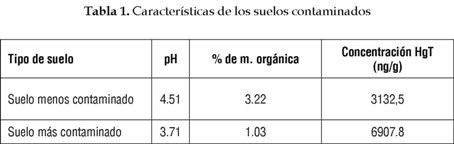
Población, unidad experimental y muestra. La población en este estudio es el total de bolsas que contienen las plántulas de Cecropia peltata sembradas en los suelos contaminados, y la unidad experimental es cada una de esas bolsas. Las muestras de suelo más y menos contaminadas se tomaron a los 8° 42' 42,9'', 8° 42' 42,4", latitud Norte y 74° 42' 15,8'', 74° 17' 53,5" longitud Occidente, respectivamente, en el municipio de Barranco de Loba, sur de Bolívar. Las concentraciones de HgT, porcentaje de materia orgánica y pH de los suelos colectados son los siguientes:
Siembra de plántulas. Inicialmente se germinaron las semillas en un suelo libre de Hg y se trasplantaron 80 plántulas de guarumo individualmente en 0.6 Kg de suelo (unidad experimental) y se llevaron a un invernadero de 5 x 4 m, ubicado en las instalaciones de la Universidad de Sucre, a condiciones normales, donde evitaron gradientes de luz y temperatura.
Seguimiento al crecimiento. Todas las plantas se regaron dos veces al día con agua de grifo a tres cuartos de su capacidad de campo y se realizó un seguimiento de las características morfológicas como longitud de la planta, número de hojas, abscisiones, número de hojas con clorosis y necrosis, para identificar posibles efectos tóxicos generados por los suelos contaminados con Hg sobre las plantas de Cecropia peltata. La comparación se realizó con plantas de guarumo sembradas en un suelo control, que se colectó en inmediaciones de los terrenos de la Universidad de Sucre, el cual posee una concentración de Hg T, pH y % de materia orgánica de 513.8 ng/g, 7.01, y 3.15, respectivamente.
Análisis de laboratorio. El proceso de digestión de las muestras se realizó con una mezcla de ácidos nítrico y sulfúrico durante tres horas a 100-110 °C. El análisis de mercurio total se realizó empleando espectroscopia de absorción atómica mediante la técnica de vapor frío descrita en [2].
Análisis de resultados. Los datos de concentración de HgT en ng/g peso seco en suelos, raíces, tallos y hojas se presentan como media +/- error estándar. Para el análisis estadístico de los datos se aplicaron inicialmente las pruebas de normalidad (Kolmogorov-Smirnov) y el test de homogeneidad de varianza de Bartlett. Posteriormente, se aplicaron anovas factoriales para determinar la influencia de los factores sobre las variables dependientes, utilizando el software Statgraphics centurión version 15.2.06. También se realizaron Anovas en una vía para la evaluación de la cinética de acumulación, empleando el software Instat 3.05.
3. RESULTADOS Y DISCUSIÓN
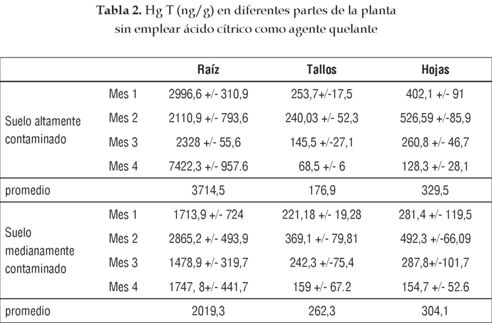
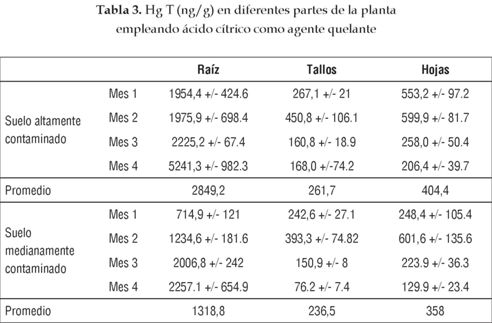
Como se muestra en las tablas 2 y 3, la parte de la planta que más acumula mercurio es la raíz, seguida de las hojas y finalmente el tallo. Este comportamiento se debe a que las raíces están expuestas directamente al mercurio presente en el suelo, y sobre ellas se adhiere una gran cantidad de Hg en las paredes celulares para así evitar efectos tóxicos en las partes superiores de la planta, en especial el desarrollo de necrosis y clorosis en hojas. Este proceso se realiza a través de la secreción de fitosideróforos, tales como las fitoquelatinas, a las cuales se une fácilmente el mercurio por su contenido de aminoácidos azufrados como cisteína, haciéndolo no disponible para su translocación al tallo, como lo indican Cobbett [25] y Thumann et al. [26].
La mayor concentración en hojas que en tallos se debe a que las primeras son el receptor final del metal en la planta; allí cambia su estado de oxidación de Hg2+ a Hgo, es fitoquelado y acumulado en las vacuolas como mecanismo de resistencia tóxica, como lo establece Moreno et al [2]. Además, las hojas también pueden capturar el Hgo presente en el aire por medio de sus estomas. Sin embargo, se destaca que las hojas se renuevan continuamente, lo que conlleva a que la concentración de las nuevas sean diferentes a la de las antiguas. Asimismo, gran parte del metal que llega a las hojas es fitovolatilizado, lo que implica que no todo el contaminante que llega a esta parte de la planta es acumulado en ella. Por otra parte, la baja concentración en tallo se debe a que este no tiene como propósito acumular el metal, más bien su función es transportarlo a las partes altas de la planta; además, la misma retención ocasionada por las raíces limita el transporte del Hg hacia estos tejidos y por ende la concentración de Hg que se pueda encontrar en los tallos.
Las concentraciones de HgT en Cecropia peltata son más altas que las encontradas en un gran número de especies presentes en sitios altamente contaminados alrededor del mundo. Un caso específico es el distrito minero de Almaden, España, que a pesar de que el suelo tiene en promedio 330 mg Hg T/Kg [27], mucho más alta de la considerada en este estudio, alrededor de la mitad de las especies de plantas presentes tienen menor concentración y biomasa que el guarumo. Además, la Cecropia peltata presentó concentraciones cercanas a plantas denominadas hiperacumuladoras como Brassica juncea, aunque esta última se evaluó en suelos con contenido de HgT menores que los de este estudio. Sin embargo, la Brassica juncea presenta menor biomasa que la del guarumo. Esto nos indica que los comparativos entre plantas acumuladoras requieren de una valoración más completa que incluya la concentración de mercurio total, biodisponible, características edáficas y fisicoquímicas del suelo. Sin embargo, se puede establecer que el guarumo es una planta significativamente acumuladora de Hg, debido a la alta concentración del contaminante en una mayor biomasa que en comparación de otras plantas acumuladoras, y a que no presentó efectos fitotóxicos considerables tanto en laboratorio como en campo.
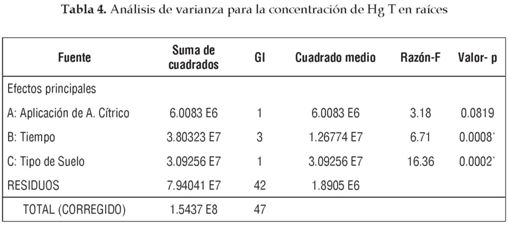
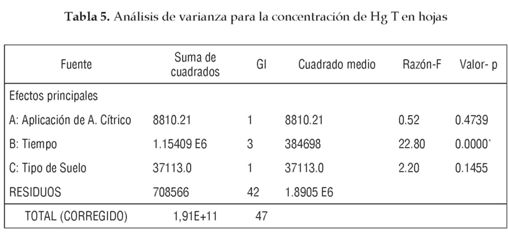
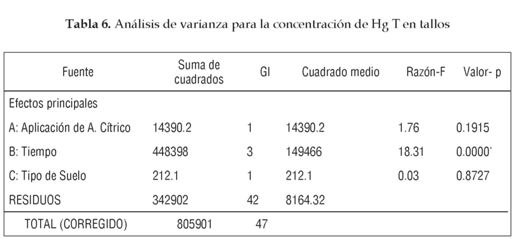
Para determinar la Influencia del grado de contaminación del suelo, la presencia de ácido cítrico como agente quelante y el tiempo de crecimiento de la planta sobre la concentración de Hg T en las diferentes partes de la planta se realizó un Anova factorial, cuyos resultados se muestran en las tablas 4, 5 y 6.
La aplicación de ácido cítrico no contribuye al incremento en la concentración de Hg en las diferentes partes de la planta; esto se debe en gran medida a que un alto porcentaje del Hg se encuentra biodisponible gracias a la contaminación continua con Hg° generada en los procesos de amalgamación de oro realizada en mina de estudio, al bajo pH de los suelos que facilita la movilidad del contaminante y a la poca concentración de materia orgánica que provoca una disminución de transformaciones que aten con mayor intensidad las especies de mercurio al suelo. Además, las condiciones climáticas que implican alta humedad y temperatura presentes en el sur de Bolívar favorecen la mineralización del ácido cítrico y por ende su acción quelante.
Cafer et al. [28] determinó incrementos de acumulación de HgT en Helianthus annuus de sólo 0.65 mg en su ciclo de crecimiento, empleando concentraciones similares de ácido cítrico a las utilizadas en este estudio, lo que indica que las características ambientales y del suelo determinan la influencia del quelante sobre la tasa de remediación. Además, el mismo autor reportó efectos fitotóxicos como disminución de las tasas de crecimiento y generación de biomasa al emplear concentraciones mayores de 1g/Kg de suelo.
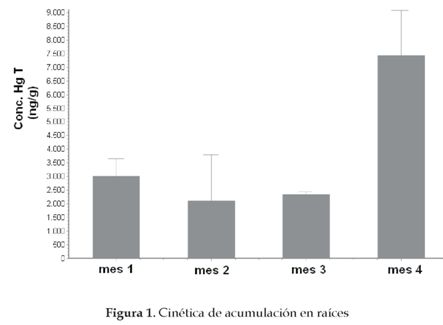
La cinética de acumulación de mercurio en raíces indica que en el cuarto mes de crecimiento de las plantas hay diferencias estadísticamente significativas (P < 0.01) con respecto a la concentración de HgT en los tres meses anteriores (figura 1). Esto muestra que el tiempo de exposición favorece el aumento de la concentración del contaminante en las raíces a partir del cuarto mes de crecimiento de la planta, en especial por la retención continua de Hg en su epidermis. Incluso, los niveles de HgT al final del tratamiento son cercanos a los de plantas hiperacumuladoras como la Brassica Juncea, que está en capacidad de acumular hasta 9020 ng/g al final de su crecimiento [2]. Y a pesar que esta última acumula esta cantidad en un suelo menos contaminado que los empleados en este estudio, el guarumo tiene mayor biomasa en sus raíces, lo que posibilita una mayor acumulación de HgT en sus tejidos.
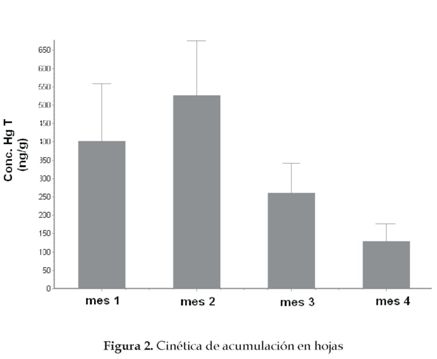
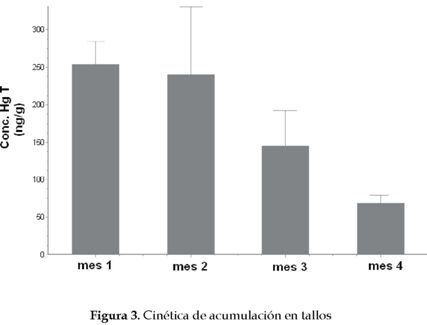
El comportamiento de la cinética de acumulación en tallos y hojas es similar (figuras 2 y 3). Los dos primeros meses no presentan diferencias significativas, pero a partir del tercer mes, la concentración de HgT decrece considerablemente. Esto se debe a la mayor capacidad de retención de Hg por parte de la raíz, pero en especial a la ganancia considerable de biomasa por parte de tallos y hojas, lo que reduce considerablemente la concentración del contaminante.
Capacidad remediadora
Para determinar la capacidad que posee Cecropia peltata para remediar suelos contaminados con mercurio, procedentes del municipio de Barranco de Loba, en su etapa inicial de crecimiento, se analizó la concentración de HgT en suelos de diferente grado de contaminación, antes y después cuatro meses de crecimiento de los árboles. Los resultados se muestran en la tabla 7
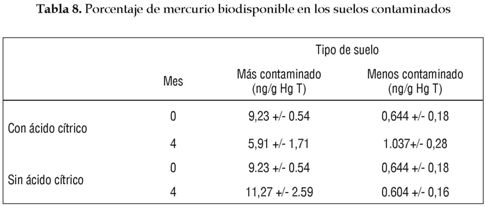
En la tabla 7 se observa las altas tasas de remoción del contaminante en un tiempo relativamente corto. Este fenómeno está favorecido por la gran acumulación que genera el árbol, y el inusual porcentaje de Hg biodispo-nible que presentan los suelos, en especial el más contaminado (tabla 8).
La alta disponibilidad de mercurio en los suelos se debe a la continua emisión del contaminante en los procesos de extracción de oro en Barranco de Loba, al bajo pH y a la poca de materia orgánica de los suelos. Es así que los porcentajes de mercurio biodisponible encontrados en este estudio están por encima de la mayoría de investigaciones de referencia; incluso, en zonas con mayor grado de contaminación como es el caso de Almaden, España, donde el punto de mayor porcentaje de biodisponibilidad se sitúa en el 6,4%, valor que es menor que los encontrados en el suelo más contaminado en Barranco de Loba.
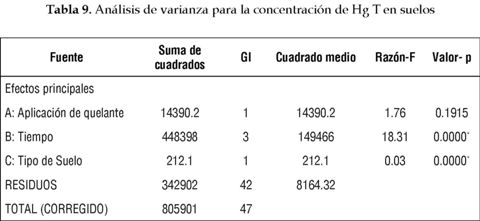
El análisis estadístico descrito en la tabla 9 muestra que el grado de contaminación y el tiempo transcurrido del tratamiento tienen un efecto significativo sobre la concentración de Hg T en suelos. También indica que la aplicación de ácido cítrico no genera mayores tasas de remoción del suelo.
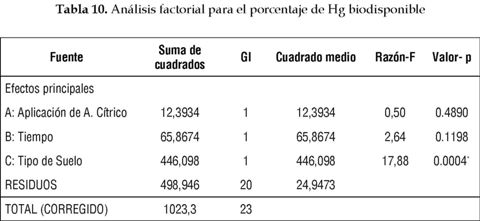
De igual manera, el Anova factorial sobre el grado de biodisponibilidad del Hg indicó que la única variable que tiene influencia sobre ella es el grado de contaminación del suelo; así, entre más alto el grado de contaminación mayor Hg biodisponible hay, como indica la tabla 10. Esto reitera la gran capacidad que tiene la Cecropia peltata para crecer en sitios erosionados, con historial minero y concentraciones muy altas de Hg disponibles como las encontradas en mina de estudio, sin presentar efectos fitotoxicos considerables.
4. CONCLUSIONES
La Cecropia peltata es una especie que acumula una cantidad considerable de Hg en sus tejidos, y la raíz es la parte de la planta que presenta mayor concentración de Hg T, seguida de las hojas y finalmente tallos. La capacidad de acumulación en las raíces está relacionada con el mayor grado de contaminación de los suelos y esta se va incrementando a través del tiempo de crecimiento del guarumo, en virtud a la mayor cantidad de contaminante que es retenido en su epidermis como defensa a los efectos tóxicos adversos que puede generar el mercurio en las partes superiores de la planta.
Las tasas de remoción de HgT en suelo estuvieron entre 15.7% y 33.7 %, en cuatro meses de crecimiento de la planta, lo que implica que esta especie tiene una significativa capacidad para ser empleada en fitorremediación de suelos contaminados considerados en este estudio. Al igual que en la acumulación del contaminante en tejidos, las variables de mayor influencia en las tasas de remoción del suelo son el tiempo de tratamiento y el grado de contaminación del suelo; también cabe destacar que el ácido cítrico no contribuye a una mayor acumulación en tejidos ni remoción de Hg del suelo contaminado.
Referencias
[1] E. U. Islam, X. E. Yang, Z. L. HE, and Q. Mahmood, "Assessing potential dietary toxicity of heavy metals in selected vegetables and food crops," IEEE J. Zhejiang Univ Sci, vol. 8, pp. 1-13, 2007. [ Links ]
[2] F. N. Moreno, W. N. Anderson, R. B. Stewart, and B. H. Robinson, "Mercury volatilisation and phytoextraction from base-metal mine tailings," IEEE Environ Pollut, vol. 136, pp. 341-352, 2005. [ Links ]
[3] J. Olivero, B. Johnson, El lado gris de la minería de oro, Colombia, Ed. Alpha Ltda. Cartagena, Colombia, 2002, pp. 122. [ Links ]
[4] G. Qiu, X. Feng, P. Li, S. Wang, G. Li, L. Shang et al, "Methylmercury accumulation in rice (Oryza sativa L.) grown at abandoned mercury mines in Guizhou, China," IEEE J Agric Food Chem. vol. 56, n.°7, pp. 2465-2468, 2008. [ Links ]
[5] J. R. Peralta, M. L. López, M. Narayan, G. Saupe and J. Gardea, "The biochemistry of environmental heavy metal uptake by plants: implications for the food chain," IEEE Int J Biochem Cell Biol, vol. 41 n.° 8-9, pp. 1665-1677, 2009. [ Links ]
[6] P. Li, X. B. Feng, G. L. Qiu, L. H. Shang and Z. G. Li, "Mercury pollution in Asia: a review of the contaminated sites," IEEE J Hazard Mater, vol. 168, n.° 2-3, pp. 591-601, 2009. [ Links ]
[7] P. E. Ozuah, "Folk use of elemental mercury: a potential hazard for children," IEEE J Natl Med Assoc, vol. 93, n.° 9, pp. 320-322, 2001. [ Links ]
[8] L. M. Bocayuva, V. M. Camara, O. Malm and E. C Oliveira, "Performance on neurological development tests by riverine children with moderate mercury exposure in Amazonia, Brazil," IEEE Saúde Pública, vol. 21, n.°4, pp. 11601167, 2005. [ Links ]
[9] C. Chen, L. Qu, B. Li, L. Xing, G. Jia, T. Wang et al., "Increased oxidative DNA damage, as assessed by urinary 8-Hydroxy-2-Deoxyguanosine concentrations, and serum redox status in persons exposed to mercury," IEEE Clin Chem, vol. 51, n.° 4, pp. 759-764, 2005. [ Links ]
[10] D. L. LeDuc and N. Terry. "Phytoremediation of toxic trace elements in soil and water", IEEE JInd Microbiol Biotechnol, vol. 32, n.°11-12, pp. 514-520, 2005. [ Links ]
[11] M. N. Prasad and M. E Freitas, "Metal hyperaccumulation in plants - Biodiversity prospecting for phytoremediation technology," IEEE Electronic J Biotechnol, vol. 6, pp. 275-321, 2003. [ Links ]
[12] P. S. Thangavel and C. A. Subhuram, "Phytoextraction - Role of hyper accumulators in metal contaminated soils," IEEE Indian National Science Academy, vol. 70, pp. 109-130, 2004. [ Links ]
[13] L. E. Marchiol, "Phytoextraction of heavy metals by canola (Brassica napus) and radish (Raphanus sativus)," IEEE Environ. Pollut, vol. 132, pp. 21-27, 2004. [ Links ]
[14] K. E. Prabha and L. Loretta, "Phytoremediation Technology: Hyper-accumulation Metals in Plants," IEEE Water Air Soil Pollut, vol. 184, n.° 1-4, pp. 105126, 2007. [ Links ]
[15] L. C. Bontidean, "Biosensors for detection of mercury in contaminated soils," IEEE Environ Pollut, vol. 131, pp. 255-262, 2004. [ Links ]
[16] A. C Heaton, C. E. Rugh and R. A. Meagher, "Physiological responses of trans-genic merA-tobacco (Nicotiana tabacum) to foliar and root mercury exposure," IEEE Water Air Soil Pollut, vol. 161, pp. 137-155, 2005. [ Links ]
[17] H. F. Sun, Y. H. Li, Y. F. Ji, L. S. Yang and W. Y. Wang, "Spatial distribution and ecological significance of heavy metals in soils from Chatian mercury mining deposit, western Hunan province", IEEE Huan Jing Ke Xuek, vol. 30, n.°4, pp. 1159-1165, 2009. [ Links ]
[18] E. C. Lombi, "Phytoremediation: Phytoremediation of heavy metal-contaminated soils: Natural hyperaccumulation versus chemically enhanced Phytoextraction," IEEE J Environ Qual, vol. 30, pp. 1919-1926, 2001. [ Links ]
[19] S. Wei and Q. Zhou, "Screen of Chinese weed species for cadmium tolerance and accumulation characteristics," IEEE Int J Phytoremediation, vol. 10 n.° 6, pp. 584-597, 2008. [ Links ]
[20] D. L. Jones, K. L. Williamson and A. G. Owen, "Phytoremediation of landfill leachate," IEEE Waste Manag, vol. 26, n.° 8, pp. 825-837, 2006. [ Links ]
[21] I. M. Marquez and F. M Micheletto, "Germination of seeds of tropical pioneer species under controlled and natural conditions", IEEE Rev Brasil Bot, vol. 24, pp. 79-84, 2001. [ Links ]
[22] R. Canuel, S. B. Grosbois, L. Atikessé, M. Lucotte, P. Arp and C. Ritchie, "New evidence on variations of human body burden of methylmercury from fish consumption," IEEE Environ Health Perspect, vol. 110, pp. 859-864, 2002. [ Links ]
[23] UPME Unidad de Planeación Minera Energética, Estadísticas minero energéticas, 13° ed., Bogotá, Colombia: 2001, pp. 220-225. [ Links ]
[24] I. Marques and F. Micheletto, "Germination of seeds of tropical pioneer species under controlled and natural conditions", IEEE Rev Brasil Bot, vol. 24, pp. 9-84, 2001. [ Links ]
[25] C. Cobbett, "Phytochelatins and their roles in heavy metal detoxification," IEEE Plant Physiology, vol. 123, pp. 825-832, 2007. [ Links ]
[26] J. Thumann, "Reactivation of metal-requiring apoenzymes by phytochela-tinmetal complexes", IEEE Formerly European Journal of Biochemistry, vol. 284, pp. 66-69, 1991. [ Links ]
[27] R. Millan, "Rehabilitación de suelos contaminados con mercurio: estrategias aplicables en el área de almaden", IEEE Ecosistemas, vol. 16, pp. 56-65, 2002. [ Links ]
[28] T. Cafer, K. Pepe and T. Cutright, "The effect of EDTA and citric acid on phytoremediation of Cd, Cr, and Ni from soil using Helianthus annuus", IEEE Environ Poll, vol. 131, pp. 147-154, 2004. [ Links ]