Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y Desarrollo
versão impressa ISSN 0122-3461versão On-line ISSN 2145-9371
Ing. Desarro. v.29 n.2 Barranquilla jul./dez. 2011
Resistencia a la corrosión de recubrimientos electroquímicos de cromo y zinc mediante EIE
Corrosion resistance of chromium and zinc platings by EIS
Magda Marcela Torres Luque*
Universidad de los Andes (Colombia)
Jhon Jairo Olaya Flórez**
Universidad Nacional de Colombia
Hugo del Luján Ascolani***
Centro Atómico Bariloche (Argentina)
* Ingeniera Física y magister en Materiales, Universidad Nacional de Colombia. Estudiante de doctorado de Ingeniería, Universidad de los Andes. mmtorreslu@unal.edu.co
** Ph.D. en Ingeniería, Universidad Nacional Autónoma de México. Profesor asociado, Departamento de Ingeniería Mecánica y Mecatrónica, Universidad Nacional de Colombia. jjolaya@unal.edu.co
*** Ph.D. en Física, Universidad Nacional de Cuyo (Argentina). Investigador del Centro Atómico Bariloche, Comisión Nacional de Energía Atómica de Argentina. ascolani@cab.cnea.gov.ar
Correspondencia: Jhon Jairo Olaya, Departamento de Ingeniería Mecánica y Mecatrónica, Facultad de Ingeniería, Universidad Nacional de Colombia. A.A. 14490. Tel. 3165000, ext. 11208. Bogotá, D.C. (Colombia).
Subvenciones y apoyos recibidos: Los autores agradecen el soporte económico de DIB-UNAL a través del proyecto QUIPU 202010011654 y a las empresas ALFACROM S.A. y Zn~S, Inversiones Suárez Ríos LTDA.
Fecha de recepción: 15 de mayo de 2011
Fecha de aceptación: 13 de septiembre de 2011
Resumen
Se ha estudiado el comportamiento frente a la corrosión de recubrimientos electrolíticos industriales de cromo y zinc mediante la técnica de espectroscopia de impedancia electroquímica en electrólito de NaCl al 3% en peso. Con el objetivo de determinar los mecanismos de protección y de falla de estos recubrimientos se ha correlacionado la resistencia a la polarización en el tiempo, con la morfología y la composición química. Para ello, los recubrimientos fueron caracterizados mediante microscopia electrónica de barrido, difracción de rayos X, espectroscopia de fotoelectrones de rayos X y espectroscopia de electrones Auger. Ambos recubrimientos muestran degradación en el tiempo de ensayo debido a los defectos presentes en su microestructura, sin embargo, el mecanismo de protección y, por tanto, de falla es diferente para cada sistema. Estos detalles son discutidos en esta investigación.
Palabras clave: Corrosión, cromo, impedancia, zinc.
Abstract
The corrosion behavior of chromium and zinc industrial coatings was investigated in 3%wt NaCl solution using electrochemical impedances pectroscopy technique. In order to determine the mechanisms of proresistance in time function, with the morphology and chemical composition. To do this, we characterized the microstructure of the coatings by scanning electron microscopy, the crystalline phases with X-ray diffrac-tion and chemical composition, before and after exposure to a corrosive environment, by X-ray photoelectron spectroscopy and Auger electron spectroscopy.
Overall, both coatings (Cr and Zn) showed degradation with the immersion time, due to microstructure defects, however, the protective and failure mechanisms are different for each system. These details are discussed in this research.
Keywords: Corrosion, chromium, impedance, zinc.
1. INTRODUCCIÓN
Los recubrimientos electrolíticos han sido utilizados con fines decorativos desde el año 4000 a.C., y en el siglo XIII a.C. ya se recubrían materiales con oro y plata. Sin embargo, la técnica industrial actual se desarrolló a mediados del siglo XIX, cuando sus posibles aplicaciones extendieron su uso [1]. Las propiedades superficiales que en general tratan de ser mejoradas mediante estos recubrimientos son reflectancia y apariencia, dureza y resistencia a la corrosión. Además, también se buscan recubrimientos con buena adherencia al sustrato y, sobre todo, que sea posible su producción masiva [2].
El cromo, en forma de recubrimiento, es un material ampliamente utilizado en la protección de piezas de uso industrial y en la recuperación de piezas desgastadas, como cigüeñales, cojinetes, asientos de válvulas, troqueles y herramientas que se encuentran sometidas a medios altamente corrosivos y expuestas a grandes esfuerzos mecánicos. Además, el cromo negro, obtenido por baños electrolíticos, es usado en celdas solares y superficies antirreflectantes, por su alta absorción, baja emisividad y resistencia a altas temperaturas. De igual forma, el cromo poroso se ha convertido en otra opción para el recubrimiento de anillos de pistones, cilindros de aviones y motores diesel. Estas aplicaciones se deben a sus propiedades físicas, químicas y mecánicas, entre las que se destacan: baja conductividad eléctrica, estabilidad química, bajo coeficiente de fricción y durezas superiores a 700 HV [3], [4]. En la actualidad, la técnica más común para la obtención de los recubrimientos de cromo es la electroquímica a partir de cromo hexavalente [Cr(VI)]; esto debido a sus bajos costos, alta eficiencia y la posibilidad de producción en masa [4].
Por su parte, el galvanizado o zinc electrodepositado es utilizado en una gran variedad de productos que requieren protección contra la corrosión y una buena apariencia física. Se usa principalmente en obras públicas y viales, para la protección del acero estructural, en las torres de transmisión y comunicaciones, además de la industria química, transporte, minería, etc. Entre las ventajas que presenta este recubrimiento se pueden mencionar los bajos costos de producción, buen desempeño en la protección contra corrosión, buena adherencia al acero y la resistencia a daños mecánicos [5], [6]. Por otro lado, en la industria se encuentran diferentes tipos de galvanizado, los cuales, además de presentar diferencia en la apariencia física, también se desempeñan de forma diferente en cuanto a la protección contra la corrosión [7]. Estas diferencias se deben a los parámetros de depósito, es decir, en cuanto a la composición del electrolito, aditivos, densidad de corriente y temperatura aplicada al baño electrolítico [8]. Debido a que el mecanismo de protección del galvanizado es principalmente catódico, es de suma importancia el valor del espesor de la capa y, además, el medio al cual estará expuesto.
Debido a la importancia que tienen dichos recubrimientos en el ámbito industrial, esta investigación se ha centrado en el estudio del comportamiento frente a la corrosión de estos dos importantes recubrimientos metálicos mediante técnicas electroquímicas y la identificación de los mecanismos de protección y falla mediante técnicas de caracterización microestructural y química.
2. DESARROLLO EXPERIMENTAL Producción de recubrimientos
Los recubrimientos electroquímicos de cromo duro fueron suministrados por la empresa ALFACROM S.A., y los de zinc, por la empresa ZnvS, Inversiones Suárez Ríos LTDA, bajo estándares propios de las mismas. Los recubrimientos fueron proporcionados con espesores entre 10 y 12 mm aproximadamente.
Para ambos casos, los recubrimientos fueron depositados sobre sustratos de acero estructural, ASTM A36 (0,26% C, 1,3% Mn, 0,04%P, 0,4%Si, Bal. Fe), los cuales fueron pulidos hasta un acabado # 600 con lija de agua.
Pruebas electroquímicas
Para evaluar la resistencia a la corrosión se realizaron ensayos de espectroscopia de impedancia electroquímica (EIE). Para ello se utilizaron las recomendaciones de la norma ASTM G5 y se empleó un contraelectrodo de grafito de alta pureza y un electrodo de referencia de calomel saturado (SCE). El área de exposición de la muestra fue de 0.8 cm2. Los ensayos se hicieron con un electrolito de NaCl al 3% en peso y se manejó un rango de frecuencias entre 10 mHz y 1 MHz, midiendo 10 puntos por década, para diferentes tiempos de inmersión: 1, 24, 48, 72 y 168 horas.
Caracterización superficial
Los recubrimientos fueron estudiados estructuralmente mediante difracción de rayos x (DRX) en un equipo X-pertPro Panalytical en los modos de haz rasante y Bragg-Brentano con la línea monocromática ka del cobre (1,540998A) trabajando a 45 kV y 40 mA. La morfología de la superficie de los recubrimientos y los productos de corrosión se observó a través de microscopía electrónica de barrido (MEB), con un equipo FEI QUANTA 200 en alto vacío y un voltaje de 30 kV.
Los espectros de espectroscopia de fotoelectrones de rayos X (EFRX) se obtuvieron usando un sistema comercial VG ESCA/SAM a una presión del orden de 10-9mbar, con un ánodo doble Al/Mg, utilizando la radiación de la línea Ka del Al (hn = 1486eV). La fuente fue operada con una corriente de emisión de 15 mA y 12 kV y las energías de enlace fueron referenciadas con respecto a la línea del Cu 2p3/2 (932,4eV). Por último, para hacer el tratamiento de los espectros primero se verificó la ausencia de efectos de carga sobre ellos; para esto se tomó como referencia la energía de ligadura del C 1s, en 284,6eV y luego se realizaron los respectivos ajustes de los espectros de alta resolución con el software FUT 1.2 (GTK), utilizando el método Shirley.
Los espectros de espectroscopia de electrones Auger (EEA) se obtuvieron usando el mismo sistema comercial VG ESCA/SAM a una presión del orden de 10-9mbar. La energía del haz de electrones incidente fue de 3 keV. Para obtener los perfiles de profundidad en función del tiempo de sputtering se bombardearon las superficies con iones de Ar acelerados con una energía de 3 keV durante diferentes tiempos de acuerdo con el material. La presión alcanzada durante el bombardeo dentro de la cámara fue del orden de 10-6 mbar.
Después se obtuvieron los espectros con EEA, y en algunos casos con EFRX, para hacer estudio cuantitativo y cualitativo de los cambios, tanto en la concentración como en los estados químicos, ocurridos sobre las superficies.
3. RESULTADOS Y DISCUSIÓN Caracterización superficial
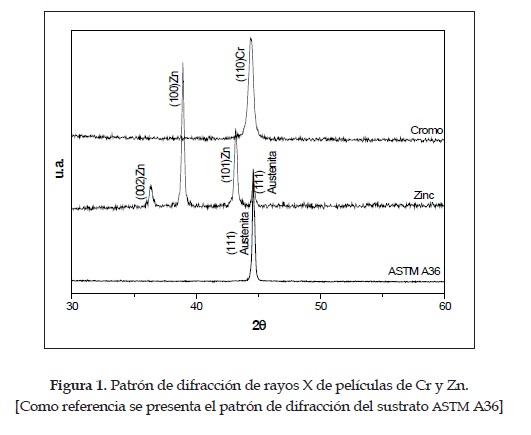
En la figura 1 se muestran los patrones de difracción de los recubrimientos electrolíticos de cromo y zinc. Los resultados indican que en el caso del cromo, una estructura BCC, orientada de forma preferencial en la dirección (110) en 44,34°, mientras que en el recubrimiento de zinc se observa una estructura hexagonal y se destacan los planos (002), (101) y (111), ubicados en 36.32, 38.92 y 43.16° respectivamente, que coinciden con los publicados en las cartas PDF [9].

En la figura 2 se muestra la morfología superficial de los recubrimientos. En el caso específico del cromo duro, se observa crecimiento nodular, que es producto de los acomplejantes en el baño electrolítico [10]; en los recubrimientos de zinc se presenta una superficie mucho más homogénea y lisa, características típicas de superficies brillantes, de lo cual se puede inferir la presencia de aditivos orgánicos y cianuros en el baño electrolítico, generadores de estructuras laminares [11] .
Pruebas electroquímicas
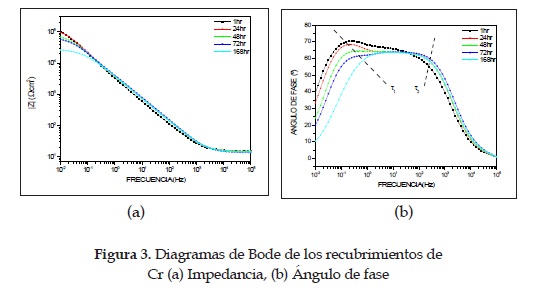
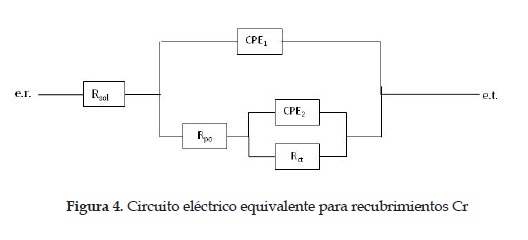
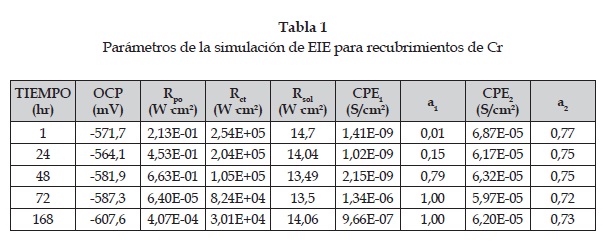
En la figura 3 se muestran los diagramas de Bode del recubrimiento de cromo duro. En el diagrama de ángulo de fase se observan de forma clara dos constantes de tiempo (t1 y t2): la primera, a bajas frecuencias, representa el comportamiento de la interfase recubrimiento/sustrato, y la segunda, a altas frecuencias, representa el carácter dieléctrico del recubrimiento. Por esto, el circuito eléctrico equivalente (CE) que se utiliza para modelar el comportamiento de los recubrimientos de Cr es el de la figura 4. En dicho circuito se observan dos circuitos en paralelo. El primero (CPE1 Rpo) representa el carácter dieléctrico del recubrimiento, el cual, aunque no presenta cambios notorios en el valor de ángulo de fase en el tiempo, sí presenta un corrimiento hacia frecuencias más altas, disminuyendo el tiempo de carga de dicho circuito. El resistor es interpretado como la resistencia del recubrimiento a la penetración de electrolito a través de defectos permeables, tales como poros, áreas dañadas o defectos del mismo; y el elemento de fase constante (CPE) es el comportamiento dieléctrico del recubrimiento en medio del electrolito y el sustrato. En tanto que el segundo circuito (CPE2 Rct) simula el comportamiento de la interfase recubrimiento-sustrato, cuya impedancia disminuye con el tiempo de inmersión, debido, probablemente, a que después de siete días el electrolito alcanza dicha interfase a través de los defectos mencionados [12]. Con base en estas observaciones se puede suponer que las propiedades dieléctricas, tanto del recubrimiento como del sustrato, disminuyen en el tiempo, aunque no de forma abrupta, es decir, que presentan un comportamiento aproximadamente estable en el tiempo de inmersión. Estas observaciones son corroboradas mediante la simulación con el CE correspondiente y cuyos resultados se presentan en la tabla 1.
En la figura 5 (a) se observa la micrografía de la superficie del recubrimiento de Cr después de siete días de inmersión en electrolito de NaCl al 3% y en las figuras 5 (b) y 5 (c) se presentan los espectros de EFRX de alta resolución de Cr 2p y Fe 2p respectivamente. En el primer espectro se identifica la presencia de cromo metálico, Cr2O3 y CrO2 como productos de corrosión, que son coherentes con las energías de ligadura del Cr 2p3/2 en 573,8eV, 576,5eV y 576,2eV respectivamente [13], [14]. En el segundo espectro se observa la presencia de Fe2O3 en 710,8eV [13], [14]; esto debido también a la degradación del sustrato, cuyos productos migran a través de los caminos del recubrimiento que, como se observó antes, tiene estructura nodular. En este caso, el electrolito se difunde hacia el sustrato con trayectorias de zig-zag [10].
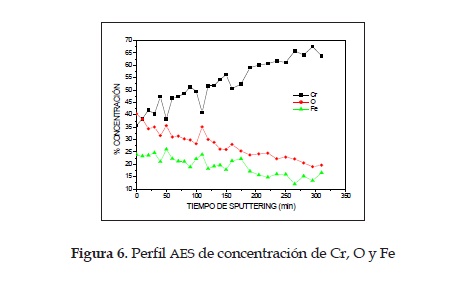
Por último, al realizar perfiles de concentración de la superficie corroída y hacer seguimiento con EEA durante 340 minutos (figura 6) se observa que las concentraciones del Fe y del O tienden a disminuir hacia la interfase sustrato/recubrimiento, mientras que la concentración de Cr aumenta, lo cual es acorde con los espectros de EFRX, que muestran que aunque disminuye el O, sigue existiendo Fe en la subsuperficie.
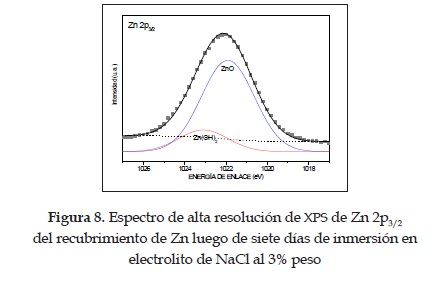
Por otro lado, los recubrimientos electrolíticos de Zn muestran un comportamiento bastante diferente del de los anteriores recubrimientos, como se aprecia en la figura 7. En el diagrama de ángulo de fase se observan claramente tres constantes de tiempo (t1, t2 y t3) luego de 7 días (168h) de inmersión. La primera se presenta a bajas frecuencias debido a la interacción entre el electrolito y el sustrato a través de los poros y posibles fallas del recubrimiento; la segunda se relaciona con comportamiento electroquímico del recubrimiento de Zn cuando está en contacto con el electrolito, lo cual genera difusión de masa e intercambio de electrones; y la última, a altas frecuencias, debido a la capa porosa de ZnO/Zn (OH)2 que forman estos recubrimientos al reaccionar con el electrolito. Esta última capa se logró observar a simple vista por la formación de "islas" blanquesinas, cuya formación se corrobora con mediciones complementarias de EFRX a alta resolución, tal como se muestra en la figura 8. Se puede apreciar la formación de ZnO, el cual tiene su energía de enlace centrada en 1021,9eV y el Zn(OH)2 en 1023eV [13], [15].
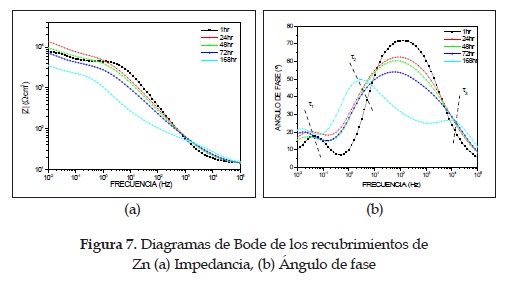
Ahora bien, aunque para los tiempos de 1, 24, 48 y 72 horas no se observan claramente las tres constantes de tiempo, estas sí podrían estar presentes, solo que hay un solapamiento entre los efectos ocurridos en la capa porosa y los del recubrimiento de Zn, debido a que en el recubrimiento se producen las reacciones que generan la capa porosa. En el espectro de impedancias de la figura 7 se nota el cambio continuo en la pendiente de la curva, lo cual da un indicio de la presencia de las tres constantes de tiempo durante los siete días de ensayo.
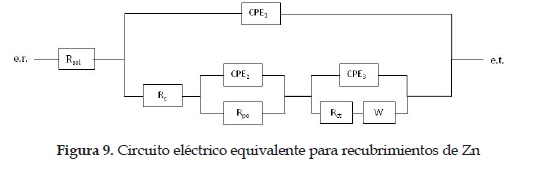
Por estas razones, para el tratamiento de los espectros de los recubrimientos de zinc es necesario utilizar otro CE, el cual represente no solo los procesos sobre el recubrimiento y la intercara, sino también procesos corrosivos sobre la capa porosa de ZnO/Zn(OH)2. Para esto, el CE de la figura 9 reproduce de forma satisfactoria los espectros de impedancia electroquímica de los recubrimientos de Zn. Al igual que en el CE descrito antes, se utilizan circuitos en paralelo de CPE con resistencias, añadiendo la nueva capa porosa de ZnO/Zn(OH)2 (CPE1 Rc), y una impedancia finita de Warburg, que en general representa los procesos de transferencia de masa entre el recubrimiento y el electrolito a través de la, ya mencionada, capa porosa [10].
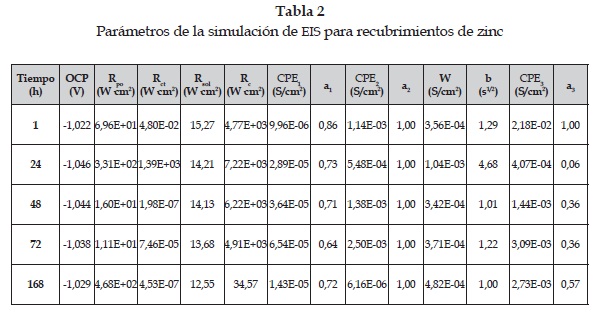
En la tabla 2 se muestran los parámetros de la simulación con el CE correspondiente; allí se observa que el comportamiento de la interfase sustrato/ recubrimiento muestra que, a excepción del segundo tiempo de medición, los otros tiempos se encuentran dominados por procesos difusivos, ya que la Rct es muy pequeña y solo es observable la impedancia finita de Warburg [16]. Además, observando la variación de la constante a3 del CPE3 se aprecia la disminución de sus valores en el tiempo, hasta valores aproximados de 0,4, lo cual es otro indicio de la presencia de fenómenos de difusión desde el recubrimiento hacia el electrolito [16].
Por otro lado, las micrografías de la figura 10 muestran algunas grietas sobre la superficie del recubrimiento y las ya mencionadas "islas". Sobre esta superficie se realizaron los análisis químicos, localizando el haz de electrones en el límite de una de las "islas" y aumentando su diámetro, con el fin de ampliar el área de estudio y lograr abarcar el interior y el exterior de la "isla". Para ello se hace bombardeo con Ar+ y seguimiento con AES durante 285 minutos. En la figura 11(a) se observa que el contenido de O tiende a desaparecer, mientras que la concentración de Zn aumenta, hasta lograr la composición del Zn electrolítico del recubrimiento [ver figura 11 (b)]. Esto indica que, en efecto, la protección catódica que el Zn ofrece al acero es eficiente, ya que si bien el electrolito puede alcanzar la superficie de la pieza en siete días a través de poros y defectos, no lo corroe debido a la presencia del Zn, que es más activo que el Fe [6], [17] .
Para finalizar, en la figura 12 (a) se muestran los valores de resistencia a la polarización (Rp = Rc + Rsol + Rpo + Rct) de ambos recubrimientos; allí se observa que mientras el cromo presenta valores del orden de 105 W·cm2, el Zn no asciende a más de 104 W·cm2; esto puede deberse, principalmente, a que el Cr presenta un mecanismo de protección de barrera, mientras que el Zn es catódico. Además, los valores de Rp de los recubrimientos de Zn muestran una reducción notoria al final de las 168 horas, lo cual se puede atribuir al desprendimiento de la capa porosa de Zn/Zn (OH)2.
CONCLUSIONES
Se logró observar con éxito los procesos corrosivos de los recubrimientos electrometalúrgicos de cromo y de zinc en soluciones salinas mediante el uso de la técnica de espectroscopia y la caracterización de los productos de corrosión con las técnicas de espectroscopia de electrones Auger y fotoelectrones de rayos X.
El recubrimiento de Zn muestra un buen comportamiento frente a la corrosión, ya que en la superficie no se presenta ningún producto de corrosión del sustrato. El mecanismo de corrosión está influenciado por la formación y adherencia de la capa porosa de ZnO/Zn (OH)2. La tendencia a disminuir de la resistencia a la polarización de los recubrimientos de Zn puede deberse al desprendimiento parcial o total de la capa porosa que se formó.
Mediante los estudios químicos XPS y AES se pudo corroborar las diferencias de la eficiencia y el mecanismo de protección entre los diferentes recubrimientos. Se notó que el electrolito alcanzó y degradó el sustrato y se formaron productos de corrosión Cr2O3 y CrO2, Cr (OH)3, Fe2O3 y Fe (OH)2. Ahora bien, aunque el efecto barrera de los recubrimientos de Cr tiende a disminuir en las soluciones salinas, muestra una gran estabilidad en el tiempo de inmersión. En general, los procesos corrosivos en recubrimientos de Cr están dominados por la presencia de poros e imperfecciones en la capa.
REFERENCIAS
[1] European Commission, "Integrated Pollution Prevention and Control Reference Document on Best Available Techniques for the Surface Treatment of Metals and Plastics", 2006, p. 582. [ Links ]
[2] M. C. Barros et al., "Integrated pollution prevention and control in the surface treatment industries in Galicia (NW Spain)", Clean Technologies and Environmental Policy, vol. 10, pp. 175 -188, 2008. [3] K. R. Newby, "Functional chromium plating", Metal Finishing, vol. 105, pp. 182-191, 2007. [ Links ] [ Links ]
[4] J. E. Alfonso et al., "Crecimiento y caracterización de películas de Cr mediante pulverización catódica magnetrón RF", Revista Latinoamericana de Metalurgia y Materiales, vol. S1, pp. 969-972, 2009. [ Links ]
[5] Acabados Galvánicos, L. (2009). Zincado. [online]. Available: http://www.acabadosgalvanicos.com/servicios.swf. [ Links ]
[6] J. Castaño et al., "Corrosión atmosférica del zinc en ambientes exteriores e interiores", Revista de Metalurgia, vol. 43, pp. 133-145, 2007. [ Links ]
[7] P. Spathis and I. Poulios, "The corrosion and photocorrosion of zinc and zinc oxide coatings", Corrosion Science, vol. 37, pp. 673-680, 1995. [ Links ]
[8] B. A. Hoyos et al., "Electrodeposición de Níquel Duro con Ondas de Corriente Pulsante Triangulares", Información Tecnológica, vol. 18, pp. 9 -14, 2007. [ Links ]
[9] ICDD, "JCPDS PDF-2", 1995. [ Links ]
[10] G. Saravanan and S. Mohan, "Corrosion behavior of Cr electrodeposited from Cr(VI) and Cr(III)-baths using direct (DCD) and pulse electrodeposition (PED) techniques", Corrosion Science, vol. 51, pp. 197-202, 2009. [ Links ]
[11] S. C. Chung et al., "EIS behavior of anodized zinc in chloride environments", Corrosion Science, vol. 42, pp. 1249-1268, 2000. [ Links ]
[12] C. Liu et al., "An electrochemical impedance spectroscopy study of the corrosion behavior of PVD coated steels in 0.5 N NaCl aqueous solution: Part I. Establishment of equivalent circuits for EIS data modelling", Corrosion Science, vol. 45, pp. 1243-1256, 2003. [ Links ]
[13] J. F. Moulder et al., Handbook of X-Ray Photoelectron Spectroscopy. Minnesota, USA, 1992. [ Links ]
[14] P. Keller and H.-H. Strehblow, "XPS investigations of electrochemically formed passive layers on Fe/Cr-alloys in 0.5 M H2SO4", Corrosion Science, vol. 46, pp. 1939-1952, 2004. [ Links ]
[15] G. Ballerini et al., "The acid-base properties of the surface of native zinc oxide layers: An XPS study of adsorption of 1,2-diaminoethane", Applied Surface Science, vol. 253, pp. 6860-6867, 2007. [ Links ]
[16] J. Mendoza et al., "Espectroscopia de impedancia electroquímica en corrosión", in Técnicas electroquímicas para el estudio de la corrosión, J. G. Llongueras, Ed. Querétaro, México: UNAM y Instituto Mexicano del Petróleo, 2008. [ Links ]
[17] T. Prosek et al., "Corrosion mechanism of model zinc-magnesium alloys in atmospheric conditions", Corrosion Science, vol. 50, pp. 2216-2231, 2008. [ Links ]














