Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y Desarrollo
versão impressa ISSN 0122-3461versão On-line ISSN 2145-9371
Ing. Desarro. v.29 n.2 Barranquilla jul./dez. 2011
Nanopartículas de TiO2, fase anatasa, sintetizadas por métodos químicos
Nanoparticles of TiO2, anatase phase, synthesized by chemical methods
Mónica Andrea Vargas Urbano*
Yasser Halil Ochoa Muñoz**
Yamileth Ortegón Fernández***
Patricia Mosquera****
Jorge Enrique Rodríguez Páez***** Universidad del Cauca (Colombia)
Rubén Jesús Camargo Amado***** Universidad del Valle (Colombia)
* Ingeniera Física, Universidad del Cauca (Colombia). monicavargas13@hotmail.com
** Ingeniero Físico, Universidad del Cauca (Colombia). yasser8a@hotmail.com
*** Ingeniera Física, Universidad del Cauca (Colombia). yamileth 851230@hotmail.com
**** Técnica de la Unidad de Microscopia de la Universidad del Cauca. Bióloga de la Universidad del Cauca. pmosquera@unicauca.edu.co
*****Docente del Departamento de Física de la Universidad del Cauca (Colombia). Doctor en Ciencias. Universidad Autónoma de Madrid (España).
****** Docente de la Escuela de Ingeniería Química de la Universidad del Valle (Colombia). Doctor en Ingeniería, Universidad Industrial de Santander (Colombia). rcamargo@univalle.edu.co. Correspondencia: Mónica Andrea Vargas. Calle 4 n° 39A-20 Ma Occidente. Tel. 8395968. Popayán (Colombia).
Fecha de recepción: 2 de noviembre de 2010
Fecha de aceptación: 16 de septiembre de 2011
Resumen
El dióxido de titanio, TiO2, es un material de gran importancia tecnológica por sus propiedades fisicoquímicas. También se conoce que las propiedades que presenta un material dependen del proceso de síntesis utilizado para su obtención, condición que es más exigente en las nuevas tecnologías, concretamente en la nanotecnología. En este trabajo se utilizaron dos métodos de síntesis para obtener el TiO2, sol-gel y precursor polimérico (Pechini); se realizó un análisis comparativo de los dos procesos. Los polvos sintetizados se caracterizaron utilizando espectroscopia infrarroja (FTIR), difracción de rayos X (DRX) y microscopía electrónica (MET y MEB), para determinar el efecto de los métodos de síntesis sobre las características del producto final. Los polvos obtenidos presentaron tamaño nanométrico (<100 nm) y como principal fase cristalina la anatasa, a partir de una temperatura mayor que 450°C. la presencia del acomplejante (AcacH), en el sistema, redujo el tamaño de los aglomerados y modificó su morfología.
Palabras clave: Microestructura, Pechini, Sol-Gel, TiO2
Abstract
The titanium dioxide, TiO2, is a material of technological importance for their physicochemical properties. Also is known that material properties depend of synthesis process used for their production, condition that is more demanding in new technologies, specifically in nanotechnology. In this work we used two methods of synthesis, sol-gel and polymeric precursor (Pechini), we realized a comparative analysis of the two processes. The synthesized powders were characterized using infrared spectroscopy (FTIR), X-ray diffraction (XRD) and scanning electron microscopy (TEM and SEM). With the results we determined the effect of the synthesis methods on the characteristics of the final product. The powders obtained presented nanometric size and primary anatase crystalline phase, from a temperature up of450°C. The presence of AcacH complexing, in the system, reduced the size of the agglomerates and modified their morphology.
Keywords: Microstructure, Pechini, Sol-Gel, TiO2.
1. Introducción
El dióxido de titanio, TiO2, es un semiconductor tipo n sensible a la luz que absorbe radiación electromagnética, principalmente en la región UV; además es un óxido anfótero muy estable químicamente. Por las características mencionadas, es el fotocatalizador más empleado actualmente para degradar moléculas orgánicas durante la purificación del agua. Además se utiliza como pigmento blanco, recubrimiento anticorrosivo, sensor de gases, absorbente de rayos UV en productos cosméticos y de manera general en la industria cerámica [1]. Los polvos de dióxido de titano han sido obtenidos utilizando diversos métodos, entre los que se destacan la síntesis química en fase vapor [2], hidrotermal [3], precipitación controlada [4], sol-gel [5] y precursor polimérico (Pechini) [6]. En este trabajo se utilizaron dos rutas químicas para sintetizar el dióxido de titano, sol-gel y Pechini, con el fin de evidenciar sus ventajas comparativas con relación a otros métodos y las diferencias que se presentan entre ellos; estos métodos permiten tener un mejor control sobre el tamaño de las partículas y su pureza química.
En el método Pechini [6], normalmente, se adicionan las sales o los compuestos orgánicos que contienen los cationes de interés, en el presente caso titanio, a una solución viscosa de ácido cítrico y etilenglicol. Esta mezcla, en agitación continua, lleva a la conformación de una disolución líquida transparente. Como en el sistema se encuentran presentes cationes es posible que se conformen quelatos polibásicos, ácidos, que posteriormente, por calentamiento, experimenten polimerización, lo cual da origen a una resina viscosa [6], [7]. El calentamiento de la solución se debe realizar continuamente hasta que toda el agua y el ácido cítrico se destilen, lo que da como resultado el polímero. Esta resina, comúnmente amorfa, se calcina a temperaturas inferiores a 350°C.
Por otro lado, el método sol-gel implica la transición de un sistema en estado líquido, "sol" (suspensión coloidal de partículas sólidas de tamaño nanométrico), a una fase sólida denominada "gel" (sólido constituido por al menos dos fases, con la fase líquida atrapada e inmovilizada por la fase sólida) [8]. Las reacciones más importantes que ocurren en el seno del sistema, durante la formación del sol y su transición a gel, son las de hidrólisis y condensación [9]. En el sistema se forman cadenas de partículas sólidas pequeñas inmersas en el líquido (solvente orgánico o acuoso). Las partículas sólidas, o las cadenas de partículas, son tan pequeñas, 1 a 1.000 nm, que las fuerzas gravitacionales son despreciables y las interacciones que predominan son las de tipo Van der Waals, coulómbicas y estéricas; el "sol" es estabilizado por la repulsión estérica por el efecto de la doble capa o la combinación de las anteriores [8], [9].
La transformación del sol a gel permite obtener materiales cerámicos con diversas formas. Cuando el "sol" se coloca en un recipiente, preferiblemente de vidrio, se forma un "gel húmedo", que con un secado y un tratamiento térmico posterior se puede convertir en un polvo cerámico [8], [9].
En este trabajo se realizó una adecuada descripción de los procesos de síntesis para obtener el TiO2 con el fin de garantizar la reproducibilidad de los mismos, asegurando así la obtención de las propiedades deseadas en el producto final. Se determinó, además, el efecto del acomplejante (AcacH) sobre la morfología y el tamaño de las partículas. Los polvos cerámicos obtenidos se caracterizaron utilizando espectroscopia infrarroja (FTIR), difracción de rayos X (DRX) y microscopia electrónica (MET y MEB).
2. Metodología
Método Sol-gel
En el método sol-gel, la obtención de soles estables de TiO2 se realizó a través de las reacciones de hidrólisis y policondensación del tetrabutóxido de titanio (TBT-Across), Ti(OBu)4, acomplejado con acetilacetona (AcacH-Merck) para retardar las reacciones de hidrólisis en el sistema TBT-solvente. Se empleó como disolvente alcohol etílico (Merck), al que se le adicionó el TBT, teniendo la precaución de que este reactivo no se hidrolice al entrar en contacto con el medio ambiente. La solución fue agitada durante 20 minutos y, finalmente, se adicionó el agua destilada, manteniendo en agitación durante otros 20 minutos. Posteriormente, se adicionó hidróxido de amonio para obtener una condición básica en la solución y favorecer la formación de partículas nanométricas en el sistema.
A la muestra sólida se le realizó un tratamiento térmico que involucró un incremento de la temperatura, desde ambiente hasta 150°C, con el fin de eliminar completamente el agua fisisorbida y el solvente. Posteriormente se incrementó nuevamente la temperatura hasta 350, 450, 500, 600 y 700°C, a una velocidad de 3°C/min, con un tiempo de residencia a cada una de estas temperaturas de 2 horas. Mediante este método se conformaron dos sistemas, uno sin acomplejante (sin AcacH) y otro con una relación TBT/ AcacH de 2/1.
Método Pechini
En el método Pechini se mezclaron inicialmente, a 70 °C, etilenglicol y ácido cítrico en ciertas cantidades con el fin de obtener una relación 4:1. Después de que se enfrió la mezcla se adicionó el precursor de titanio (TBT-Across) mezclado con etanol, en cantidades determinadas por la concentración del sistema que se iba a estudiar. Se garantizó que la solución obtenida fuera totalmente transparente, condición que indica una mezcla uniforme de los diferentes reactivos y el favorecimiento de la formación del citrato. Luego, a la mezcla obtenida se le adicionó NH4OH para incrementar el pH del sistema, controlando que no se formen precipitados en la solución. Después de la adición del hidróxido de amonio, el sistema se trató térmicamente a una temperatura entre 80 y 120°C para favorecer las reacciones de poliesterificación y, por lo tanto, la conformación de la resina. Una vez obtenida la resina, esta se precalcinó tratándola a una temperatura entre 250 y 300°C, durante veinticuatro (24) horas, y se obtuvo un sólido negro muy fino, con alto contenido de carbono. El tratamiento térmico final se realizó a temperaturas de 350, 450, 500, 600 y 700°C durante 3 horas.
Caracterización de los polvos cerámicos
Con el fin de determinar los grupos funcionales presentes en las muestras sólidas, con tratamientos térmicos y sin estos, se utilizó espectroscopia infrarroj a empleando el equipo Termo Nicolet IR200 Spectrometer. Las fases cristalinas presentes en las muestras sólidas se determinaron con difracción de rayos X, utilizando para ello el difractómetro Philips PW1710 y la radiación Ka del Cu, l= 1.54 A, en el intervalo 29 entre 10 y 70°, a una velocidad de barrido de 0.04°s-1. Finalmente, el tamaño y la morfología de las partículas se determinaron utilizando MET (equipo JEOL JEM-1200) y MEB (equipo JEOL JSM-6340F).
3. Resultados y discusión
Evolución de los grupos funcionales con el tratamiento térmico
En la figura 1 se muestran los espectros IR de las muestras tratadas a diferentes temperaturas de los dos sistemas. Para los sólidos obtenidos por el método sol-gel, los espectros presentan una banda a 3440 cm-1, que se asocia al modo vibracional de tensión del H-OH y que disminuye a medida que se aumenta la temperatura; la banda a 1630 cm-1 correspondería al modo de flexión del agua. La banda a 1430 cm-1 se podría asociar a la vibración de grupos orgánicos C-H residuales [10]. Observando específicamente la región de 1000 a 400 cm-1 del espectro, figura 1(a) sistema sin AcacH, la región presenta una banda de área grande que se define aun más a medida que se aumenta la temperatura. Las bandas características de esta región están ubicadas a 500 y 760 cm-1 y se pueden asociar al grupo funcional Ti-O-Ti. La banda a 600 cm-1 también se puede asociar al modo vibracional del grupo Ti-O.
En general, en la figura 1 se observa un incremento en el área de las bandas para temperaturas bajas, la cual disminuye cuando se somete a temperaturas mayores, como a 500°C; esto pone en evidencia que la formación del enlace Ti-O no es muy fuerte a temperaturas altas [11].
En la figura 1(b) se presentan los espectros para muestras sólidas del sistema con relación Ti/AcacH = 2/1, donde se observan bandas más definidas en la región entre 1000 y 1500 cm-1 y que estarían relacionadas con los modos y(Ti-O-C) (1045, 1075 y 1130 cm-1) [11]. Además, se presenta una banda a 500 cm-1, que se puede asociar a la vibración Ti-O-Ti, con una alta área bajo la banda, que va disminuyendo notablemente al aumentar la temperatura. En este sistema, el grupo funcional asociado a la banda de 500 cm-1 disminuyó en intensidad al incrementarse la temperatura de la muestra.
En la figura 2 se muestran los espectros correspondientes a la muestra tratada a diferentes temperaturas obtenida por el método Pechini. Hay que ponerle especial atención al intervalo entre 400 y 1000 cm-1 porque es en esta región donde están las bandas de interés correspondientes a los enlaces Ti-O, Ti-OH y Ti-C.
En el espectro del pre-calcinado (250°C), figura 2, aparece un doblete en la región entre 600 y 900 cm-1; en esta zona están presentes las bandas a 617, 768 y 872 cm-1, que son características del ácido cítrico y etilenglicol [12].
Al incrementar la temperatura a 400°C se observan las bandas a 443 y 480 cm-1, correspondientes al enlace Ti-C, y las ubicadas a 566 y 581 cm-1, que se pueden asociar a los enlaces que se forman entre el oxígeno y el titanio, O-Ti-O [9]. La banda ubicada a 787 cm-1 pertenece al enlace C-H alcano en modo de balanceo [13]. A la temperatura de 400°C, el doblete alrededor de 1500 cm-1 es menos intenso, condición que pudo ser ocasionada por la eliminación de gran parte de la fase orgánica. En el espectro de IR de la muestra tratada a 450°C se comienza a formar una banda de área grande, a 511 cm-1, que se define aún más a medida que se aumenta la temperatura de tratamiento; esta banda es característica de la fase inorgánica presente en la muestra y concretamente estaría relacionada con los enlaces Ti-O y Ti-OH, principalmente. A 500°C se observa un aumento en el área de la banda ubicada entre 400 y 650 cm-1, banda que se puede asociar a uno de los modos vibracionales del Ti-O [11].
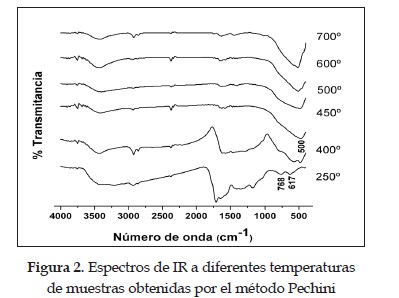
Es necesario indicar que en el rango de temperaturas entre 500 y 600°C coexisten las fases anatasa-rutilo en el TiO2 tal como lo indican los resultados de DRX y la literatura [13].
El espectro de IR, a 700°C (figura 2), presenta unas bandas ubicadas a 513, 580 y 649 cm-1, que estarían relacionadas con la formación de enlaces TiO-Ti [11]. Es de esperar que a esta temperatura, 700°C, sea la fase rutilo la que predomine; según la literatura [11], las bandas alrededor de 560 y 674 cm-1 son características del rutilo.
Fases cristalinas presentes en los sólidos
Para conocer las fases cristalinas presentes en los sólidos se utilizó DRX. Los resultados para las muestras obtenidas por el método sol-gel se indican en la figura 3, tanto para muestras sin y con AcacH.
Los difractogramas de la figura 3(a), sin acomplejante, indican que las muestras son amorfas aun a 350°C, pero al tratarlas a 450°C cristalizan, y se obtiene como fase cristalina principal la anatasa (PDF 21-1272); la muestra tratada a 500°C, durante 2 horas, sigue presentando el TiO2, fase anatasa, como principal fase cristalina.
NANOPARTÍCULAS DE TIO2, FASE ANATASA, SINTETIZADAS POR MÉTODOS QUÍMICOS
Los difractogramas de la figura 3(b) corresponden a muestras que contienen acomplejante y que presentan una relación 2/1. Tales difractogramas indican que al tratar la muestra a 350°C, el sólido es amorfo y que a 450°C cristaliza, y se obtiene como principal fase cristalina la anatasa (TiO2). Igual que para el caso anterior, la muestra tratada a 500°C, durante 2 horas, presenta como principal fase cristalina el TiO2-anatasa (PDF 21-1272).
Los difractogramas de la figura 4 corresponden a los sólidos obtenidos por el método Pechini, sometidos a diferentes tratamientos térmicos. Las muestras tratadas térmicamente a 450°C, durante cinco y siete horas, presentan como principal fase cristalina el TiO2-anatasa (PDF 21-1272).
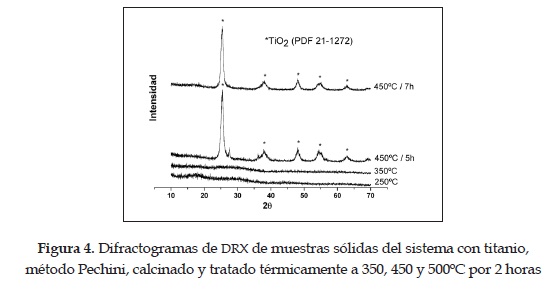
Los difractogramas de las figuras 3 y 4 indican que las muestras sintetizadas, por los dos métodos empleados en este trabajo, son aún amorfas a 350°C y que a 450°C se alcanza la cristalización del sólido y se obtiene como fase cristalina la anatasa (PDF 21-1272).
Morfología y Tamaño de partícula
Para conocer el tamaño y la morfología de las partículas presentes en las muestras se utilizó microscopía electrónica (MET y MEB).
En la figura 5 se ilustran las fotografías obtenidas con MET de muestras sintetizadas, del sistema sin AcacH, tratadas térmicamente a 100, 450 y 700°C por 2 horas. En ellas se observa la presencia de partículas con un tamaño promedio de 100 nm y otras que superan los 500 nm, que realmente son aglomerados de partículas primarias y que presentan una morfología esferoidal. A medida que se aumenta la temperatura del tratamiento térmico, la muestra presenta partículas de mayor tamaño, figura 5(b), lo que pone en evidencia el efecto de la temperatura sobre la microestructura del sólido, favoreciéndose la sinterabilidad de las partículas primarias. En la figura 5(c) aparecen partículas primarias, con un tamaño de ~100 nm.

En la figura 6 se observan las muestras del sistema Ti/AcacH= 2/1. En este caso, las partículas son mayores a 200 nm y presentan formas irregulares con bordes agudos; con el incremento de la temperatura se favorece la formación de aglomerados de alrededor de 700 nm.

En la figura 7 se muestran los sólidos sintetizadas con Pechini. En las figuras 7(a) y 7(b) se observan partículas con formas irregulares y bordes suaves, de tamaños superiores a los 100 nm; a medida que la temperatura de tratamiento aumenta, figura 7(c), se forman aglomerados que contienen partículas pequeñas, de forma irregular, con un tamaño aproximado de 10 nm.

Si se comparan las partículas obtenidas por los dos métodos (figura 8), se puede observar que, en primer lugar, la presencia del acomplejante (método de sol-gel) varía la forma de la partícula: mientras en el sistema sin AcacH se obtienen partículas esféricas y con aglomerados de gran tamaño, en el sistema 2/1 se obtienen partículas con formas irregulares. En cuanto al método de Pechini, se obtienen partículas con formas irregulares y bordes suaves. Es importante destacar que en los tres casos se obtienen partículas con un tamaño de aproximadamente 100 nm, por lo que utilizando estos dos métodos de síntesis se puede garantizar la obtención de partículas de tamaño nanométrico.

En las figuras 9(a) y 9(b) se ilustran las fotografías obtenidas con MEB de las muestras del sistema sin AcacH tratadas a 450°C. En ellas se observa la presencia de aglomerados mayores que 10 µm, compuestos de partículas menores que 1 µm.
En la figura 9(c) se observa la muestra sintetizada por el método Pechini, tratada a 450°C. En ella se observan partículas entre 5 a 15 µm, con una textura superficial muy fina.
Comparando las partículas obtenidas por los dos métodos (figura 9) se puede observar que la presencia del acomplejante, figura 9(b), reduce un poco la formación de aglomerados, mientras que en el sistema sin AcacH se obtienen aglomerados de gran tamaño. En cuanto al método de Pechini, este permite obtener agregados debido a la gran sinterabilidad de las partículas primarias.

Conclusiones
Independiente del método de síntesis, los espectros de infrarrojo presentan, principalmente, las bandas a 500 y ~700 cm-1, que corresponden al grupo funcional Ti-O-Ti, y a 600 cm-1, que se asocia al enlace Ti-O. Para el caso concreto del método sol-gel, el acomplejante (AcacH) juega un papel importante en las reacciones, lo que es indicado por la aparición de bandas a 1040, 1075 y 1130 cm-1 y que se pueden asociar al grupo funcional Ti-O-C.
El estudio de las fases cristalinas mostró que los sólidos obtenidos, por los métodos sol-gel y Pechini y tratados a 350°C, son amorfos y a 450°C cristalizan, y se presenta como principal fase cristalina la anatasa (TiO2).
Observando las fotografías obtenidas con MET de las muestras sintetizadas por el método sol-gel se encuentra que la presencia del acomplejante (AcacH) modificó la morfología de las partículas y disminuyó el tamaño de las mismas; sin acomplejante, las partículas presentaron una forma esferoidal y un tamaño < 500 nm, mientras que con acomplejante, tenían formas irregulares, con bordes agudos, y un tamaño < 200 nm. Por otro lado, utilizando el método Pechini se obtuvieron partículas más pequeñas, < 100 nm, con formas irregulares y bordes no muy agudos.
Las fotografías obtenidas con MEB, de las muestras sintetizadas por el método sol-gel, mostraron la formación de grandes aglomerados, > 10 µm, mientras que con el método Pechini se formaron partículas > 5 µm, con una textura más suave, lo cual evidencia un gran avance del proceso de sinterabilidad de las partículas primarias.
Agradecimientos
Este trabajo fue financiado por el proyecto titulado "Muerte fotocatalítica de células cancerígenas de útero por efecto del óxido de titanio (TiO2) y radiación ultravioleta", financiado por Colciencias, contrato RC n° 512-2009 de enero de 2010. Agradecimientos especiales a la Unidad de Microscopía de la Universidad del Cauca por la colaboración con el estudio de MET y a la VRI- Unicauca por el apoyo recibido.
REFERENCIAS
[1] R. Parra, M. S. Góes, M. S. Castro, E. Longo, P. R. Bueno, and J. A. Varela, "Reaction Pathway to the Synthesis of Anatase via the Chemical Modification of Titanium Isopropoxide with Acetic Acid", Chem. Mater., vol. 20, pp. 143 150, 2008. [ Links ]
[2] K. Akurati, "Synthesis, characterization and sintering of nanocrystalline titania powders produced by chemical vapour synthesis". Joint Research Laboratory Nanomaterials. Darmstadt, Germany: Institute for Materials Science, 2006, pp. 2248-2254. [ Links ]
[3] H. P. Shivaraju, K. Byrappa, T. M. S. Vijay Kumar, and C. Ranganathaiah, "Hydrothermal Synthesis and Characterization of TiO2 Nanostructures on the Ceramic Support and their Photo-catalysis Performance", Bulletin of the Catalysis Society of India, vol. 9, pp. 37-50, 2010. [ Links ]
[4] H. R. Clauser, The Encyclopedia of Engineering Materials and Processes. Barcelona (España): Labor, 1990, pp. 806-807. [ Links ]
[5] H. Monreal y V. A. Martínez, "Obtención de (nanocilindros) de TiO2 por ADN mediante Sol-Gel", Rev. del Centro de Inv, México, vol. 6, n° 23, pp. 21-26, ene - jun de 2005. [ Links ]
[6] M. P. Pechini, "Method of preparing lead and alkaline earth titanates and niobates and coating method using the some to form a capacitor". US Patent n° 3, 330,697, 11 July 1967. [ Links ]
[7] H. J. Fecht, in Nanomaterials: Synthesis, Properties and Applications, A.S. Edelstein and R. C. Cammarata, Eds. of Phys. Publishing Bristol and Philadelphia, 1996, pp. 89-110. [ Links ]
[8] C. J. Brinker and G. W. Scherer, "Hydrolysis and Condensation I: Nonsilicates," in Sol-gel Science: The Physics and Chemistry of Sol-Gel Processing (ch. 2).San Diego: Academic Press, 1991, pp. 30-34. [ Links ]
[9] A. Guzmán, A. Fernández y J. E. Rodríguez, "Estudio de las reacciones de hidrólisis y condensación del titanio en presencia de acetilacetona", Rev. Acad. Colomb. Cienc., vol. 31, pp. 529-536, 2007. [ Links ]
[10] K. Nakamoto, "Inorganic Compounds," in Infrared and Raman Spectra of Inorganic and Cordination Compound, New York: John Wiley & Sons, 1962. [ Links ]
[11] L. Téllez, F. Rubio, R. Peña-Alonso y J. Rubio, "Seguimiento por espectroscopía infrarroja (FT-IR) de la copolimerización de TEOS y PDMS en presencia de TBT", Bol. Soc. Españ. Cerám. y Vidrio, vol. 43, pp. 883-890, 2004. [ Links ]
[12] A. Mosquera y J. E. Rodríguez, "Obtención de nanoestructuras bidimensionales de SnO2 utilizando el método Pechini: estudio de la conformación de la resina", Bol. Soc. Españ. Cerám. y Vidrio, vol. 47, pp. 278- 286, 2008. [ Links ]
[13] R. Silverstein, F. Webster, and D. Kiemle, "Infrared Spectrometry", in Spectrometric Identification of Organic Compounds, 7th ed. New York: John Wiley & Sons, 2005. [ Links ]














