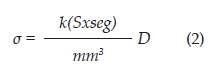Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y Desarrollo
versão impressa ISSN 0122-3461versão On-line ISSN 2145-9371
Ing. Desarro. vol.34 no.1 Barranquilla jan./jun. 2016
https://doi.org/10.14482/inde.33.2.6368
http://dx.doi.Org/10.14482/inde.33.2.6368
Estimación de la propagación eléctrica cerebral generada por la DBS en pacientes con enfermedad de Parkinson de la región sur-occidente de Colombia
Estimation of brain electrical propagation generated by the DBS in patients with Parkinson's disease from South-west region of Colombia
Hernán Darío Vargas Cardona*
Mauricio Alexander Álvarez López**
Alvaro Ángel Orozco***
Universidad Tecnológica de Pereira (Colombia)
* Universidad Tecnológica de Pereira, departamento de Ingeniería Eléctrica, estudiante de doctorado en ingeniería, hernan.vargas@utp.edu.co, Magister en Ingeniería Eléctrica.
**Universidad Tecnológica de Pereira, departamento de Ingeniería Eléctrica, Profesor asociado, malvarez@utp.edu.co, PhD en Ciencias de la Computación.
*** Universidad Tecnológica de Pereira, departamento de Ingeniería Eléctrica, Profesor titular, aaog@utp.edu.co, PhD en Bioingeniería.
Correspondencia: Hernán Darío Vargas Cardona, Universidad Tecnológica de Pereira, Vereda la Julita, Edificio de Ingeniería Eléctrica, Oficina E-106, Pereira, Risaralda, Colombia. Tel 6-3137122 ext. 109. Cel: 3104682683
Origen de subvenciones: este trabajo hace parte del proyecto de investigación titulado "Estimación de los parámetros de neuro-modulación con terapia de estimulación cerebral profunda en pacientes con enfermedad de Parkinson a partir del volumen de tejido activo planeado", financiado por Colciencias mediante la convocatoria 657 del 2014 con código 111065740687.
Fecha de recepción: 14 de octubre de 2014
Fecha de aceptación: 24 de noviembre de 2015
Resumen
La Enfermedad de Parkinson (ep) es un grupo de desórdenes neurológicos causado por un déficit de dopamina en una estructura cerebral llamada Sustancia Nigra Reticulata (snr). La Estimulación Cerebral Profunda (dbs) del Núcleo Subtalámico (stn) ha demostrado ser un tratamiento exitoso para esta patología. La dbs modula la actividad neuronal con campos eléctricos, no obstante se conoce muy poco acerca de la distribución de voltaje generada en el cerebro por los electrodos estimuladores. El conocimiento del potencial eléctrico generado por la dbs es necesario para encontrar los parámetros óptimos de estimulación que entreguen los mejores resultados clínicos y los mínimos efectos secundarios. En este trabajo, proponemos una metodología de estimación del potencial eléctrico basada en el procesamiento de imágenes de resonancia magnética con tensor de difusión (mri-DT) para el análisis específico de cada paciente y el método de los elementos finitos para la solución de la ecuación del modelo, contrario a otros trabajos similares donde se emplean modelos genéricos y homogéneos. Los resultados obtenidos son coherentes con lo previamente reportado y permiten establecer que el modelo tensorial de conductividad eléctrica es más preciso y detallado para realizar simulaciones de dbs, en comparación a modelos genéricos con conductividad homogénea.
Palabras clave: enfermedad de Parkinson, estimulación cerebral profunda, núcleo subtalámico, potencial eléctrico, tensores de difusión.
Abstract
Parkinson's disease (pd) is a group of neurological disorders caused by a deficiency of dopamine in a brain structure called Substance Nigra reticulata (snr). Deep Brain Stimulation (dbs) of subthalamic nucleus has proved to be a successful treatment for this pathology. dbs modulates the neuronal activity with electrical fields. However, the distribution of the voltage generated in the brain by the stimulating electrodes is not well known. Knowledge of the electrical potential generated by dbs is necessary to find optimal stimulation parameters that deliver the best clinical results and minimal side effects. In this paper, we propose a methodology for estimating the electrical potential based on processing of magnetic resonance image with diffusion tensor (mri-dt) for specific patient analysis and the finite element method for solution of model equation, in contrast to another similar works where it is employed generic and homogeneous models. Results are consistent with previously outcomes reported in the state of the art and they allow to establish that tensorial model for electrical conductivity is more accurate and detailed to perform dbs simulations, in comparison to generic models with homogenous conductivity.
Keywords: Parkinson's disease, Deep Brain Stimulation, Subthalamic Nucleus, Electrical potential, Diffusion Tensors.
INTRODUCCIÓN
La Enfermedad de Parkinson (ep) es una condición degenerativa y progresiva del sistema nervioso central, que se manifiesta fundamentalmente como rigidez muscular, hipoquinesia, bradiquinesia y temblor. Las causas de esta patología no se conocen completamente, pero es sabido que hay un deterioro significativo de las células de una estructura cerebral conocida como Sustancia Nigra Reticulata (snr). Por este motivo, se genera una disminución de niveles de dopamina, produciendo un efecto en otras estructuras como el Núcleo Subtalámico (stn) y el globo pálido. Estas estructuras son muy relevantes en el control de los movimientos del ser humano [1].
Debido a que los efectos secundarios de los medicamentos se convierten en un problema para los pacientes, el tratamiento quirúrgico es una alternativa para el tratamiento de la ep [2], ya que la cirugía contribuye a una adecuada respuesta a los medicamentos, a la disminución de los efectos adversos de estos, también a una reducción de los síntomas y el mejoramiento de la calidad de vida [3]. La estimulación cerebral profunda (en inglés dbs), es el procedimiento quirúrgico más común y exitoso para el tratamiento de la Enfermedad de Parkinson [4], [5]. Consiste en la implantación de una unidad de marcapaso que transmite a las neuronas circundantes, una corriente eléctrica desde un generador ubicado en la región subclavicular a un electrodo implantado en uno de los núcleos de control del movimiento (tálamo, núcleo subtalámico o globo pálido interno). Para esto se utiliza sistema de localización estereotáxica, el cual por medio de cálculos compu-tarizados logra ubicar el punto exacto donde se desea implantar el electrodo.
Si bien el propósito fundamental de la dbs consiste en modular la actividad neuronal con campos eléctricos [6], [7], y a pesar del éxito clínico de este procedimiento, no se ha determinado completamente la distribución de voltaje que se genera en el cerebro mediante la estimulación con electrodos dbs. Además, existen muchos interrogantes relacionados a las consecuencias que la dbs genera en el sistema nervioso. También, es muy difícil predecir con exactitud, cuáles áreas se ven afectadas directamente por la estimulación, y no se puede determinar fácilmente el Volumen de Tejido Activo (vta) en el cerebro, siendo el vta la cantidad de tejido cerebral que presenta excitación o respuesta eléctrica a la estimulación de los electrodos. Lo anterior conlleva a que todas aquellas preguntas relacionadas con los beneficios terapéuticos y efectos secundarios de la dbs sean materia de investigación en la actualidad [8].
Los efectos secundarios que puede producir la dbs en el sistema nervioso no se han explicado satisfactoriamente, debido a la inhabilidad para cuantificar el potencial eléctrico generado durante la estimulación [9]. Estudios clínicos han establecido que los resultados terapéuticos de la dbs dependen fuertemente de tres factores: 1). Selección cuidadosa de pacientes apropiados [10], 2). Ubicación quirúrgica precisa de los electrodos en la región cerebral objetivo para el desorden de movimiento establecido [11] y 3). Valoración atenta y específica para cada paciente de los parámetros iniciales de estimulación [12]. La ubicación del electrodo y los parámetros iniciales de estimulación interactúan sinérgicamente para definir las mejores condiciones terapéuticas de estimulación, o los parámetros espaciales donde la estimulación provee beneficios terapéuticos sin que la estimulación genere efectos secundarios. Además, múltiples factores pueden influir en la respuesta clínica a la dbs, como el estado de la enfermedad del paciente, la anatomía de las regiones cerebrales objetivo, la ubicación de los electrodos, la geometría del electrodo y la selección de los parámetros de estimulación (contacto, voltaje, ancho de pulso y frecuencia). Entre los efectos secundarios que produce la dbs del stn se menciona la parálisis, la disquinesia, la pérdida de sensibilidad en las extremidades, la reducción de la velocidad en la pronunciación de palabras (fluidez verbal), entre otros [13].
Con relación a algunos estudios sobre estimación de la distribución de voltaje generado por dbs en el cerebro [6], [7], [9], [12], [13], se han examinado relaciones directas entre los parámetros configurables de la estimulación (corriente, frecuencia, ancho de pulso, contacto, impedancia) y la respuesta terapéutica a la dbs [14], e incluso se ha investigado la mejor ubicación posible del electrodo en el Núcleo Subtalámico (stn). No obstante, solo recientemente se han desarrollado herramientas metodológicas que enlazan análisis científico y modelos tanto eléctricos como anatómicos de la dbs en los seres humanos [9]. Los modelos basados en elementos finitos con tensor de difusión para determinar el voltaje propagado, muestran que el beneficio terapéutico se puede lograr con estimulación directa en un amplio rango de la región subtalámica [15].
En este trabajo se presenta una metodología de simulación para estimar el potencial eléctrico generado por la dbs. Se emplea resonancia magnética con tensores de difusión de pacientes de la región sur-occidente de Colombia para obtener el modelo de conductividad cerebral y por medio del método de los elementos finitos se determina la distribución espacial del voltaje generado por la dbs, el cual depende de parámetros de estimulación como la amplitud, la frecuencia y la conductividad cerebral. Para validar de manera más objetiva la metodología empleada, también se realizaron experimentos con estudios mri-dt de pacientes de una base de datos internacional, lo cual arrojóresultados promedio muy similares a los de la base de datos local. Un aporte significativo de la metodología propuesta es que el análisis es específico para cada paciente, en comparación a otros trabajos donde se emplean modelos de conductividad genéricos y homogéneos para todos los pacientes. La introducción de los tensores de difusión como modelo de conductividad cerebral para cada individuo permite un estudio detallado de los sujetos de prueba, con un valor agregado de que el tejido cerebral se considera como anisotrópico y heterogéneo.
MARCO CONCEPTUAL
Imágenes de resonancia magnética con tensor de difusión (MRI-DT)
Las imágenes de resonancia magnética con tensor de difusión (mri-dt), se basan en técnicas de resonancia magnética que estudian la difusión de las partículas de agua en el cerebro humano. La dirección de esta difusión se relaciona a la microestructura local de las regiones cerebrales y usualmente estáalineada a través de estructuras orientadas, como las fibras conectivas del cerebro. En otras palabras, esta técnica puede ser usada para investigar cuales vías neuronales son las utilizadas para la comunicación entre varios centros de actividad cerebral. Se cree que hay una relación entre algunas enfermedades y los cambios en la conectividad de ciertas áreas del cerebro, por lo tanto el campo aplicativo de las dti es muy grande, en cuanto al diagnóstico y la planeación pre-operativa de enfermedades neurodegenerativas [14].
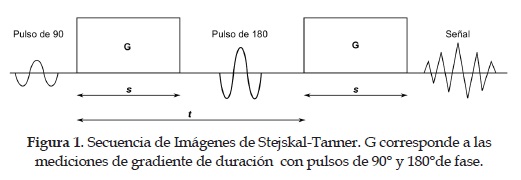
Las mri-dt son sensibles al desplazamiento molecular respecto al eje de los gradientes de campo magnético que se aplican para medir la difusión de agua. El protocolo estándar para la aplicación de los gradientes pulsados se conoce como pgse (Pulsed-Gradient Spin-Echo) [16]. Por lo tanto, la difusión en direcciones diferentes se puede hallar fácilmente mediante la variación de la dirección de los gradientes. En las dti, las intensidades de las imágenes dependen de la movilidad relativa de las partículas de agua en los tejidos. A partir de las medidas de difusión en varias direcciones se calcula un tensor para cada Voxel, el cual describe la difusión local de agua. Para lograr esto, típicamente se usa la secuencia de imágenes Stejskal-Tanner [16]. Esta secuencia usa dos pulsos de gradientes muy fuertes, simétricamente posicionados alrededor de un pulso de reorientación de 180° que permite una difusión controlada (ver figura 1). El primer pulso de gradiente induce un desplazamiento de fase para todos los spins y el segundo pulso lo revierte. Entonces el desplazamiento de fase se cancela para los spins estáticos. No obstante, para los spins que han cambiado de posición debido al movimiento browniano durante un periodo de tiempo, el desplazamiento de fase serádiferente para los dos pulsos de gradiente. Esto significa que no se reenfocan los dos pulsos, lo cual resulta en una pérdida de señal.
Las imágenes están sensibilizadas de manera diferente a la difusión, pero siguen siendo idénticas en todos los demás aspectos. Para corregir esto, se realiza una medición sin difusión ponderada y otra con difusión ponderada para calcular la difusión real con la siguiente ecuación [16]:

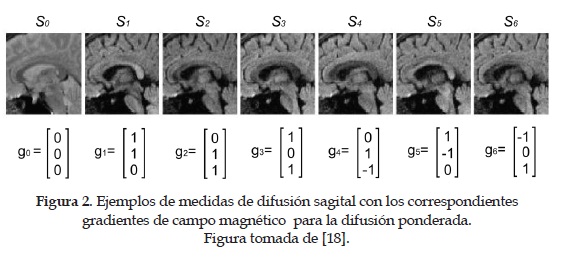
donde D es la difusión constante en el Voxel, S0 es la intensidad de la señal observada sin difusión ponderada (i.e b = 0 ) y Sk es la imagen con difusión ponderada (Diffusion Weighted Image- DWI). La cantidad de difusión ponderada estádada por el factor b, introducido por [17]. Además de la imagen base de referencia S0, existe la necesidad de hacer al menos seis medidas, usando direcciones de gradientes no colineales y diferentes para estimar el tensor de difusión simétrico D. Por lo tanto, se requieren mínimo 7 imágenes dwi con tensores ponderados y direcciones de gradiente diferentes para cada corte (slice) en el conjunto de datos. La Figura 2 tomada de [18], muestra un ejemplo de 7 dwi con las correspondientes direcciones del gradiente, donde S(/ S1,... ,S6 representan las intensidades de la señal en presencia de los gradientes gkpara k = 0,1, 6. S0es la medida básica de referencia con la que se obtienen las demás imágenes Sk, de modo que se insertan los gradientes g. Finalmente, es posible determinar el valor de cada una de las componentes de D, que debido a su simetría solo requeriráde seis gradientes para obtener seis ecuaciones. Se suele usar una mayor cantidad de gradientes para que la redundancia garantice una mejor resolución.
MATERIALES Y METODOLOGÍA
Base de datos
La base de datos estáconformada por cinco estudios mri-dt completos de pacientes con desórdenes neurológicos. La adquisición de los estudios sigue los protocolos clínicos del centro de imágenes diagnósticas cedicaf y el Instituto de Epilepsia y Parkinson del Eje Cafetero y son utilizadas para el planeamiento quirúrgico. Los pacientes son informados del propósito de la investigación y avalan el consentimiento informado. Para completar el estudio, se obtuvieron 4 estudios mri-dt internacionales disponibles en [19]. Las imágenes dti, obtenidas de un individuo de la base de datos se pueden ver en la figura 3 . Los pacientes son informados del propósito de la investigación y avalan el consentimiento informado.
Procedimiento metodológico
La dinámica de desarrollo del proyecto se fundamentóen la cooperación del Grupo de Investigación en Automática (Universidad Tecnológica de Pereira) y el Instituto de Epilepsia y Parkinson del Eje Cafetero (Neurocen-tro). Es importante y pertinente aclarar, que la incidencia de este proyecto no afectóo modificóel procedimiento conocido como estimulación cerebral profunda (dbs), el cual es establecido, estandarizado y aprobado por la sociedad de neurología de Colombia, ni puso en peligro a los pacientes, ya que la investigación se basóen el procesamiento de imágenes de resonancia magnética con tensor de difusión (mri-dt) que se adquieren en la planeación previa a la intervención quirúrgica. La adquisición es realizada por un conjunto de especialistas médicos conformado por neurólogos, neurofisiólogos, anestesiólogos y neurocirujano funcional pertenecientes al instituto de epilepsia y Parkinson del eje cafetero-Neurocentro S. A. El procedimiento metodológico se resume en los siguientes puntos:
1. Obtención de la matriz de conductividades: la obtención de la matriz de conductividades se puede dividir en dos pasos:
1. Cálculo del tensor de difusión D a partir de las imágenes: un dti típicamente contiene una imagen por cada dirección de gradiente y una imagen de referencia por cada corte (slice). En este caso se seleccionan K = 25 direcciones de gradiente y 24 slices que abarcan las zonas cerebrales de relevancia: Núcleo Subtalámico (stn), Tálamo (Tal) y Sustancia Nigra reticulata (snr). Por lo tanto el conjunto de datos contiene (25+1) x 24 = 624 imágenes. En Matlab, estos datos se organizan en un volumen de 4 dimensiones, que puede ser indexado así: M[k; fila; columna; slice], siendo el valor de M la intensidad de señal en la dirección, k = 1,...,K+1 la cantidad de gradientes; fila = 1,... ,256, columna = 1,..., 256 las coordenadas espaciales (x,y), y slice = 1,..., 24 es el número de cortes del mri. El dato M[1 : K + 1; 1 : 256; 1 : 256; 1 : 24] consiste en K + 1 imágenes de volumen con 24 slices cada una. La primera imagen representa la adquisición de referencia para calcular las demás, es decir la imagen S0. Luego para cada Voxel se calcula el tensor de difusión basado en los valores de
dimensiones: D[i; j; fila; columna; slice], donde i = 1,2,3 es el i-ésimo elemento fila y j = 1,2,3 es el j-ésimo elemento columna del tensor. Por lo tanto para cada Voxel se obtiene un tensor, el cual a su vez es una matriz de 3 x 3.
2. Conversión de Difusión a Conductividad: Los valores de difusión obtenidos en el análisis de las imágenes dti, se convierten de difusión a conductividad usando la transformación escalar dada por [20],
donde D es el tensor individual del cada Voxel, k = 0.844 ± 0.0545, S: Siemens, seg : segundos.
3. Estimación del potencial eléctrico: Luego de obtener la caracterización completa del comportamiento eléctrico de las estructuras cerebrales del paciente, se identifica la zona cerebral de estimulación. Finalmente, con la información de los parámetros de estimulación (amplitud, frecuencia, ancho de pulso, impedancia) y la matriz de valores de conductividad cerebral obtenida previamente, se estiman los valores del potencial eléctrico y su distribución espacial en las tres dimensiones. El resultado seráuna matriz tridimensional de valores de intensidades de activación eléctrica y cada dimensión es un eje espacial (x, y, z). El fenómeno de activación eléctrica cerebral se describe mediante la ecuación de Poisson [21], determinando el voltaje de activación como una función espacial junto a parámetros del tejido:
donde Ve es el voltaje de propagación, I representa la corriente inyectada en la estimulación y a es la matriz de conductividad del tejido cerebral. La ecuación (3) puede ser solucionada mediante aproximación por elementos finitos, debido a que no es posible hallar la solución analítica. El método de los elementos finitos consiste en dividir una estructura compleja en numerosas subdivisiones discretas para facilitar su análisis y estudio [22], [23]. En este enfoque las neuronas se representarán por modelos sencillos o múltiples, lo que permite determinar su dinámica dentro del campo de voltaje, e inclusive se incorporaráinformación detallada de atlas cerebrales, para mejorar aún más el modelo. Una vez que se ha caracterizado completamente las propiedades de las estructuras cerebrales (núcleo subtalámico, tálamo, sustancia Nigra) es necesario observar la difusión eléctrica de la dbs en función de los parámetros de estimulación y también de la impedancia de la interfaz tejido-electrodo.
4. Modelo Gráfico 3D para la visualización de estructuras cerebrales y potencial eléctrico generado en el sistema nervioso: la reconstrucción en tres dimensiones de las estructuras cerebrales se realizaráa partir del mapeo de imágenes bidimensionales de un atlas cerebral junto a MRI obtenidas de pacientes. Las imágenes del atlas cerebral tienen la ventaja de una métrica establecida y estandarizada, es decir, las estructuras mapeadas vienen medidas en milímetros; por otro lado, la MRI permite la segmentación clara de esas estructuras y es posible obtener una reconstrucción ajustada a la realidad. El modelo se desarrollóen lenguaje C++ usando la librería vtk. El modelo gráfico 3D es necesario para visualizar las estructuras cerebrales importantes en la dbs. También se puede observar el electrodo de prueba y el voltaje generado por la estimulación, de acuerdo a los parámetros y las características de difusión eléctrica obtenidas previamente. La visualización 3D tiene las opciones básicas de las imágenes tridimensionales como el zoom, transparencias y giros en todos los ángulos y direcciones.
RESULTADOS EXPERIMENTALES Y DISCUSIÓN
Cálculo de los tensores de difusión y de conductividad a partir de las imágenes DTI
El tensor de difusión es una medida vectorial de la difusión de cada Voxel. Luego que se estiman los tensores, se utiliza el 3D slicer para ubicar la región de interés en las secuencias de imágenes, por medio del módulo de segmentación o etiquetado automático con Atlas cerebral. Para la cirugía de la enfermedad de Parkinson, la región de interés estácompuesta por el Tálamo, el núcleo subtalámico y la sustancia Nigra. Debido a que el tensor de difusión de cada Voxel contiene demasiada información y su procesamiento requiere un supercomputador, se obtienen los resultados de algunas métricas promedio para la región talámica (Tal), subtalámica (stn) y sustancia Nigra (snr), las cuales se consignan en la Tabla 1.
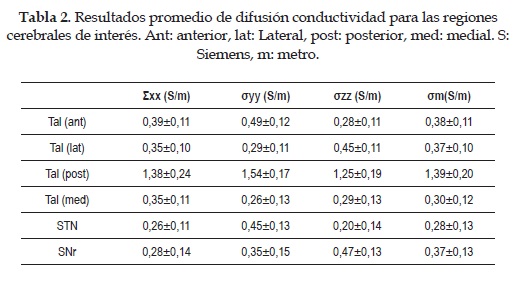
Con los resultados de la Tabla 1 y mediante la ecuación (2) se obtienen los valores promedio equivalentes de conductividad (Tabla 2). Donde Dxx, Dyy y Dzz son las difusiones en los ejes coordenados y Dm es la difusión media del tejido. La Anisotropía Fraccional (FA) es una medida de cuan isotrópico es un tejido. Por ejemplo un valor de FA igual a 0 representa una esfera perfecta, mientras que un FA de 1 es una difusión lineal ideal. Se conoce que los tractos bien definidos tienen un fa mayor a 0.20 y que muy pocas regiones tienen un FA mayor a 0.9. Esta medida da información de cuan asimétrica es la difusión, pero no dice nada de la dirección.
En este caso 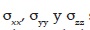 son las conductividades de los ejes coordenados y
son las conductividades de los ejes coordenados y 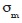 es la conductividad media.
es la conductividad media.
Estimación teórica del potencial eléctrico generado por la DBS
La ecuación (3) se soluciona mediante aproximación por elementos finitos [22], [23] debido a que no es posible hallar la solución analítica. El modelo volumétrico de elementos finitos se desarrollóen el software comsol Multiphysics 4.3. Se implementaron dos modelos de conducción del stn: el primero isotrópico y homogéneo con conductividades estandarizadas del tejido cerebral; el segundo anisotrópico y heterógeneo con tensores de difusión promedio de los pacientes.
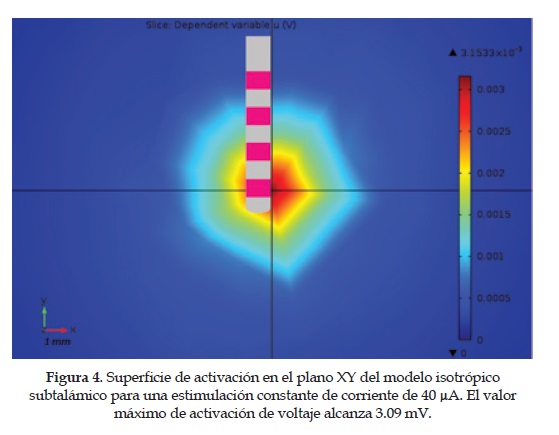
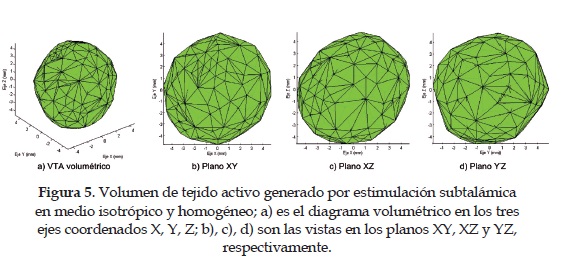
5. Modelo isotrópico del núcleo subtalámico: Se realizóun barrido de estimulación de corriente desde 20 hasta 200 |iA para obtener la propagación del potencial eléctrico en función de una conductividad promedio de 0.3 S/m para todo el tejido de estudio. Los resultados completos de la estimulación del stn se observan en las Figuras figura 4 y figura5 . Los resultados se obtienen para una estimulación controlada de corriente de 40 |iA.
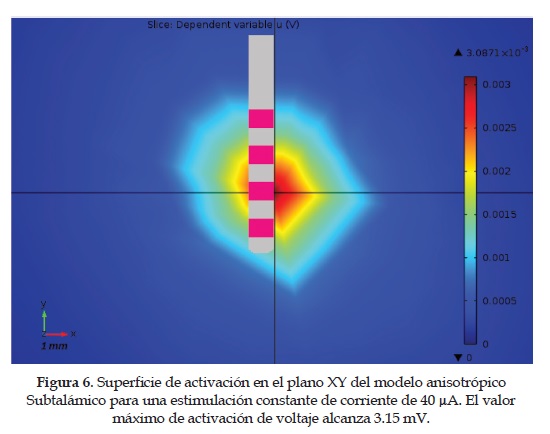
6. Modelo Anisotrópico del Núcleo Subtalámico: contrario al modelo isotró-pico donde se emplea un valor constante de conductividad, en este caso se utilizan los valores de conductividad promedio de la Tabla 2. Los resultados completos de la estimulación del núcleo subtalámico en medio anisotrópico se observan en las Figurasfigura 6 y figura 7 . Los resultados se obtienen para una estimulación controlada de corriente de 40 |iA.
Modelo tridimensional de simulación de DBS
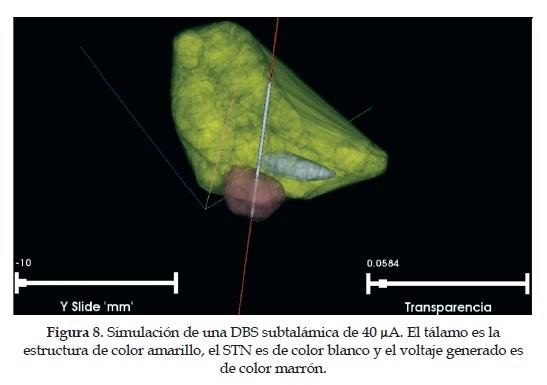
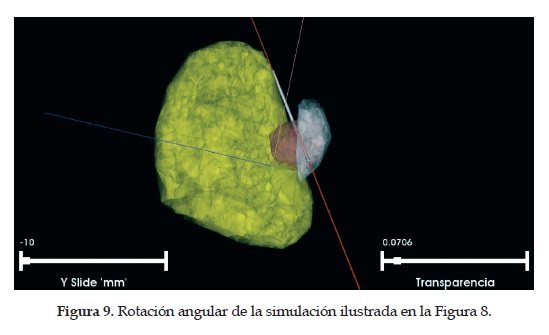
Se desarrollóun modelo gráfico tridimensional para la reconstrucción de las estructuras cerebrales importantes en la cirugía de la enfermedad de Parkinson, además el modelo permite la inclusión del electrodo de estimulación de prueba, asícomo el movimiento de este en el espacio. El modelo fue programado en lenguaje C++ usando la librería VTK (Visualization Toolkit). Finalmente, se realiza la renderización de los datos, es decir, el mapeo tridimensional usando la librería VTK (la descripción detallada de este proceso puede ser leída en [24]). Existen otros aspectos de la aplicación, como lo son la interfaz del electrodo y el volumen de tejido activo generado bajo parámetros de estimulación ya establecidos. Además, se puede visualizar la trayectoria del electrodo, el cual se renderiza como una línea recta en la escena de visualización que representa en donde estaráubicado el electrodo, si avanza o retrocede. Esta línea es un cilindro de diámetro menor y longitud mucho mayor, aplicándole la misma rotación que se le aplica al electrodo, la trayectoria queda también direccionada desde el punto de inserción, hasta el punto objetivo. En las Figuras 8 y 9 se muestran dos ángulos diferentes de una simulación completa con el electrodo y la propagación eléctrica generada para una estimulación subtalámica del hemisferio derecho.
En las Figuras 9 y 10 se ilustra el tálamo (color amarillo), el núcleo subtalámico (color gris), el potencial eléctrico generado (color marrón), el electrodo de estimulación intraoperatorio (cilindro de color gris) y su trayectoria (línea roja), asícomo los ejes espaciales (líneas perpendiculares de color azul, rosado y verde). Las barras de "transparencia" y "Y slide" son para controlar el nivel de transparencia de los objetos de la escena y para mover el electrodo por la trayectoria definida en el planeamiento de la cirugía.
Discusión general de los resultados
Los aspectos más importantes de los resultados se discuten y se analizan en los siguientes puntos:
1. Se construyóuna base de datos de imágenes de tensor de difusión de cinco pacientes locales y se obtuvieron otras pertenecientes a bases de datos internacionales. Aunque a nivel mundial, esta modalidad de MRI es ampliamente conocida y utilizada, en Colombia no se han desarrollado trabajos de investigación profundos acerca de las numerosas aplicaciones médicas que tienen estas imágenes. Los tensores de difusión proveen información muy importante acerca de la difusión de agua en el tejido cerebral, lo que permite realizar modelos de conductividad más precisos y específicos en comparación con anteriores datos de conductividad eléctrica cerebral. Además, ofrecen información de la direccionalidad y anisotropía de los tejidos, con lo cual se demuestra que los modelos homogéneos e isotrópicos no son recomendables para el modelo de conductividad cerebral. De lo anterior, se puede concluir que los tensores de difusión tienen un campo de desarrollo investigativo muy grande, con aplicaciones de alto impacto en el campo médico neurológico. Una ventaja adicional es que esta modalidad de resonancia magnética se puede utilizar tanto en la planeación de la cirugía de la enfermedad de Parkinson como en el diagnóstico y tratamiento de otros desórdenes neurodegenerativos como la epilepsia o migraña.
2. Se calcularon los tensores de difusión y se utilizóel software 3D slicer para ubicar la región de interés en las secuencias de imágenes. Se obtuvieron los resultados de algunas métricas promedio para la región talámica, del stn y de la snr (ver Tabla 1). Los resultados de difusión obtenidos en la población de estudio del eje cafetero son coherentes a los que se han reportado previamente para la materia gris y blanca y el líquido cerebro espinal. Un aspecto importante es que los ganglios basales presentan un valor de anisotropía fraccional (fa) considerable. Los valores de fa que se observan en la Tabla 1 son muy importantes, porque permiten establecer si la difusión en el tálamo, núcleo subtalámico y sustancia Nigra se pueden considerar como isotrópica. El valor de umbral establecido para considerar isotropía o anisotropía es 0.2 [25]. Los resultados obtenidos de FA para las distintas estructuras cerebrales importantes en la enfermedad de Parkinson, muestran que la sustancia Nigra es la más anisotrópica de ellas con un valor de 0.468±0.087, y se puede inferir que estácompuesta en su mayoría por materia blanca. Las demás estructuras (tálamo completo y el stn) muestran valores muy similares de fa, que son acordes con los intervalos establecidos, por lo cual un modelo isotrópico puede representar con poca precisión la activación eléctrica. Aunque el modelo isotrópico y homogéneo sigue siendo válido para la conductividad eléctrica en el cerebro, es claro que hay un error considerable al no tener en cuenta que cada estructura estáconformada por diferentes tipos de tejido, ya sea materia blanca, gris o líquido cerebro espinal.
3. Con la inclusión y cálculo de los tensores de difusión en el modelo se ha podido mejorar la estimación de la conductividad de las estructuras cerebrales relevantes en la DBS. La conversión escalar desarrollada por [20], es una buena aproximación de difusión a conductividad. El estudio desarrollado en [20] demostróque hay una fuerte relación entre la conductividad y los valores propios de la difusión. Los valores que se obtuvieron (ver Tabla 2) son consistentes con las medidas reportadas de conductividad del fluido cerebroespinal (1.54 S/m) [26] y de los ganglios basales (0.3 S/m) en modelos isotrópicos.
4. La estimación teórica del potencial eléctrico se logrócon la introducción del método de los elementos finitos. Para la comparación de resultados se establecióun modelo isotrópico y otro anisotrópico con tensores de difusión. Si bien, la expansión volumétrica de la activación eléctrica no difiere mucho en ambos modelos: aproximadamente entre 4 y 5 mm de radio, estos si difieren en su forma y orientación. Se puede observar en la figuras 4, 5, 6 y 7 que el modelo isotrópico presenta una propagación más uniforme y simétrica en todo el espacio, contrario al modelo anisotrópico donde la forma y orientación de la activación son irregulares, porque dependen de la conductividad tensorial obtenida de los pacientes. Es decir, el primero es un modelo genérico, donde se utiliza un valor de conductividad constante (0.3 S/m) para todo el medio. Mientras el segundo es un modelo específico, donde la conductividad es cambiante en el medio y es obtenida del procesamiento de mri-dt de los pacientes. En pocas palabras, el mayor problema del modelo isotrópico y homogéneo es que considera que el tejido cerebral presenta las mismas propiedades eléctricas en todo el espacio de análisis. Cuando la realidad es que el tejido neuronal es completamente heterogéneo, y los valores de conductividad no sólo van cambiando dependiendo del tipo de tejido (materia blanca, materia gris, líquido cerebro-espinal, etc.), sino que su orientación y directividad también lo hacen, con lo cual se afecta la geometría del volumen de activación. Esto tiene serias implicaciones en los resultados terapéuticos de la dbs, debido a que la activación eléctrica puede afectar otras estructuras cerebrales adyacentes al núcleo subtalámico, con lo cual se generan efectos secundarios no deseados. Con la inclusión de un modelo tensorial y heterogéneo, se logra capturar las propiedades anteriormente descritas, porque el tensor de conductividad no solo entrega la información del valor de conductividad en el medio, sino que también describe la directividad y orientación de la propagación del voltaje.
5. Se desarrollóun modelo gráfico tridimensional para la reconstrucción de las estructuras cerebrales, el electrodo intra-operatorio y el potencial eléctrico. Este modelo permite la visualización interactiva desde el desplazamiento del electrodo en los ganglios basales, asícomo la propagación eléctrica generada por la estimulación cerebral profunda con parámetros previamente establecidos. El modelo fue programado en lenguaje C++ usando la librería vtk (Visualization Toolkit), a partir de un atlas cerebral [27].
6. La metodología de simulación desarrollada en este trabajo se puede definir como un modelo realista que permite ver la incidencia del potencial eléctrico en otras estructuras del cerebro, lo cual puede servir para correlacionar la activación eléctrica con los resultados terapéuticos y los efectos secundarios que se producen por la estimulación cerebral profunda en enfermos de Parkinson de la región del eje cafetero en Colombia. Aunque estos resultados son preliminares, este modelo y metodología de simulación se pueden refinar mediante el registro gráfico con imágenes de resonancia magnética que permitan un análisis detallado de cada paciente. Actualmente, se estáadaptando esta metodología para aplicarse en el tratamiento de pacientes con enfermedad de Parkinson intervenidos en el instituto de Epilepsia y Parkinson del eje cafetero.
CONCLUSIONES
En este trabajo se desarrollóuna metodología para la estimación del potencial eléctrico generado por la dbs en pacientes con enfermedad de Parkinson. Se demostróque los modelos tensoriales de propagación eléctrica con tejido cerebral anisotrópico y heterogéneo son más precisos y acordes a la respuesta real de las neuronas ante la estimulación controlada, contrario a modelos simplificados como los que consideran el medio conductivo homogéneo e isotrópico. Igualmente, se establecióque la forma del volumen de la propagación eléctrica depende, en gran parte, de las propiedades intrínsecas que tiene el tejido cerebral afectado, por ejemplo de la cantidad de materia blanca y gris que lo conforman. Finalmente, se mostróque los tensores de difusión describen muy detalladamente el tejido cerebral y entregan información muy útil sobre la direccionalidad de los tractos nerviosos de estructuras relevantes en la dbs como el tálamo y el núcleo subtalámico.
AGRADECIMIENTOS
Los autores agradecen al instituto de epilepsia y Parkinson por la organización y etiquetado de la base de datos. Este trabajo hace parte del proyecto de investigación titulado: Estimación de los parámetros de neuro-modulación con terapia de estimulación cerebral profunda en pacientes con enfermedad de Parkinson a partir del volumen de tejido activo planeado, financiado por Colciencias mediante la convocatoria 657 del 2014 con código 111065740687. El autor H. D. Vargas Cardona estáfinanciado por el programa de Colciencias para la formación de alto nivel para la ciencia, la tecnología y la innovación - Convocatoria 617 de 2013.
REFERENCIAS
[1] S. Agrado Castaño, D. L. Guarín, y Á. A. Orozco. "Detection of determinism in neuronal activity background from microelectrodes recording signals", XVII Symposium of Image Signal Processing and Artificial Vision (STSIVA), 2012. [ Links ]
[2] A. Pedroza, Compendio de neurocirugía. 1st edition. Bogotá: Fundación Proneu-rocirugía, 2002. [ Links ]
[3] J. Ahlskog, "Parkinson disease medical and surgical treatment," Neurologic Clinics, vol. 19, pp. 579-605, 2001. [ Links ]
[4] J. Obeso, C. Olanow, M. Rodriguez-Oroz, P. Krack, R. Kumar, y A. Lang, "Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in parkinson's disease," N Engl J Med, vol. 34, pp. 956963, 2001. [ Links ]
[5] P. Limousin, P. Krack, P. Pollak, A. Benazzouz, C. Ardouin, D. Hoffmann, y A. Benabid, "Electrical stimulation of the Subthalamic nucleus in advanced parkinson's disease," N Engl J Med, vol. 339, pp. 1105-1111, 1998.
[6] W. Nowinski, D. Belov, P. Pollak, y A. Benabid, "Statistical analysis of 168 bilateral subthalamic nucleus implantations by means of the probabilistic functional atlas," Neurosurgery, vol. 57, pp. 319-30, 2005. [ Links ]
[7] J. Yelnik, P. Damier, S. Demeret, D. Gervais, E. Bardinet, B. Bejjani, C. Francois, H. JL, I. Arnule, D. Dormont, D. Galanaud, B. Pidoux, P. Cornu, y Y. Agid, "Localization of stimulating electrodes in patients with Parkinson'disease by using a three-dimensional atlas-magnetic resonance imaging coregistra-tion method," J Neurosurg, vol. 99, pp. 89-99, 2003. [ Links ]
[8] M. Johnson, S. Miocinovic, C. McIntyre, y J. Vitek, "Mechanisms and targets of deep brain stimulation in movement disorders," Neurotherapeutics, vol. 5, pp. 294-308, 2008. [ Links ]
[9] C. Butson, C. Maks, B. Walter, J. Vitek, y C. Mclntyre, "Patient specific analysis of the volume of tissue activated during deep brain stimulation," Neuroimage, vol. 34, pp. 661-670, 2007. [ Links ]
[10] B. Walter y J. Vitek, "Surgical treatment for parkinson's disease," Lancet Neurology, vol. 3, pp. 719- 28, 2004. [ Links ]
[11] A. Machado, A. Rezai, B. Kopell, R. Gross, A. Sharan, y A. Benabid, "Deep brain stimulation for parkinson's disease: surgical technique and perioperative management," Mov Disord, vol. 21, pp. 247-258, 2006. [ Links ]
[12] J. Volkmann, E. Moro, y R. Pahwa, "Basic algorithms for the programming of deep brain stimulation in parkinson's disease," Mov Disord, vol. 21, pp. 84-89, 2006. [ Links ]
[13] A. Mikos, D. Bowers, A. Noecker, C. McIntyre, M. Won, A. Chaturvedi, K. Foote, y M. Okun, "Patient-specific analysis of the relationship between the volume of tissue activated during dbs and verbal fluency," NeuroImage, vol. 54 , pp. 238-246, 2011. [ Links ]
[14] C. C. McIntyre, y C. R. Butson, "Tissue and electrode capacitance reduce neural activation volumes during deep brain stimulation," Clinical Neurophysiology, vol. 116, pp. 2490-2500, 2005. [ Links ]
[15] C. Maks, C. Butson, B. Walter, J. Vitek, y C. McIntyre, "Deep brain stimulation activation volumes and their association with neurophysiological mapping and therapeutic outcomes," J Neurol Neurosurg Psychiatry, vol. 80, pp. 659666, 2009. doi:10.1136/jnnp.2007.126219 [ Links ]
[16] J.E Tanner, y E.O Stejskal. "Spin diffusion measurements: Spin echoes in the presence of a time-dependent field gradient," Journal of Chemical Physiology, vol. 42, pp. 288-292, 1995. [ Links ]
[17] E. Breton, D Lallemand, P Grenier, E Cabanis, M Laval-Jeantet, y D LeBihan. "MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders," Radiology, vol. 161, pp. 401-407, 1986. [ Links ]
[18] K. Oppedal, "Quantitative Analysis of Magnetic Resonance Diffusion Tensor Imaging of the Human Brain". M.S. thesis, Dept. Biomedicine, Univ. Bergen, Bergen, Norway, 2005. [ Links ]
[19] National Alliance for Medical image computing, Midas Database [online]. Disponible en: http://www.insight-journal.org/midas/collection/view/190 [ Links ]
[20] D. Tuch, V. Wedeen, A. Dale, J. George, y J. Belliveau, "Conductivity tensor mapping of the human brain using diffusion tensor MRI," Proc Natl Acad Sci, vol. 98, pp. 11697-11701, 2001. [ Links ]
[21] S. Miocinovic, S. Lempka, G. Russo, C. Maks, C. Butson, K. Sakaie, J. Vitek, y C. McIntyre, "Experimental and theoretical characterization of the voltage distribution generated by deep brain stimulation," Exp Neurol, vol. 216, pp. 166-176, 2009. [ Links ]
[22] L.J. Segerind, Applied Finite Element Analysis. 2nd edition. New York, USA: John Wiley & Sons, 1984. [ Links ]
[23] D Hutton, Fundamentals of Finite Element Analysis. 1st ed. USA: McGraw-Hill,2004. [ Links ]
[24] D. Castillo, "Desarrollo de un modelo volumétrico que permita visualizar el recorrido de un microelectrodo de registro en línea durante la operación de Parkinson," Pregrade thesis, Dept. Ingeniería electrónica, Universidad del Quindío, Armenia, Colombia, 2012. [ Links ]
[25] P. Basser, "Inferring microstructural features and the physiological state of tissues from diffusion weighted images," NMR Biomed, vol. 8, pp. 333-344, 1995. [ Links ]
[26] B. Roth, "Steady-state point-source stimulation of a nerve containing axons with an arbitrary distribution of diameters," Med. Biol. Eng. Comput., vol. 30, pp. 103-108, 1992. [ Links ]
[27] A. Morel, Stereotactic Atlas of the Human Thalamus and Basal Ganglia. 1st edition. United States: Informa Healthcare, 2007. [ Links ]