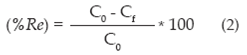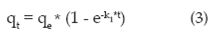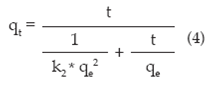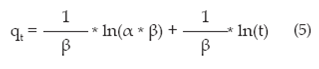INTRODUCCIÓN
El cromo es uno de los metales pesados que por su toxicidad y baja biode-grabilidad natural provoca la contaminación de las aguas residuales, debido alo cual constituye un problema ambiental muy grave 1, 2. Este metal se encuentra presente en el agua y suelo principalmente en dos estados de oxidación: trivalente (Cr(III)) y hexavalente (Cr(VI)). El cromo (VI) está presente principalmente en forma de ion cromato (CrO4 2-) e ion dicromato (Cr2O7 2-), y posee niveles más altos de toxicidad que en sus otros estados de valencia. El Cr(VI) es tóxico y cancerígeno, y puede causar irritaciones en la piel y daños en los ríñones, el hígado y el estómago 3),(4. Por lo tanto, la remoción de Cr (VI) del agua y aguas residuales es importante para la protección del medio ambiente y la salud humana 5.
Históricamente el cromo ha sido uno de los metales más ampliamente uti lizados para el revestimiento de piezas metálicas, debido a su resistencia a la corrosión. Además, forma parte de curtientes, pigmentos y conservantes textiles, aleaciones, pinturas, antiincrustantes, catalizadores, agentes anti corrosivos, lodos de perforación, baterías de alta temperatura, fungicidas, conservantes de madera, recubrimientos metálicos y electrogalvanizados 6.
Para el tratamiento de los efluentes líquidos que contienen metales pesa dos existen diferentes métodos fisicoquímicos; los más empleados son los siguientes: intercambio iónico, precipitación, ósmosis inversa y adsorción 7. Los elevados costos asociados al consumo de energía y productos químicos representan una desventaja de los métodos mencionados al ser aplicados a efluentes industriales con concentraciones bajas de metales. Adicionalmente, la disposición de los lodos resultantes resulta compleja debido a que estos, por su composición, representan un gran peligro para el medio ambiente 8.
Para ser atractivas, para las pequeñas y medianas empresas, las tecnologías emergentes de remoción de metales deben ser de bajo costo y fácil imple-mentación, debido a los recursos económicos restringidos que las Pymes pueden asignar a un sistema de protección ambiental adecuado que trate sus efluentes y cumpla la normativa vigente 8.
En este trabajo se utilizó cáscara de yuca (Manihot esculenta) para adsorber cromo (VI) de disoluciones acuosas. Se estudió la influencia de la con centración y de la temperatura en la cinética de adsorción y se realizaron pruebas para determinar la influencia de la concentración del adsorbente en la capacidad de remoción.
METODOLOGÍA
Materiales y reactivos
Se utilizó dicromato de potasio (K2Cr2O7) (Merck) (grado analítico) para preparar las disoluciones, ácido sulfúrico (H2SO4) para ajustar el pH y agua previamente destilada y desionizada. La cáscara de yuca se obtuvo en el municipio de Tubará (departamento del Atlántico, Colombia). La biomasa fue lavada, secada (al sol), molida y tamizada. Se seleccionó el tamaño de partícula <130 μm. Se realizaron pruebas para determinar el porcentaje de lignina en la biomasa. Además se hizo un análisis infrarrojo a la cáscara de yuca antes y después de la adsorción. Para la determinación del porcentaje de lignina se siguió el procedimiento descrito por Marion Carrier et al.9.
Instrumentos
Para el análisis de la concentración de cromo en las muestras se utilizó un espectrómetro de fluorescencia de rayos X por reflexión total (txrf) ("s2 picofox") de bruker 10. Para las pruebas de infrarrojo se utilizó un espectro-fotómetro iraffinity-1S de shimadzu. Con ayuda del "software"Statgraphics Centurion xvi.i, en su opción de ajuste de datos (regresión no lineal) se relacionaron los datos de cada prueba a cada uno de los modelos cinéticos.
Métodos
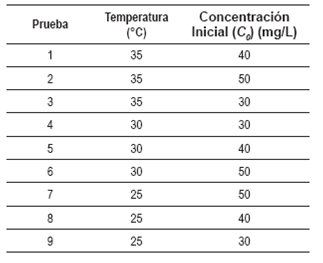
La disolución stock de Cr(VI) se preparó disolviendo 2 g de dicromato de potasio (K2Cr2O7) en 2000 ml de agua destilada y desionizada. Las disolu ciones estándar se obtuvieron por dilución hasta obtener las concentraciones de 30, 40 y 50 mg/l. El proceso de adsorción se realizó en un montaje por lotes. Se tomaron 300 ml de las soluciones estándar en un Erlenmeyer y este se introducía en un baño de agua con control de temperatura a tres temperaturas diferentes: 25, 30 y 35 °C. La masa de material adsorbente (Dp<130 μn) fue de 1 g por prueba. El pH de las disoluciones se ajustó antes de agregar la biomasa hasta el valor de 2, agregando la cantidad necesaria de ácido sulfúrico (H2SO4). El sistema se mantuvo en constante agitación con ayuda de un agitador magnético. Se tomaron 9 alícuotas (de 3 ml) a intervalos regulares de tiempo durante 40 minutos luego de agregado el adsorbente. Las alícuotas fueron centrifugadas a 5000 rpm durante 2 mi nutos para separar el adsorbente.
La tabla 1 muestra las condiciones de temperatura y concentración inicial de cada una de las pruebas realizadas. Cada prueba se realizó por duplicado.
La cantidad de cromo adsorbida por la biomasa (mmo1/g) se calculó ha ciendo uso de la siguiente expresión matemática:
Donde
C0 = concentración inicial de cromo en la disolución (mmo1/1).
Cf = concentración final de cromo en la disolución (mmo1/1).
Vo = volumen inicial de disolución (1).
Vf = volumen final de disolución (1).
m = masa de bioadsorbente utilizada en los ensayos (g).
El porcentaje de remoción se halló de la siguiente manera:
Los datos obtenidos en cada prueba se trataron y se filtraron. Posteriormente se ajustaron a los modelos cinéticos que se mencionan más adelante.
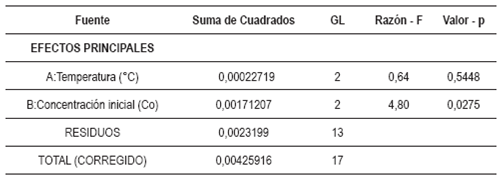
Con ayuda de Statgraphics Centurion xvii se realizó un análisis de varianza (anova multifactorial) tomando como variable dependiente la capacidad de adsorción en el equilibrio (Qe) y como variables independientes (facto res) la concentración inicial de las disoluciones (Co) y la temperatura (T); lo anterior con el propósito de determinar cuál es el efecto que tienen las variables independientes sobre la variable dependiente.
Por último, se realizaron pruebas variando la relación biomasa/solución en 2, 4, 20 y 25 g/l; la concentración inicial de las disoluciones fue de 100 mg/l y la temperatura 30 °C. El tiempo de contacto fue de 120 minutos. Cada prueba se realizó por duplicado.
• Porcentaje de lignina (%LG)
Se tomó 1 g de biomasa pre-tratada en un Soxhlet con acetona. Esta fue tratada con 15 cm3 de una disolución de ácido sulfúrico (H2SO4) al 72% durante dos horas a temperatura ambiente. La disolución anterior se diluyó con 560 cm3 de agua para reducir la concentración del ácido hasta el 3% y luego se puso a hervir durante 4 horas. El residuo (lignina) fue filtrado, lavado con agua caliente y secado.
• Modelo de primer orden reversible
Se basa en la suposición de que a cada ion metálico se le asigna un sitio de adsorción del material adsorbente. La ecuación algebraica que describe dicho modelo es
Donde qt es la cantidad adsorbida en un tiempo t, qe es la cantidad adsorbida en el equilibrio y k1 es la constante cinética de primer orden 11.
• Modelo de Pseudosegundo orden
En este modelo se supone que el adsorbato se adsorbe en dos sitios activos de la biomasa y la ecuación algebraica que describe este modelo es
Donde, qe es la capacidad de adsorción en el equilibrio y k2 es la constante cinética de Pseudosegundo orden 11.
• Modelo de Elovich
Este modelo supone la heterogeneidad de los sitios activos y, por ende, energías de activación diferente para cada uno de ellos. El modelo asume que la quimisorción en los sitios activos es un proceso heterogéneo mode lado con una reacción de segundo, lo cual conlleva a una expresión para la adsorción del tipo
Donde α es la velocidad inicial de adsorción y β está relacionado con la superficie cubierta y la energía de activación por quimisorción 11.
• Modelo de Difusión Intrapartícula
Para obtener la ecuación que describe la difusión intraparticular se mo dela el adsorbente con una estructura porosa homogénea y se asume que la velocidad de adsorción está limitada por la velocidad de difusión del adsorbato en los poros del adsorbente.
Bajo estas circunstancias, Weber y Morris 12 encontraron que la ecuación que define la difusión intraparticular viene dada por
Donde k es la constante de velocidad de difusión intraparticular 11.
RESULTADOS Y DISCUSIÓN
Cinética de adsorción
Dependiendo del pH, el cromo (VI) puede existir en forma de sales de áci do crómico (H2CrO4), ion cromato de hidrógeno (HCrO4 -) y el ion cromato (CrO4 2-) 13. Al pH de trabajo, el cromo está en forma de ion cromato de hidrógeno (HCrO4 -).
Pájaro et al.14 estudiaron el desempeño de la cáscara de yuca como adsorbente de cromo (VI) en medio acuoso; determinaron que el proceso presenta mayor remoción a pH ácidos y que existe una gran posibilidad que la adsorción sea del tipo química. Como es típico, el poder oxidante del Cr(VI) está en función del pH y a medida que este se hace más bajo, el Cr(VI) tiende a ser más oxidante (mayor reactividad) y es menos reactivo a pH más alto 13.
Dakiky et al.15 emplearon siete tipos de adsorbentes para remover Cr(VI) de aguas residuales industriales, alcanzando los máximos porcentajes de remoción a pH aproximadamente 2.
Bhattacharya et al.16 obtuvieron los mayores porcentajes de remoción de Cr(VI) de soluciones acuosas en el rango de pH de 2 a 3, utilizando distintos adsorbentes de bajo de costo.
Bhatt et al.4) removieron cromo de soluciones acuosas utilizando reticulado de quitosano-ácido dietilentriaminopentaacético y cuyo pH óptimo fue 3.
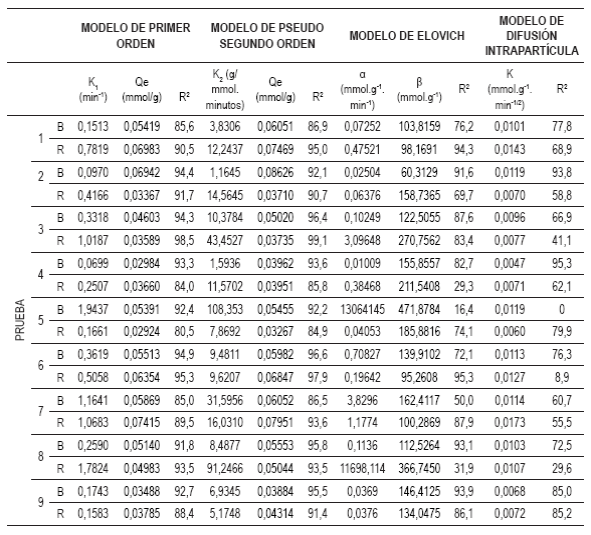
En la tabla 2 se reportan los parámetros de ajuste a cada modelo y su coefi ciente de determinación R2. Se observa que los modelos de primer orden y pseudosegundo orden son los que mejor describen la cinética de adsorción (mayores valores de R2).
El propósito de estos dos modelos es determinar la capacidad de adsorción máxima en el equilibrio (Qe) y las constantes de velocidad cinética de ad sorción (K 1 o K2). La importancia de las constantes de velocidad reside en la rápida eliminación del metal de la solución. Una constante cinética más alta significa una eliminación más rápida del ion metálico de la solución y una mejor adsorción; además, una rápida adsorción es atractiva para las industrias, ya que minimiza los costos de operación, número de empleados y la energía consumida. La capacidad de adsorción máxima en el equilibrio se asemeja a la cantidad de ion metálico que se puede remover potencial-mente por un adsorbente dado. Para este parámetro, una alta capacidad de adsorción se asocia también con la eficiencia del adsorbente 17.
El modelo de pseudosegundo orden es generalmente más apropiado que el modelo de primer orden para representar la cinética de biosorción de metales pesados, tal como se ha reportado previamente 18),(19.
Arris et al.20 informaron sobre la sorción de cromo (VI) usando carbón preparado por la calcinación de subproductos de cereales y concluyeron que el proceso se ajusta con un mayor índice de correlación al modelo de pseudosegundo orden que a los modelos de primer orden o difusión intrapartícula.
Cantu et al.21 utilizaron nanomateriales de óxido de manganeso Mn3O4 para remover Cr(III) y Cr(VI) de soluciones acuosas y determinaron que la cinética de sorción sigue un mecanismo de quimisorción de pseudose-gundo orden.
V. Marjanovic et al.22 concluyeron que el modelo de segundo orden es el mejor para ajustar el proceso de adsorción cromo(Vl) de soluciones acuosas utilizando sepiolitas (naturales y con activación ácida).
En el modelo cinético de pseudosegundo orden, la etapa limitante en la velocidad del mecanismo es la adsorción superficial, la cual implica quimisorción, en la que la remoción del metal es debido a interacciones fisicoquímicas entre dos fases 23. Los valores de la constante cinética K2 son relativamente elevados en comparación con otros procesos de sorción de Cr(VI) reportados en la literatura. En la tabla 3 se muestra un cuadro comparativo de los valores de la constante cinética de segundo orden para procesos de adsorción de Cr(VI) utilizando distintos adsorbentes. Estos valores altos de la constante cinética permiten suponer que el equilibrio de adsorción se alcanza con mayor rapidez. En esta investigación se determinó que el tiempo en el cual se alcanza el equilibrio está entre 10 y 25 minutos aproximadamente, tiempo que es bajo en comparación con otros adsorbentes utilizados para remover Cr(VI) reportados en la literatura.
Tabla 3 Comparación de las constantes cinéticas de pseudosegundo orden para remoción de Cr(VI) con distintos adsorbentes (K2: g/mmol. minutos), (T: temperatura en °C), (C0: concentración inicial en mg/l).
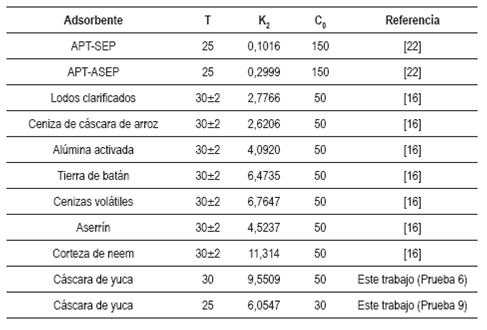
Lo anterior nos permite inferir que los sitios activos del adsorbente no presentan impedimentos estéricos que impidan un rápido ataque de los iones metálicos a los mismos o que el tamaño de los poros del biomaterial es adecuado para la adsorción de Cr(VI).
Bhattacharya et al.16 utilizaron siete tipos de materiales para adsorber cromo (VI) y determinaron que el tiempo necesario para alcanzar el equi librio, para el caso de dos de los adsorbentes que utilizaron, era de 2 horas y de 3 horas para los otros cinco (ver tabla 4). Por lo anterior, la cáscara de yuca ofrece una ventaja competitiva como material adsorbente, ya que se disminuye el tiempo de contacto necesario para lograr el equilibrio.
Tabla 4 Tiempo necesario para alcanzar el equilibrio para diferentes adsorbentes. (C0=50 mg/l; Relación de 10 g/l) (16)

En la tabla 5 se puede notar que la capacidad de adsorción de la cáscara de yuca es comparable e incluso superior en algunos casos con la de otros adsorbentes.
Efecto de la concentración inicial y la temperatura sobre la capacidad de adsorción máxima en el equilibrio (Qe)
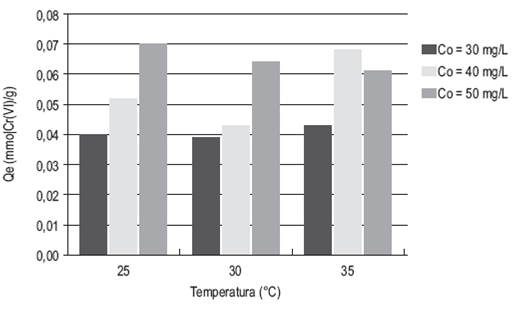
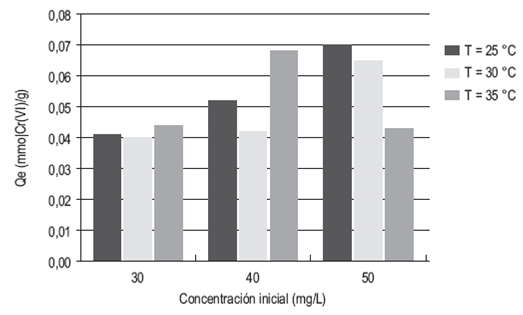
Las figuras 1 y 2 fueron construidas con base en los valores de la capacidad de adsorción Qe obtenidos con el ajuste de los datos al modelo de pseudo-segundo orden (tabla 2). Los valores de cada prueba fueron promediados.
Se puede notar la relación de proporcionalidad entre la capacidad de adsor ción y la concentración inicial de la disolución: a mayor concentración mayor es la capacidad de remoción. Por otro lado, se observa que la temperatura es una variable que no se relaciona proporcionalmente con la capacidad de remoción y no se observa una clara tendencia en el comportamiento de estas variables.
Por otra parte, el análisis de varianza (tabla 6) muestra que la temperatura no tiene un efecto significativo sobre la capacidad de adsorción en el equilibrio (Qe) (Valor-p > 0,05), caso contrario a lo que ocurre con la concentración inicial, (Valor-p < 0,05), lo cual indica que esta sí afecta de manera signifi cativa a la variable dependiente.
Efecto de la concentración del adsorbente sobre el porcentaje de remoción
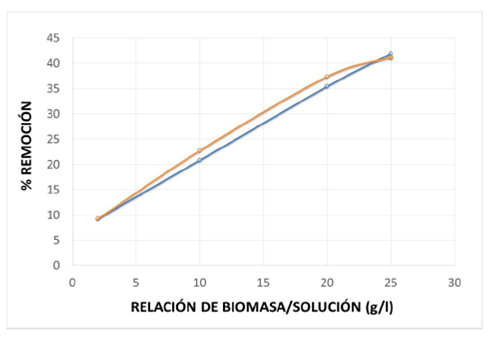
En la figura 3 se observa que el porcentaje de remoción aumenta proporcionalmente con la relación de biomasa, siendo que hasta el valor de 25 g/l la curva aún mantiene una tendencia lineal, por lo que se espera que en valores superiores a este, el porcentaje de remoción siga aumentando y alcance valores superiores al 40 %. El tiempo de contacto para estas pruebas fue de 120 minutos, y se alcanzó el equilibrio antes de 40 minutos.
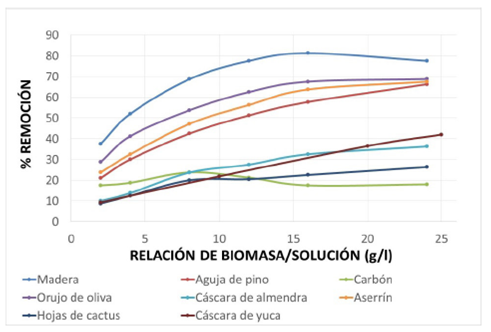
Figura 4 Efecto de la concentración del adsorbente en el porcentaje de remoción de Cr(VI) por distintos adsorbentes: pH=2; (Cr(VI))=100 mg/l; tiempo de contacto 2 horas; y temperatura 30 °C 15
Dakiki et al.15 estudiaron el desempeño de seis materiales para remover Cr(VI) de aguas residuales industriales (madera, carbón, cáscara de almendra, hojas de cactus, aguja de pino, orujo de oliva, aserrín). En la figura 4 se presenta un gráfico en el cual se muestra cómo varía el porcentaje de remoción del metal al variar la concentración de los adsorbentes utilizados en su investigación, comparado con el desempeño que ofrece la cáscara de yuca (este trabajo).
En la figura 4 se nota que a la relación de 24 g/l, el porcentaje de remoción de la cáscara de yuca es aproximadamente 40%; valor que es superior al reportado para los otros materiales adsorbentes como el carbón, cáscara de almendra, hojas de cactus, pero a su vez inferior al de los otros cuatro adsorbentes utilizados. Por lo anterior se puede decir que la cáscara de yuca ofrece porcentajes de remoción de Cr(VI) medios, en las condiciones de trabajo, y que ofrece la ventaja de poder aumentar la concentración del biosorbente, haciéndola aun más prometedora para la descontaminación de aguas residuales. Futuras investigaciones deberán estar encaminadas a tratar de mejorar la capacidad de adsorción de la cáscara de yuca mediante tratamientos físicos o químicos, y aprovechar la ventaja competitiva que ofrece la cáscara de yuca en cuanto a la rapidez de adsorción.
Caracterización del material biosorbente
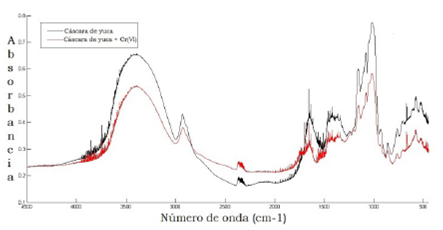
El porcentaje de lignina del material adsorbente utilizado en esta investi gación fue de 18.7 %. En la figura 5 se muestran los espectros del análisis IR realizado a la cáscara de yuca antes y después del proceso de adsorción.
Analizando los espectros se evidencia que la cáscara de yuca exhibe una super ficie heterogénea y compleja, y la comparación de los espectros del adsorbente sin cromo y el adsorbente con cromo adsorbido muestra la alteración de algunos grupos funcionales después de la adsorción. El pico observado en 3404 cm-1, que corresponde al O-H del grupo hidroxilo en la estructura lignocelulósica (25, 26), presenta una disminución de su intensidad después de la adsorción, además el pico correspondiente al grupo carboxílico (1653 cm-1) para adsorbido de igual forma muestran una disminución de la intensidad del pico luego del proceso. Aparece un hombro en 1734 cm-1 en el espectro de la cáscara de yuca con cromo adsorbido y desaparición de un pico alrededor de 931 cm-1 (25, 26).
En general, el cambio en los grupos funcionales de la superficie del adsor bente se observa principalmente en los grupos hidroxilo y carboxilo; lo cual nos permite inferir que en estos se da la adsorción de Cr(VI) y se pueden denotar como los sitios activos del adsorbente.
CONCLUSIONES
La cáscara de yuca es un material de bajo costo, cuya capacidad de remo ción de Cr(VI) (en medio acuoso) es relativamente buena para realizar tratamientos primarios de efluentes industriales contaminados con este ion metálico. Se encontró una relación directa entre la concentración de la disolución y la capacidad de remoción de la cáscara de yuca. El modelo que mejor ajusta el proceso de adsorción de Cr(VI) es el de Pseudosegundo Orden y los sitios activos de adsorción se dan principalmente en los grupos funcionales hidroxilo y carboxilo en la superficie del adsorbente, lo cual evidencia que el proceso puede ser considerado como adsorción química. Por otra parte, el equilibrio de adsorción, a las condiciones estudiadas, se alcanza en tiempos relativamente cortos, entre 10 y 25 minutos, en compa ración con otros materiales. Finalmente, se observó que la temperatura, dentro del rango estudiado, no presenta una influencia significativa sobre la capacidad de adsorción máxima de equilibrio, mientras que la dosis de adsorbente aumenta proporcionalmente el porcentaje de remoción.