I. INTRODUCCIÓN
Todo proceso de reciclaje debe cumplir los criterios de ser ambientalmente benéfico y económicamente viable. Esta evaluación debe basarse en el buen conocimiento técnico de los procesos implicados en el procesamiento del material en cuestión [1], [2]. En la actualidad, las baterías de plomo-ácido son recicladas en más del 90 % por medios pirometalúrgicos, en los que se recupera generalmente el ácido, el polipropileno de la carcasa y el plomo, y con la misma tecnología el proceso continúa para la recuperación de otros metales tales como zinc, níquel y cadmio [3]. Esta metodología de reciclaje tiene el inconveniente de promover emisiones de dióxido de azufre al descomponer el sulfato de plomo a temperaturas elevadas, además de las emisiones de partículas muy finas de plomo que contribuyen a la polución del medio ambiente [4], [5]. El plomo en sus diversas formas se considera un residuo peligroso, debido a los efectos nocivos que tiene sobre los organismos vivos y, en especial, sobre la salud humana [6], [7]. Existen procesos conocidos a nivel mundial para el reciclaje de baterías, algunas veces diseñados para una clase especial de baterías. Sin embargo, de igual forma las baterías se pueden reciclar junto con otros tipos de materiales. Algunos de estos procesos son los siguientes: Sumitomo (japonés); Recytec (suizo); Atech; y Snam-Savam (franceses); Sab Nife (suizo); Inmetco (norteamericano); Waelz, TNO; y Accurec (alemanes), entre otros [4]. El reciclaje de baterías de plomo no es ajeno a Colombia, incluso esta actividad está contemplada por la ley. En la Resolución 0372 de 2009 del Ministerio de Ambiente, Vivienda y Desarrollo Territorial de la República de Colombia se establecen los elementos que deben contener los planes de gestión de devolución de productos posconsumo de baterías usadas de plomo-ácido [8].
Una batería es un dispositivo electroquímico que posee la habilidad de convertir energía química a energía eléctrica. Una batería básica consiste en un ánodo, un cátodo, un electrolito, unos separadores y una carcasa. Las diferentes baterías se clasifican por los materiales utilizados como electrodos y electrolitos. Los componentes potencialmente peligrosos de las baterías incluyen mercurio, plomo, cobre, zinc, cadmio, manganeso, níquel y litio [9]. Las baterías de plomo-ácido están compuestas de una aleación de plomo y un material base de óxido de plomo (PbO2). Durante el lento proceso de descarga de las baterías se forma sulfato de plomo (PbSO4), de manera que termina así la vida útil de las baterías. El electrolito generalmente usado es una solución de ácido sulfúrico (H2SO4) [10].
Si se tienen en cuenta las propiedades tóxicas del plomo, es muy importante considerar otras formas de reciclaje para la recuperación de materiales de desecho que contienen plomo, como, por ejemplo, los procesos hidrometalúrgicos, los cuales tiene ventajas ya conocidas, tales como: costo de capital menor en comparación con un proceso pirometalúrgico; mayor flexibilidad para el tratamiento de variedad de metales o incluso residuos de procesos; la mano de obra en un proceso hidrometalúrgico es la mitad con relación a un proceso pirometalúrgico; los métodos hidrometalúrgicos pueden separar metales con propiedades similares, además de trabajar -en su mayoría- a temperatura ambiente y, por ende, no son fuentes de emisiones de SO2; las plantas hidrometalúrgicas trabajan con soluciones y pulpas que pueden transportarse por cañerías cerradas, lo cual muchas veces es conveniente y económico; entre otras ventajas [11].
La literatura técnica presenta diferentes agentes lixiviantes ácidos para atacar el plomo de las baterías de plomo-ácido. Baba et al. [12] determinaron que la velocidad de lixiviación aumenta con la concentración de ácido clorhídrico, la temperatura y la velocidad de agitación, y decrece con la razón sólido-líquido y el tamaño de partícula. Smaniotto et al. [6], al trabajar con ácido cítrico, citrato de sodio y mezclas de estos, determinaron que, si bien estos reactivos son llamativos por sus pocos impactos medioambientales, son restrictivos cuando se utilizan como agentes lixiviantes. Otros reactivos utilizados son mezcla de citrato de sodio y ácido acético, agentes interesantes debido a su poca polución ambiental y bajos costos [13].
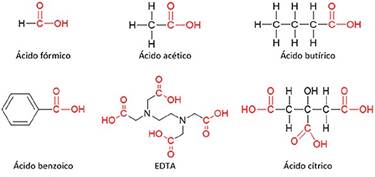
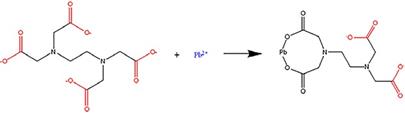
El reactivo ácido etilendiaminotetracético (EDTA) se ha utilizado de forma eficiente en procesos de lixiviación (o biolixiviación) a fin de disolver metales, como, por ejemplo, plomo [14]-[16], plomo y zinc [17], plomo y cadmio [18], y plomo y cromo [19], pues causa menos daños medioambientales cuando llega a las aguas subterráneas. El plomo se puede disolver a partir de fases oxidadas en soluciones acuosas de ácidos carboxílicos (-COOH) [20]; otros ácidos carboxílicos utilizados son el ácido fórmico, ácido acético, ácido butírico, ácido benzoico, ácido cítrico, ácido etilendiaminotetracético (EDTA), entre otros. Una representación de la estructura de estos ácidos se muestra en la Fig. 1.
A diferencia de los ácidos inorgánicos comunes tales como el ácido clorhídrico (HCl), el nítrico (HNO3) y el sulfúrico (H2SO4), los ácidos carboxílicos, por lo general, son ácidos débiles, y se ionizan en forma limitada en el agua, lo cual tiene alguna ventaja medioambiental. En el equilibrio, las diluciones acuosas de los ácidos débiles contienen una mezcla de moléculas del ácido sin reaccionar, iones H+ y su base conjugada [21]. Un pretratamiento con peróxido de hidrógeno e hidracina se puede llevar a cabo antes del proceso de lixiviación de plomo, con el fin de liberar los iones de plomo (Pb2+), lo cual se realiza para facilitar el proceso de complejación del plomo con citrato trisódico y con ácido etilendiaminotetraacetato (EDTA) [20], [21].
Dado que el objeto del proyecto es disolver el plomo presente en las fases oxidadas de los residuos de baterías de plomo-ácido, se debe buscar una sal que aporte la base conjugada fuerte (disociación completa) del ácido carboxílico, por ejemplo, y que dicho agente lixiviante además de tener un bajo costo, también sea medioambientalmente amigable.
II. METODOLOGÍA
A. Preparación de la muestra
El material escogido para analizar fueron las baterías de plomo-ácido gastadas que utilizan los automóviles. El proceso de preparación de la muestra comienza con la eliminación del ácido sulfúrico contenido en las baterías (que se puede recuperar fácilmente) y, posteriormente, la extracción de las celdas compuestas por plomo y óxido de plomo. El paso siguiente es la preparación mecánica del material (disminución de tamaño), la separación y la clasificación del material que se va a lixiviar.
B. Caracterización del material de trabajo
Con el objetivo de determinar las fases mayoritarias presentes en el residuo, el material clasificado se caracterizó mediante difracción de rayos x (drx) en un equipo de referencia panalytical xPert PRO MPD, en un intervalo 2θ entre 4° y 70°, con un paso de 0,02° y un tiempo de acumulación de 56 segundos; se usó un ánodo de cobre con Kα = 1,5406 å. También se utilizó microscopia electrónica de barrido (MEB) para establecer las características microestructurales de las partículas de la muestra, y además un análisis puntual por espectrometría de dispersión de energía de rayos X, EDS, los cuales fueron hechos en un equipo de referencia Phenom Pro X.
C. Análisis de estabilidad termodinámica
Para este análisis se crearon diagramas de estabilidad termodinámica (de Pourbaix) con el software Medusa. Esto se realiza con el fin de tener una mejor compresión de la naturaleza de los complejos de plomo formados y, particularmente, de las zonas de solubilidad en presencia de sulfato, plomo y diversos ácidos carboxílicos (ácido fórmico, ácido acético, ácido oxálico, ácido cítrico y ácido etilendiaminotetracético).
D. Proceso de lixiviación
A partir de los diagramas de Pourbaix se obtuvieron las condiciones de lixiviación teórica para los agentes lixiviantes analizados. Estas condiciones de lixiviación determinan el rango de pH de trabajo dentro de la región de estabilidad del agua, la temperatura de trabajo, el porcentaje de sólidos de la pulpa y la concentración del reactivo de lixiviación a utilizar. Antes del proceso de lixiviación se realizó un pretratamiento que consistió en la adición de 10 ml de peróxido de hidrogeno (al 50 %), y cuatro gotas de hidracina (pura) para liberar el ion plomo (Pb 2+). Se debe tener presente que este proceso es para un material que contenga en su gran mayoría sulfato de plomo y dióxido de plomo (48 % PbSO4 y 46 % PbO2). Las pruebas de lixiviación con citrato se llevaron a cabo en un Erlenmeyer con agitación magnética, a temperatura de 25 °C, con una pulpa al 10 % de sólidos, una concentración de agente lixiviante a 1M, y el pH se modificó con ácido clorhídrico hasta un pH de 7. Las condiciones de lixiviación con EDTA fueron iguales a las anteriores, excepto por el pH -el cual fue de 12-, resultado de la agregación del reactivo lixiviante. El análisis cinético se realizó con base en el porcentaje de plomo lixiviado a 15, 30, 60, 120, 180 y 240 minutos. Los licores obtenidos en los procesos de lixiviación se analizaron en un espectrofotómetro de absorción atómica de referencia Thermo Scientific iCE 3000.
III. RESULTADOS Y DISCUSIÓN
A. Preparación de la muestra
El proceso comienza con la abertura y extracción de la pasta de las baterías y la disposición del ácido sulfúrico (H2SO4), el cual fue neutralizado con carbonato de sodio (Na2CO3). La pasta de la batería se lavó y secó a temperatura ambiente y se aseguró una humedad del 10 % máximo. El residuo fue tratado mecánicamente a través de un pulverizador y luego clasificado hasta obtener un tamaño de partícula pasante malla Tyler N°200 (< 75 μm).
B. Caracterización del material de trabajo
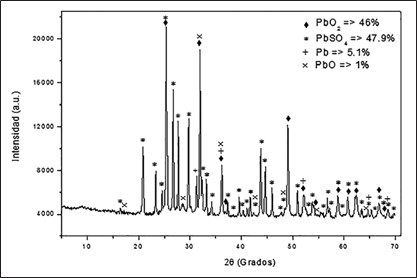
El análisis por DRX arrojó las fases predominantes que existen en el residuo en estudio, como se muestra en el difractograma de la Fig. 2. En esta se observa que las dos fases mayoritarias son el sulfato de plomo (PbSO4) con una concentración aproximada del 48 %; y el dióxido de plomo (PbO2) con una concentración aproximada del 46 %. El plomo metálico (Pb) se encuentra en una concentración del 5,1 % y el óxido de plomo (PbO) está presente con una concentración aproximada del 1 %. La cuantificación se realizó utilizando el software de análisis High Score Plus.
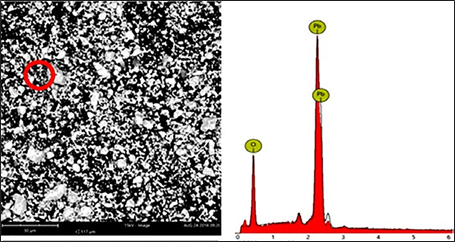
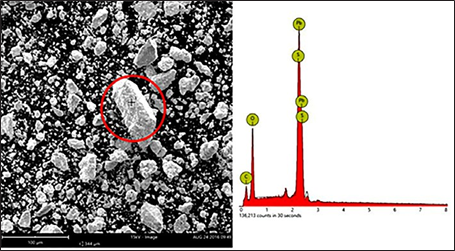
El análisis por microscopía electrónica de barrido (MEB) del residuo en estudio evidencia que el tamaño de las partículas es inferior a 100 µm, y se encontraron inclusive partículas inferiores a 4 µm, como se puede observar en la Fig. 3. El material de estudio también presenta una distribución de tamaños sin presencia de partículas angulosas o planas, tal vez debido a la poca dureza que caracteriza a los materiales que contienen plomo.
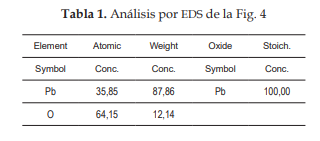
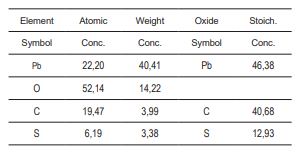
Los análisis por eds demuestran que el residuo en estudio contiene partículas de óxidos de plomo (ver Fig. 4 y Tabla 1). Además del óxido de plomo, debe existir presencia de azufre debido al sulfato de plomo (ver Fig. 5 y Tabla 2); la presencia de carbono se debe a la cinta de carbono en la que se monta la muestra.
C. Análisis de estabilidad termodinámica
Con la información suministrada por la difracción de rayos X y la cuantificación de especies presentes en la muestra es posible realizar el balance másico de plomo y el ion sulfato (las especies de interés en la reacción de complejación). Se debe tener en cuenta la presencia de los dos iones escogidos para la lixiviación: el ion citrato (HsC6O3- ) que es la base conjugada del ácido cítrico (véase la Fig. 6a); y el ion etilendiaminotetraacetato (H12C10N2 O4-8), que corresponde a la base conjugada del ácido etilendiaminotetracético (EDTA) (véase la Fig. 6b). El análisis termodinámico supone un residuo en el que el plomo está presente en un 78,6 %, y el ion sulfato en un 15,7 %; además, se tiene en cuenta una pulpa al 10 % de sólidos. El análisis se realiza considerando una concentración de plomo del 0,08 M, del ion sulfato del 0,03 M, y la concentración para las diversas bases conjugadas de los ácidos carboxílicos de 1M.
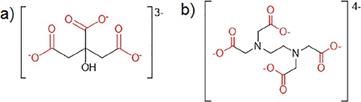
Figura 6 a) Base conjugada del ácido cítrico; b) Base conjugada del EDTA; obtenidas del software Medusa
En el análisis termodinámico se utilizaron los iones: formiato, acetato, oxalato, citrato y EDTA. Los diagramas de estabilidad termodinámica mostraron que solo con las bases conjugadas del ácido cítrico y el ácido etilendiaminotetracético (EDTA) se forman complejos de plomo estables (véanse la Fig. 7 y la Fig. 9), por lo tanto, esta es la razón de las pruebas de lixiviación con sal de citrato trisódico y sal tetrasódica de EDTA.
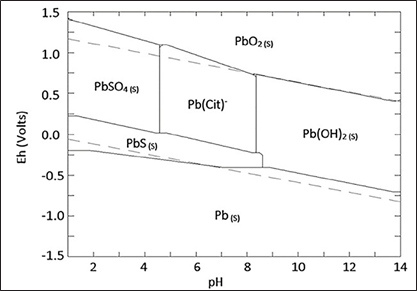
En la Fig. 7 se muestra el diagrama de Pourbaix para el sistema plomo- citrato-sulfato-agua. El área de solubilidad del plomo se encuentra en una región de pH entre 4,5 y 8,5, dentro la zona de estabilidad del agua, lo que indica los parámetros de solubilidad del plomo que estarían presentes en la muestra de trabajo. Se puede observar además que a pH menores a 4,5 no es posible lixiviar el plomo, pues este precipitaría como sulfato de plomo, o incluso, como sulfuro de plomo, también insoluble a pH ácidos. A pH alcalino mayor a 8,5 tampoco es posible disolver el plomo, pues este ahora precipitaría como hidróxido de plomo impidiendo su lixiviación.
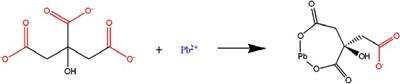
En la Fig. 8 se representa y plantea una posible vía de reacción para la formación del complejo plomo-citrato (Pb(Cit) - ), en la que los dos iones carboxilo de la molécula del ion citrato ligan al ion Pb2+ para formar el complejo C6H5o7Pb - “Pb(Cit) - ”.
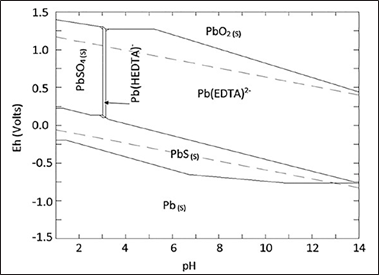
En la Fig. 9 se presenta el diagrama de Pourbaix para el sistema plomo- EDTA-sulfato- agua, en el que se observa que el área de solubilidad del plomo es mayor en comparación con el citrato, pues a partir de un ph de 3 hasta 14 se observa el ion Pb(EDTA)2 - en condiciones estables. Se observa además que si el ph disminuye a un valor menor a 3, el plomo precipitaría como sulfato de plomo y se detiene el proceso de disolución.
En la Fig. 10 se plantea la posible vía de reacción para la formación del complejo pb(EDTA)2-, en la que dos iones carboxilo de la molécula del ion etilendiaminotetraacetato ligan al ion de plomo para formar el complejo C10H12N8O8pb2 - “pb(EDTA)2 - ”.
D. Proceso de lixiviación
Además de la visión técnica y medioambiental del presente trabajo de investigación, otro elemento a tener en cuenta en este proyecto es la visión industrial. Por este motivo, la pureza química de los reactivos utilizados en el proceso de lixiviación es grado técnico, con costos de USD 1,7 500 gramos de ácido cítrico, y USD 2 500 gramos de EDTA (valores a febrero del 2017). Se debe tener presente que este proceso es para un material que contenga en su gran mayoría sulfato de plomo y dióxido de plomo (48 % PbSO4 y 46 % PbO2).
Lixiviación con citrato trisódico
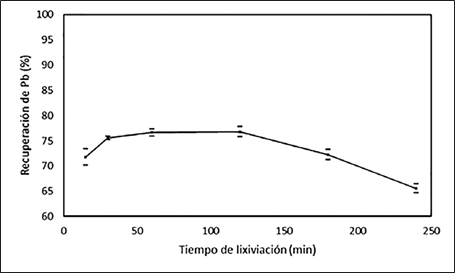
La Fig. 11 muestra la cinética del proceso de lixiviación de plomo con el ion citrato, en la que se logra la máxima extracción del metal aproximadamente a los 60 minutos, con un promedio del 76,8 %. Luego de este tiempo la extracción de plomo permanece constante hasta los 120 minutos, y a partir de este punto la extracción decae en el tiempo; esto puede ser a causa de la posible desestabilización del ion plomo-citrato y la aparición de la reacción inversa, pues como se observa en el análisis termodinámico este complejo tiene un área de estabilidad limitada.
Lixiviación con ácido etilendiaminotetraacetato (edta)
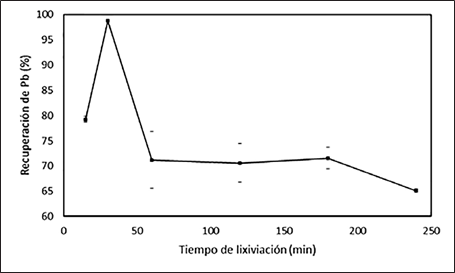
La Fig. 12 muestra la cinética del proceso de lixiviación de plomo con el EDTA, al lograr una extracción promedio de plomo del 99 % en tan solo un tiempo de lixiviación de 30 minutos. Posteriormente, la extracción de plomo decae, lo que también se puede explicar de nuevo por una desestabilización del complejo de plomo o por el principio de Le Chatelier. Por este motivo, se puede diseñar un proceso que incluya extracción del licor a un tiempo de 30 minutos y suministro de nuevos reactivos, a fin de que la cinética de reacción siempre tenga una pendiente positiva y se logre un proceso continuo.
IV. CONCLUSIONES
En el desarrollo del presente proyecto de investigación se logró establecer que la composición química del material sólido de baterías de plomo-ácido es aproximadamente 48 % pbSO4, 46 % pbO2, 5 % pb y 1 % pbO. Las condiciones de lixiviación y tipos de agente lixiviante se obtuvieron a partir de los diagramas de Pourbaix. Se lograron extracciones del 77 % de plomo utilizando el ion citrato con una concentración de 1M, a temperatura ambiente, pH de 7, al 10 % de sólidos y en un tiempo de 60 min; y extracciones del 99 % para el ion etilendiaminotetraacetato con una concentración de 1M, a temperatura ambiente, ph de 12, al 10 % de sólidos y en un tiempo de 30 min. A partir de las pruebas de laboratorio se demuestra que es técnicamente posible un proceso hidrometalúrgico para el reciclaje de plomo proveniente de baterías de plomo-ácido agotadas, pues con este proceso no existen emisiones de dióxido de azufre al descomponer el sulfato de plomo a temperaturas elevadas, ni tampoco emisiones de partículas muy finas de plomo al medio ambiente.