Introducción
Los tratamientos convencionales para el cáncer de piel incluyen cirugía (escisiones, disecciones de nodos linfáticos), inmunoterapia, terapia dirigida, quimioterapia y radioterapia. Sin embargo, cada una de las técnicas mencionadas plantea restricciones y efectos secundarios, tales como amputaciones para el caso de escisiones quirúrgicas de gran tamaño, linfodemas en disecciones de nodos linfáticos, fiebres, vómitos y depresión en inmunoterapias o quimioterapias y caída del cabello, entre otros [1]. Es por esto que desde la bioingeniería se han buscado alternativas que puedan ser más eficientes y con menores impactos secundarios sobre el paciente, dentro de las cuales se destaca la nanomedicina [2]. De acuerdo con el U.S. National Institutes of Health, entre los años 2012 y 2013, de 7343 ensayos clínicos realizados alrededor del mundo y registrados en su base de datos relacionados con cáncer de piel, solo 107 involucran la nanomedicina, ninguno de los cuales se lleva a cabo en Latinoamérica [3]. Por otro lado, frente a la aplicación de biocampos en presencia de tumores de piel, solo se llevan a cabo en la actualidad 26 estudios (todos ellos en EE. UU.), la mayoría de los cuales se enfocan en el diagnóstico y no en el tratamiento de carcinomas [4].
En el periodo 2000-2006 se presentaron 70 887 nuevos casos de cáncer, en los cuales se destaca por su incidencia el cáncer de piel. Si bien no se tienen cifras precisas, se estima que para el 2020 la incidencia podría estar cercana a 102 casos por cada 100 000 habitantes [5]. El Instituto Nacional de Cancerología indicó que en Colombia, para el 2010, el 17,6% de los casos de cáncer atendidos por esta entidad correspondieron a cáncer de piel, lo que muestra también que en el país es el cáncer más frecuente [6]. Aunque la mortalidad por cáncer de piel no melanoma es relativamente baja (0,9 por 100 000 habitantes al año), la enfermedad genera altos costos a los sistemas de salud, además de dificultades para los pacientes [7].
Entre las alternativas para el cáncer de piel se encuentra el uso de nanopartículas metálicas. Las nanopartículas de plata tienen muchas propiedades que varían dependiendo de su tamaño y su forma, como, por ejemplo, sus características ópticas, químicas, magnéticas y físicas, lo que les confiere una gran importancia debido al gran número de aplicaciones en las que se pueden utilizar [8]. Las nanopartículas de plata se pueden usar en imágenes médicas, filtros, administración de fármacos, nanocompuestos y electrodos celulares 9. En recientes investigaciones, se ha observado una preferencia por las nanopartículas de plata en comparación con otras nanopartículas metálicas debido a que poseen una mejor absorción de la luz, por tanto, una mejor resolución y, a su vez, se ha demostrado una mejor afinidad por la funcionalización [9], [10], [11], [12]. En medicina se usan debido a su actividad antimicrobiana contra microorganismos. Su actividad está estrechamente relacionada con su tamaño, ya que las partículas con un área superficial mayor (más pequeñas) son más activas [11]. Se han realizado estudios en el cáncer de piel como, por ejemplo, el de Das et al. en el 2013, en el cual las nanopartículas poseían un tamaño de partícula de 50 nm [13].
El mayor desafío técnico que plantea el uso de nanopartículas es la reproducibilidad en su fabricación, ya que se requiere que estas tengan formas y tamaños específicos, lo que no constituye una labor trivial, especialmente cuando se busca incrementar los efectos biológicos a través de procesos bioquímicos denominados "de biofuncionalización" [2]. Pruebas in vitro han demostrado que las nanopartículas (interés del presente proyecto) tienen una aceptable tasa de éxito. Es así como este trabajo tiene como objetivo evaluar dos procesos de síntesis de nanopartículas de plata, utilizando, además, un proceso de biofuncionalización con polietilenglicol (PEG) para mejorar las propiedades de anclaje y la biocompatibilidad de las nanopartículas.
Materiales y métodos
Materiales
Los siguientes reactivos químicos se utilizaron para la síntesis de nanopartículas de plata, amino PEG, mPEG-NH2 Cat. N.o PG1-AM-5k-1, nitrato de plata Panreac, sodio citrato tribásico dihidrato acs de Panreac, ácido ascórbico (vitamina c) para bioquímica Panreac.
Métodos
Protocolo 1
El protocolo de síntesis de nanopartículas de plata se realizó con base en el método de reducción química. Se prepararon 200 ml de solución de nitrato de plata (AgNO3) con una concentración de 0,001 M, y se calentaron hasta ebullición manteniendo agitación constante; luego se agregaron 25 ml de la solución de citrato trisódico al 1% con agitación vigorosa hasta que la solución alcanzó un color amarillo pálido, tiempo en el cual se retira la fuente de calor y se deja en agitación vigorosa hasta alcanzar la temperatura ambiente. Con dicho proceso se obtienen semillas de nanopartículas de plata.
Estabilización
En la solución de semillas de plata se utilizan dos agentes estabilizadores, lo que divide este método en dos diferentes vías. En la primera se utiliza ácido ascórbico y en la segunda polietilenglicol PEG.
Con ácido ascórbico. Se esperaba que con la solución de ácido ascórbico las nanopartículas de plata queden espaciadas entre sí. Para este paso se prepararon 20 ml de una solución de ácido ascórbico (2,5x10-2M) en agua destilada bajo agitación. A esta solución se le agregaron 200 µl de la solución de semillas de plata (Protocolo 1) a temperatura ambiente y se mezcló por una hora. Este protocolo se denominó “A1”.
Con PEG. Con la mezcla de la solución con PEG se esperaba que este polímero sirviera de agente estabilizador al separar las nanopartículas y evitar su aglomeración, de manera que se lograra una activación superficial y se alcanzara un recubrimiento con este polímero. De esta manera, se llegaría a un tamaño de partícula óptimo para esta aplicación con niveles controlados de cobertura superficial con una buena estabilidad mecánica, química y térmica. Para este paso se tomaron 20 ml de PEG y se mezclaron con 20 ml de la solución de semillas de plata usando agitación por dos horas a temperatura ambiente; al final del proceso la solución tomo un color morado intenso. Este ensayo se denominó “P1”.
Protocolo 2
Se prepararon 200 ml de una solución de AgNO3 con una concentración de 2,08 ml y se calentó hasta ebullición con agitación constante a reflujo para evitar la evaporación del solvente. A esta solución se le agregaron, gota a gota, 17 ml de citrato trisódico dihidratado con una concentración del 1%, y se dejó por 45 min a reflujo bajo agitación. Posteriormente, se dejó enfriar hasta temperatura ambiente con agitación constante. Con el anterior protocolo se obtuvieron semillas de nanopartículas de plata, las cuales fueron filtradas y caracterizadas. A este protocolo se le nombró “semillas”.
Con ácido ascórbico. Una solución de 20 ml de ácido ascórbico se mezcla bajo agitación con 200 µl de solución de semillas de plata (“Protocolo 2”) por un tiempo de una hora. Este protocolo se llamó “AA2”.
Con PEG. Se tomaron 20 ml de PEG y se mezclaron bajo agitación con 20 ml de la solución de semillas de nanopartículas de plata (Protocolo 2), a temperatura ambiente por un tiempo de dos horas. Este protocolo se denominó “P2”.
Filtración
Todas las muestras anteriores se realizaron por duplicado y se depositaron en tubos falcón de 15 ml. Estas muestras fueron ultrafiltradas en una membrana de ultrafiltración de 5 kDa (Pellicon XL, biomax 50 cm2, Millipore). Luego fueron centrifugadas por 10 min a 4000 rpm. Después de la centrifugación se extrajo el precipitado de 200 µl y se obtuvieron alícuotas en recipientes de 1,5 ml y se almacenaron a 4 °C.
Caracterización
Identificación de la banda de la resonancia del plasmón
Con el fin de observar la absorción en la región ultravioleta-visible (UV-Vis) del espectro electromagnético de las muestras de AgNPs, se realizó un barrido desde 200 hasta 700 nm con un espectrofotómetro de fluorescencia Biotek synergy H1 del laboratorio de Bioprocesos de la Universidad de Antioquia, utilizando como blanco una solución de agua destilada.
Determinación del tamaño y la distribución de tamaño de partícula
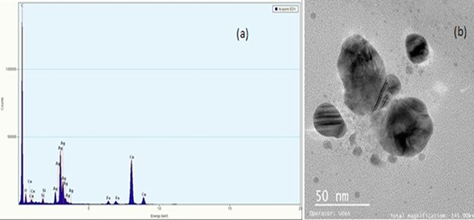
La evaluación del tamaño y la distribución de las nanopartículas se realizó por microscopía electrónica de transmisión (TEM), usando el equipo Tecnai G2 F20 de FEI del Laboratorio de Equipo Microscopía Electrónica de Transmisión de la Universidad de Antioquia. Como pretratamiento de la muestra, a una fracción de la dispersión coloidal se le realizó un proceso de deshidratación y de desecación de cualquier líquido que se encuentre en la muestra, luego se depositó en una rejilla portamuestras para la toma de las fotografías a escala nanométrica. Adicionalmente, un análisis semicuantitativo de la composición química de la muestra se realizó por espectrometría de dispersión de energías de rayos X (EDX) mediante el sistema acoplado al equipo de TEM.
Ensayo de viabilidad celular y citotoxicidad
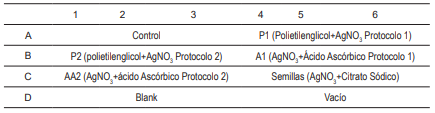
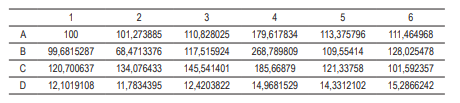
El ensayo para viabilidad celular se basa en la reducción metabólica del Bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT) realizada por la enzima mitocondrial succinato-deshidrogenasa en un compuesto coloreado de color azul (formazan), lo cual permitió determinar la funcionabilidad mitocondrial de las células tratadas. Este método ha sido muy utilizado para medir supervivencia y proliferación celular. La cantidad de células vivas fue proporcional a la cantidad de formazán producido. Este método lo desarrolló Mosmann en 1983, y lo modificaron, en 1986, Francois Denizot y Rita Lang . En este ensayo se utilizaron como control fibroblastos humanos sin ningún aditivo. Las nanopartículas de plata obtenidas en los diferentes procesos se esterilizaron con UV por una hora, luego se pusieron en contacto con 50 000 células de fibroblastos por pozo, por 24 h, con el fin de observar si a este tiempo se observa citotoxicidad. Se realizó cada ensayo por triplicado, y finalmente se midió la absorbancia a cada uno de los pozos y se comparó con el control para determinar la citotoxicidad y la viabilidad celular. En la Tabla 1, con las letras A, B, C y D se encuentran los protocolos en cada una de las filas. Los números significan el número de repeticiones por ensayos que se realizaron. El ensayo de viabilidad se llevó a cabo utilizando el esquema que se presenta en la misma Tabla 1.
Los resultados se expresarán como porcentaje (%) de células vivas, según la siguiente relación (Ecuación 1):
Donde la densidad óptica es la medida de la absorbancia en el pozo, las células tratadas son aquellas que estuvieron en contacto con las nanopartículas de plata producidas por los diferentes tratamientos y el control son las células sin ningún tratamiento.
Resultados y discusión
Identificación de la banda de plasmón
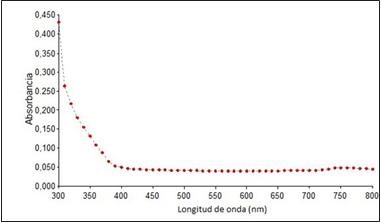
La espectroscopía de absorbancia UV-Vis es una técnica que se utiliza en el estudio de nanopartículas metálicas, ya que la longitud de onda de la banda y el ancho de banda produce una huella espectral para cada metal y varía según la forma y el tamaño de la nanopartícula [10]. En la Figura 1 se muestra el espectro de absorción UV-Vis tomado a la muestra de semillas del segundo protocolo, en la que se observa un pico de absorbancia máximo alrededor de los 435 nm, correspondiente a la resonancia de plasmón de las AgNPs.
La absorbancia de plasmón reportada en la literatura para coloides de plata se encuentra en el intervalo de 400-450 nm y varía dependiendo de la forma, el tamaño, la dispersión y el método de síntesis [15]. Como se observa en la Figura 1, la muestra obtenida arrojo un máximo de absorbancia aproximada de 435 nm que se encuentra en el rango mencionado, lo que demuestra la presencia de nanopartículas de plata y éxito en el protocolo. Al observar el resultado en la caracterización UV-Vis de Chowdhury et al. [12], en el cual obtienen un máximo pico de absorbancia alrededor de los 430 nm, y comparado con el resultado que se obtuvo en este trabajo, se confirma la presencia de AgNPs en este estudio.
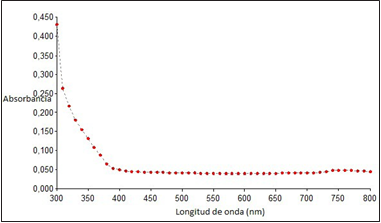
En la figura 2 se puede observar el resultado del espectro entregado por el UV-Vis en el cual no se observa la banda característica de nanopartículas de plata cerca de los 430 nm. Esto debido a que en la síntesis no se logró la particulación del nitrato de plata, por lo cual no se obtuvieron nanopartículas de plata.
Determinación del tamaño y la distribución de tamaño de partícula
Se le realizó caracterización TEM a tres muestras. La primera fue a la muestra semilla del segundo protocolo, la cual antes había arrojado positivo en la prueba de absorbancia que se observa en la Figura 2.
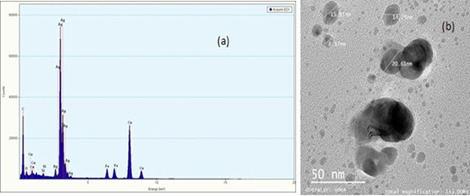
En la Figura 2a se observa el espectro EDX, en el cual se evidencia una gran presencia de plata (Ag), lo cual confirma que las nanopartículas efectivamente contienen este elemento, sin presencia significativa de oxígeno en relación con la plata, por lo que se puede entender que la plata no está oxidada. En pequeñas proporciones se observan otros elementos como Fe, C, Cu y Si, cuya presencia puede ser debida a la membrana que suspende la muestra, por lo que dichos elementos no pertenecen a la muestra. En la micrografía (Figura 2b), se observan las nanopartículas de plata de tamaño nanométrico (<100 nm). En la imagen se observan nanopartículas cuasi esféricas de diferentes tamaños que van desde menos de 5 nm a 40 nm, ideales para la función que se propone en este trabajo: servir en el tratamiento del cáncer. Se observan espacios entre la mayoría de ellas, lo que puede dar indicios de la utilidad del citrato de sodio tribásico dihidrato tanto como agente reductor como agente estabilizador; no obstante, se presentan acumulaciones de algunas partículas en islotes que se superponen, como se observa en la imagen como nanopartículas más oscuras en escala de grises. Aunque algunas de las nanopartículas quedaron de tamaño muy pequeño para el propósito de este proyecto (menores de 10 nm), ya que según la literatura es bueno trabajar con un tamaño de partícula de más de 10 nm para evitar la permeabilidad en algunas membranas del cuerpo humano y evitar citotoxicidad, se debe utilizar un posterior tamizaje a fin de obtener solo las nanopartículas de tamaño deseado (mayores de 10 nm) 9.
Las nanopartículas obtenidas usando el Protocolo 2 que contiene polietilenglicol, llamado “P2”, se muestran a continuación en la Figura 3. En la Figura 3a el espectro EDX muestra la presencia de plata, pero una proporción mucho más pronunciada de carbono que podría indicar la presencia del polímero PEG; los otros elementos de nuevo se pueden deber a la rejilla en la que se deposita la muestra. En la Figura 3b se observa la imagen TEM de la muestra de semillas de plata (Protocolo 2) con presencia del polímero PEG, en la cual se observa aún el patrón de tamaños observado en la figura 2b, lo cual también puede evidenciar que el PEG ha embebido las nanopartículas de plata que era el objetivo de usar dicho material en el protocolo de síntesis. Comparado con otros estudios, se observa similitud en los resultados obtenidos en las imágenes como lo muestra el de Muhammad et al. 16, en el que obtuvieron nanopartículas de plata funcionalizadas con PEG y metotexatre y un promedio de tamaños de 15 nm; su coloración es parecida a las obtenidas en este trabajo. También se comparan los resultados con los obtenidos por Bastos et al. [17], en los que compararon los resultados de las síntesis con citrato de sodio y PEG; obtuvieron varios tamaños de partículas dependiendo de la concentración de los reactivos (como se evidenció en este trabajo). Al comparar las imágenes obtenidas por microscopía electrónica de transmisión de dicho trabajo con las obtenidas en este, se observa una cantidad de islotes aglomerados de nanopartículas de tamaño variable, tal como se observan en las figuras con PEG.
En la Figura 2 se observa el Protocolo 2, el cual se denominó “semillas”. En este se utiliza el citrato trisódico con una concentración de 1% para realizar la doble función tanto como agente reductor como estabilizador, de lo que se obtienen nanopartículas de buen tamaño con buena estabilización. En la Figura 3 se observa cómo el PEG se confirma como buen agente estabilizador y ofrece un recubrimiento adicional para el objetivo de este proyecto.
En la muestra que se trata del primer protocolo con presencia del polímero PEG, llamado “P1”, se observa lo siguiente: en la Figura 4 se observa el resultado de la imagen TEM, en la cual se observa una gran disminución en el tamaño de las nanopartículas en comparación con los resultados del Protocolo 2. Esto se puede deber a una mayor concentración de citrato trisódico y una menor concentración de AgNO3, lo que genera una mayor reducción de las partículas. También se notan distribuidas de forma homogénea y poco aglomeradas, por lo que se puede pensar en que el PEG actúa de buena manera como agente estabilizador; asimismo, se notan unas grandes manchas sobre la superficie que se cree que son del polímero. En esta prueba no fue posible realizar la prueba de EDX, ya que al material no se le pudo eliminar la humedad en el proceso de preparación, pues el PEG es un polímero de mayor densidad que el agua y el equipo necesita que la muestra esté totalmente seca para realizar dicho ensayo.
Al revisar otros estudios como el realizado por Vlăsceanu et al. [18], en el cual desarrollaron una revisión exaustiva de la síntesis de nanpartículas de plata y su posterior aplicación en diferentes tumores cancerígenos, se encontró que el resultado que ellos obtuvieron se puede comparar con el resultado de este proyecto, y que este resultado puede evaluar su potencial como posible terapia para cáncer de piel.
Ensayo biológico
En la Tabla 2 se muestra el resultado de la viabilidad celular en porcentaje comparado con el crecimiento de las células control, en el cual se observan viabilidades celulares superiores al 100% debido a la proliferación celular que se dio durante las 24 horas de incubación.
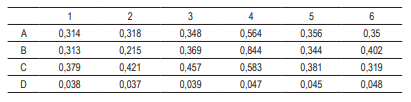
En la Tabla 3 se observa el resultado arrojado por la medición de la absorbancia en cada uno de los pozos y por triplicado de los tratamientos, en los que se observa el control ubicado en la fila A, donde obtienen una absorbancia de 0,3; al compararla con los otros tratamientos, no se observa una diferencia significativa que pueda considerar un aumento o pérdida de la viabilidad celular. Así, se puede concluir que las nanopartículas no presentan una citotoxicidad con 24 horas de exposición en fibroblastos humanos. Además, en el ensayo no se observó contaminación en los cultivos celulares, por lo que se concluye que la esterilización por luz UV fue efectiva para las nanopartículas, además del supuesto de que ellas son por sí mismas antibacterianas. En el trabajo realizado por Chowdhury et al. [12] evaluaron la viabilidad celular mediante MTT a diferentes concentraciones de AgNPs y diferentes tiempos de exposición hasta por 72 h; en este trabajo se observó que un tiempo de exposición mayor a 24 h aumenta la citotoxicidad de las nanopartículas, además, que existe una correlación con la concentración de estas. Al compararlos con los resultados obtenidos en este trabajo se confirma que las nanopartículas no presentaron una citotoxicidad aparente en ninguna de las muestras, debido a que la concentración de nanopartículas es baja y el tiempo de exposición no fue mayor a 24 h. Esto en razón a que la posible aplicación es para cáncer de piel y la exposición en tiempo es corta durante el procedimiento médico. Esté resultado alienta más la aplicación de estas nanopartículas en el cáncer de piel, ya que abre un abanico de aplicaciones en las que se puede utilizar, por ejemplo, con la adición de campos electromagnéticos para generar hipertermia localizada.
Conclusiones
Los métodos utilizados por reducción química para obtener nanopartículas de plata fueron efectivos, ya que al variar los parámetros de agente estabilizador y concentración de nitrato de plata se obtienen diferentes resultados en cuanto al tamaño y la aglomeración, entre otros.
En el primer protocolo, al utilizar como agente reductor el citrato trisódico dihidrato y como agente estabilizador el PEG, se observó que la relación AgNO3 vs. agente reductor fue buena, ya que se obtuvieron nanopartículas cuasi esféricas, homogéneamente distribuidas y de tamaño nanométrico.
El segundo protocolo presentó mayor tamaño de partícula, aunque con algunos aglomeramientos debido, principalmente, a la presencia del PEG. Se confirmó la presencia de este polímero mediante EDX y con tamaños aceptables para el objetivo del presente proyecto que es el cáncer de piel.
En el ensayo de viabilidad celular no se observó un cambio significativo en el porcentaje de los tratamientos con nanopartículas de plata comparado con el blanco, por lo que se concluye que las nanopartículas no generan citotoxicidad en los fibroblastos humanos con una exposición a 24 horas.
Con respecto a la aglomeración que se presenta en las muestras, se debe disminuir el porcentaje de PEG en la muestra para mejorar la distribución de las nanopartículas en la solución.