Introducción
En las proyecciones de la OECD/FAO [1] se prevé que la producción mundial de leche aumentará a 175 millones de toneladas (t) hacia el 2024. El queso seguirá siendo el producto lácteo más importante, representando alrededor del 40% de la leche elaborada en todo el mundo [2]. Esta producción de queso trae consigo una mayor producción de lactosuero. El lactosuero posee un color amarillo verdoso, un sabor característico agridulce y un contenido significativo de proteínas, carbohidratos, vitaminas y minerales susceptibles de aprovechamiento [3]. Para el año 2017, la producción de queso a nivel mundial se estimó en 20.015.000 t. Se calcula que esta cantidad de queso produjo 180.135.000 t de lactosuero aproximadamente [4], [5]. En Colombia, la producción de lactosuero para el 2016 se calculó en 827.596 t [6], [7]. Una parte del lactosuero producido en el mundo la transforman diferentes industrias en concentrados y aislados de proteína (WPC y WPI por sus siglas en inglés) [8]-[10]. En Colombia, una pequeña parte del lactosuero producido la procesan algunas industrias del sector lácteo a fin de obtener lactosueros dulces en polvo [10]-[12].
El lactosuero representa un problema serio de contaminación debido a su alta demanda biológica de oxígeno (35.000-45.000 mg/L) y demanda química de oxigeno (60.000-80.000 mg/L) [14]. El lactosuero, cuando no es tratado correctamente, disminuye de manera drástica la concentración de oxígeno en los afluentes donde es vertido [15]. Adicionalmente, la transformación del lactosuero líquido en lactosuero en polvo, WPC y WPI, genera corrientes (por ejemplo, permeado) con un contenido significativo de lactosa y otros compuestos [16] que se deben separar o tratar antes de disponerlos como residuos.
La lactosa es uno de los compuestos más representativos del lactosuero después del agua, con un contenido del 4,80% [17]. La lactosa es un compuesto no muy comercial, debido a sus características físico-químicas y sensoriales [18]. A lo anterior, se suma la intolerancia a este compuesto que afecta hasta a un 70% de la población mundial [19], lo cual restringe su uso en los alimentos.
Se identifica que el sector lácteo colombiano aprovecha parte del suero de leche que produce en lactosueros dulces, pero la falta de diseños de procesos e integración másica de sus corrientes (principal y efluentes) [20]no permite visualizar otros usos o aprovechar material valioso (lactosa) de sus residuos, lo cual representaría una alternativa para la obtención de otros productos como, por ejemplo, los galactooligosacáridos (GOS). Por tanto, se plantea la siguiente pregunta de investigación: ¿La revisión de la documentación científica y técnica a nivel mundial del aprovechamiento del suero de leche, permitirá aportar con información relevante sobre la producción de GOS como proceso alterno a la trasformación del suero de leche para aprovechar la lactosa de la materia prima (lactosuero) y de sus residuos? En este sentido, el objetivo de la presente revisión bibliográfica es analizar las aplicaciones del lactosuero desde diferentes campos investigativos; entre estos, la producción de lactosueros en polvo, WPC, WPI y GOS como alternativa de proceso adjunto al procesamiento tradicional del lactosuero.
Consulta de la información
La consulta de la información se realizó en las bases de datos de Scopus y Web of Science, y tuvo los siguientes criterios de búsqueda: algoritmo de búsqueda aplicado únicamente al título, el resumen y las palabras claves de los artículos de la base de datos; consulta en todos los documentos publicados a la fecha; solo documentos de investigación clasificados como artículos; y documentos escritos en inglés y en español. El algoritmo de búsqueda se construyó a partir de palabras claves en inglés como: “whey”, “protein”, “galactooligosaccharides”, “lactose”, “whey protein concentrates” y “whey protein isolates”; así como, la conjugación de estas palabras en español. Se utilizaron los operadores booleanos AND, OR y el comodín (*) a fin de complementar las búsquedas y hallar la mayor cantidad de documentos relacionados. Las búsquedas fueron acotadas a 100 artículos, y los resultados se exportaron a una hoja de cálculo de Excel para su respectivo análisis a partir del título y el resumen de cada artículo; posteriormente, los artículos identificados como relevantes se analizaron en profundidad.
Marco teórico
Lactosuero
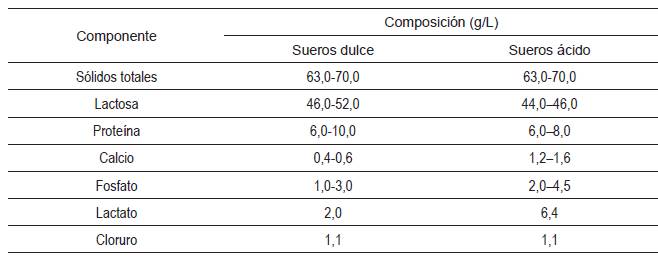
El lactosuero representa aproximadamente, del 85% al 95% del volumen de leche, y retiene el 55% de sus nutrientes [21]. Estos nutrientes pueden recuperarse para ser utilizados en diferentes campos (alimentarios y farmacéuticos). Existen dos clases de lactosuero (véase la Tabla 1), el lactosuero ácido (pH de 4,5) y el lactosuero dulce (pH 6,0-6,5) [22].
El lactosuero dulce se obtiene por la coagulación de la caseína utilizando cuajo (mezcla de la enzima quimosina u otras enzimas coagulantes de caseína) a un pH de 6,5, aproximadamente. El lactosuero ácido se obtiene por fermentación o adición de ácidos orgánicos o minerales para coagular la caseína [22]. La coagulación ácida genera un lactosuero con una acidez sustancialmente baja (pH 4,5, aproximadamente), necesaria para la precipitación de la caseína en la leche. A este bajo pH, el calcio coloidal contenido en las micelas de caseína de la leche se solubiliza y se distribuyen en el suero. La coagulación por medio de cuajo produce un fragmento k-caseína llamada “glicomacropéptido” (GMP) que termina en el suero. El GMP constituye aproximadamente, el 20% de la fracción de proteína de suero de leche dulce, pero no está presente en el suero ácido [23]. El conjunto único de aminoácidos en el GMP lo convierte en un ingrediente codiciado con propiedades nutracéuticas [24]. En este sentido, la obtención de lactosuero dulce genera una fracción de proteína de alto valor nutricional (GMP) que podría separarse por la tecnología de membranas [24], con el fin de ser utilizada como aditivo alimentario. La tecnología de separación por membranas se encuentra disponible en la mayoría de las industrias procesadoras de lactosuero, siendo necesario configurar y evaluar el proceso de obtención de GMP de la forma adecuada para su implementación. Esta configuración y evaluación se puede llevar a cabo por medio del diseño y la simulación de procesos [26].
Lactosa
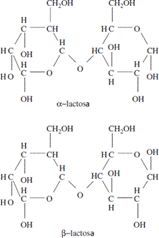
La lactosa (4-O-β-galactopiranosil-D-glucopiranosa, C12H22O11) es un disacárido que comprende una molécula de glucosa ligada a una molécula de galactosa por un enlace β (1,4). La lactosa en soluciones acuosas está presente en las formas α y β (véase la Figura 1) [18]. La lactosa es el mayor componente de los sólidos presentes en la leche de vaca, con excepción de la grasa en ciertas razas [27].
El peso molecular de la lactosa es de 342 g/mol. Se diferencian estructuralmente sus formas isómeras (α y β) solo en la posición del grupo -OH en el carbono anomérico de la glucosa [28]. Los cristales de α-lactosa se pueden preparar como monohidrato mediante la concentración de una solución acuosa de lactosa hasta la sobresaturación, lo cual permite que se cristalice por debajo de 93,5 ºC. La rotación óptica de la α-lactosa en el agua es (α) D20= +89,4 (base de peso anhidro), su punto de fusión es de 201,6 ºC y sus cristales son poco solubles. Los cristales de la α-lactosa poseen un tamaño mayor a 10-16 μm. Esta condición de la α-lactosa hace que pueda detectarse sensorialmente y crear un efecto llamado “arenoso”. La rotación óptica de la β-lactosa es (α)D20= +35º y tiene un punto de fusión de 252,2 ºC. Los cristales β-anhidro son más dulces y solubles que el α-hidrato [18].
La lactosa es considerablemente menos dulce que la sacarosa o la glucosa debido a que tiene un poder edulcorante del 20% y 30% de la sacarosa respectivamente [29] por lo que su contribución a la dulzura es irrelevante y, por el contrario, puede impartir un sabor desagradable a los alimentos que contienen altas cantidades de la misma [30]. La solubilidad de la lactosa es una función compleja debido a que ambos anómeros (α y β) están en equilibrio mutarrotacional, el cual es dependiente de la temperatura [31]. En términos prácticos, la lactosa es un azúcar que tiene baja solubilidad en el agua (alrededor de 180 g/L a temperatura ambiente) por lo que tenderá a precipitar a concentraciones más altas y a temperaturas bajas, de forma que afecta las propiedades organolépticas y funcionales de los productos que la contienen como por ejemplo, en los helados [32].
En el comercio existen cuatro grados principales de lactosa (fermentativa, cruda, comestible y farmacológica) que son utilizados para diferentes actividades industriales [27]. En particular, la lactosa se usa ampliamente como un relleno o aglutinante en la fabricación de tabletas y cápsulas farmacéuticas [33]. Desde otro punto de vista, la lactosa es un compuesto de interés cuando se transforma de su forma nativa a otros productos de valor agregado como, por ejemplo, lactulosa [34], GOS [35], lactosucrosa, lactitol, ácido lactobiónico, tagatosa, epilactosa y fructosil-GOS [36], [37], en ácidos orgánicos [38] y en jarabes de glucosa [39], entre otros productos.
A nivel mundial las investigaciones sobre el aprovechamiento de la lactosa se orientan a estudiar y mejorar la hidrólisis de este compuesto para ser aplicado al procesamiento de productos y subproductos lácteos [18]. Por ejemplo, en los campos de los productos lácteos líquidos, a fin de mejorar la hidrólisis de la lactosa [40]; en el control de la cristalización de la lactosa en productos lácteos concentrados [41]; en la aplicación del lactosuero y su permeado en el campo alimentario y no alimentario [39]-[42]; en la producción de oligosacáridos [37] y exopolisacáridos [40]; en la mejora de la producción de cultivos celulares [21],[44], [45]; y en el desarrollo de nuevos sabores y productos desde la hidrólisis de la lactosa (quesos, bebidas, jarabes, compuestos químicos, etc.) [38], [41], [42], [46].
De acuerdo con lo anterior, existe un amplio campo de investigación del aprovechamiento de la lactosa que puede utilizarse en Colombia para desarrollar la economía de los diferentes sectores industriales y la tecnología de sus procesos. El aprovechamiento de la lactosa está sujeta al nivel de madurez tecnológica que posea el proceso de trasformación [47] y al desarrollo tecnológico con el que cuente el sector industrial (equipos y procesos, entre otros aspectos). Desde este punto de vista, el diseño conceptual y básico de procesos [48], [49] puede ser una herramienta poderosa que permita integrar la madurez de la tecnología y el nivel de desarrollo tecnológico. Como, por ejemplo, se tiene la producción de jarabe de glucosa [39] y la producción de GOS [35], que potencialmente pueden ser implementados en Colombia.
Proteínas
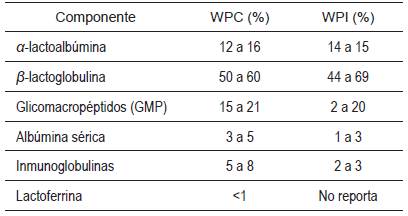
Las principales proteínas del lactosuero son la β-lactoglobulina (β-Lg), la α-lactoalbúmina (α-La) y, en menores cantidades, las inmunoglobulinas (13%), la lactoferrina (3%) y la albúmina sérica (5%) [50], [51], entre otras. Las proteínas del lactosuero conforman el 20% del contenido total de proteína en la leche bovina, son globulares y están presentes como moléculas discretas con un número variable de entrecruzamientos (disulfuro) [52]. Estas proteínas son más sensibles al calor y menos sensibles al calcio que las caseínas. Las proteínas del lactosuero desempeñan un importante papel nutritivo como una fuente rica y balanceada de aminoácidos esenciales (26% aproximadamente) [53], [54]. Las proteínas del lactosuero poseen una calidad igual a las proteínas del huevo. Los aminoácidos que se encuentran en mayor cantidad en el suero de leche son la leucina (9,5%) y la lisina (9%); estos aminoácidos parecen ejercer determinados efectos positivos biológicos y fisiológicos in vivo, potenciando la respuesta inmune, tanto humoral como celular [55].
La β-Lg es la principal proteína del suero de leche y representa entre el 48% y el 58% de sus proteínas [56], [57]. La β-Lg actúa como un transportador de ácidos grasos y retinol, y puede jugar un papel en la regulación enzimática y la inmunidad de los neonatos. La β-Lg, principalmente, es una fuente importante de aminoácidos [58]. La β-Lg pertenece a la familia de las lipocalinas, cuenta con 162 aminoácidos [59] y su peso molecular es de 36 700 Da, aproximadamente [57]. La β-Lg posee un punto isoeléctrico de 5,2 de acuerdo con su solubilidad, y por su mayor o menor capacidad de polimerizarse y modificar su estructura según el pH [60]. La desnaturalización de la β-Lg por calentamiento puede conducir a la formación de una cuajada sin firmeza durante la elaboración del queso [61], [62].
La α-La se produce únicamente en la glándula mamaria lactante y está presente en las leches de las principales subdivisiones de mamíferos, los euterios, los marsupiales y los monotremas [63]. La α-La representa aproximadamente el 19% de las proteínas del lactosuero, posee un peso molecular de 14.200 Da, aproximadamente, y su punto isoeléctrico es de 5,1 [56]. La α-es la proteína de suero predominante en la leche humana y sus niveles aumentan del 21% al 34% entre los días 1 y 14 de lactancia. La α-La de la leche humana y bovina puede tener un 76% de residuos de aminoácidos totalmente conservados (93 a 123). La α-La tiene una estructura globular en solución acuosa y presenta una alta afinidad por los iones metálicos como el calcio [64]. El agotamiento del calcio a un pH bajo hace que los cambios estructurales formen el llamado estado de glóbulo fundido. Esto tiene implicaciones importantes durante los procesos de purificación y para la bioactividad de la proteína [65].
Aplicaciones del lactosuero
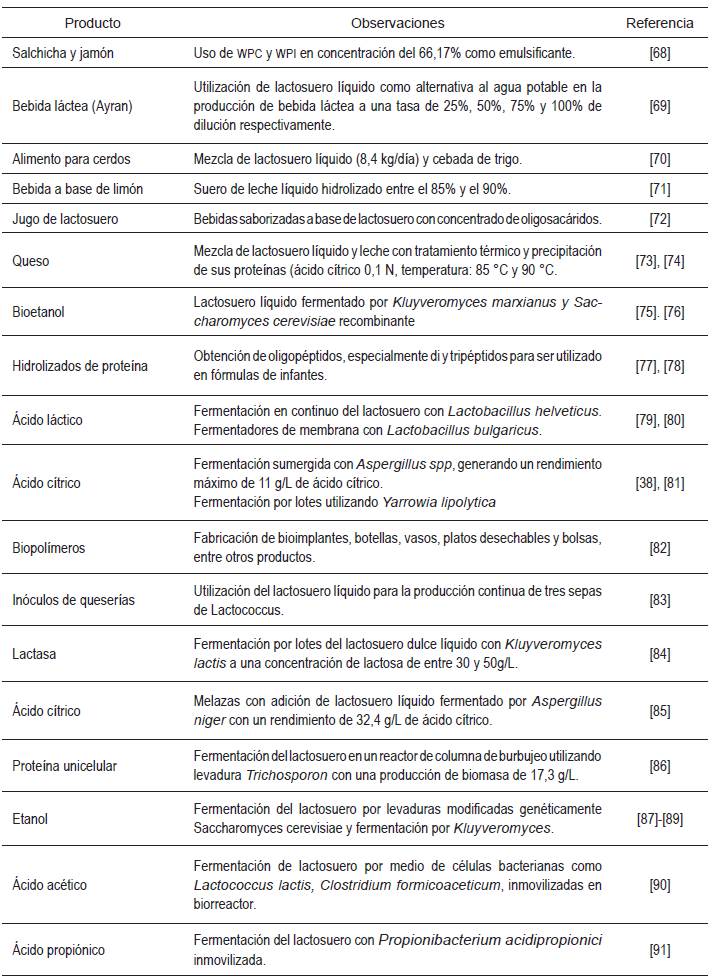
El lactosuero en su estado líquido se utiliza, tradicionalmente, para la alimentación animal y como fertilizante para cultivos, entre otros usos. El lactosuero procesado se usa como aditivo en alimentos para infantes, bebidas y en productos farmacéuticos [3]. Las aplicaciones del lactosuero que actualmente son relevantes están orientadas, en su mayoría, a la utilización de sus proteínas [39]. Las proteínas del lactosuero confieren características diferentes a los productos en los cuales se emplean. Las proteínas del lactosuero son utilizadas ampliamente en una variedad de alimentos por sus propiedades gelificantes [66], emulsionantes (aceite en agua) y estabilizantes de alimentos [67]. El lactosuero es ampliamente utilizado en quesos [3] debido al contenido de sólidos que le puede aportar a este producto. En la Tabla 2 se presentan algunas aplicaciones del suero de leche líquido.
Se concluye de la Tabla 2 cómo el lactosuero es, en su mayoría, utilizado en su forma líquida. Posiblemente una causa de esta característica sea el menor grado de inversión en tecnología que se requiere para procesar el lactosuero líquido comparado con otras tecnologías que permitan separar sus compuestos (por ejemplo, tecnología de membranas). La utilización de la tecnología de separación y concentración por membranas puede representar un alto costo energético para los procesos de producción debido al reciclo que se genera en las operaciones y la implementación de otras etapas de acondicionamiento de la materia prima y el producto en proceso.
En las aplicaciones del lactosuero también se identifica su utilización como medio de cultivo para suministrar las fuentes de carbono y la energía necesaria para el desarrollo de diferentes microorganismos [92]. Este aprovechamiento del lactosuero puede ser limitado debido a que el número de microorganismos que tienen la capacidad de asimilar la lactosa es bajo. En algunos casos la lactosa debe ser hidrolizada al emplear β-galactosidasas a fin de obtener glucosa y galactosa. La hidrólisis de la lactosa amplía el uso del lactosuero en cultivos celulares como, por ejemplo, en la propagación de inóculos de quesería, en la obtención de lactasa y ácido cítrico, entre otros productos [38], [92]-[94]; pero puede disminuir la viabilidad económica cuando se quiere escalar este tipo de procesos a nivel industrial debido al requerimiento de equipos e insumos especializados (biorreactores, enzima, inoculo, etc.).
Producción de lactosuero en polvo, WPC y WPI
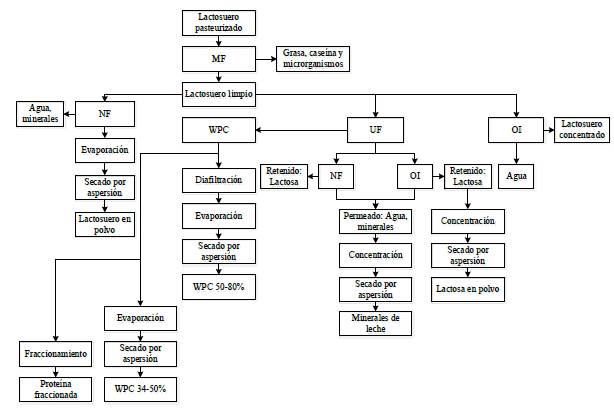
Los WPC, WPI (véase la Tabla 3) y los lactosueros en polvo se obtienen a partir de suero de leche líquido por medio de operaciones de separación, concentración y secado (véase la Figura 2). El lactosuero en polvo parcialmente desmineralizado producido en Colombia posee un máximo de proteína y lactosa del 15% y 82%, respectivamente [95]. La cantidad de proteína del lactosuero en polvo parcialmente desmineralizado podría potencialmente mejorarse si se extrae mayor cantidad de lactosa y se utilizan etapas de concentración en paralelo con un factor de concentración (alimentación/ retenido) de 9 [26]. Por otra parte, los WPC poseen un contenido de proteína y lactosa que varía entre el 34% y el 82%, y entre el 10% y el 52%, respectivamente [56]. Los WPI poseen un contenido de proteína superior al 90% [8], [9] con un menor contenido de lactosa (0,5-1,0%) [56]. Para lograr el porcentaje de proteína deseado en el lactosuero en polvo, WPC y WPI, estos deberán ser concentrados en varias ocasiones. Por ejemplo, a fin de elaborar un producto de proteína del 35%, el lactosuero líquido se concentrará seis veces hasta un contenido total del 9% de sólidos en base seca [17]. Los WPC se utilizan como suplementos de proteína en productos lácteos (yogurt, queso) [16], así como en productos cárnicos y en bebidas, entre otros productos. Los WPI se utilizan, por lo general, como fuente de péptidos o en fórmulas de alimentos para niños y deportistas [96]. El lactosuero en polvo parcialmente desmineralizado se utiliza como aditivo en productos que requieren una fuente de sólidos lácteos económica y con bajo nivel de minerales como, por ejemplo, algunas fórmulas infantiles [3] y alimentos para animales, entre otros productos.
Producción de GOS a partir de la lactosa del lactosuero
La lactosa se puede transformar en diferentes productos (como se presenta en la Figura 3). Entre estos productos se encuentran los GOS, los cuales son compuestos prebióticos derivados de la hidrólisis de la lactosa empleando la enzima β-galactosidasa (EC 3.2.1.23) [35]. Los prebióticos son ingredientes alimentarios no digeribles que alcanzan el colon y estimulan el crecimiento o la actividad de las bacterias benéficas del sistema digestivo [98]. Los GOS están compuestos de un número variable de unidades de galactosilo (de dos a nueve) y una unidad de glucosa terminal unida por diferentes enlaces glicosídicos que varían según la enzima y las condiciones de reacción utilizadas en su síntesis, y son, en su mayoría, los enlaces β(1-4) y β(1-6) (véase la Figura 4) [99]. Los GOS se utilizan ampliamente en alimentos, bebidas y fórmulas infantiles [100].
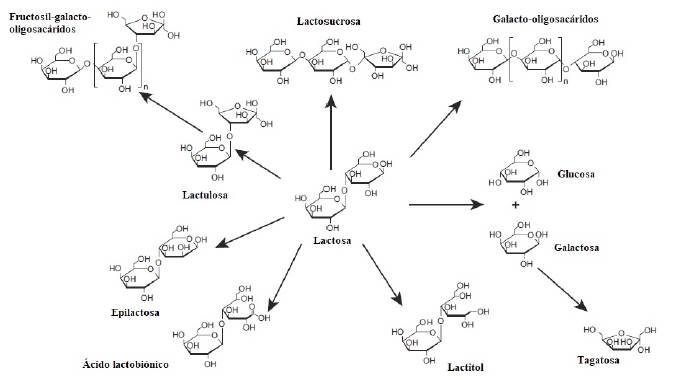
Fuente: Tomado de [36].
Figura 3 Estructura química de oligosacáridos no digeribles derivados de lactosa.
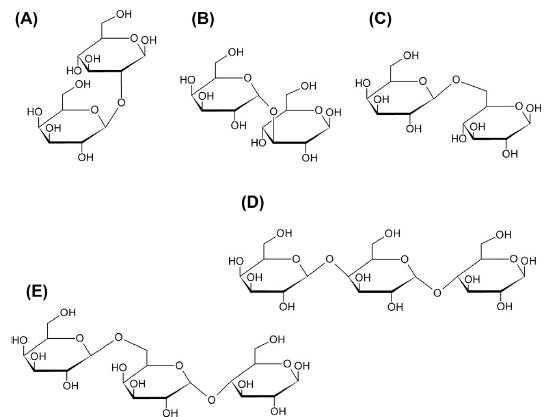
Fuente: tomado de [99].
Figura 4 Estructura química de algunos galactooligosacáridos. (a) Gal(β1-2) Glu; (b) Gal(β1-3)Glu; (c): Gal(β1-6)Glu; (d): Gal(β1-4)Gal(β1-4)Glu; (e): Gal(β1-6)Gal (β1-4)Glu.
Los GOS, por lo general, se producen a partir de jarabe de lactosa concentrado a través de una reacción de transgalactosilación mediada por la enzima β-galactosidasa. El mecanismo indica que la enzima transfiere galactosa a aceptores nucleófilos que contienen un grupo hidroxilo. La transferencia al agua produce galactosa y la transferencia a otro azúcar produce di-, tri- y galactosil-sacáridos superiores, denominados colectivamente oligosacáridos [102]. El mecanismo de reacción general para las acciones de β-galactosidasa en la lactosa se muestra en la Figura 5.
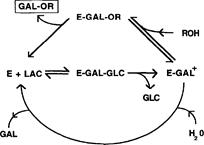
Figura 5 Mecanismo de reacción propuesto para la acción de la β-galactosidasa en lactosa: E: enzima; LAC: lactosa; GAL: galactosa; GAL+: estado de transición del ión carbonio; GLC: glucosa; ROH: azúcar aceptor; GAL-OR: azúcar galactosil (oligosacáridos).
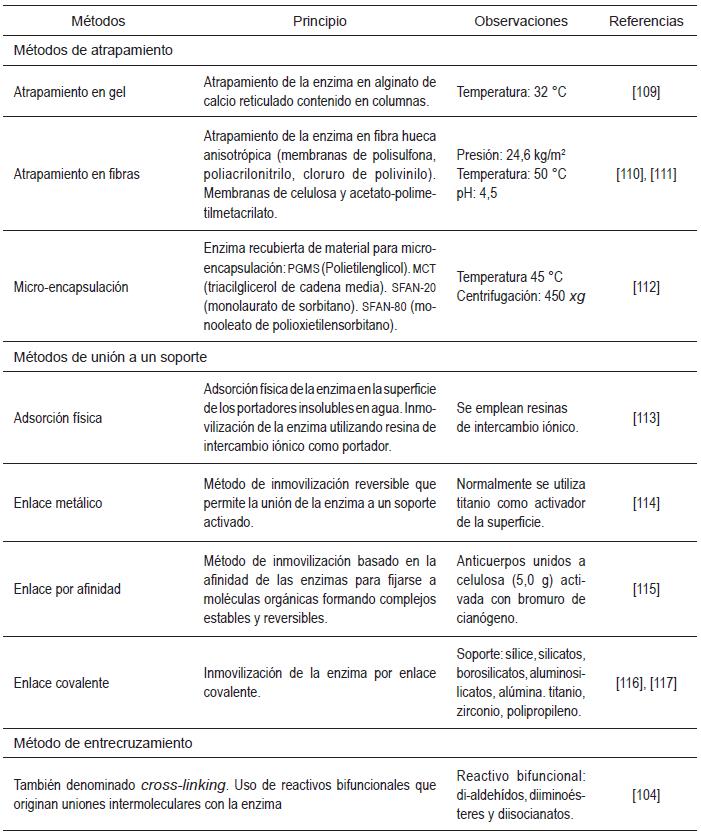
La producción de GOS se puede llevar a cabo mediante dos procesos. En el primer proceso se emplean enzimas libres de células, y en el segundo células completas. El proceso con células libres se puede dividir en la utilización de enzimas solubles y en la utilización de enzimas inmovilizadas [103]. En detalle, la inmovilización de enzimas se presenta como una alternativa para llevar a cabo el proceso de hidrólisis con β-galactosidasas de forma eficiente. En la Tabla 4 se presentan algunos métodos para inmovilizar enzimas.
Convencionalmente, las reacciones enzimáticas en sus formas solubles se realizan en un baño de mezcla completa al incubar el sustrato con la correspondiente enzima. Cuando la reacción ha finalizado resulta difícil recuperar la enzima activa del medio de reacción para poder utilizarla de nuevo; por este motivo, las enzimas se eliminan, generalmente, po desnaturalización,mediante tratamiento térmico o pH extremos. La inmovilización de enzimas es una posibilidad para disponer de catalizadores con una elevada actividad, estabilidad y apropiada especificidad. La inmovilización de enzimas es un proceso en el que se confina o localiza a la enzima en una región definida del espacio para dar lugar a formas insolubles que retienen su actividad catalítica y pueden reutilizarse repetidamente [104]; en este sentido, con el método de inmovilización la materia prima fluye por el soporte que tiene la enzima inmovilizada por un período de tiempo determinado, con lo cual se logra hidrolizar el sustrato y conservar la enzima [105].
La inmovilización de las enzimas β-galactosidasa es una alternativa para aumentar la eficiencia del proceso de hidrólisis de la lactosa. A nivel mundial, diferentes autores han inmovilizado la lactasa en diversos soportes con el objetivo de conservar y aumentar su actividad, así como generar mayor resistencia de la enzima al sustrato en diversas condiciones. Por ejemplo, Ovsejevi et al. [106] inmovilizó la β-galactosidasa de Kluyveromyces lactis en un soporte de tiosulfato reteniendo más del 80% de su actividad. Xuemei et al. [107] inmovilizaron la β-galactosidasa en algodón logrando el 95% de conversión de la lactosa. Ladero et al. [108] inmovilizaron la β-galactosidasa de Kluyveromyces fragilis en un soporte de sílica-alúmina, con lo cual lograron una actividad superior al 50%. Es importante destacar que la unión covalente puede ser el método más interesante para el sector lácteo debido a la estabilidad de los enlaces, la no presencia de la enzima en el producto y la alta actividad en el soporte.
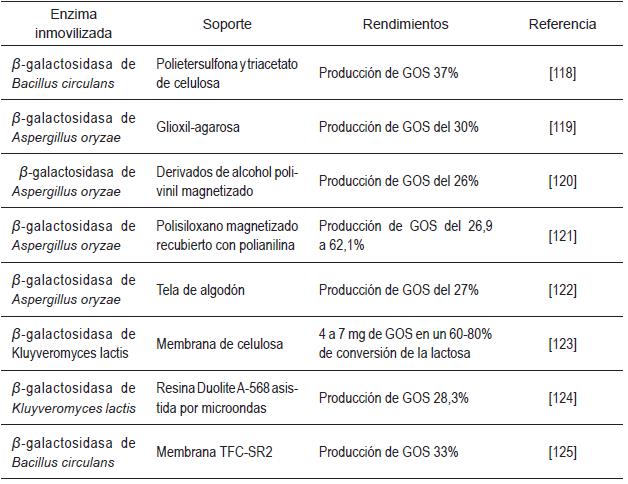
A nivel mundial se identifica en la literatura científica un aumento en las investigaciones relacionadas con la inmovilización de las enzimas β-galactosidasas para la producción de GOS (véase la Tabla 5).
De la Tabla 5 se concluye que las diversas investigaciones sobre la inmovilización de las enzimas β-galactosidasa para la producción de GOS están orientadas a estudiar las diferentes técnicas de inmovilización y los tipos de soporte que se pueden emplear para esta clase de enzimas [126]. Posiblemente, uno de los factores que impulsa este tipo de investigaciones es el interés por aumentar la producción de GOS utilizando una menor cantidad de recursos. Las ventajas que tiene el retener la enzima y su actividad en un soporte (prolongar la actividad de la enzima por un mayor período de tiempo y disminuir la cantidad utilizada en el proceso de hidrólisis) [127] puede llevar a disminuir costos y tiempos de producción en el proceso de hidrólisis de la lactosa, si se compara con el método convencional que utiliza enzimas solubles.
La tecnología de inmovilización con β-galactosidasas representa una oportunidad de desarrollo para el sector lácteo no solo en el campo de la producción de GOS, sino en la hidrólisis de la leche [109]. En este sentido, un efluente de 475 000 kg que contenga el 4,8% de lactosa aproximadamente [17], puede generar 6840 kg de GOS, aproximadamente, con un rendimiento de entre el 30% y el 34% [35].
Conclusiones
La revisión de la documentación científica permitió identificar información relevante sobre los actuales usos que se le están dando al lactosuero. El aprovechamiento industrial del lactosuero se orienta a la recuperación de sus proteínas y en mínima proporción recupera la lactosa. En este sentido, se identifica que la producción de GOS es una alternativa de aprovechamiento para la lactosa. La producción de GOS puede ser implementado en conjunto con los procesos del sector lácteo colombiano que transforman el lactosuero líquido. En el diseño de este tipo de procesos es necesario evaluarla tecnología utilizada en las investigaciones a nivel mundial y la tecnología del sector lácteo en Colombia para establecer la mejor configuración tecnológica a implementar. La simulación de procesos es una herramienta útil para evaluar tecno-económica y ambientalmente el aprovechamiento del lactosuero con un proceso adjunto (GOS) para su implementación a nivel industrial.