Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CT&F - Ciencia, Tecnología y Futuro
Print version ISSN 0122-5383On-line version ISSN 2382-4581
C.T.F Cienc. Tecnol. Futuro vol.1 no.4 Bucaramanga Jan./Dec. 1998
BIODEGRADACIÓN OXIGÉNICA DE BTX EN MATRICES ACUOSAS: EVALUACIÓN DE PARÁMETROS OPERACIONALES
RESUMEN
En el laboratorio de Biotecnología del Instituto Colombiano del Petróleo (ICP) fueron aisladas y seleccionadas bacterias oxigénicas nativas de muestras de aguas y suelos, contaminados con compuestos aromáticos volátiles como benceno, tolueno e isómeros dexilenos (BTX). Un estudio preliminar permitió identificar un grupo o consorcio microbiano capaz de biodegradar estos compuestos en matrices acuosas. En el presente estudio se evaluaron parámetros operacionales tales como oxígeno disuelto (OD), concentración de BTX y nutrientes, y su influencia en la cinética de remoción en un sistema tipo batch, operado a escala de laboratorio. Estas condiciones operacionales serán usadas para determinar la cinética de remoción y los parámetros requeridos para la planta a escala piloto y reactores industriales. El proceso aplicado a matrices acuosas en un reactor totalmente hermético, saturado con oxígeno gaseoso y operado a pH 6,5 y 306 K, permitió disminuir la carga contaminante desde 1 70 g·m-3 hasta concentraciones inferiores a los 0,3 g·m-3, en 10 horas con una velocidad máxima de remoción de 26,27 g·m-3·h-1. Sin embargo, cuando la carga contaminante disminuyó a concentraciones menores a los 5 g·m-3, la velocidad máxima sólo alcanzó un valor de 0,745 g·m-3·h-1. En el sistema evaluado, el benceno presentó la máxima velocidad de remoción (15,80 g·m-3·h-1), seguido del tolueno (6,41 g·m-3·h-1). Los xíleños mostraron velocidades de degradación más bajas, con valores máximos de 1,80 g·m-3·h-1, para o- y m- xíleños, y de 0,85 g·m-3·h-1 para el p-xileno.
Palabras clave: BTX, biodegradación, aeróbico, consorcio.
ABSTRACTT
Selected native aerobic strains able to grow in the presence of volatile aromatics compounds in aqueous matrices were isolated and identified at the Biotechnology laboratory of the Instituto Colombiano del Petróleo ICP. These strains were obtained from water and soil samples contaminated with benzene, toluene and xylenes isomers (BTX), these consortia was capable of reducing BTX concentrations to acceptable international environmental standards. Operational parameters such as temperature, BTX initial concentration, dissolved oxygen (DO) and nutrient content, were evaluated, as they relate to removal rate of BTX in batch systems. These operational conditions will be used to determine the kinetics of removal and the parameters required for the scale-up pilot to plant and industrial size reactors. Operational conditions for the aqueous matrices included saturation of oxygen, temperature (305 K) and pH (6,5) control in an hermetic bioreactor. BTX total concentrations were reduced from 1 70 g·m-3 to 0,3 g·m-3 in less than ten (10) hours with a maximum removal rate of 26,27 g·m-3·h-1 . The removal rate was reduced to 0,745 g·m-3·h-1 for initial BTX concentrations of 5 g·m-3. Benzene showed the highest removal rate (1 5,80 g·m-3·h-1) followed by toluene (6,41 g·m-3·h-1 ). Xylene isomers exhibit the lowest biodegradation rates, ranging from 1,80 g·m-3·h-1 for the o-xylene to 0,85 g·m-3·h-1 forthe p-xylene.
Keywords: BTX, biodegradation, aerobic, consortium.
INTRODUCCIÓN
Los hidrocarburos aromáticos volátiles: benceno, tolueno, etilbenceno e isómeros del xileno, comúnmente conocidos como BTX, se liberan a la atmósfera, aguas y suelos como productos de procesos químicos e industriales, constituyendo una gran fracción de la mezcla de residuos orgánicos que contaminan el ambiente (Grifoll et al., 1995). Estos compuestos se movilizan fácilmente en cuerpos de agua, especialmente por la relativa alta solubilidad del benceno (1,750 g·m-3) y del tolueno (525 g·m-3), considerándose de alto impacto ambiental (Bowlen and Kosson 1995). Adicionalmente, por sus propiedades químicas, los BTX son cancerígenos y mutagénicos, aún en muy bajas concentraciones, por lo cual la Agencia de Protección Ambiental de EUA "Environmental Protection Agency EPA" los ha clasificado dentro del grupo de los hidrocarburos altamente tóxicos (Chen et al., 1995).
Los métodos de tratamiento más utilizados para la eliminación de BTX presentes en matrices acuosas comprenden procesos físicos y químicos, entre los que se tienen las técnicas conocidas como como air stripping o venting y peroxidación con peróxido de hidrógeno. En el primer caso existen problemas ambientales asociados con la volatilización de los tóxicos y su respectiva emisión a la atmósfera. Con el tratamiento químico pueden presentarse limitaciones en caso de una rápida descomposición del peróxido y/o precipitación de metales pesados (Bowlenn et al., 1995). Otras alternativas, como la incineración o sorción mediante carbón activado, son altamente costosas (Bowlen et al., 1995).
Por otra parte, se han estudiado los tratamientos biológicos, tanto oxigénicos como anoxigénicos, para la remediación de suelos, lodos, aguas y aire contaminadas con BTX. Los procesos anaerobios son muy lentos y las reacciones de sulfatos y nitratos involucrados en el proceso inhiben la remoción de tolueno y m-, p- xilenos (Reinhard et al., 1997 ).
La degradación microbiana oxigénica aplicada a matrices acuosas presenta ventajas, tanto económicas como operacionales, sobre los procesos físicos y químicos (Irvine, 1995; Yocum et al., 1995). Para este tipo de tratamiento se ha reportado principalmente el uso de reactores con células inmovilizadas, con los cuales se logran remociones superiores al 99,9%. En estos sistemas las células microbianas están fuertemente influenciadas por factores físicos y químicos, tales como temperatura, oxígeno, nutrientes, salinidad, presión, pH y concentración del contaminante. De éstos depende que el sistema pueda producir una alta densidad celular, generando una biopelícula biofilme que permita mantener biomasa tolerante a altas concentraciones del contaminante, y usar ésta como fuente disponible para la actividad biológica, proceso conocido como adaptabilidad de la población microbiana, (Zhou and Crawford, 1995).
En el presente trabajo se evaluó el efecto de parámetros operacionales tales como nivel de oxígeno disuelto, temperatura y concentración de nutrientes, en un sistema oxigénico tipo batch, totalmente hermético, sobre la capacidad que presentan algunos microorganismos nativos para metabolizar BTX bajo condiciones aerobias. Tales microorganismos fueron aislados y seleccionados en el laboratorio de Biotecnología del Instituto Colombiano del Petróleo. Los resultados revelan que la cinética del proceso es función directa de la concentración de oxígeno disuelto en el medio y de la concentración de contaminante en el medio, para el rango evaluado (40 - 170 g·m-3).
MATERIALES Y MÉTODOS
Aislamiento y selección de microorganismos
Los cultivos puros usados para la conformación del consorcio bacteriano evaluado en este estudio fueron aislados a partir de aguas, suelos industriales contaminados con benceno, tolueno y xilenos, y muestras representativas de gasolinas. En tubos de 15·10-6 m3 se adicionó una mezcla de agua contaminada (suelo contaminado o gasolina) y medio mineral en relación de 1:9, disponiendo como única fuente de carbono y energía una mezcla de benceno, tolueno, o-xileno, m-xileno y p-xileno (BTX), en concentraciones de 50, 20 y 10 g·m-3, respectivamente. Los tubos fueron sellados herméticamente con teflón y silicona, e incubados en rotor de tubos a 303 K por una semana, haciendo transferencia seriada hasta conseguir un desarrollo estable de crecimiento (Stetzenbach et al.,1986). Una vez alcanzado un buen crecimiento microbiano, dado por una densidad óptica de 1,2, medida a 540 nM, se realizó el aislamiento microbiano sobre placas de agar de medio basal de sales, solidificado con 2% de agar noble. A fin de lograr una óptima selección, las cajas fueron incubadas en cámara de humo con solución saturada de BTX a 303 K durante cinco días (Oh et al.,1994).
La identificación de los microorganismos se hizo mediante coloración de Gram y el sistema Biolog, basado en una batería de ensayos enzimáticos que permite una identificación tentativa del microorganismo. Los microorganismos aislados fueron identificados como Pseudomonas cepacea y Pseudomonas putida tipo A1.
En un estudio preliminar se determinaron las condiciones de operación del reactor, las características del consorcio microbiano y la concentración de adición a la solución acuosa. Para este estudio se determinaron condiciones de pH óptimo en el rango de 6,5 a 7,0 y, como medio mineral salino, una mezcla de sales constituida por: 2,22·103 g·m-3de fosfato ácido de potasio (K2HPO4), 7,26·103 g·m-3 de fosfato diácido de potasio (KH2PO4), 3,96·103 g·m-3 de sulfato de amonio [(NH4)2 SO4], y 0,2·103 g·m-3 de sulfato de magnesio heptahidratado (MgSO4·7H2O), (Yocum et al., 1995, Vargas et al., 1997).
Reactor de Biodegradación
El reactor de biodegradación oxigénica tipo batch empleado en el laboratorio se construyó con base en el diseño reportado por Lee et al. (1993). El biorreactor, con una capacidad de cinco litros, está equipado con un medidor de oxígeno disuelto y válvulas (superiores y laterales) que facilitan la toma de muestras (acuosas y gaseosas).
Biodegradación de BTX
Los ensayos de biodegradación se realizaron a fin de determinar las condiciones óptimas para el crecimiento y la actividad microbiana. En estos experimentos el proceso se evaluó a pH 6,5 bajo diferentes condiciones de oxígeno disuelto, nutrientes y temperatura, siguiendo el procedimiento general descrito a continuación.
Un volumen de 2·10-3 m3 de medio mineral modificado de sales de amonio, fósforo y magnesio (Yocum et al., 1995) se adicionó al recipiente de 5·10-3 m3 y el conjunto se sometió a esterilización. A continuación el sistema de reacción se saturó con oxígeno (empleando oxígeno puro o aire libre de CO2) y se selló herméticamente. Finalmente, a través de las válvulas superiores, se contaminó el medio líquido con una solución de BTX y se adicionó el consorcio biodegradador a una concentración del 10%, con un título microbiano de 107. Los BTX se adicionaron como reactivos puros (a una concentración variada, sujeta al tipo de experimento). El consorcio fue previamente centrifugado y resuspendido en un medio mineral modificado de sales de fosfato, amonio y magnesio.
Para cada experimento de biodegradación se preparó un control abiótico en el cual el inoculo fue remplazado con el mismo volumen de medio basal estéril. Todos los cultivos de biodegradación y sus respectivos controles fueron preparados por duplicado.
El cambio en la concentración de los monoaromáticos a lo largo del proceso se determinó mediante la técnica instrumental Cromatografía de Gases (CG) empleando un detector de ionización en llama (FID). La cuantificación de los BTX se realizó mediante el método estándar externo. Durante la experimentación se monitorearon parámetros como absorbancia (λ = 450 nm), unidades formadoras de colonia (UFC·10-6 m-3), pH, temperatura (T), oxígeno disuelto (OD) y concentración de BTX.
Efecto de la concentración de oxígeno
Para estudiar este parámetro, el proceso microbiano aplicado en matrices acuosas contaminadas con 60 g·m-3 BTX se evaluó de manera independiente, con oxígeno gaseoso y con aire libre de CO2. En ambos casos los gases se aplicaron hasta el punto de saturación con una concentración final de oxígeno en el medio líquido igual a 40 g·m-3 y 8,08 g·m-3, respectivamente. El ensayo se llevó a cabo empleando el medio Basal de Sales descrito anteriormente y a temperatura ambiente (296 K).
Efecto de la concentración de nutrientes
Con el fin de optimizar la fuente nutricional en el medio de cultivo microbiano (matriz acuosa contaminada con 60 g·m-3 de BTX), el proceso de biodegradación se estudió variando la concentración de las sales de amonio [(Na)2SO4], fosfato (K2HPO4 y KH2PO4) y magnesio (MgSO4·7H2O). De esta forma se formularon y evaluaron tres medios, con diferentes niveles de concentración salina.
Medio 1: 2,22·103 g·m-3 de fosfato ácido de potasio (K2HPO4), 7,26·103 g·m-3 de fosfato diácido de potasio (KH2PO4), 3,96·103 g·m-3 de sulfato de amonio [(NH4)2SO4] y 0,1·103 g·m-3 de sulfato de magnesio heptahidratado (MgSO4·7H2O), pH 7,0. Medio 2. 1,11·103 g·m-3 de K2HPO4, 3,63·103 g·m-3 de KH2PO4, 1,98·103 g·m-3de (NH4)2SO4 y 100 g·m-3 de MgSO4·7H2O, pH 7,0. Medio 3. 750 g·m-3 de K2HPO4, 250 g·m-3 de KH2PO4 y 600 g·m-3 de (NH4)2SO4, pH 7,0. Todos los ensayos se realizaron a temperatura ambiente (296 K ± 3) empleando matrices acuosas contaminadas con 60 g·m-3 de BTX y oxígeno gaseoso.
Efecto de la concentración de contaminante sobre el proceso de biodegradación
Aplicando el procedimiento general de biodegradación bajo las condiciones operacionales estandarizadas previamente (oxígeno gaseoso, medio mineral 2, 306 K), se evaluó el efecto de la carga contaminante sobre la actividad microbiana. El proceso se aplicó por separado a matrices acuosas contaminadas con concentraciones de BTX iguales a 40, 60, 100 y 170 g·m-3.
Estudio estadístico
El proceso de biodegradación aeróbica, aplicado a matrices acuosas contaminadas con concentraciones cercanas a los 170 g·m-3 de BTX, fue evaluado por duplicado bajo condiciones óptimas de operación: 2 ·10-3 m3 del medio mineral 2, oxígeno gaseoso hasta el punto de saturación (concentración de oxígeno disuelto en el medio igual a 40 g·m-3), 306 K de temperatura y pH = 6,5.
Seguimiento analítico
La separación de los volátiles desde la matriz acuosa se realizó mediante extracción líquido-líquido, empleando n-hexano como solvente. El cambio en la concentración de los monoaromáticos a lo largo del proceso se determinó mediante cromatografía de gases (CG). Una pequeña fracción (10 μL) de los extractos orgánicos fue inyectada en un cromatógrafo de gases (CG) Hewlett Packard (HP) 5890A Serie II, equipado con un inyector split/splitless (523 K, relación split 1:50), un detector de ionización en llama (FID) operado a 573 K y un sistema computarizado de datos (SCD).
Para la separación de los volátiles se empleó una columna capilar de sílica fundida con fase estacionaria apolar de fenilmetilsiloxano (Ultra 2, J&W Scientific, Folson, CA, USA), de 25 m x 0,2·10-3 m d.i. x 0,33 μm de espesor de película interna. La temperatura del horno se programó desde 318 K (3 min) hasta 373 K (10 min), con una velocidad de calentamiento de 3° min-1. Se usó helio como gas de arrastre con un flujo de 0,81·10-6 m3·min-1. Los flujos de aire e hidrógeno fueron de 300 y 30·10-6 m3·min-1, respectivamente. La cuantificación de los BTX se realizó mediante el método de patrón externo.
RESULTADOS Y DISCUSIÓN
Efecto del oxígeno
Al evaluar el proceso de biodegradación de BTX en medios saturados con oxígeno gaseoso (OD = 40 g·m-3) y con aire libre de CO2 (O.D. = 8,08 g·m-3) se observó mayor velocidad de biodegradación en el primer caso. En el sistema de biodegradación saturado con oxígeno gaseoso se alcanzó un porcentaje de biodegradación del 99% en 30 horas, mientras que en el sistema saturado con aire fueron necesarias 38 horas. Como se aprecia en la Figura 1, los sistemas presentaron remociones del 99,5% a las 24 h y 30 h, respectivamente.
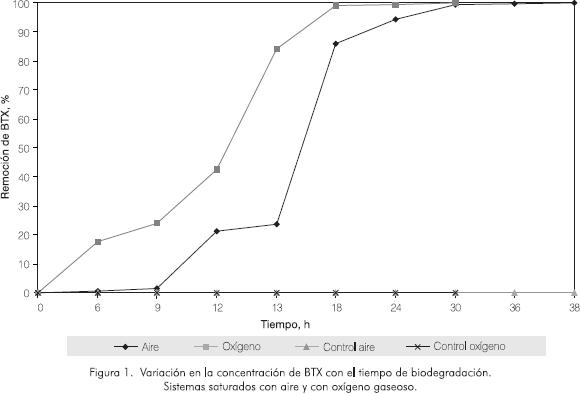
Las velocidades de biodegradación alcanzaron valores máximos de 6,44 g·m-3 h-1 y 5,35 g·m-3 h-1 para los sistemas saturados con oxígeno y aire, respectivamente. Como se aprecia en la Figura 2, esta tendencia está directamente relacionada con el crecimiento microbiano, el cual presentó una fase de latencia de 8 horas para el sistema con aire, mientras que en el sistema con oxígeno gaseoso no se observó. En este último caso, la actividad celular se inició desde el tiempo cero, alcanzando un máximo a las 13 h, con un porcentaje de remoción de BTX del 85%. Para el sistema con aire libre de CO2 este máximo se presentó a las 18 h, con una remoción del 86%.
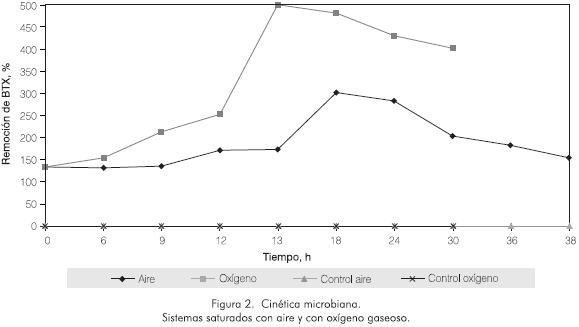
Pasadas las 13 h y 18 h en los sistemas saturados con oxígeno gaseoso y aire, respectivamente, se observó la etapa de declive en el cultivo microbiano, manifestada por la disminución progresiva de los valores de ufc·10-6 m-3. Esto sugiere que en estos momentos los microorganismos no sólo han suspendido su crecimiento, sino que han empezado a morir. Este último fenómeno puede ser causado por la ausencia de sustrato en el medio ya que, como se comentó anteriormente, en esos tiempos de reacción la concentración de BTX ha bajado notablemente (remociones cercanas al 90% en ambos casos). En los respectivos controles no se observó variación en la concentración de BTX, lo cual indica que la oxidación del proceso es netamente biológica.
Efecto de nutrientes
El estudio del proceso de biodegradación en los tres medios de cultivo formulados (medios 1, 2 y 3) se llevó a cabo saturando el medio de reacción con oxígeno gaseoso. Los resultados indican que los microorganismos tienen capacidad para remover más del 90% de los BTX presentes en concentraciones de 60 g·m-3 , en un tiempo aproximado de 22 h. Sin embargo, tal como se ilustra en la Figura 3, el mejor comportamiento bacteriano se observó en el medio 2. En el sistema conformado con este medio se presentó la máxima velocidad de biodegradación (4,14 g·m-3 ·h-1) y se alcanzó remoción de BTX del 83% en 14 h, disminuyéndose la carga de contaminante hasta 10,8 g·m-3 , límite exigido por la EPA para vertimientos industriales. Transcurridas 18 h de proceso se observó una remoción del 95,7%, y una concentración mínima remanente durante 6 h, al final de las cuales se presentó una remoción del 100% (Figura 3).
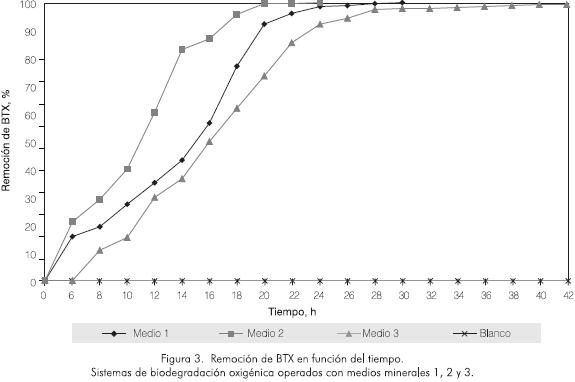
El reactor que contenía el medio 1 presentó un comportamiento similar al del medio 2. Sin embargo, la velocidad máxima de biodegradación sólo alcanzó un valor de 3,49 g·m-3·h-1. En este caso, a las 18 h sólo se había removido el 77% de la carga contaminante, alcanzándose una concentración de BTX igual a 14,2 g·m-3 (Figura 3). Aunque en el reactor que contenía el medio 3 se alcanzó una velocidad máxima de biodegradación de 3,40 g·m-3 h-1, hacia las 18 h sólo se había alcanzado una remoción del 62%.
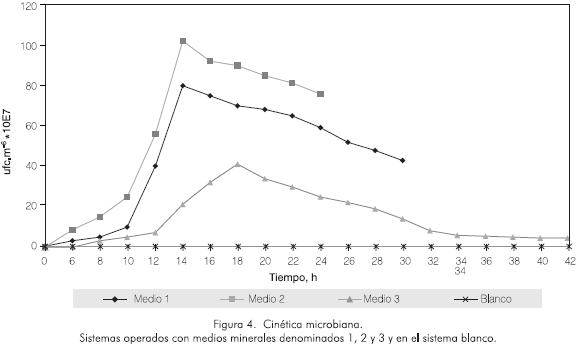
Los sistemas de reacción con medio mineral 1 y 2 mostraron la misma tendencia de degradación, con velocidades máximas de degradación muy similares (Figura 3). Sin embargo, presentaron marcadas diferencias en los tiempos de remoción total, requiriéndose 30 h y 38 h, respectivamente. Este fenómeno se puede explicar con base en el crecimiento bacteriano como se aprecia en la Figura 4. Los microorganismos cultivados en el medio 3 presentaron una fase de latencia de 6 h, mientras que los microorganismos cultivados en los medios 1 y 2 empezaron su fase exponencial desde el tiempo cero.
Efecto de la concentración del contaminante (BTX)
El sistema de biodegradación operado a 306 K con medio mineral 2 y oxígeno gaseoso se aplicó por separado a matrices acuosas contaminadas con 40, 60, 100 y 170 g·m-3 de BTX. Como se aprecia en la Figura 5, el consorcio microbiano mostró buena actividad metabólica en las cuatro concentraciones de contaminantes evaluadas, alcanzándose remociones del 99,99% en 6 y 9 horas, para los medios con 40 y 60 g·m-3 deBTX, respectivamente, y en 10 h para matrices con 100 y 170 g·m-3 .
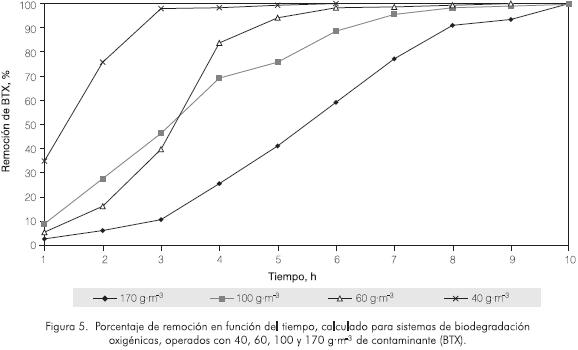
Aunque en los sistemas con 100 y 170 g·m-3 se observaron iguales tiempos de remoción total, se presentaron diferencias en los tiempos necesarios para alcanzar los parámetros de la EPA, mientras que en matrices contaminadas con 100 g·m-3 se requiere de aproximadamente 5,5 h, para matrices contaminadas con 170 son necesarias 7,5 h. Vale la pena resaltar que en estos casos, a las 8 h los sistemas ya habían superado el 90% de la remoción total, con un remanente mínimo que permanece por 2 h más.
Las velocidades máximas de biodegradación alcanzaron valores de 28 - 19,95 - 15,52 y 15,56 g·m-3 h-1, para los sistemas con 170, 100, 60 y 40 g·m-3 . Estos resultados indican que en concentraciones máximas de BTX de 170 g·m-3 el proceso microbiano no se inhibe. En este caso se observó una relación directa entre las velocidades máximas de biodegradación y la carga de contaminante.
Este comportamiento es corroborado por los valores de unidades formadoras de colonia (ufc·m-6), medidos a lo largo del proceso de biodegradación para los cuatro sistemas evaluados (40, 60, 100 y 170 g·m-3 ), los cuales revelan que las altas cargas de contaminante no inhiben el crecimiento bacteriano y los títulos microbianos se mantienen hasta que el sustrato aromático se consume.
Estudio estadístico
En la Tabla 1 se reportan las concentraciones, los porcentajes y las velocidades de remoción de BTX a lo largo de la biodegradación, tanto para los biorreactores como para el control. Como se observa, los valores de desviación estándar están por debajo de 4 y los coeficientes de variación no superan el 5%, lo que muestra la veracidad del proceso.
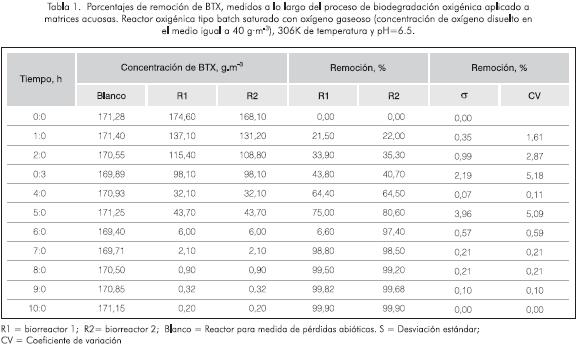
En la Figura 6 se ilustran las velocidades de remoción para la mezcla de BTX y para los compuestos individuales a lo largo del proceso. El sistema presentó una remoción promedio del 97% a la hora 6, mientras que en las últimas 4 h sólo se logró un 2,5 % de la remoción total de BTX. En este caso el benceno presentó los valores más altos de velocidad máxima de remoción (15,80 g·m-3 h-1), seguido del tolueno (6,41 g·m-3 h-1), alcanzándose una remoción total de estos monoaromáticos a las 7 h y 9 h (Tabla 1), respectivamente. Por otra parte los xilenos mostraron las velocidades máximas de degradación más bajas, con valores de 1,80 g·m-3 h-1, para o- y m- xilenos y de 0,85 g·m-3 h-1 para el p-xileno. La velocidad máxima de remoción en la mezcla alcanzó valores promedio de 26,27 g·m-3 h-1, para concentraciones altas de BTX. Sin embargo, cuando la carga contaminante se encuentra por debajo de 5 g·m-3 , la velocidad máxima de remoción disminuye a valores de 0,745 g·m-3 h-1.
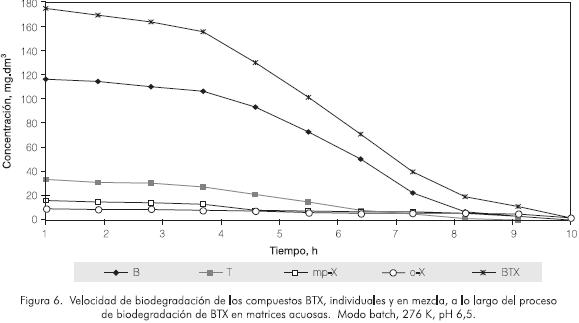
Por otra parte, los resultados obtenidos para el control (Tabla 1) muestran claramente que la desaparición de los BTX es un proceso netamente biológico y no está generada por efectos de volatilización.
CONCLUSIONES
-
Los resultados revelan que los microorganismos nativos, aislados y evaluados en el Laboratorio de Biotecnología del Instituto Colombiano del Petróleo (Consorcio BTX-ICP), presentan capacidad para metabolizar BTX bajo condiciones oxigénicas, soportando cargas de contaminante con concentraciones cercanas a los 170 g·m-3 .
-
Se encontró que el proceso de biodegradación de BTX, empleando el consorcio ICP, es función directa del oxígeno disuelto en el medio, en donde se evidenció una velocidad máxima de biodegradación de 6,44 g·m-3 h-1. Aunque el consorcio bacteriano creció favorablemente mostrando la misma tendencia de biodegradación en los tres medios minerales evaluados, su velocidad máxima de biodegradación alcanzó valores más altos (4,14 g·m-3 h-1) en el sistema operado con el medio 2.
-
Los resultados obtenidos al evaluar el parámetro nutricional indican claramente que los microorganismos aislados por el laboratorio de Biotecnología del ICP presentaron capacidad para crecer y metabolizar BTX en medios líquidos con concentraciones de medio mineral PAM más bajas que las reportadas por Yocum et al., 1995.
-
Las remociones alcanzadas son del 100%, con sistemas de reacción oxigénico por lotes y tiempos de residencia de 10 h. Los coeficientes de variación (CV < 5) y las desviaciones estándar (s < 4) obtenidas garantizan la veracidad de los datos y, por ende, del proceso.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la doctora Julia Raquel Acero y a los Ingenieros Mauricio Cardeñosa y Luis Ortiz, por sus sugerencias y comentarios durante la realización de este trabajo.
A los laboratorios de Biotecnología y Cromatografía del Instituto Colombiano del Petróleo, por su colaboración en la ejecución de las muestras.
A Ecopetrol ICP, especialmente al Instituto Colombiano de Petróleo y al Complejo Industrial de Barrancabermeja, por el apoyo financiero, que hizo posible el desarrollo de este proyecto.
REFERENCIAS
Bowlen, C. and Kosson, D., 1995. "In situ Proccessess for Bioremediation of BTX and Petroleum fuel Products" in: Young, L and Cerniglia, C., 1995. "Microbial Transformation and Degradating of Toxic Organic Chemicals", by Wiley-Liss: 515 - 542. [ Links ]
Chen, C. and Taylor, R., 1995. "Thermophilic Biodegradation of BTEX by two Thermus species", Biotechnology and Bioengineering, 48: 614 - 624. [ Links ]
Grifoll, M., Selifonov, S., Gotlin, Ch. and Chapman, P., 1995. "Actions of a versatile fluorene degrading bacterial isolated on Polyciclic Aromatic Compounds", Applied Environmental Microbiology, 61 (10): 3711 - 3723. [ Links ]
Irvine, R. L., 1995. "Adsorption and Desorption Studies in the Aqueous Phase for the Toluene Activated Carbon System", Environmental Progress, 13 (1): 21 - 25. [ Links ]
Lee, J. Y., Choi, Y. B. and Kim, H. S., 1993. "Simultaneous Biodegradation of Toluene and p-xylene in a Novel bioreactor: Experimental Results and Mathematical Analysis", Biotechnology, 9: 46 - 53. [ Links ]
Oh, Y. S., Shareetdeen, Z., Baltzis, B. and Bartha, R., 1994. "Interaction between benzene, toluene and p-xylene (BTX) during their biodegradation", Biotechnology and Bioengineering, 44: 533 - 538. [ Links ]
Reinhard, M., Shan, S., Kitanidis, P. K., Orwin, E., Hopkins, G. and Lebron, C. A., 1997. "In situ BTEX Biotransformation under Enhanced Nitrate and Sulfate Reducing Conditions", Environ. Sci. Technol. 31: 28 - 36. [ Links ]
Stetzenbach, L., Kelley, L. M. and Sinclair, N. A., 1986. "Isolation, identification and growth of well-water bacteria", Ground water, 24 (1): 6 - 10. [ Links ]
Vargas, M. C., Ramírez N. E. Mora, A, y Dugarte, F. 1997. "Biodegradación de hidrocarburos arómaticos volátiles benceno, tolueno e isómeros del xileno en matrices acuosas", Documento Institucional Instituto Colombia- no del Petróleo. Ecopetrol. [ Links ]
Yocum, P. S., Irvine, R. L. and Bumpus, J. A., 1995. "Bioremediation of Water Contaminated with jet fuel-4 in a Modified Sequencing batch reactor", Water Environmental Research, 67 (2): 174 - 180. [ Links ]
Zhou, E. and Crawford, R. L., 1995. "Effects of oxygen, nitrogen, and temperature on gasoline biodegradation in soil", Biodegradation, 6: 127 - 140. [ Links ]














