Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CT&F - Ciencia, Tecnología y Futuro
Print version ISSN 0122-5383On-line version ISSN 2382-4581
C.T.F Cienc. Tecnol. Futuro vol.3 no.1 Bucaramanga Jan./Dec. 2005
RESUMEN
Se explora la aplicación de tecnologías de oxidación avanzada en las aguas residuales típicas del proceso de refinación de crudo, como tratamiento para la mineralización de compuestos orgánicos, especialmente aromáticos de gran importancia, dada su toxicidad aún a muy bajas concentraciones, su resistencia a los tratamientos tradicionales especialmente los biológicos, los costos de tratamiento y las normas ambientales cada vez más exigentes. En este documento se explorarán los procesos conocidos como oxidación avanzada, ozonización en medio básico y ozonización con peróxido de hidrógeno, los cuales han sido reportados entre los de mayor potencial en el tratamiento de estos contaminantes. A diferencia de los estudios de oxidación avanzada para este sistema, en donde se evaluaron aguas con altas concentraciones de contaminantes, en este articulo se determinarán los efectos de procesos de oxidación avanzada para aguas de bajas concentraciones de contaminante previamente tratadas con otros procesos. Las evaluaciones de tratamiento se harán determinando los cambios de la concentración de los compuestos fenólicos en función del tiempo, la concentración de los agentes oxidantes, el pH tanto para aguas industriales como para las aguas sintéticas de concentración similar a las industriales con el fin de determinar la influencia de la complejidad de las mezclas sobre las eficiencias de la reacción. Los resultados obtenidos muestran que estos procesos son una alternativa muy promisoria en el tratamiento de compuestos fenólicos en aguas residuales.
Palabras clave: ozono, procesos de oxidación avanzada, fenol, aguas residuales.
ABSTRACT
Although more efficient and economical processes for the treatment of sewage have been developed in recent years, the challenge they are facing - due to the greater knowledge of the effect that pollutants have on the environment, the greater consumption of water because of the development of human and industrial activity and the reduction of fresh water sources- indicate that we are far from attaining the final solution. This affirmation specially applies to the pollutants which are resistant to biological treatment processes, such as most of the aromatic compounds found in sewage of the petrochemical industries. In this document, the processes known as advanced oxidation will be explored. Theses have been reported as having the greatest potential in the treatment of these pollutants. Likewise the results of the application of these technologies with waters typical of the petroleum industry will be reported. These have previously been evaluated with processes of typical ozonization.
Keywords: ozone, advanced oxidation processes , phenol, waste water.
INTRODUCCIÓN
Las aguas residuales industriales presentan una gran cantidad de contaminantes que tienen una acción muy compleja sobre el medio ambiente, afectando el desarrollo natural de los ecosistemas por el cambio de condiciones tales como la toxicidad, olor, color, entre otras. Estas aguas han sido tradicionalmente tratadas por métodos convencionales. Sin embargo, la efectividad de estos procesos se está viendo seriamente limitada en los últimos años principalmente por restricciones cada vez más severas. Estas restricciones son debido al mayor conocimiento del impacto de los contaminantes en el ambiente, la disminución de la disponibilidad de agua fresca, y al aumento de la demanda tanto humana como industrial, lo cual significa mayores caudales de agua residual a tratar.
En respuesta a esta creciente demanda ambiental para la descontaminación de aguas residuales de la industria se han desarrollado en los últimos años nuevas tecnologías, que tienen en cuentan en su aplicación factores fundamentales como la naturaleza y las propiedades fisicoquímicas del sistema; la factibilidad de reuso, la economía y la eficiencia de los procesos y sus rangos de aplicación.
En este artículo se continuará trabajando con las aguas residuales de la industria del petróleo, la cual tiene como característica principal la presencia de un alto contenido de compuestos orgánicos de alta toxicidad. Se analizarán de manera comparativa las tecnologías existentes, tanto convencionales como avanzadas, recomendadas para estos casos y se mostrarán los resultados de la aplicación de algunos de estos procesos a nuestro caso.
MARCO TEÓRICO
Se debe tener en cuenta que para que haya una eficiente remoción de los compuestos orgánicos se requiere de una combinación de tratamientos básicos tales como la oxidación química, despojo por aire, extracción líquido-líquido, absorción, ósmosis inversa, ultra filtración, o tratamiento biológico. Estos son clasificados como destructivos y no destructivos y son usados según el elemento contaminante, la concentración y el caudal de la corriente a tratar.
Sin embargo, estos procesos no son la solución total. Por esta razón se han desarrollado procesos de oxidación más eficientes llamados Procesos Avanzados de Oxidación (AOP) los cuales son aplicados generalmente en pequeña o mediana escala y especialmente en donde los métodos convencionales pierden eficiencia. Este es el caso de aguas con concentración de contaminantes tóxicos no biodegradables muy altas (> 1 g/l), o muy bajas (< 5 mg/l). Los AOP generalmente pueden usarse solos o combinados entre ellos, pudiendo ser aplicados también a contaminantes de aire y suelos.
La Figura 1 muestra una clasificación de las distintas tecnologías existentes para el tratamiento de contaminantes orgánicos en agua. Se consideran la mayoría de contaminantes orgánicos que aparecen normalmente disueltos en agua y las industrias que típicamente los producen. La lista incluye, entre otros, detergentes, pesticidas y compuestos complejos de residuos industriales con alta carga de materia orgánica (Glaze et al., 1987).
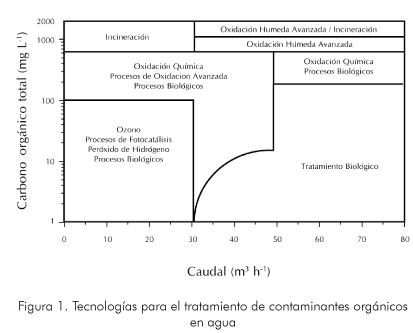
Las AOP se basan en procesos fisicoquímicos capaces de producir cambios profundos en la estructura química de los contaminantes debido a que involucran la generación y uso de especies transitorias con un elevado poder oxidante como el radical hidroxilo (HO•). Este radical puede ser generado por varios medios y es altamente efectivo para la oxidación de materia orgánica, en especial aquella que no es biodegradable. Algunas AOP recurren, además, a reductores químicos que permiten realizar transformaciones en contaminantes tóxicos poco susceptibles a la oxidación, como iones metálicos o compuestos halogenados (Legrini et al., 1993; Huang et al., 1993).
Actualmente los estudios se enfocan en la búsqueda de valores óptimos para los diferentes parámetros que afectan el proceso de oxidación: pH, temperatura, diseño del reactor, naturaleza y concentración del contaminante, y agentes oxidantes que puedan mejorar la reacción. Además se estudia con detalle la cinética de reacción, que generalmente es de primer orden con respecto a la concentración de radicales hidroxilo y a la concentración de las especies a ser oxidadas. Las velocidades de reacción generalmente están en el rango de 108-1011 L/mol.s, y la concentración de radical hidroxilo están entre 10-10-10-12 mg/l variable que juega una papel muy importante en la real aplicación del proceso.
En la Tabla 1 se enumeran las principales tecnologías de oxidación avanzada, algunas de las cuales son evaluadas a escala de laboratorio y planta piloto.

Las principales ventajas de las AOP respecto a los métodos tradicionales las principales son:
• Transforman y destruyen químicamente el contaminante hasta la mineralización.
• En general, no generan subproductos que requieran posterior procesamiento.
• Son muy útiles para contaminantes refractarios que resisten otros métodos de tratamiento, principalmente el biológico.
• Operan en rangos donde los sistemas convencionales no son factibles.
• Son ideales para preparar las corrientes a tratamientos convencionales. Aumentan la biodegradabilidad.
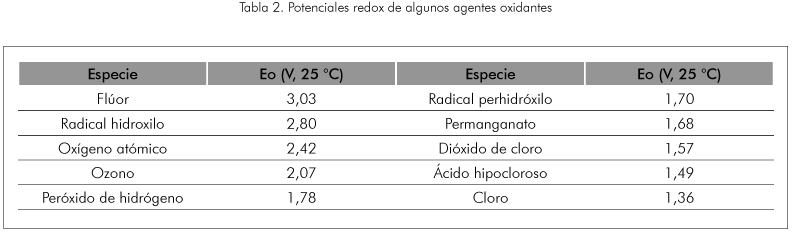
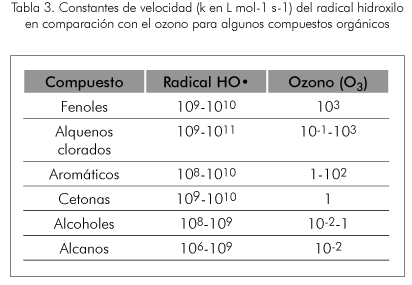
La Tabla 2 presenta potenciales de oxidación de distintas especies, se observa que después del flúor, el HOº es el oxidante más potente. En la Tabla 3 se puede observar la gran diferencia de las velocidades de reacción de los diferentes agentes oxidantes.
TECNOLOGÍAS AVANZADAS DE OXIDACIÓN NO FOTOQUÍMICAS
Estas AOP generan los radicales de oxidación a condiciones de temperatura y presión cercanas al ambiente, mediante la utilización de distintas formas de energía, excepto la lumínica.
Reactividad del ozono
El ozono en solución acuosa puede reaccionar con la mayoría de contaminantes que están en las aguas residuales industriales de dos diferentes maneras.
1. Por reacción directa del ozono molecular.
2. Por reacción de las especies formadas por la descomposición del ozono en el agua (radicales libres), (Masten, 1994; Hoigné y Bader, 1977).
En una reacción que siga la vía de radicales, el mecanismo se basa principalmente en la formación de radicales hidróxilo. Existen tres clases de sustancias que pueden afectar el proceso de reacción por radicales libres: iniciadores, promotores e inhibidores.
Los iniciadores son compuestos capaces de inducir la formación de un ión súper óxido (O2-) a partir de una molécula de ozono. Dichos compuestos pueden ser inorgánicos (iones hidroxilo, iones hidroperóxido y algunos cationes) u orgánicos (ácido glioxálico, ácido fórmico o sustancias húmicas).
Los promotores de reacciones por radicales libres son todas las moléculas orgánicas e inorgánicas capaces de regenerar el anión súper óxido (O2-) a partir de un radical hidroxilo. Los promotores orgánicos más comunes son los compuestos que incluyen grupos arilo, ácido fórmico, ácido glioxálico, alcoholes primarios y ácidos húmicos. Entre los inorgánicos los principales son las especies de fosfatos.
Los inhibidores son compuestos capaces de consumir radicales OH, sin regenerar el anión súper óxido O2-. Los inhibidores más comunes son los iones carbonato y bicarbonato, los grupos alquilo y alcoholes terciarios.
Un proceso de radicales libres es menos selectivo que uno de reacción directa. Sin embargo, se realiza a mayor velocidad lo cual es más importante en un proceso de tratamiento de aguas residuales. Por lo tanto, la eliminación de inhibidores es un factor muy importante en el transcurso de la reacción, con el fin de reducir el consumo de ozono.
La oxidación de las especies químicas presentes en el agua por parte del ozono es de especial interés en el trabajo desarrollado. La acción del ozono es conveniente para el tratamiento de especies químicas que contienen sitios nucleofílicos caracterizados por la presencia del O, N, S o fósforo. Debido a la acción del ozono, sustancias como aminas, pesticidas y especies aromáticas pueden ser transformadas y llevadas a un estado en el cual su biodegradabilidad puede realizarse fácilmente.
Los fenoles son un grupo de sustancias potencialmente susceptibles a la ozonación. Los productos fenólicos (el fenol, los compuestos fenol-sustituidos, las quinonas y los poli fenoles) se caracterizan por la presencia de un grupo donor OH sobre el núcleo aromático. Este radical los hace fuertemente reactivos hacia el ozono por esto su oxidación, relacionada con el tratamiento de agua potable y el manejo de agua de desecho, ha sido extensamente estudiado (Masten, 1994).
El ataque o reacción directa entre el fenol y el ozono sigue una reacción de primer orden, aunque esta suposición no siempre es exacta (Gurol,1982):
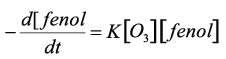
Los productos generados en esta reacción dependen de la intensidad de la misma. En caso de oxidarse el anillo aromático se tienen difenoles y quinonas. Cuando se rompe el anillo por la acción del ozono se generan ácidos mucónicos y sus derivados y la ozonólisis de estas sustancias produce ácidos oxálico, glioxálico, y fórmico así como glioxal.
Independiente del mecanismo que se presente en la reacción (directo o vía radicales) los productos de oxidación son los mismos. Sin embargo, la eficiencia de la reacción puede ser mejorada por procesos de oxidación avanzada, incluyendo radiación ultravioleta (UV), en este caso se ha propuesto el siguiente orden de eficiencia en reactividad (Gurol et al.,1987):
O3 + UV > O3 > UV
Dependiendo de su estructura, la reacción de los compuestos fenólicos se incrementa cuando la densidad electrónica en el anillo aromático es mayor y decrece con el tamaño del sustituyente. También se ha demostrado que la velocidad de reacción se incrementa a un valor de pH alto debido a la disociación del fenol en iones fenatos. Aunque las velocidades de reacción, medidas en los trabajos que se han realizado al respecto presentan ciertas variaciones se pueden considerar valores del siguiente orden (Hoigne y Bader, 1983):
1.3 *103 M-1 S-1 para el fenol no disociado
1.4 *109 M-1 S-1 para el ión fenato
Otros parámetros fundamentales a tener en cuenta son:
pH: El aumento de pH ha demostrado disminuir la estabilidad del ozono. Por consiguiente la dosis aplicada de ozono, debe aumentarse.
Dosificación requerida: La dosis de ozono requerida para la oxidación del fenol por lo general es determinada de manera experimental, aunque en la mayoría de los casos se requieren unos pocos mg O3/l de agua residual.
Tiempo de residencia: El tiempo de contacto óptimo, depende básicamente del objetivo de la ozonización. En general, las reacciones de oxidación del ozono con los fenoles ocurren en corto tiempo. En los ensayos a escala piloto será máximo de seis minutos a través del sistema.
Gas de alimentación: Podría utilizarse oxígeno puro o aire atmosférico, pero más del 99% de los sistemas que utilizan ozono para el tratamiento de sus aguas, utilizan aire como gas de alimentación. El aire alimentado puede contener impurezas, humedad relativa, material particulado y concentraciones de hidrocarburos, por lo cual debe ser preparado antes de entrar al sistema.
Ozonización en medio alcalino
El ozono puede reaccionar en forma directa con un sustrato orgánico a través de una reacción lenta y selectiva (Ecuación 1), o de una reacción de radical libre favorecida en medio alcalino -rápida y no selectiva- (Ecuación 2):
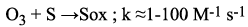
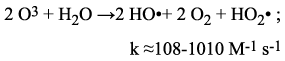
Las constantes de velocidad con compuestos orgánicos difieren mucho para ambos tipos de procesos, tal como se ha mostrado en la Tabla 3.
La primera reacción es de importancia en medios ácidos y para solutos que reaccionan muy rápido con el ozono; ejemplos de ello son los compuestos orgánicos no saturados, con grupos aminos. La segunda reacción puede iniciarse de distintos modos, con especies tales como HO-, HO2-,HCOO-, Fe2+ o sustancias húmicas.
Por lo tanto, al principio la ozonización es sensiblemente más eficiente en medios alcalinos. La Figura 1.a muestra un esquema de las principales especies de la descomposición de ozono en agua pura iniciada por iones hidróxido (Glaze et al., 1987).
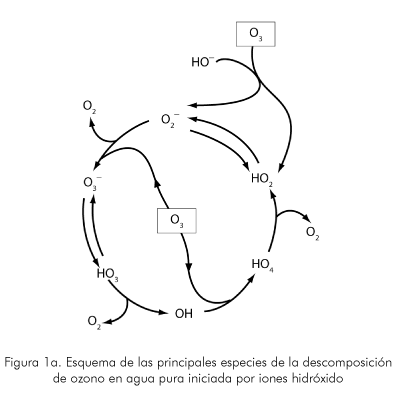
Este camino indirecto es menos selectivo, ya que las especies formadas tienen gran capacidad oxidante. Existen sin embargo, compuestos refractarios que resisten la mineralización pero gran parte de la materia orgánica reaccionará al combinar las reacciones, dependiendo de la composición del agua tratada, del pH y de la dosis de ozono. Debe tenerse cuidado de no elevar excesivamente el pH, debido a la acción competitiva de los iones bicarbonato y carbonato, limitadores de la acción de los radicales HO• según las siguientes reacciones.
HO• + HCO3 - → CO3•
HO• + CO32- → CO3- + HO
La ozonización es un buen pretratamiento para procesos biológicos, y versátil para técnicas combinadas. No produce trihalometanos (THM) u otros compuestos clorados; uno de los principales problemas de otros tratamientos como la cloración o el óxido de cloro. El ozono puede producirse fácilmente in situ por descarga eléctrica en corriente de aire, y no deja olores ni gustos residuales. Sin embargo, se debe tener en cuenta que por su estado gaseoso, a diferencia de un oxidante totalmente miscible con el agua como el peróxido de hidrógeno; la ozonización involucra procesos de transferencia de la molécula gaseosa a la fase acuosa, existiendo entonces limitaciones de transferencia de masa. Por consiguiente, se minimizan estas limitaciones incrementando el área y el tiempo y el contacto de fases, lo cual requiere de consumo energético adicional que en la mayoría de casos no es limitante.
Ozono/peróxido de hidrógeno (H2O2)
La adición de peróxido de hidrógeno a los sistemas de ozonización es una de las formas más inmediatas de acelerar la descomposición de ozono a la formación de radicales hidróxilo (OH). El H2O2 es un ácido débil, un poderoso oxidante y un compuesto inestable. El uso de estos dos oxidantes combinados permite aprovechar los efectos sinérgicos entre ellos, lo que produce una destrucción adicional de la carga orgánica. Entre las posibles mezclas de agentes oxidantes, la combinación peróxido de hidrógeno y ozono es sin duda la más usada.El proceso pretende combinar la oxidación directa del ozono con la reacción rápida y poco selectiva de los radicales H2O2 con los compuestos orgánicos.
El proceso no es barato pero es rápido, y puede tratar contaminantes orgánicos presentes en muy bajas concentraciones (ppb), a pH entre 7 y 8; la relación molar óptima generalmente de O3/H2O2 es 2:1. El proceso se acelera a pH alcalino.
El tratamiento ha resultado efectivo para descomponer compuestos organoclorados como tricloroetileno, tetracloroetileno, etc. Por lo tanto, es excelente para el postratamiento de aguas sometidas a tratamientos de desinfección con cloro o dióxido de cloro. Uno de los principales campos de aplicación es la degradación de plaguicidas presentes en aguas.
También se ha usado en la decoloración de compuestos de aguas residuales de la industria papelera y otros procesos industriales (Balcioglu I.A., 2001)
Análisis general de las AOP
Una de las situaciones probablemente mas clara al hacer una revisión de las publicaciones realizadas sobre las AOP, es que uno de los problemas bastante difíciles para la aplicación de estas tecnologías es el de escoger el sistema más eficiente para un contaminante dado, y en especial para un sistema en donde existe una mezcla compleja de sustancias a tratar.
Sin embargo, en esta revisión se pueden derivar una serie de sugerencias tales como las que manifiestan los trabajos realizados por algunos investigadores que hacen referencia a los resultados de la aplicación de algunas AOP para la oxidación de nitrobenceno concentrado a altos pH tales como: O3/H2O2, H2O2/UV, y O3/UV. Aquí se muestran algunas de las ventajas y desventajas de cada proceso.
Como resultado de estos análisis se concluye que puede haber limitaciones muy drásticas en la aplicación de AOP para el tratamiento de compuestos orgánicos en aguas residuales muy concentrados. Sin embargo, su uso en el tratamiento de aguas de procesos en donde se considera la concentración de sustancias a degradar en el rango de los micro-contaminantes (aguas subterráneas, aguas de proceso de semiconductores, etc.) es muy competitivo.
Para este caso se encontró como una de las características más relevante de este sistema es que para concentraciones altas (> 50ppm) en matrices complejas es altamente consumidora de energía y agentes oxidantes, además se mostró que la velocidad de degradación del nitrobenceno con tecnologías AOP, sin ozonización es casi la misma para los sistemas de oxidación con la combinación de O3/H2O2 o O3/UV.
Las reacciones que se involucran en las AOP son en general tan complejas que y de difícil análisis cinético que para el tratamiento de diferentes compuestos orgánicos el orden de eficiencia puede ser muy diverso. Por ejemplo, el orden de eficiencia para el tratamiento del antraceno es el siguiente:
Estos resultados fueron similares cuando se usaron estas tecnologías en el tratamiento de PAHs. Lo cual indica que en este sistema el número de radicales HO• no juega un papel tan importante.
Sin embargo, para el sistema de degradación de los nitro fenoles el orden de eficiencia es el siguiente:
Para este caso por ejemplo si se desea disminuir el consumo de ozono en la reacción se debe usar el sistema O3/H2O2/UV combinado con bajos pH.
METODOLOGÍA
Agua residual utilizada en los experimentos La fase acuosa se obtuvo a partir de soda cresílica gastada proveniente de los procesos de endulzamiento de nafta. La fase acuosa soda cresílica nafta fue previamente tratada por medio de un proceso de neutralización controlada y de extracción de los compuestos fenólicos, con el objeto de reducir su concentración hasta 2000 mg/l de fenol (Forero et al., 1999). posteriormente, de realizó un proceso de tratamiento con ozono en un reactor de pulso de acuerdo a un procedimiento desarrollado en el ICP (Forero et al., 2000). El pH de la solución se mantuvo constante durante toda la prueba, controlándose con soluciones de soda cáustica.
Contacto ozono/agua residual
El ozono se puso en contacto con la fase acuosa por medio de un sistema diseñado en el Instituto Colombiano del Petróleo (ICP) que alcanza altos grados de dispersión. Este está compuesto por un reactor de pulso, cuyo relleno es un contactor estático de alto esfuerzo cortante. Para asegurar el tamaño de las burbujas de gas con diámetros menores a 1 mm, el pulso es generado por una bomba de diafragma a una frecuencia de 60 pulsaciones por minuto.El volumen de cada pulsación varia entre 5 y 7% del volumen total del reactor, el uso de este sistema de contacto asegura una eficiencia de transferencia de ozono mayor al 95% (Forero et al., 1999).
Un volumen determinado de muestra es introducido en el tanque de donde es tomado y recirculado a través de un reactor tubular de pulso, construido en PVC transparente de 2,54 cm. (1´´) de diámetro por 6 m de largo, por medio de una bomba a una velocidad de flujo de 30 l/min con una presión de 1,448 Bar (21 psi).
El ozono se produjo a partir de un generador OZONAIR, el cual es alimentado con oxígeno puro proveniente de un cilindro que asegura el suministro constante a lo largo del experimento. Se alcanza una producción de 19 gramos de ozono por hora en proporción de aproximadamente el 4% en volumen de la mezcla total de oxígeno-ozono. Esta mezcla característica se utilizó para todos los experimentos.
Los experimentos para el tratamiento de agua residual se llevaron a cabo en dos etapas: la primera se realizó hasta lograr una degradación del 90% del sustrato, con inyección de ozono. La segunda, hasta degradar aproximadamente el 9% del sustrato residual de una muestra previamente tratada en la primera etapa, usando oxidación avanzada.
Métodos analíticos
La generación de ozono y las pérdidas en el tanque de almacenamiento fue determinada por el método yodo métrico 2350E del Standard Methods.
Durante el experimento se tomaron muestras de 20 ml a intervalos de tiempo definidos, desde el centro del tanque de almacenamiento que siempre permaneció completamente agitado y homogéneo. A las muestras se les determinó el contenido de fenol, la demanda química de oxígeno (DQO), según los procedimientos 5530D y 5220 respectivamente del Standard Methods.
Parámetros evaluados
Los parámetros que se evaluaron en el presente estudio fueron:
• El sistema de oxidación avanzada.
• El tipo de carga: Agua Residual Industrial (ARI) y Agua Fenólica Sintética (AFS).
• La relación de agente oxidante y sustancia a degradar.
• El efecto del catalizador (óxidos metálicos) en el sistema.
• La relación Gas/Líquido en el reactor y tubular.
•El pH.
RESULTADOS Y ANÁLISIS
En la Figura 2 se muestra el efecto que produce la variación del tipo de carga en el sistema de ozonización en medio básico, al someterla a una corriente de ozono de 19 g/h controlando el pH de la solución. En la curva (AFS) se representa la disminución de fenol con respecto al tiempo en el agua fenólica sintética diferentes pH (6,9), la curva (ARI) representa el mismo tratamiento pero llevado a cabo sobre el agua residual industrial (200 mg/l de fenol), también a diferentes pH (6,9).
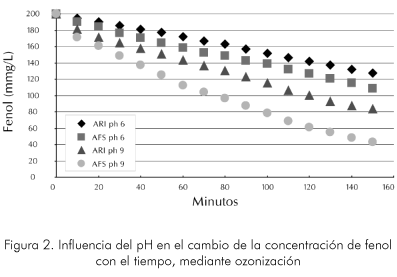
Como se observa en la Figura 2 se puede considerar que la reacción en estas condiciones tiene un comportamiento muy cercano a una línea para todas las condiciones del experimento. Esto implica que el orden de la reacción es cero, aunque en las condiciones más eficientes, se percibe un pequeño cambio de pendiente a concentraciones por debajo de los 100 ppm. Sin embargo, se encuentra una influencia relativamente alta del pH, esto demuestra que la reacción se ve favorecida por los pH altos, lo que conlleva a que el mecanismo de reacción esté soportado principalmente por la generación del ión hidróxilo.
Para el mismo tiempo de la reacción el pH básico mejora la eficiencia de velocidad de degradación en promedio de 80 a 120%. También se observa que la complejidad de la muestra real de agua fenólica es alta, dado que las velocidades de degradación se disminuyen por la presencia de la mezcla de los compuestos orgánicos que se presentan en estas muestras. Esto hace que la velocidad de reacción se disminuya en promedio entre 30 y 50% a diferentes puntos de muestreo.
Debido a que la matriz de AFS está libre de inhibidores o su efecto es mínimo sobre el sistema, dicha desviación sugiere la presencia de sustancias interferentes en las ARI que alteran la reacción del fenol con el ozono o que llegan a interactuar con este antes de que se pueda presentar una degradación de los compuestos fenólicos. A diferencia de las evaluaciones hechas en sistemas mas concentradas en donde inicialmente no hay tanta variación entre las velocidades de los sistemas reales y los sintéticos. Se puede inferir que el efecto de los inhibidores y de reacciones competitivas es menor, esto es posiblemente debido a que a bajas concentraciones del reactivo principal estos inhibidores toman mayor importancia.
Si se compara el tiempo necesario para alcanzar una concentración de 100 mg/l de fenol en los cuatro sistemas, se puede observar que el ozono tiene un mayor impacto en la degradación del fenol analítico (AFS) que en el de la solución de soda gastada. En el experimento para las ARI se requieren más de 180 y 120 minutos a diferentes pH (6,9) para lograr los 100 mg/l de fenol final, lo cual representa un consumo adicional de más del 35% de ozono. Por lo tanto, se puede concluir que para este sistema las diferencias en tiempos de degradación de fenol se atribuyen principalmente a tres factores:
• Presencia de sustancias orgánicas adicionales al fenol, las cuales aportan una mayor demanda de ozono al sistema de reacción.
• Acción de inhibidores de radicales como los iones carbonato y bicarbonato, los cuales son comunes en este tipo de aguas (Langlais, 1991).
• El aumento de la complejidad en las estructuras de los compuestos fenólicos, hecho que disminuye su velocidad de reacción con respecto al ozono (Berné, 1995).
En el caso de la prueba que involucra el peróxido de hidrogeno, a diferentes niveles de pH (6 y 9) Figuras 3 y 4, se evalúa la influencia de la concentración inicial de este componente. Con este peróxido, se observa un comportamiento totalmente diferente al caso de tratamiento solo con ozono en medio básico. Debido a que se pierde la linealidad en la degradación del compuesto orgánico, se concluyó que esta reacción no es de orden cero sino de uno mayor en el rango de las condiciones del experimento. Es importante anotar que el cambio de pendiente es muy drástico para todos los casos cuando han trascurrido aproximadamente entre el 60 y 80 minutos de la reacción. Es claro que la cantidad inicial de peróxido aplicada a la muestra afecta la velocidad de reacción. Se puede encontrar que la eficiencia en promedio se mejorará en más del 100% para cuando se usa el doble de este reactante, por lo cual se reduce aproximadamente a la mitad el consumo de ozono. Esto haría que el proceso de mayor peróxido sea económicamente más atractivo que el de mayor ozono.
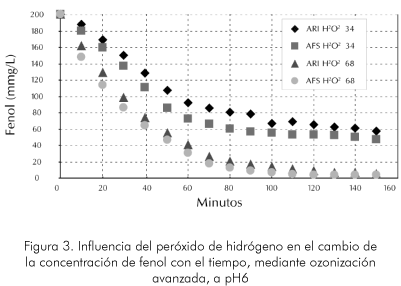
Otra ventaja del uso de mayor peróxido es que su eficacia puede hacerlo la única solución a las condiciones estudiadas. Esto debido a que su nivel de tratamiento llegó a concentraciones mucho más bajas que con bajo peróxido, es decir, a niveles finales de concentración de compuestos orgánicos menores a 5 ppm , mientras que en el otro caso solo llegó a niveles 10 veces mayor.
La diferencial del comportamiento del sistema en el caso de las aguas sintéticas y de las reales no fue tan marcado en este proceso en especial para el de mayor índice de peróxido inicial. Esto podría implicar que la complejidad de las aguas reales no es limitante para este proceso, menos aún en concentraciones mayores de peróxido. Aunque no existe un mecanismo apropiado para explicar este comportamiento, se ha supuesto que en el proceso con catalizador la reacción ozono-fenol tiene lugar por otra vía diferente a la de la simple formación de radicales libres. Parece ser que en este caso la influencia de los inhibidores de radicales en solución, es mínima (Longman, 1997).
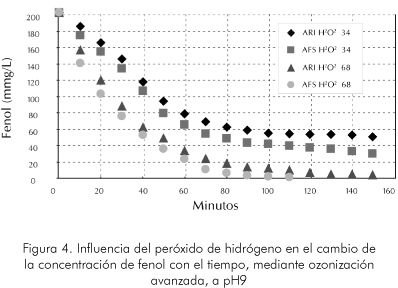
En la Figura 4 se observa la influencia de la concentración inicial de peróxido en la velocidad de degradación del fenol en medio básico pH (9). Se demuestra nuevamente que la influencia de la concentración inicial del peróxido es similar a la mostrada para la misma reacción en medio ácido pH (6), respecto al cambio de la linealidad. El cambio de pendiente aparece cuando ha trascurrido aproximadamente entre el 60 y 80 minutos de la reacción. Sin embargo, el cambio de pendiente parece ser más suave, lo que muestra que la generación de iones hidróxilo es alta. La velocidad de reacción es en general mayor entre 30-40% aproximadamente, lo que permite que también se llegue a un nivel de agente residual a tratar para esta prueba menor que a pH ácido.
También a pH altos se observa la influencia de la cantidad inicial de peróxido mejorando la eficiencia en alrededor del 100%, reduciendo al consumo de ozono para alcanzar una concentración final similar.
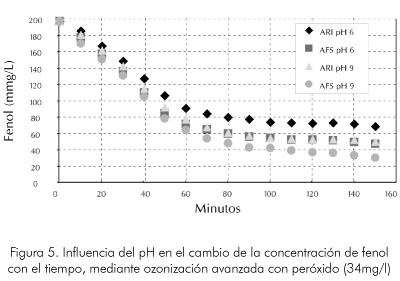
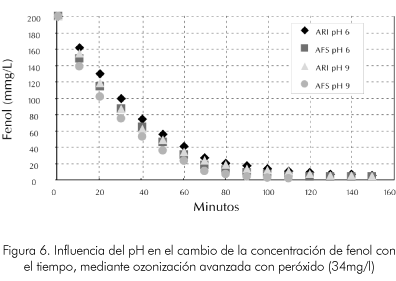
En cuanto a la economía del sistema y sus aplicaciones a escala industrial este sistema es similar a las condiciones que rigen la reacción a pH bajo. En las Figuras 5 y 6 se observa la influencia del pH en la velocidad de reacción para el sistema a diferentes niveles de concentración inicial de peróxido. Podemos observar que es mucho más notoria la influencia de la concentración de peróxido que la del pH a las condiciones evaluadas.
En la Figura 7 se muestra la velocidad de degradación de fenol para los tres mejores sistemas de AOP. Se observa claramente que los factores que más influyen en la eficiencia de la oxidación son el pH y la mayor concentración de peróxido, además se puede apreciar el efecto del peróxido en la eficiencia del sistema. Bajo estas condiciones es posible encontrar que no necesariamente la mayor inyección de ozono asegura la mejor degradación de los compuestos aromáticos solubles en agua y que, por el contrario, una adecuada relación de varios agentes oxidantes puede ser mucho mejor para lograr un sistema más eficiente y económico.
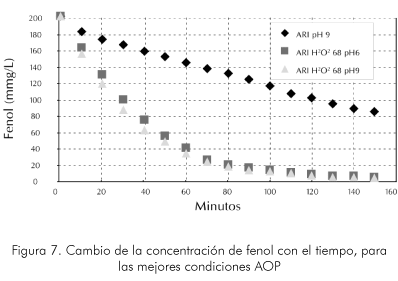
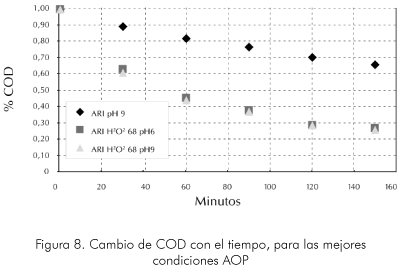
Finalmente, en la Figura 8 se muestra el cambio de COD (Chemical Oxigen Demand) durante la prueba de ozonización de ARI. Se observa que la COD varía proporcionalmente con el contenido de fenol en las aguas tratadas. Sin embargo, a diferencia de la degradación de fenoles el COD cambia en una forma más suave, mostrando que se generan compuestos intermedios que pierden su carácter aromático pero que siguen siendo agentes contaminantes intermedios entre el compuesto aromático y el producto de mineralización completa que para el caso tratado. Esta disminución apreciable de la toxicidad de las aguas tratadas, muestra que estos métodos de oxidación son una muy buena alternativa para el tratamiento por medios biológicos de los afluentes tóxicos.
CONCLUSIONS
• Para las reacciones de ozonización la influencia del pH en la velocidad de reacción es clara. En general a las mismas condiciones de tratamiento la velocidad de reacción es en promedio 100-150% mayor a pH 9 que a pH 6 para las muestras evaluadas.
• La complejidad de la muestra industrial hace que la reacción sea más lenta (20-40%) comparada con la solución de fenol analítico. Esta diferencia se debe principalmente a la naturaleza de las mezclas de compuestos fenólicos naturales y a su contenido de sales que pueden actuar como inhibidores.
• El uso de peróxido de hidrógeno incrementa de una manera notoria la velocidad de degradación del fenol (150-200%).
• El contenido inicial de peróxido de hidrógeno es proporcional a la velocidad de degradación de los compuestos orgánicos de la mezclas evaluadas. Al duplicar esta concentración la velocidad de reacción puede incrementarse entre 120-160% en las muestras evaluadas.
• Al usar peróxido de hidrógeno la influencia del pH en la velocidad de reacción tiene la misma tendencia que en reacciones de ozonización pero las diferencias son menores. Estos incrementos a los diferentes pH (6,0 -9,0) son sólo de 30-40% y no de 100-150% obtenidos en las pruebas anteriores.
• La velocidad de desaparición de fenol para la mayoría de casos analizados no presenta una tendencia lineal con el tiempo para las condiciones de la prueba. Sin embargo, el cambio de COD es lineal y su velocidad de reacción es baja y varia entre 40-60% de la del fenol, indicando que se están generando compuestos intermedios de reacción.
• La combinación del tratamiento con ozono en medio básico con el peróxido de hidrógeno es un proceso muy eficiente para degradar los compuestos orgánicos tóxicos de las aguas residuales de la refinación de petróleo.
• La relación económica de gramos de oxidante a usar en las aguas tratadas es menor cuando se usa peróxido que cuando se usa solamente ozono, además que el tiempo de reacción puede llegar a ser menor al 50%. • Es de mayor impacto para la degradación de orgánicos para el caso de el sistema O3/H202 el contenido de peróxido inicial que el control de pH, que para los casos reales es mucho mas práctico.
BIBLIOGRAFÍA
1. Balcioglu, I. A. and Arslan, I., 2001. "Partial oxidation of reactive dyestuffs and synthetic textile dye-bath by the O3 and O3/H2O2 processes". Water Science and Technology, 43(2): 221-228. [ Links ]
2. Berné, F. and Cordonnier, J., 1995. Industrial Water Treatment. Institut Francais du Pétrole Publications. Paris. [ Links ]
3. Forero, J., 1999. "Design and Evaluation of Oxygen Transference Processes Wastewater Treatment", CT&F - Ciencia, Tecnología y Futuro, 1 (5): 57-65. [ Links ]
4. Forero, J., 1999. "Diseño de un nuevo sistema de flotación para el tratamiento de Aguas Industriales", CT&F - Ciencia, Tecnología y Futuro, 1 (5): 67-75. [ Links ]
5. Forero, J., 2000. "Manejo integral de sodas y disposición de sodas gastadas". Documento interno ECOPETROL - CIT-ICP, colección restringida. [ Links ]
6. Glaze, W. H., Kang, J. W., and Chapin, D. H., 1987. "The chemistry of water treatment processes involving ozone, hydrogen peroxide and ultraviolet radiation". Ozone Sci. & Technol., 9, 335-352. [ Links ]
7. Gurol, M. et al., 1982. "Kinetics of ozone decomposition". A Dynamic Approach, Envir. Sci. Technol. [ Links ]
8. Gurol, M. et al., 1987. "Oxidation of phenolic by Ozone and Ozone + UV Radiation: A Comparative Study", Water Research, 21, 895-900. [ Links ]
9. Gurol, M. D. and Singer, P. C., 1982. Kinetics of ozone decomposition: a dynamic approach. Environ. Scienc. Technol., 16 (7): 377-383. [ Links ]
10. Hoigné, J. and Bader, H., 1977. "Ozonation of Water: Selectivity and Rate of Oxidation of Solutes". Ozone Scienc. and Engineer., 1, 73-85. [ Links ]
11. Hoigné, J. and Bader, H., 1983. "Rate Constants of Reaction of Ozone with Organic and Inorganic Compounds in Water", Water Research, 17, 173-183. [ Links ]
12. Huang, C. P., Dong, Ch. and Tang, Z., 1993. Waste Management, 13, 361-377.
13. Langlais, B. et al., 1991. "Ozone in water Treatment Application and Engineering". Lewis Publishers, Michigan . [ Links ]
14. Legrini, O., Oliveros. E., and Braun, A. M., 1993. "Photochemical processes for water treatment". Chem. Rev., 93, 671-698. [ Links ]
15. Longman, F. and Anne, H., 1997. Water with Fixed Bed Catalytic Ozonation Process. Wat. Sci. Tech., 35(4): 353-360. [ Links ]
16. Masten, S et al., 1994. The Use of Ozonation to Degrades Organic Contaminants in Wastewaters. Envir.Sci.Tech. [ Links ]














