Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Universitas Scientiarum
versão impressa ISSN 0122-7483
Univ. Sci. v.13 n.2 Bogotá maio/ago. 2008
Evaluación de la capacidad probiótica "in vitro" de una cepa nativa de Saccharomyces cerevisiae
"in vitro" evaluation of the probiotic capacity of a native strain of Saccharomyces cerevisiae
Gustavo Arbeláez3, David Gómez3, Balkys Quevedo-Hidalgo2
2 Grupo de Biotecnología Ambiental e Industrial. Facultad de Ciencias. Pontificia Universidad Javeriana
3 Unidad de Investigaciones Agropecuarias. Facultad de Ciencias.
Pontificia Universidad Javeriana, Cra. 7 N° 43-82. Bogotá, Colombia
aaguirr@javeriana.edu.co, bquevedo@javeriana.edu.co
Recibido: 16-01-2008: Aceptado: 14-10-2008:
Resumen
En el presente estudio se evaluó la capacidad probiótica in vitro de una cepa nativa de Saccharomyces cerevisiae (A) y se comparó con una cepa comercial (B) utilizada como probiótico. Para esto se determinó la concentración de melaza de caña (10, 20 y 30% (p/v)) que permitiera obtener la mayor cantidad de biomasa de las cepas, así mismo se determinaron parámetros cinéticos. La concentración de melaza que arrojó mejores resultados fue 20% (p/v) y se encontró diferencia en la producción de biomasa para la cepa en estudio A (28g/L) y la cepa control B (3g/L) en medio melaza. Se realizaron pruebas in vitro como resistencia a sales biliares, tolerancia a rangos de pH y jugos gástricos, donde no se observaron diferencias entre la cepa A y B al medir el crecimiento. La reducción del colesterol en presencia de sales biliares después de 12 horas de incubación fue de 54% para la cepa A y 58% para la B. Por último se realizó una prueba de adherencia en células Caco-2, encontrando adherencia a estas por parte de ambas cepas. De acuerdo con los resultados anteriores se demostró que la cepa A tiene propiedades probióticas in vitro que pueden ser corroboradas con posteriores estudios in vivo que confirmen su utilización como probiótico en nutrición animal.
Palabras clave: Adherencia, Biomasa, Melaza de caña, Probiótico, Saccharomyces, Tolerancia.
Abstract
The in vitro probiotic capacity of a native strain of Saccharomyces cerevisiae (A) was evaluated and compared with a commercial strain (B) used as a probiotic. The effect of the concentration of sugarcane molasses (10, 20 and 30% (w/v)) on the biomass production was investigated and kinetic parameters were determined. The best molasses concentration was 20% (w/v) and differences in biomass production on molasses medium between strain A (28 g/L) and control strain B (3 g/L) were observed. In vitro tests such as tolerance to bile salts, pH and gastric juices were carried out, and no differences in growth between strain A and B were found. Cholesterol reduction on presence of bile salts after 12 hours of incubation was of 54% for strain A and 58% for strain B. Both strains showed adherence to Caco-2 cells. Results reveal that strain A possesses in vitro probiotic properties that can be verified with further in vivo studies to confirm its suitability as probiotic in animal nutrition.
Key words: Adherence, Biomass, Sugarcane molasses, Probiotic, Saccharomyces, Tolerance.
INTRODUCCIÓN
Un probiótico es una preparación o un producto que contiene microorganismos viables en suficiente número, los cuales alteran la microflora (por implantación o colonización) en un compartimiento del hospedero provocando efectos beneficiosos sobre la salud del mismo (Schrezenmeier y De Vrese, 2001).
Los probióticos pueden contener una o más cepas microbianas. Se han utilizado diferentes géneros bacterianos como: Lactobacillus, Bifidobacterium, Estreptococus, Leuconostoc, Pediococus, Propionibacterium, Bacillus y Escherichia coli no patógenos, así como levaduras del género Saccharomyces (Fuller, 1992).
S. cerevisiae ha sido ampliamente estudiada, pero se conoce poco acerca de su capacidad como microorganismo probiótico, ya que las investigaciones se han enfocado en otros microorganismos de mayor uso (Guslandi et al., 2003). Esta levadura ha sido reportada como un suplemento en la dieta de animales monogástricos (Agarwal et al., 2000), señalando que su uso como probiótico, reduce algunos enteropatógenos, produce cambios favorables en la mucosa intestinal y mejora el comportamiento productivo con raciones bajas en proteína (González y Valenzuela, 2000); también se le ha reconocido el ser promotor de crecimiento, aumentar la producción de vitamina B, ayudar a la ganancia de peso, mejorar la digestión de algunos alimentos, estimular el sistema inmune, mejorar la asimilación de nutrientes y corregir el balance de la población microbiana (Yépez, 1995).
Debido a lo mencionado anteriormente, la evaluación de la capacidad probiótica de este microorganismo es importante, para verificar que resiste las condiciones del tracto gastrointestinal y que posteriormente la cepa en estudio puede ser suministrada al animal. Para llevar a cabo esto, es necesaria la producción de biomasa levaduriforme, para lo cual se debe seleccionar un sustrato económico que aporte los nutrientes para el crecimiento y reproducción. Un sustrato que cumple con las condiciones descritas anteriormente, es la melaza de caña, ya que contiene compuestos que favorecen el desarrollo de la biomasa como altos contenidos de carbohidratos (sacarosa, glucosa y fructosa), proteínas, grasas, calcio, fósforo, aminoácidos y vitaminas entre otros (Yépez, 1995; Téllez, 2004).
Los objetivos del presente estudio fueron evaluar la melaza de caña como sustrato para la producción de biomasa levaduriforme a diferentes concentraciones y determinar la capacidad probiótica de una cepa nativa de S. cerevisiae mediante pruebas "in vitro".
MATERIALES Y MÉTODOS
Obtención y conservación de cepas
Se utilizaron dos cepas; la cepa A (S. cerevisiae) la cual es una cepa nativa aislada previamente de melaza de caña que hace parte de la colección CMDM-PUJ 213, y la cepa B (S. cerevisiae var. boulardii) fue obtenida a partir de un probiótico comercial. Ambas cepas fueron conservadas en medio YPG (1% (p/v), extracto de levadura, 2% (p/v) peptona y 2% (p/v) glucosa) con glicerol al 30% (p/v) a - 70°C. Se determinó la viabilidad haciendo recuento en placa en agar YPG cada dos meses con el fin de establecer la estabilidad del banco.
Producción de inóculo
El inóculo utilizado para todos los cultivos discontinuos fue preparado en 40 mL de medio YPG o melaza de caña en las diferentes concentraciones evaluadas con ampicilina (300 mg/L). Posteriormente se adicionó una suspensión celular de S. cerevisiae (cepa A) o S. boulardii (cepa B). Se incubó a 30°C, 150 rpm, durante 12 horas. Se realizó recuento inicial en placa para verificar viabilidad de la cepa.
Fermentación discontinua a nivel de erlenmeyer y biorreactor de 1.5L de las cepas A y B.
La evaluación del efecto de la concentración de melaza de caña sobre el crecimiento de los microorganismos en estudio se realizó inicialmente a nivel de erlenmeryer con el fin de seleccionar la concentración que permitiera obtener la mayor concentración de biomasa levaduriforme para la posterior evaluación de la capacidad probiótica. Las concentraciones de melaza de caña evaluadas fueron: (10, 20 y 30% (p/v)) empleando caldo YPG, como medio control.
Para el cultivo en erlenmeyer de 500 mL, con el respectivo medio, se adicionó un volumen de inóculo correspondiente al 10% (v/v) y se mantuvo a 150 rpm, 30°C durante 20 horas. Se realizaron muestreos cada dos horas con el fin de determinar la concentración de biomasa y concentración de sustrato residual. Una vez seleccionada la concentración de melaza de caña adecuada para ambas cepas, se procedió a realizar fermentaciones discontinuas en fermentador de 1.5L.
El cultivo en biorreactor se realizó con 540 mL del medio a la concentración de melaza de caña seleccionada adicionando un inóculo de 60 mL, a 150 rpm, 30°C y 1 v.v.m., durante 20 horas. Los muestreos para la cuantificación de biomasa y sustrato residual fueron realizados de la misma forma que a nivel de erlenmeyer. Todos los ensayos se realizaron por triplicado.
Determinación de biomasa
La biomasa se determinó mediante la técnica de peso seco (Godoy, 2002a) para ambas cepas.
Determinación de azúcares reductores totales
Teniendo en cuenta que el medio de cultivo está compuesto por sacarosa, se hizo necesario realizar hidrólisis ácida previa a la cuantificación de azúcares reductores.
Se realizaron curvas patrón con glucosa (0.5-2g/L) y sacarosa (1.6-6 g/L). Inicialmente se llevó a cabo la hidrólisis de las muestras con HCl (diluido 1:1) y posteriormente se neutralizaron con NaOH 25% (p/v). (NTC 587, 1994; Godoy, 2002b). Los azúcares reductores fueron cuantificados por la técnica del ácido 3,5 dinitrosalicílico (DNS) (Miller, 1959).
Los datos de concentración de melaza, fueron analizados estadísticamente por medio de una prueba "T student" con el programa SPSS versión 14.
Evaluación de la capacidad probiótica
Para determinar la capacidad probiótica se realizaron diferentes pruebas por triplicado para la cepa en estudio (A) y para la cepa control (B).
Tolerancia a sales biliares. Se evaluó la tolerancia a diferentes concentraciones de sales biliares preparando caldo YPG suplementado con sales biliares (Bile Oxgall Difco®) para obtener concentraciones de 0.05, 0.1, 0.15, 0.2, 0.25 y 0.3% (p/v), el cual fue inoculado con una suspensión de levaduras (108 células/mL) previamente obtenida. Las muestras fueron incubadas a 30 ± 2°C durante 24 h. Finalizado el período de incubación se realizaron recuentos en placa por la técnica de microgota (Collins y Lyne,1989; Spencer y Ragout, 2001).
Tolerancia a pH. Se evaluó la tolerancia a pH preparando caldo YPG el cual fue ajustado a diferentes rangos de pH (2.0, 2.5, 3.0, 3.5, 4.0, 4.5 y 5.0) con HCl concentrado. Cada tubo, fue inoculado con una suspensión de levaduras (108 células/mL) obtenida previamente. Las muestras fueron incubadas a 30°C durante 24h. Finalizado el período de incubación se realizaron recuentos en placa por la técnica de microgota (Collins y Lyne, 1989; Spencer y Ragout, 2001).
Determinación de resistencia a jugos gástricos. Se preparó jugo gástrico artificial, para el cual se adicionó NaCl (2 g/ L) y pepsina (3.2 g/L), ajustando a pH final de 2.0- 2.3 con HCl concentrado. Como control, se ajustó jugo gástrico artificial a un pH de 6.5 - 7.0 con NaOH 5N. La esterilización se llevó a cabo por filtración con membrana de 0.22 µm. El jugo gástrico artificial y el control se inocularon con una suspensión de levaduras en una concentración de 108 células/mL, éstos fueron incubados a 30°C, tomando muestras en 0, 1, 2, 3, 4 y 24 horas. Para cada una se realizaron recuentos en placa por la técnica de microgota (Collins y Lyne, 1989; Spencer y Ragout, 2001).
Reducción del colesterol en presencia de sales biliares. Se preparó medio YPG suplementado con sales biliares (Bile Oxgall Difco®). Posteriormente se adicionaron 224.2 mg/mL de Lipids Colesterol Rich (Sigma ®). Este medio fue inoculado con 1% (v/v) de la suspensión de levaduras en una concentración de 108 células/mL. La mezcla se llevó a incubar a 30°C por 12 horas. El medio fue centrifugado a 8000 x g por 15 minutos, al sobrenadante se le adicionaron 3 mL de etanol al 95% (v/v), seguido por 2 mL de hidróxido de potasio al 50% (v/v). Posteriormente las muestras fueron calentadas en baño de agua a 60°C por 10 minutos, a continuación se adicionaron 5 mL de hexano y 3 mL de agua destilada agitando en vortex después de la adición de cada componente. De la fase acuosa (capa de hexano) se transfirieron 2.5 mL a un tubo, éste fue evaporado en un horno a 60°C. El residuo formado fue resuspendido en 4 mL de 0 - phthalaldehído. Luego de ser mantenido durante 10 minutos a temperatura ambiente se adicionaron 2 mL de ácido sulfúrico concentrado, transcurridos 10 minutos en reposo se procedió a medir la absorbancia a 550 nm contra el reactivo blanco con previa elaboración de una curva patrón con una solución concentrada de 130 µg de colesterol/mL (Spencer y Ragout, 2001).
Prueba de adherencia. Se utilizó la línea celular Caco-2, la cual fue obtenida del laboratorio de virología de la Pontificia Universidad Javeriana. Inicialmente fue crecida a 37°C en un ambiente con 5% de CO2 utilizando MEM (GIBCO ®), hasta observar la monocapa. Posteriormente las células fueron lavadas tres veces con PBS estéril (pH 7.0 ± 0.2). Se tomaron 5 mL de cultivo de cada una de las cepas, los cuales fueron centrifugados y lavados con PBS estéril (pH 7.0 ± 0.2), luego fueron resuspendidas en MEM.
Las células Caco- 2 fueron inoculadas con 0.8 mL del cultivo de levadura tratado. La mezcla fue incubada a 37°C durante 90 minutos en un ambiente con 5% de CO2, luego la monocapa fue lavada 4 veces con PBS estéril (pH 7.0 ± 0.2), a continuación se realizó coloración de Wright, la cual fue observada en el microscopio invertido contando el número de levaduras adheridas a las células Caco-2 en 20 campos microscópicos aleatorios. La capacidad de adherencia se expresó como el número de levaduras adheridas a 100 células Caco- 2 (Jacobsen et al., 1999; Kumura et al., 2004).
RESULTADOS
Evaluación de la concentración de melaza para obtención de biomasa
Los resultados de la fermentación de las cepas A y B en medio control YPG mostraron que la mayor producción de biomasa se llevó a cabo durante las primeras 8 horas para las dos cepas, y luego de la fase de desaceleración se llegó a la misma concentración por parte de las dos cepas (15 g/ L) (Figura 1). El comportamiento cinético obtenido en este estudio coincidió con lo reportado por Rubio (2008) y Pérez et al. (2005) quienes obtuvieron también la mayor concentración de biomasa en las primeras 8 horas en medio YPG.
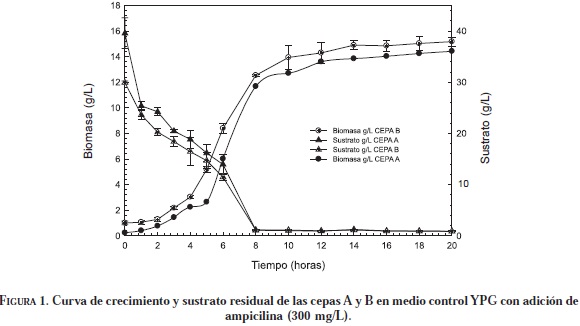
Al comparar los parámetros cinéticos (Tabla 1) de las dos cepas se observa que el comportamiento cinético es similar en el medio YPG; sin embargo, la cepa A tiene una mayor velocidad de crecimiento.
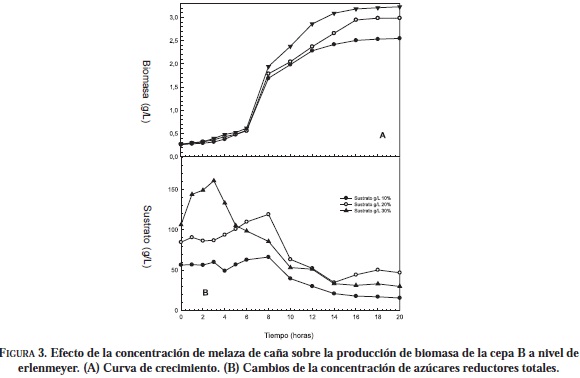
Al realizar las fermentaciones a nivel de erlenmeyer con melaza de caña 10, 20 y 30 (p/v) (Figuras 2 y 3), se observó en todos los casos la presencia de una fase de adaptación, tanto para la cepa A como para la B, la cual no se presentó con el medio YPG, esto debido a que la composición de este medio favorece la rápida recuperación de la levadura por su composición.
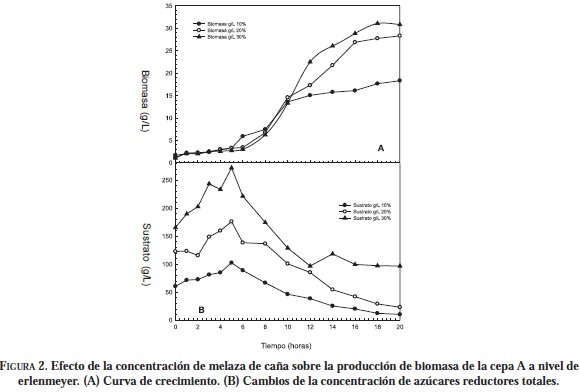
Al evaluar la producción de biomasa de la cepa A en las tres concentraciones de melaza de caña, se observó al final de cada fermentación una alta producción de biomasa. En la hora 18 se obtuvo el máximo crecimiento de S. cerevisiae obteniendo una concentración en g/L de 18 en 10% (p/v); 28 en 20% (p/v) y 31 en 30% (p/v).
En la producción de biomasa de la cepa B en las tres concentraciones de melaza de caña (Figura 3), se observó al final de cada fermentación una baja producción de biomasa comparada con la cepa A. En la hora 16 se obtuvo el máximo crecimiento de S. cerevisiae var boulardii, obteniendo una concentración en g/L de 2.5 en 10% (p/v); 2.94 en 20% (p/v) y 3.2 en 30% (p/v).
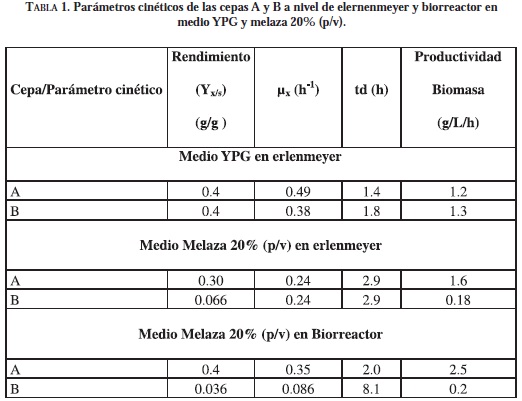
Los análisis estadísticos para las dos cepas fueron similares. La prueba t student, permitió concluir que existe diferencia estadísticamente significativa (p > 0.05) para decir que el promedio de la concentración de biomasa evaluada con melaza de caña al 20% fue mayor que en la del 10%. Además, se concluyó que no existe diferencia estadísticamente significativa (p > 0.05) en la concentración celular promedio evaluada con las concentraciones de melaza del 20 y 30%. Por lo tanto, se seleccionó la concentración de melaza de caña del 20% (p/v) para escalar el proceso de fermentación. La Tabla 1 muestra los resultados de la fermentación con 20% (p/v) de melaza para las dos cepas.
Al comparar las dos cepas en medio melaza 20% /p/v), se tiene una gran diferencia en el rendimiento y la productividad, mostrando que la cepa A arroja mayores valores, que son resultado de la capacidad que tiene la cepa para tomar el sustrato y transformarlo en biomasa; sin embargo, la velocidad de crecimiento es similar.
Los resultados a nivel de biorreactor con la concentración de 20% (p/v) (Tabla 1, Figura 4) de melaza mostró un aumento en la concentración de biomasa de S. cerevisie, siendo de 38.77 g/L en 14 horas, comparada con 26.88 g/ L a nivel de erlenmeyer, con un aumento del 44%.
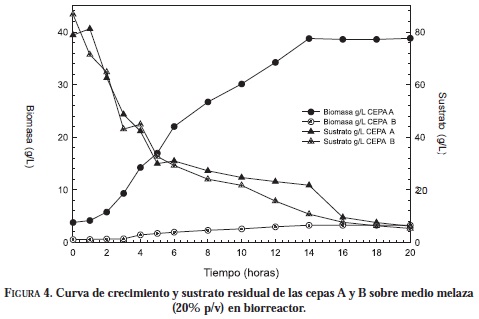
Aumentar la escala del proceso de fermentación no aumentó la concentración de biomasa de la cepa B, arrojando un valor de 3.3 g/L en 14 horas, similar al valor a nivel de erlenmeyer (2.9 g/L), indicando que el medio melaza y las condiciones de agitación y aireación no favorecieron el crecimiento de esta cepa, viéndose reflejado en la disminución del rendimiento, la velocidad de crecimiento y la productividad con respecto al proceso a nivel de erlenmeyer.
Evaluación de la capacidad probiótica
Se evidenció que el crecimiento de ambas cepas fue similar manteniéndose en una concentración de 105 UFC/mL, en todas las concentraciones de sales biliares evaluadas. Se presentó una leve disminución del crecimiento en la concentración de 0.3% (p/v); sin embargo, se mantuvieron dentro del mismo ciclo logarítmico.
En cuanto a la tolerancia al pH se evidenció que la concentración de la cepa A se mantuvo en un ciclo logarítmico de 106 UFC/mL, en todos los intervalos de pH evaluados. En la cepa comercial se encontraron valores más bajos (105 UFC/mL) en valores de pH inferiores a 4.0 ± 0.2, cuando el valor de pH aumentó a 4.5 y 5.0, el crecimiento también aumentó en un ciclo logarítmico.
Adicionalmente, se determinó la reducción de colesterol en presencia de sales biliares. La concentración experimental inicial de colesterol fue de 221.2 mg/mL, igualmente se determinó el colesterol residual del medio YPG suplementado con sales biliares (Bile Oxgall Difco®) y Lipids Colesterol Rich (Sigma ®), el cual fue para la cepa A de 102 mg/mL y para cepa B de 93.64 µg/mL. A partir de esto se determinaron los porcentajes de asimilación, siendo de 54 y 58% respectivamente.
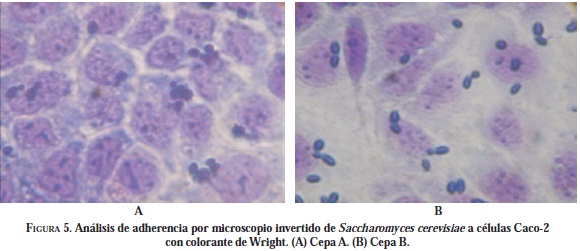
De acuerdo con los resultados ambas cepas presentaron adherencia a la línea celular Caco-2 (Figura 5); sin embargo, la cepa de estudio A presentó mayor adherencia que la cepa B.
DISCUSIÓN
La melaza de caña por ser un subproducto de la industria azucarera, contiene impurezas en su composición y frecuentemente se contamina con bacterias ácido lácticas, por lo que en este estudio fue necesario la adición de ampicilina (300 mg/L) para inhibir la carga acompañante y favorecer el desarrollo de la levadura. Se ha demostrado que las melazas, a pesar de su bajo contenido en nitrógeno y fósforo, constituyen un buen medio nutritivo para muchos microorganismos, como hongos y bacterias. Con base en esto, se utilizó un antibiótico β-lactámico como la ampicilina, la cual impide que la pared celular se construya correctamente ocasionando la lisis celular (Jaccques et al., 1999).
La adición de un antibiótico como la ampicilina al medio YPG, no afectó el crecimiento de S. cerevisiae, ya que los resultados en medio YPG con y sin ampicilina fueron iguales (Buitrago y Tenjo, 2007).
El comportamiento del sustrato residual para las cepas fue similar, en las primeras horas se presentó un incremento, debido a la composición de la melaza (azúcares reductores y sacarosa) y a la hidrólisis de la sacarosa por parte de la enzima invertasa, produciendo glucosa y fructosa, estos monosacáridos son sustratos fácilmente asimilables por Saccharomyces (Kazuhiko y Kozo, 1995) permitiendo el aumento de la velocidad de crecimiento (Figura 2). Sin embargo, el sustrato no se consumió totalmente en ningún caso, aparentemente como resultado de no expresar la invertasa. Según Olsson y Nielsen (2000), la regulación de la expresión de la invertasa en S. cerevisiae, cuando se usa sacarosa, sólo es regulada por represión de glucosa, por ejemplo cuando la glucosa no está presente la invertasa es expresada y en este caso al haber glucosa residual no se indujo la expresión de la enzima.
La baja producción de biomasa de la cepa B comparada con la cepa A, puede deberse a que la variedad boulardii presenta menor afinidad por sustratos complejos como la melaza. Las melazas pueden ser satisfactoriamente utilizadas como sustrato; sin embargo, Brandberg et al. (2006) analizaron que para microorganismos más exigentes es necesario el suplemento con ciertos aminoácidos libres o sulfato de amonio que le sirvan de fuente de nitrógeno y sugieren controlar el pH para que los medios con melaza se conviertan en un excelente sustrato para las fermentaciones microbianas. Esto se confirma, ya que el comportamiento en caldo YPG fue muy similar a la cepa A, teniendo en cuenta que este medio tiene extracto de levadura y peptona.
Fietto et al. (2004) compararon la respuesta de cepas de S. cerevisiae y S. boulardii a diferentes condiciones de estrés, demostrando que S. boulardii es genética, metabólica y fisiológicamente muy cercana o casi idéntica a S. cerevisiae; sin embargo, existe un comportamiento muy diferente, en relación a la producción de biomasa, la resistencia a la temperatura y la tolerancia a ciertos ácidos. Además se observó que la agitación y la aireación a nivel de biorreactor influyó disminuyendo notablemente la velocidad específica de crecimiento, indicando que la transferencia de oxígeno no favoreció a la cepa B. Contrariamente, la cepa A si aumentó su rendimiento, velocidad específica de crecimiento y productividad, mostrando que las dos cepas responden diferente a las condiciones de transferencia de oxígeno y agitación. Sin embargo, un punto que favoreció el crecimiento de la cepa A fue que al ser aislada de melaza de caña desarrolló fácilmente mecanismos adaptativos de tipo bioquímico al ser cultivada en el mismo medio.
Aunque las levaduras activan mecanismos de resistencia a sales biliares, valores muy altos tienden a retardar el metabolismo de las cepas (Rose, 1987). Los datos obtenidos en el presente estudio coinciden con lo reportado por Kumura et al. (2004), quienes al exponer cepas de Saccharomyces spp., a 0,1% (p/v) de sales biliares y 37°C durante 72 h, no observaron disminución en la viabilidad celular.
Ortiz (1997), asegura que S. cerevisiae posee proteínas en la membrana unidas a ATP, responsables de la traslocación de las sales biliares las cuales permiten transportar más eficientemente ácidos biliares conjugados. Se ha encontrado la presencia de vesículas presentes en las levaduras, similares a las encontradas en mamíferos que pueden internalizar las sales, para su posterior degradación mediante enzimas catabólicas (St Pierre et al., 1994). Otro mecanismo por el cual la levadura es resistente a altas concentraciones de sales biliares, se centra en la acumulación de polioles y glicerol, como mecanismo para regular la presión osmótica de la célula con el medio externo (Rose, 1987).
La tolerancia a pH puede deberse a dos tipos de antiportadores de Na+/H+ que posee la levadura; Nha1p, encontrado en la membrana plasmática y Nhx1p, que se localiza en el compartimiento endosomal prevacuolar. Estas proteínas catalizan el intercambio de cationes monovalentes (Na+ o K+) y H+ a través de las membranas, de tal modo que regulan las concentraciones de cationes y pH a nivel citoplasmático y de organelos (Mitsui et al., 2005, Ohgaki et al., 2005). Otro de los posibles mecanismos de regulación es una ATPasa localizada en la membrana citoplasmática, ésta puede crear un gradiente electroquímico de protones que conduce al transporte secundario de solutos y que está implicado en el mantenimiento del pH cercano a la neutralidad (Viegas et al., 1998; Sychrova et al., 1999; Thomas et al., 2002).
Aunque ambas levaduras toleraron valores de pH ácidos y presentaron mecanismos que les permiten regular el pH interno, la cepa en estudio demostró mayor resistencia a esta condición, que la cepa control, probablemente por el origen de la cepa, es decir, al haber sido aislada de melaza de caña está mejor adaptada a valores de pH ácidos. Los resultados son comparables con el estudio llevado a cabo por Khule et al. (2005), en el que se observó un mayor crecimiento de S. cerevisiae en comparación con S. boulardii en un medio de cultivo a pH 2.5 ± 0.2.
La capacidad de soportar rangos de pH y concentraciones de sales biliares ha sido demostrada por Psomas et al. (2001) en combinación con la capacidad de crecer en 37°C, asegurando que éstos son criterios de selección para la evaluación del potencial probiótico de cepas.
Otra prueba que pone de manifiesto la capacidad probiótica de una cepa es la resistencia a jugos gástricos. El jugo gástrico secretado tiene pH ~2.0 y concentración de sales ~0.5% (p/v) y enzimas catabólicas (Martins et al., 2005). En el presente estudio, las dos cepas evidenciaron viabilidad durante 24 horas, en el jugo gástrico artificial. Los recuentos obtenidos en las 4 primeras horas de muestreo, permanecieron similares para ambas cepas (siendo ligeramente mayor para la cepa B); sin embargo, la cepa en estudio tuvo recuentos superiores a partir de la cuarta hora de incubación y para la hora 24 este valor siguió aumentando. (Datos no mostrados).
Adicionalmente, se determinó la reducción de colesterol en presencia de sales biliares encontrando valores similares para ambas cepas. Los resultados obtenidos en este estudio son satisfactorios ya que tan solo con 12 h de incubación a 37°C la asimilación de colesterol fue del 54 y 58% para las cepas A y B respectivamente, mientras que autores como Psomas et al. (2003) quienes expusieron cepas de levaduras a una concentración de colesterol similar obtuvieron con 12 h de incubación a una temperatura de 37°C valores promedio cercanos al 9,7%. Se demostró que la reducción de colesterol incrementa de acuerdo al aumento del período de incubación ya que Psomas et al. (2003) luego de 24 h de incubación encontraron valores de 84% y a las 48 horas de incubación a 37°C se obtuvo el porcentaje máximo de asimilación 91.7%.
El colesterol no se desestabiliza ni se precipita en el medio por su conjugación con las sales biliares, por lo que es posible que las levaduras asimilen el colesterol presente en el medio para incorporarlo a su estructura. Las levaduras expuestas a medio de cultivo enriquecido con colesterol eran más difíciles de lisar después de ser sometidas a sonicación que las levaduras que no crecían en el medio enriquecido con colesterol, lo que sugiere un posible cambio morfológico en la pared o en la membrana celular, ya que al microorganismo incorporar este esterol a su estructura, se hace más resistente a la lisis celular, comparado con los que no lo incorporan (Psomas et al., 2003).
Los resultados obtenidos muestran que la cepa nativa evaluada en este estudio es capaz de reducir el colesterol, característica que es deseable, ya que para humanos la hipercolesterolemia o elevados niveles de colesterol en la sangre, es considerada como el mayor riesgo del desarrollo de enfermedades al corazón y en animales, la menor presencia de colesterol genera carnes de elevada calidad y de mayor demanda, al encontrarse libres de grasas. La administración de probióticos ha demostrado que puede reducir notablemente el nivel de colesterol (De Smet et al., 1998; Taranto et al., 1998).
Es importante la adición de las sales biliares al medio de cultivo adicionado de colesterol, ya que cuando estuvieron ausentes, no fue posible realizar la extracción de las muestras para la curva patrón. Lo anterior debido a que las sales biliares se encuentran presentes en el organismo en actividades de emulsión, solubilización y absorción de lípidos en el intestino (Begley et al., 2006).
Uno de los criterios importantes para una cepa probiótica es la habilidad para adherirse a la superficie de la mucosa del tracto gastrointestinal; ya que "in vivo", las células de levadura se adhieren a los enterocitos evitando que posibles patógenos puedan efectuar como mecanismo de patogenicidad la adherencia celular. La exclusión por medio de la competencia por sitios de adherencia y por sustrato es uno de los mecanismos de acción de las levaduras utilizadas como probióticos. Para este estudio se empleó la línea celular Caco-2 que proviene de adenocarcinoma de colon humano la cual, desarrolla características de enterocitos maduros y provee una población uniforme de células diferenciadas las cuales pueden usarse bajo condiciones definidas para la cuantificación de microorganismos adherentes (Chauviere et al, 1992). De acuerdo con los resultados ambas cepas presentaron adherencia a la línea celular Caco-2 (Figura 5); sin embargo, la cepa de estudio A presentó mayor adherencia que la cepa B. De acuerdo al estudio de Jacobsen et al. (1999), en el cual se realizaron ensayos de adherencia a células Caco-2 con varias cepas de Lactobacilos, se determinó que las cepas que presentaban un recuento de adherencia menor a 40 microorganismos en los 20 campos contados al azar se consideraban como no adherentes, entre 41 y 100 microorganismos como adherentes y más de 100 microorganismos como fuertemente adherentes, por lo cual las cepas A y B se consideraron para el presente estudio como adherentes.
Por último, al evaluar la cepa nativa en relación al probiótico comercial se pudo establecer que la cepa en estudio presenta características propias de una cepa con potencial probiótico y además tiene mejores rendimientos en cuanto a producción de biomasa, por lo que su factibilidad a nivel industrial sería promisoria. Adicionalmente, antes de su comercialización será necesario formular un biopreparado y evaluar esta cepa "in vivo" en modelos animales.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a la Vicerrectoría Académica de la Pontificia Universidad Javeriana por la financiación de este proyecto, N° PS036.
LITERATURA CITADA
AGARWAL, N.; KAMRA, D.; CHAUDHARY, L.; SAHOO, A.; PATHAK, N. Selection of Saccharomyces cerevisiae strains for use as a microbial feed additive. Letters in Applied Microbiology, 2000, 31, 270-273. [ Links ]
BEGLEY, M.; HILL, C.; CORMAC, G. y GAHAN, M. Bile salt hydrolase activity in probiotics. Applied and Environmental Microbiology, 2006, 72 (3): 1729-1738. [ Links ]
BRANDBERG, T.; GUSTAFSSON, L. y FRANZEN, C. The impact of severe nitrogen limitation and microaerobic conditions on extended continuous cultivations of Saccharomyces cerevisiae with cell recirculation. Enzyme and Microbial Technology, 2006 40, 585-593. [ Links ]
BUITRAGO, J. y TENJO, D. Evaluación de un sustrato vegetal obtenido a partir de residuos vegetales de Crisantemo (Dendranthema grandiflora) con un consorcio celulítico. Trabajo de grado. Pontificia Universidad Javeriana., Bogotá, D.C. 2007. [ Links ]
CHAUVIERE, C.; COCONNIER, M.; KERNELS, S.; FOURNIAT, J. y SERVIN, A. Adhesion of human Lactobacillus acidophilus strain LB to human enterocyte-like Caco-2 cells. Journal of General Microbiology, 1992, 138, 1689-1696. [ Links ]
COLLINS, C.H. y LYNE, P. Métodos microbiológicos. Editorial Acribia. Zaragoza, España. 1989, 524 págs. [ Links ]
DE SMET, I.; DE BOEVER, P. y VERSTRAETE, W. Cholesterol lowering in pigs through enhanced bacterial bile salt hydrolase activity. British Journal of Nutrition, 1998, 79, 185 - 194. [ Links ]
FIETTO, J.; ARAÚJO, R.; VALADÃO, F.; FIETTO, L.; BRANDÃO, R.; NEVES, M.; GOMES, F.; NICOLI, J. y CASTRO, L. Molecular and physiological comparisons between Saccharomyces cerevisiae and Saccharomyces boulardii. Canadian Journal of Microbiology, 2004, 50, 615-621. [ Links ]
FULLER, R. Probiotics. The scientific basis. Primera edición. Editorial Chapman - Hall. Londres, Inglaterra. 1992, 398 págs. [ Links ]
GODOY, R. Determinación de biomasa por peso seco. En: Manual de métodos analíticos. Departamento de Ingeniería Química. Universidad Nacional de Colombia. Bogotá, Colombia. 2002a. [ Links ]
GODOY, R. Método DNS para la determinación de azúcares reductores totales en melaza, sustrato de fermentación y vinos. En: Manual de métodos analíticos. Departamento de Ingeniería Química. Universidad Nacional de Colombia. Bogotá, Colombia. 2002b. [ Links ]
GONZÁLEZ, A. y VALENZUELA, L. Saccharomyces cerevisiae, En: Departamento de Genética Molecular, Instituto de Fisiología Celular, Universidad Nacional Autónoma de México, 2000, 1-5. [ Links ]
GUSLANDI, M.; GIOLLO, P. y TESTONI, P. A pilot trial of Saccharomyces boulardii in ulcerative colitis. European Journal of Gastroenterology and Hepatology, 2004, 15, 697-698. [ Links ]
ICONTEC. Norma NTC 587. Industrias alimentarias e industrias de bebidas. Melaza de Caña. 1994. [ Links ]
JACCQUES, K.; LYONS, T. y KELSALL, D. The alcohol textbook. Tercera edición. Nottingham University Press. Alltech Inc. Nottingham, Inglaterra. 1999, 346 págs. [ Links ]
JACOBSEN, C.; ROSENFELDT, V.; HAYFORD, A.; MOLLER, P.; MICHAELSEN, K.; PAERREGAARD, A.; SANDSTRO, B.; TVEDE, M. y JAKOBSEN, M. Screening of Probiotic Activities of Forty-Seven Strains of Lactobacillus spp. by In Vitro Techniques and Evaluation of the Colonization Ability of Five Selected Strains in Humans. Applied and Environmental Microbiology, 1999, 16, 4949-4956. [ Links ]
KAZUHIKO, T. y KOZO, T. Factors affecting the ethanol productivity of yeast in molasses. Journal of Fermentation and Bioengineering, 1995, 79 (5): 449-452. [ Links ]
KUHLE, A.; SKOVGAARD, K. y JESPERSEN, L. In vitro screening of probiotic properties of Saccharomyces cerevisiae var. boulardii and food-borne Saccharomyces cerevisiae strains. International Journal of Food Microbiology, 2005, 101, 29-39. [ Links ]
KUMURA, H.; TANOUE, Y.; TSUKARA, M.; TANAKA, T. y SHIMAZAKI, K. Screening of dairy yeast strains for probiotic applications, Journal of Dairy Science, 2004, 87, 4050-4056. [ Links ]
MARTINS, F.; FERREIRA, F.; PENNA, F.; ROSA, C.; DRUMMOND, R.; NEVES, M. y NICOL, J. Estúdio do potencial probiótico de linhagens de Saccharomyces cerevisiae a través de testes in Vitro. Revista de Biologia e Ciencias da Terra, 2005, 5, 1-13. [ Links ]
MILLER, G. Use of Dinitrosalicilic Acid Reagent for Determination of Reducing Sugar. Analytical Chemistry, 1959, 31 (3): 426-428. [ Links ]
MITSUI, K.; YASUI, H.; NAKAMURA, N. y KANAZAWA, H. Oligomerization of the Saccharomyces cerevisiae Na+/H+ antiporter Nha1p: Implications for its antiporter activity. Biochimica et Biophysica Acta, 2005, 1720, 125-136. [ Links ]
OHGAKI, R.; NAKAMURA, N.; MITSUI, K. y KANAZAWA, H. Characterization of the ion transport activity of the budding yeast Na+/H+ antiporter, Nha1p, using isolated secretory vesicles. Biochimica et Biophysica Acta, 2005, 1712, 185-196. [ Links ]
OLSSON, L. y NIELSEN, J. The role of metabolic engineering in the improvement of Saccharomyces cerevisiae: utilization of industrial media. Enzyme and Microbial Technology, 26, 785-792. [ Links ]
ORTIZ, D.; ST.PIERRE, M.; ABDULMESSIH, A. y ARIAS, I. A yeast ATP-binding cassette-type protein medianting ATPdependent bile acid transport. The Journal of Biological Chemistry, 1997, 272, 15358-15365. [ Links ]
PÉREZ, R.; BRUNO, J. y MATALLANA, E. Monitoring Stress-Related Genes during the Process of Biomass Propagation of Saccharomyces cerevisiae Strains Used for Wine Making. Applied and Environmental Microbiology, 2005, 71 (11): 6831-6837. [ Links ]
PSOMAS, E.; FLETOURIS, D.; LITOPOULOU, E. y TZANETAKIS, N. Assimilation of Cholesterol by Yeast Strains Isolated from Infant Feces and Feta Cheese. Journal of Dairy Science, 2003, 86, 3416-3422. [ Links ]
ROSE, A.H. Responses to the chemical environment. En: Rose, A. J. The yeast. V2, yeast and the environment. Academic Press. Londres, Inglaterra. 1987, 540 págs. [ Links ]
RUBIO, A., HERNÁNDEZ, C., AGUIRRE, A., POUTOU, R. Identificación preliminar in Vitro de propiedades probióticas en cepas de S. cerevisiae. Rev. MVZ Córdoba, 2008, 13 (1): 1157-1169. [ Links ]
SCHREZENMEIER, J. y DE VRESE, M. Probiotics, prebiotics and symbiotics - approching a definition. American Journal of Clinical Nutrition, 2001, 73, 361-364. [ Links ]
SPENCER, J. y RAGOUT, A. Métodos microbiológicos. Humana Press Inc. Totowa, New Jersey, USA. 2001, 335 págs. [ Links ]
ST PIERRE, M.; RUETZ, S.; EPSTEIN, L.; GROS, P. y ARIAS, I. ATPdependent transport of organic anions in secretory vesicles of Saccharomyces cerevisiae. Proceedings of National Academic Science USA, 1994, 91, 9476-9479. [ Links ]
TARANTO, M.P.; MEDICI, M.; PERDIGON, G.; RUIZ HOLGADO, A.P. y VALDEZ, G.F. Evidence for hypocholesterolemic effect of Lactobacillus reuteri in hypercholesterolemic mice. Journal of Dairy Science, 1998, 81, 2336-2340. [ Links ]
TÉLLEZ, D. Caracterización de las melazas empleadas en el proceso fermentativo de la destilería San Martín - Industria de Licores del Valle. Trabajo de grado. Universidad del Valle, Santiago de Cali, 2004. [ Links ]
THOMAS, K.; HYNES, S. y INGLEDEW, M. Influence of Medium Buffering Capacity on Inhibition of Saccharomyces cerevisiae Growth by Acetic and Lactic Acids. Environmental Microbiology, 2002, 68, 1616-1623. [ Links ]
VIEGAS, C.; ALMEIDA, P.; CAVACO, M. y CORREIA, I. The H1- ATPase in the plasma membrane of Saccharomyces cerevisiae is activated during growth latency in Octanoic Acid-supplemented medium accompanying the decrease in intracellular pH and cell viability. Applied and Environmental Microbiology, 1998, 64, 779-783. [ Links ]
YÉPEZ, Y. Selección de una cepa de Saccharomyces cerevisiae con alta productividad de etanol y que tolere mayores niveles de azúcar que los usados en la Planta Alcoquímica Sucromiles S.A. Trabajo de grado. Pontificia Universidad Javeriana, Bogotá, 1995. [ Links ]














