Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universitas Scientiarum
Print version ISSN 0122-7483
Univ. Sci. vol.19 no.3 Bogotá Sept./Dec. 2014
https://doi.org/10.11144/Javeriana.SC19-3.mcpc
Medición de la citotoxicidad y producción de citocinas en fibroblastos gingivales humanos estimulados con Mercurius-Heel®S: Un estudio piloto
Cytotoxicity measurement and cytokine production in human gingival fibroblasts stimulated with Mercurius-Heel®S: Pilot Study
Medição de citotoxidade e produção de citocinas em fibrobastos gengivais humanos estimulados com Mercurius-Heel®®S: Estudo piloto
Dabeiba Adriana García, Liliana Patiño, Gabriela Rueda
Edited by Alberto Acosta
Centro de Investigaciones Odontológicas. Pontificia Universidad Javeriana. Bogotá-Colombia
Funding: Vicerrectoría de investigación de la Pontificia Universidad Javeriana.
Electronic supplementary material: N/A
Received: 28-03-2014 Accepted: 19-04-2014 Published on line: 27-05-2014
Para citar este artículo / To cite this article
García DA, Rueda LPG(2014) Medición de la citotoxicidad y producción de citocinas en fibroblastos gingivales humanos estimulados con Mercurius—Heel®S: Un estudio piloto. Universitas Scientiarum 19(3): 225-232 doi: 10.11144/Javeriana.SC19-3.mcpc
Resumen
El Mercurius-Heel®S es un medicamento homeopático utilizado para tratar patologías infecciosas como la gingivitis y la periodontitis; principalmente de la cavidad oral. El componente principal de este medicamento es el Mercurius solubilis. Se estableció el efecto citotóxico a través de la viabilidad celular o antiinflamatorio por medición de citocinas del Mercurius—Heel®S sobre fibroblastos gingivales humanos (FGH). Las células fueron tratadas con Mercurius—Heel®S a concentraciones desde 300 mg/ml hasta 0.0005 mg/ml y como control, células sin tratamiento. La viabilidad celular fue medida mediante la prueba colorimétrica MTS® y la expresión de citocinas (IL1b, TNFa e IL10) presentes en sobrenadantes celulares, fue realizada con Quantiquine® ELISA. Se observó incremento de la viabilidad celular significativamente mayor con respecto al control (concentraciones bajas del medicamento) a partir de 3,7 mg/ml hasta 0.0005 mg/ml. La producción de citocinas no mostró diferencias significativas a diferentes concentraciones de Mercurius-Heel®S. No se evidenció incremento significativo de IL1b, IL10 y TNFa y el Mercurius-Heel®S no mostró efecto citotóxico sobre FGH.
Palabras clave: Fibroblastos; Mercurius—Heel®S; citotoxicidad; citocinas.
Abstract
Mercurius—Heel®S is a homeopathic remedy used to treat infectious diseases such as gingivitis and periodontitis, mainly in the oral cavity. The main component of this drug is the Mercurius solubilis. Its cytotoxic effect was established based on cell viability and its anti-inflammatory effect by measuring the cytokines Mercurius—Heel®S on human gingival fibroblasts (FGH). We treated cells with Mercurius—Heel®S at concentrations of 300 mg/ml to 0.0005 mg/ml and left untreated cells as a control. Cell viability was measured using the MTS® colorimetric assay and the expression of cytokines (IL1b, TNFa e IL10) present in cell supernatants was performed with Quantiquine® ELISA. From 3.7 mg/ml to 0.0005 mg/ml, we observed a significantly higher increase in cell viability in comparison to the control (lower concentrations of the drug). Cytokine production was not significantly different at different concentrations of Mercurius—Heel®S. There was no significant increase in IL1b, IL10 and TNFa and Mercurius—Heel®S showed no cytotoxic effect on FGH.
Keywords: Fibroblast; Mercurius—Heel®S; cytotoxicity; cytocines.
Resumo
Mercurius—Heel®S é um medicamento homeopático utilizado para tratar patologías infecciosas como la gengvite e a periodontite; principalmente da cavidade oral. O componente principal deste medicamento é o Mercurius solubilis. Estabeleceu-se o efeito citotóxico através da viabilidade celular a anti-inflamatório por medição de citocinas do Mercurius-Heel®S sobre fibroblastos gengivais humanos (FGH). As células foram tratadas com Mercurius—Heel®S a concentrações desde 300 mg/ml até 0.0005 mg/ml e como controlo, células sem tratamento. A viabilidade celular foi medida a prova colorimétrica MTS® e a expressão de citocinas (IL1b, TNFae IL10) presentes em sobrenadantes celulares, foi realizada com Quantiquine® ELISA. Observou-se incremento da viabilidade celular significativamente maior com respeito ao controlo (concentrações baixas do medicamento) a partir de 3,7 mg/ml até 0.0005 mg/ml. A produção de citocinas não mostrou diferenças significativas a diferentes concentrações de Mercurius—Heel®S. Não se evidenciou incremento significativo de IL1b, IL10 e TNFa e o Mercurius—Heel®S não mostrou efeito citotóxico sobre FGH.
Palavras-chave: Fibroblastos; Mercurius—Heel®S; citotoxicidade; citocinas.
Introducción
La enfermedad periodontal es una patología de origen infeccioso, caracterizada por ocasionar secuelas destructivas al tejido de soporte del diente; producto de una elevada respuesta inflamatoria. Es así, como el tratamiento va encaminado a la destrucción de los agentes etiológicos, control en la respuesta inflamatoria y la regeneración periodontal (Chen & Jin 2010). Los intentos para controlar una exacerbada respuesta inflamatoria del huésped durante el curso de la enfermedad periodontal, involucran fármacos complementarios a la terapia básica (Sinha et al. 2012). Una alternativa es la medicina antihomotóxica (Clausen et al. 2011, Almirantis 2013).
La homotoxicolog'a fue desarrollada en el año 1955 por el médico alemán Hans—Heinrich Reckeweg, sin embargo, el reciente interés de los médicos y odontólogos en proveer terapéuticas naturales que estimulen, controlen y fortalezcan el sistema inmunitario de su paciente, ha fomentado el planteamiento de proyectos innovadores en odontolog'a, ciencia en la cual se ha iniciado la aplicación por pocos periodoncistas con medicamentos antihomotóxicos como coadyuvantes a su tratamiento tradicional (Mathie & Farrer 2007, Shaw 2010, Eames & Darby 2011).
Actualmente, se han establecido diversos protocolos de manejo biológico que incluyen este tipo de medicamentos, los cuales son administrados en dosis diluidas (decimales y centesimales) adecuados para cada patología (de Oliveira et al. 2011). El Mercurius—Heel®S, es uno de éstos medicamentos, indicado en procesos infecciosos y con propiedades anti-inflamatorias. Es propuesto como parte del tratamiento de base o primera elección en la vía oral para el manejo de la gingivitis, abscesos, aftas orales y para el tratamiento sintomático de la periodontitis; enfatizando su utilidad en enfermedades supurativas e inflamatorias no sólo a nivel oral sino también en tejidos periamigdalares (Mousavi et al. 2009, de Oliviera et al. 2011, Nayak et al. 2012, Farrer et al. 2013). En un estudio realizado recientemente en el reino unido, evaluaron la prescripción homeopática en enfermedad periodontal aguda y crónica hecha por tres odontólogos a 51 pacientes durante 18 meses, encontrando resultados positivos en cuanto a la reducción de la bolsa periodontal, sugiriendo que la homeopatía es un área promisoria en el tratamiento de la enfermedad periodontal (Farrer et al. 2013).
Su composición es Mercurius solubilis Hahnemanni D10 consistente en mercurio amidonitrato, Heparsulfuris D8, Lachesis D12, Phytolacca americana D4, Ailanthus altíssima D3, Echinacea angustifolia D3 30 mg, Atropa belladonna D4. Sus excipientes son estearato de magnesio y lactosa.
El mercurius solubilis, uno de los componentes principales de Mercurius-Heel®S, es extraído del cinabrio y está presente en fuentes termales y volcanes. Cuando es utilizado en homotoxicolog'a y homeopatía, es disuelto en ácido nítrico, formando partículas que se
secan y se pulverizan (de Oliveira et al. 2011, Almirantis 2013). La seguridad y citotoxicidad de Mercurius-Heel®S sobre fibroblastos gingivales, representan un obstáculo ético para la implementación clínica de este tipo de medicamento. De igual manera no se ha documentado si los efectos nocivos ocasionados a la intoxicación por mercurio aparecen como resultado de la administración de este medicamento (Datta et al. 2004). Aunque los índices terapéuticos sugeridos por el laboratorio farmacéutico Heel es disolver bajo la lengua una tableta tres veces al día aclaran que dentro de las reacciones adversas producidas por este medicamento puede presentarse sialorrea y casos de hipersensibilidad en casos aislados de acuerdo al tratado práctico de medicina bioreguladora (consultar: www.heel.es/pdfs/B.pdf).
Los fibroblastos gingivales, son células con diferentes funciones en el periodonto como son la producción y mantenimiento de la lámina propia del tejido gingival blando, además de la formación de fibras de colágeno y elastina y participan activamente en los eventos inmunes e inflamatorios de la enfermedad periodontal (Acosta 2006). Junto a estos fibroblastos y otras células de defensa, se producen citocinas pro-inflamatorias (Ara et al. 2013, Baek et al. 2013) como la Interleucina 1&beta (IL 1β Bhawal et al. 2012, Sawada et al. 2013), Factor de Necrosis Tumoral alfa (TNFa; Guimarães et al. 2011, Arancibia et al. 2013) y citocinas anti-inflamatorias como lainterleucina10 (IL-10); que controla una respuesta inflamatoria exacerbada (Morandini et al. 2011, Gómez-Florit et al. 2013). De esta forma, la regulación de las funciones de remodelación del tejido conectivo y respuesta inflamatoria de los fibroblastos gingivales con medicamentos antihomotóxicos, podría tener un gran potencial terapéutico en periodoncia (Saini et al. 2012). El objetivo de esta investigación, fue establecer el efecto de Mercurius-Heel®S sobre fibroblastos gingivales cultivados in vitro en diferentes tiempos y concentraciones, con el fin de dar una explicación científica al uso del Mercurius—Heel®S en enfermedades orales como la periodontitis.
Materiales y métodos
Este estudio fue dividido en dos fases: 1. En la primera fase, se estableció la viabilidad de los fibroblastos gingivales humanos cultivados in vitro estimulados durante 15 minutos y 2 horas con Mercurius-Heel®S y 2. En la segunda fase se determinaron los perfiles de citocinaspro-inflamatorias: Factor de Necrosis Tumoral Alfa (TNFa) e Interleucina 1 Beta (IL 1 &beta) y antinflamatorias: Interleucina 10 (IL10), que fueron producidas por los fibroblastos luego de su estimulo.
Cultivo celular: Se utilizaron fibroblastos gingivales humanos ATCC CRL-2014 obtenidos del Centro de Investigaciones Odontológicas de la Facultad de Odontología de la Pontificia Universidad Javeriana. Las células fueron cultivadas de acuerdo a las recomendaciones de ATCC con medio D-MEM (medio esencial modificado de Dulbecco) suplementado con Suero Fetal Bovino (SFB) al 10%, 100 U/ml de penicilina, 100 ug/ml de estreptomicina (SIGMA, USA). Los pases se realizaron mediante desprendimiento enzimático, con tripsina 0.25% (SIGMA, USA) y EDTA 1mM (GIBCO) a 37 °C durante 2 minutos. Transcurrido ese tiempo se inactivó la tripsina con medio DMEM suplementado y se centrifugó durante 5 minutos a 2000 rpm.
Preparación de Mercurius-Heel®S: Se trituraron 2 tabletas de 300 mg de Mercurius-Heel®S, (Biologische Heilmittel Heel GmbH. Berlín— Alemania) en un triturador de pastillas de Acu-Life® y posteriormente fueron añadidas al DMEM para lograr las concentraciones deseadas 300 mg/ml a 0.0005 mg/ml, realizando diluciones en base de 3 a partir de 300 mg/ml.
Prueba de citotoxicidad: La prueba utilizada fue un ensayo colorimétrico utilizando el reactivo de tetrazolio (MTS: 3—(4,5—dimethylthiazol—2—yl)—5— (3—carboxymethoxyphenyl)—2—(4—sulfophenyl)—2H— tetrazolium, inner salt) Promega®. Para esta prueba se utilizaron placas de 96 pozos y se sembraron 4.000 células por pozo de acuerdo a lo recomendado por el fabricante. Se permitió su adherencia durante 24 horas, se cambió el medio y se aplicaron los tratamientos por triplicado con Mercurius-Heel®S, a concentraciones de 300 mg/ml a 0.0005 mg/ml, durante 15 minutos y 2 horas y se retiró el tratamiento (Figura 1). El grupo control consistió en células mantenidas en medio de cultivo y no tratadas. Posteriormente fue colocado a cada pozo medio D-MEM completo y se incubó por 24 horas más. Transcurrido ese tiempo se adicionó el reactivo MTS según las recomendaciones del fabricante. Finalmente luego de 2 horas fueron leídas en el espectrofotómetro a 490 nm.
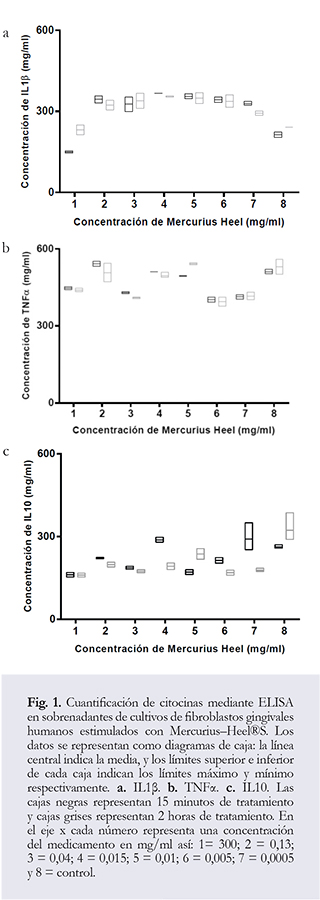
Medición de citocinas: En la segunda fase se realizó el Ensayo Inmunoenzimático Ligado a Enzimas (ELISA) para establecer perfiles de citocinas, para esta prueba se utilizaron cajas de cultivo de 25 cm2 colocando 500.000 células por caja manteniendo la misma proporción de células por área de crecimiento utilizada en la prueba de citotoxicidad. Transcurridas 24 horas posteriores al tratamiento se tomaron los sobrenadantes que inmediatamente fueron colocados a —70°C hasta su uso para determinar la concentración de Interleucina 1 Beta (IL 1&beta), Interleucina 10 (IL10) y Factor de Necrosis Tumoral Alfa (TNFa). Los controles fueron de forma similar a la prueba del MTS. Se seleccionaron las concentraciones de 0,13 mg/ml a 0,0005 mg/ml y se utilizó la concentración de 300 mg/ml como referencia a la cantidad de Mercurius presente por tableta. Los kits utilizados fueron Quantiquine (R&D Systems), siguiendo las recomendaciones del fabricante.
Análisis estadístico: En la primera parte del análisis estadístico, se inició evaluando si las variables seguían distribución normal utilizando la prueba de Shapiro Wilk. Dado que no se identificaron desviaciones de dicha distribución, se supusieron normales. Luego se compararon los promedios entre cada uno de los grupos a través de la prueba t para grupos independientes. Posteriormente, se realizó un análisis descriptivo que permitió establecer perfiles de citocinas producidos por fibroblastos gingivales cultivados in vitro y estimulados con Mercurius-Heel®S.
Resultados
Se presentan los datos del promedio de absorbancia y el porcentaje de viabilidad según los diferentes tiempos de exposición al Mercurius-Heel®S (Tabla 1). Se observó, que los porcentajes de viabilidad fueron los tratamientos de 15 minutos con respecto al de las dos horas. Al realizar comparación entre estos dos tiempos, se observaron diferencias significativas p = 0.009, observando que los resultados obtenidos luego de 15 minutos de tratamiento muestran mayor proliferación celular con respecto a las 2 horas.
Por otra parte, los porcentajes de viabilidad independientemente del tratamiento de 15 minutos y 2 horas (Tabla 1), arrojó concentraciones más bajas de Mercurius-Heel®S aproximadamente desde la concentración de 3,7 mg/ml hasta 0.0005 mg/ml.
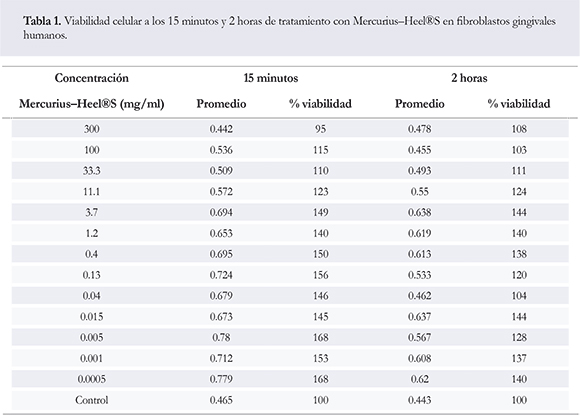
A los 15 minutos de tratamiento, se observaron diferencias significativas a partir de la concentración de 3,7 mg/ml de Mercurius-Heel®S con respecto al control (células sin tratamiento) p < 0,001, mientras que a las dos horas de tratamiento, se observaron diferencias significativas a las concentración de 3,7 mg/ml a 0,4 mg/ml y de 0,015 mg/ml a 0,0005 mg/ml de Mercurius-Heel®S con respecto al control p = 0,0005.
Estos resultados sugieren en primer lugar que el medicamento no muestra ningún efecto citotóxico sobre los fibroblastos gingivales en las concentraciones y tiempos evaluados. En segundo lugar, se muestra que a los 15 minutos (tiempo aproximado en disolverse una tableta del medicamento en boca) se observa incluso proliferación celular en comparación a las células no tratadas.
En la segunda fase del estudio, se evaluaron las concentraciones de citocinas producidas por los fibroblastos gingivales humanos luego del estímulo del Mercurius—Heel®S. Ver perfiles de IL-1 &beta, TNFa, e IL-10 (Figura 1). En este caso y basados en los resultados del MTS las células fueron tratadas a concentraciones de 300 mg/ml y desde 0,13 mg/ml hasta 0,0005 mg/ml de Mercurius—Heel®S; concentraciones que presentaron mayor viabilidad celular.
Con respecto a la IL-1&beta (Figura 1a) se observa en general mayor producción en concentraciones intermedias del tratamiento (0.13 a 0.005 mg/ml) mientras que, a concentraciones bajas (0.0005 mg/ml) y elevadas (300 mg/ml) del medicamento su producción fue menor. A través del tiempo (15 minutos y dos horas) de exposición, no se observaron diferencias significativas ni entre tiempos ni entre tratamientos p = 0,71 y p = 0,18 respectivamente.
En referencia al TNFa (Figura 1b), no se observa tendencia definida relacionada con las concentraciones en ninguno de los tiempos estudiados. Sin embargo, la mayor producción se observa a 0.13 y 0.01 mg/ ml tanto a los 15 minutos como a las 2 horas. En las menores concentraciones de 0.005, 0.0005 mg/ml, así como en altas concentraciones 300 mg/ml y 0.04 mg/ ml de Mercurius-Heel®S disminuye la producción de TNFa por parte de los fibroblastos gingivales humanos. Al comparar la cinética de esta citocina es muy similar tanto a los 15 minutos como a las 2 horas de tratamiento. No se observan diferencias significativas en estos tiempos p = 0,66. Con respecto a los diferentes tratamientos tampoco se observaron diferencias significativas p = 0,16.
Por último, la producción de IL-10 (Figura 1c) fue la citosina, que junto con la IL1&beta tuvieron menor concentración en el presente estudio (menor a 400 mg/ml de citocina). Se puede observar que tanto a los 15 minutos como a las 2 horas, existe tendencia a aumentar la concentración de IL-10 a medida que disminuye la concentración de Mercurius-Heel®S, encontrándose las concentraciones más altas de esta citocina a los 0.0005 mg/ml. Contrario a esto, las concentraciones más bajas de IL-10 se observan a mayor concentración del medicamento (300 mg/ml). Adicionalmente, la producción resulta similar a los 15 minutos comparada con las 2 horas. No se observan diferencias significativas ni entre tiempos ni entre tratamientos p = 0,98 y p = 0,34 respectivamente.
Discusión
Esta investigación, se planteó con el fin de determinar el efecto del Mercurius-Heel®S sobre la viabilidad de los fibroblastos gingivales humanos cultivados in vitro; con el fin de ver su posible uso como parte del tratamiento de la enfermedad periodontal. Esta enfermedad está caracterizada por respuesta inflamatoria generada por bacterias periodontopatógenas como la Porphyromona gingivalis ocasionando reabsorción ósea y perdida en el tejido de soporte del diente (Hajishengallis et al. 2011, Glowacki et al. 2013).
El Mercurius-Heel®S es administrado colocando una tableta de forma sublingual, hasta que se disuelva en boca tres veces al día, de acuerdo a lo recomendado por el laboratorio farmacéutico que lo produce. Un estudio realizado por Farrer et al. (2013), evaluó la prescripción homeopática en enfermedad periodontal aguda y crónica principalmente con Heparsulphuris, Arsenicumalbum, Calcarea carbonicum, Mercurius corrosivus, entre otros. Dichas prescripciones fueron hechas por tres odontólogos a 51 pacientes durante 18 meses en el Reino Unido, encontrando resultados positivos en cuanto a la reducción de la bolsa periodontal; sugiriendo que la homeopatía es un área promisoria en el tratamiento de la enfermedad periodontal.
Se ha propuesto que el Mercurius—Heel®S puede ser utilizado para diversas patologías orales como gingivitis y periodontitis, sin embargo no se ha documentado el efecto que presenta este medicamento en los fibroblastos gingivales humanos; debido a que estas células son importantes para la cicatrización y regeneración periodontal (Acosta 2006) y pueden estar en contacto con el fármaco debido a su vía de administración.
El principal hallazgo fue el aumento de la viabilidad celular. Se observó que el Mercurius-Heel®S no presentó ningún efecto citotóxico en los fibroblastos gingivales humanos, al utilizar concentraciones entre 300 mg/ml (una tableta) a 0,0005 mg/ml. Al igual que en el estudio de Oliveira et al. (2011), se obtuvó también resultados en concentraciones bajas del medicamento, lo que favorece lo descrito por la homotoxicología, donde se considera que cuanto más diluido esté un medicamento homeopático, más potentes es (Gold et al. 2008, Novella et al. 2008, Rutten 2011). Por otra parte, se observó que en periodo corto (15 minutos) es suficiente para obtener buenos resultados, tiempo en el cual la tableta se disuelve en boca (Chandira et al. 2010, Patel et al. 2010), y su efecto puede observarse hasta 48 horas después de ejercido el estímulo.
En la segunda fase del estudio, se establece que los niveles de citocinas pro-inflamatorias TNFa e IL—1 &beta producidas por fibroblastos tratados con Mercurius-Heel®S son mayores a concentraciones bajas del medicamento; siendo muy poca la diferencia a través de los tiempos de exposición. De igual manera, la citocina anti—inflamatoria IL—10, demostró aumentar a medida que disminuye la concentración de Mercurius-Heel®S.
Kubo et al.(2014), describen que el TNFa al igual que la IL1a muestran efecto positivo en procesos de cicatrización principalmente en estadios tempranos (inflamación y proliferación) mientras que en estadíos tardíos como la maduración la IL10 inhibe la proliferación celular favoreciendo el remodelamiento de la matriz extracelular (Moroguchi et al. 2004). De acuerdo a los hallazgos, se sugiere para posible regeneración periodontal, la necesidad de incremento de citocinas como la IL1a y la IL10, ya que estas citocinas además de cumplir papel importante en respuesta inflamatoria, pueden regular otros procesos celulares como la proliferación (Battergay et al. 1995).
Con respecto a los perfiles de citocinas, el único estudio con Mercurius solubilis fue realizado por de Oliviera et al. (2011), donde se muestra que en macrófagos peritoneales de ratón (células capaces de modular la respuesta inmune) a muy bajas concentraciones del Mercurius, la respuesta del macrófago se incrementaba con perfiles de citocinas y especies reactivas de oxígeno y nitrógeno. Esto estudio, indica la activación en la respuesta inmune e inflamación por aumento del óxido nítrico y la producción IFNa. Sin embargo, luego de la eliminación del agente causal de la inflamación, es necesario la activación de respuesta anti-inflamatoria como la IL4, la cual observaron que también se incrementaba. De esta manera, de Oliviera et al. (2011) sugieren que el Mercurius solubilis es capaz de modular la respuesta del macrófago induciendo un balance y homeóstasis entre respuesta pro-inflamatoria y anti-inflamatoria, estimulados con concentraciones centesimales de Mercurius solubilis de 10 mg a 300|jg y encontrando que IFNa e IL4 aumenta su expresión en sobrenadantes. Sin embargo, TNFa, IL-2 e IL-5 no cambian su expresión con respecto al grupo no tratado, resultados similares a los obtenidos en esta investigación.
Finalmente, se sugiere que el Mercurius—Heel®S puede ser usado como adyuvante o complemento al tratamiento de enfermedad periodontal, por ser ésta una patología con alto componente infeccioso y del huésped principalmente asociado a respuesta inmunológica (Deschner & Nokhbehsaim 2013, Cekici et al. 2014), sugiriendo que este medicamento puede regular la respuesta inmune y no causa efecto letal o dañino a las células del hospedero e incluso promueve proliferación celular, lo que indica su potencial uso en regeneración periodontal (Iwata et al. 2014).
Conclusión
El Mercurius-Heel®S mostró mayor efecto proliferativo en fibroblastos gingivales a los 15 minutos y en bajas concentraciones de tratamiento; sin embargo, no se observaron diferencias en la producción de citocinas pro y anti-inflamatorias con respecto a las células sin tratamiento.
Agradecimientos
Agradecemos a la Vicerrectoría de investigación de la Pontificia Universidad Javeriana por su apoyo financiero para la ejecución de este trabajo ID 004485 y al Centro de Investigaciones odontológicas por sus instalaciones para la realización del presente estudio.
Conflicto de intereses
Los autores declaramos que no existe conflicto de intereses.
Referencias
Acosta A (2006) El fibroblasto: su origen, estructura, funciones y heterogeneidad dentro del periodonto. Univ Odontol 25:26-33. [ Links ]
Almirantis Y (2013) Homeopathy-between tradition and modern science: remedies as carriers of significance. Homeopathy 102:114-22. [ Links ]
Ara T, Kurata K, Hirai K, Uchihashi T, Uematsu T, Imamura Y, et al. (2009) Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease. J Periodontal Res 44:21-7. [ Links ]
Arancibia R, Oyarzún A, Silva D, Tobar N, Martínez J, et al. (2013) Tumor necrosis factor-a inhibits transforming growth factor-B-stimulated myofibroblastic differentiation and extracellular matrix production in human gingival fibroblasts. J Periodontal 84:683-93. [ Links ]
Baek KJ, Choi Y, Ji S (2013) Gingival fibroblasts from periodontitis patients exhibit inflammatory characteristics in vitro. Arch Oral Biol 58:1282-92. [ Links ]
Battergay EJ, Raines EW, Colbert T, Ross R (1995) TNF-alpha stimulation of fibroblast proliferation. Dependence on platelet-derived growth factor (PDGF) secretion and alteration of PDGF receptor expression. J Immunol 154:6040-7. [ Links ]
Bhawal UK, Ito Y, Tanimoto K, Sato F, Fujimoto K, Kawamoto T, et al. (2012) IL-1B-mediated up-regulation of DEC1 in human gingiva cells via the Akt pathway. J Cell Biochem 113:3246-53. [ Links ]
Cekici A, Kantarci A, Hasturk H, Van Dyke TE (2014) Inflammatory and immune pathways in the pathogenesis of periodontal disease. Periodontol 2000 64:57-80. [ Links ]
Chandira RM, Venkataeswarlu BS, Kumudhavalli MV Debjitbhowmik, Jayakar B (2010) Formulation and evaluation of mouth dissolving tablets of the Etoricoxib. Pak J Pharm Sci 23:178-81. [ Links ]
Chen FM, Jin Y (2010)Periodontal tissue engineering and regeneration: current approaches and expanding oppor tunities. Tissue Eng Part B Rev 16:219-255. [ Links ]
Clausen J, van Wijk R, Albrecht H (2011) Review of the use of high potencies in basic research on homeopathy. Homeopathy 100:288-92. [ Links ]
Datta S, Biswas SJ, Khuda-Bukhsh AR (2004) Comparative Efficacy of Pre-feeding Post-feeding and Combined Pre- and Post-feeding of Two Microdoses of a Potentized Homeopathic Drug, Mercurius Solubilis, in Ameliorating Genotoxic Effects Produced by Mercuric Chloride in Mice. Evid Based Complement Alternat Med 1:291-300. [ Links ]
de Oliveira SM, de Oliveira CC, Abud AP, Guimarães FS, Di Bernardi RP, et al. (2011) Mercuriussolubilis: actions on macrophages. Homeopathy 100:228-36. [ Links ]
Deschner J, Nokhbehsaim M (2013) Regulatory effects of inflammatory and biomechanical signals on regenerative periodontal healing. Int J Oral Maxillofac Implants 28:e472-7. [ Links ]
Eames S, Darby P (2011) Homeopathy and its ethical use in dentistry. Br Dent J 210:299-301. [ Links ]
Farrer S, Baitson ES, Gedah L, Norman C, Darby P, Mathie RT (2013) Homeopathic prescribing for chronic and acute periodontal conditions in 3 dental practices in the UK. Homeopathy 102:242-7. [ Links ]
Glowacki AJ, Yoshizawa S, Jhunjhunwala S, Vieira AE, Garlet GP, et al. (2013) Prevention of inflammation-mediated bone loss in murine and canine periodontal disease via recruitment of regulatory lymphocytes. Proc NatiAcad Sci 110:18525-30. [ Links ]
Gold PW Novella S, Roy R, Marcus D, Bell I, Davidovitch N, Saine A (2008) Homeopathy-quackery or a key to the future of medicine? Homeopathy 97:28-33. [ Links ]
Gómez-Florit M, Ramis JM, Monjo M (2013) Anti-fibrotic and anti-inflammatory properties of melatonin on human gingival fibroblasts in vitro. Biochem Pharmacol 86:1784-90. [ Links ]
Guimarães MR, Coimbra LS, de Aquino SG, Spolidorio LC, et al. (2011) Potent anti-inflammatory effects of systemically administered curcumin modulate periodontal disease in vivo. J Periodontal Res 46:269-79. [ Links ]
Hajishengallis G, Liang S, Payne MIA, Hashim A, Jotwani R, et al. (2011). Cell Host Microbe 10:497-506. [ Links ]
I wata T, Yamato M, Ishikawa I, Ando T, Okano T (2014) Tissue engineering in periodontal tissue. AnatRec (Hoboken) 297:16-25. [ Links ]
Kubo H, Hayashi T, Ago K, Ago M, Kanekura T, Ogata M (2014) Temporal expression of wound healing-related genes in skin burn injury. Leg Med (Tokyo) 16:8-13. [ Links ]
Mathie RT, Farrer S (2007) Outcomes from homeopathic prescribing in dental practice: a prospective, research-targeted, pilot study. Homeopathy 96:74-81. [ Links ]
Morandini AC, Sipert CR, Ramos-Junior ES, Brozoski DT, Santos CF (2011) Periodontal ligament and gingival fibroblasts participate in the production of TGF-B, interleukin (IL)-8 and IL-10. Braz Oral Res 25:157-62. [ Links ]
Moroguchi A, Ishimura K, Okano K, Wakabayashi H, Maeba T, Maeta H (2004) Interleukin-10 suppresses proliferation and remodeling of extracellular matrix of cultured human skin fibroblasts. EurSurg Res 36:39-44. [ Links ]
Mousavi F, Mojaver YN, Asadzadeh M, Mirzazadeh M (2009) Homeopathic treatment of minor aphthous ulcer: a randomized, placebo-controlled clinical trial. Homeopathy 98:137-41. [ Links ]
Nayak C, Singh V, Singh VP, Oberai P, Roja V, et al. (2012) Homeopathy in chronic sinusitis: a prospective multi-centric observational study. Homeopathy 101:84-91. [ Links ]
Novella S, Roy R Marcus D, Bell IR, Davidovitch N, Saine A (2008) A debate: homeopathy-quackery or a key to the future of medicine? J Altern Complement Med 14:9-15. [ Links ]
Patel BP, Patel JK, Rajput GC, Thakor RS (2010) Formulation and evaluation of mouth dissolving tablets of cinnarizine. Indian J Pharm Sci 72:522-5. [ Links ]
Rutten AL (2011) Comparison of effectiveness of frequently and infrequently used homeopathic medicines. Homeopathy 100:175-82. [ Links ]
Saini P, Al-Shibani N, Sun J, Zhang W Song F, et al. (2012) Effects of Calendula officinalis on human gingival fibroblasts. Homeopathy 101:92-8. [ Links ]
Sawada S, Chosa N, Ishisaki A, Naruishi K (2013) Enhancement of gingival inflammation induced by synergism of IL-1a and IL-6. Biomed Res 34:31-40. [ Links ]
Shaw D (2010) Unethical aspects of homeopathic dentistry. Br Dent J 209:493-6. [ Links ]
Sinha MN, Siddiqui VA, Nayak C, Singh V, Dixit R Dewan D, Mishra A (2012) Randomized controlled pilot study to compare Homeopathy and Conventional therapy in Acute Otitis Media. Homeopathy 101:5-12. [ Links ]













