Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia y Tecnología Agropecuaria
versão impressa ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.13 no.2 Mosquera jun./dez. 2012
MICROBIOLOGÍA DEL SUELO
1 Centro de Investigación Tibaitatá, Corporación de Investigación Agropecuaria (Corpoica). Mosquera (Colombia). pcriollo@corpoica.org.co
Fecha de recepción: 02-03-2012. Fecha de aceptación: 22-10-2012
RESUMEN
Pennisetum clandestinum (kikuyo) es una pastura común en los sistemas silvopastoriles del altiplano cundiboyacense, con altas propiedades nutritivas. Por tanto estudios que permitan mejorar el proceso de producción en términos económicos y ambientales reviste gran importancia. En este estudio se evaluó el papel de la inoculación con bacterias promotoras de crecimiento vegetal (PGPR) sobre el crecimiento de pasto kikuyo. Las cepas 4K y 5B fueron identificadas mediante amplificación y análisis del 16S rADN, como Stenotrophomona ssp. y Pseudomona ssp., respectivamente, caracterizadas por su eficiencia in vitro en la fijación biológica de nitrógeno, producción de compuestos indólicos y solubilización de fosfatos. Se evaluaron las cepas en condiciones de invernadero en tres tiempos de crecimiento de la planta (70, 100 y 130 días). Se evidenció que la cepa 4K incrementó el peso seco radicular de la planta en 50% a los 70 y 100 días, mientras que la cepa 5B mostró un comportamiento similar en el peso seco aéreo y radicular con aumentos de hasta el 50% a los 130 d. El efecto más importante se presentó después de 100 d donde los tratamientos TQ, TB1 y TB2, superaron en más del 80% al testigo absoluto en el peso fresco de la parte aérea. Estos resultados demostraron que la inoculación de PGPR representa una alternativa biotecnológica para promover el crecimiento de P. clandestinum, con efectos relevantes en producción de biomasa 100 días después de la siembra (dds).
Palabras clave: sistemas silvopastoriles, gramíneas, fijación biológica de nitrógeno, compuestos indólicos, solubilización de fosfato
ABSTRACT
Pennisetum clandestinum (kikuyo) is a common pasture in the altiplano cundiboyacense silvopastoral systems, which possesses high nutritional value. Therefore, studies to improve the production process in both economic and environmental terms are very important. The role of inoculation with plant growth- promoting bacteria was evaluated on the growth of kikuyu grass. The 4K and 5B strains were identified, through amplification and analysis of their 16S rDNA, as members of the Stenotrophomonas and Pseudomonas genera, respectively. They were characterized in vitro for their efficiency of biological nitrogen fixation, production of indole compounds, and phosphate solubilization. Four treatments were evaluated under greenhouse conditions. Furthermore, the biomass was evaluated at different stages of the plant (70, 100 and 130 days). The 4K strain demonstrated a root dry weight that increased by 50% at 70 and 100 days and the 5B strain showed a statistically significant behavior for plant and root dry weight with an increase of 50% at 130 days. The most important effect was presented after 100 d where treatments, TQ, TB1 and TB2, exceeded more 80% to absolute control in the fresh weight of the air. These results showed that inoculation with PGPR represents a biotechnological alternative to promote growth of P. clandestinum, as we observed relevant effects on biomass production 100 days after planting.
Key words: silvopastoral system, grasses, biological nitrogen fixation, indolic compounds, phosphate solubilization
INTRODUCCIÓN
En Colombia, Pennisetum clandestinum Hochst. ex Chiov (Kikuyo) es una pastura común en muchos ambientes y se asocia principalmente a los sistemas silvopastoriles en el altiplano cundiboyasense con diferentes especies arbóreas. Debido a su rápida tasa de crecimiento se utiliza para la alimentación de ganado, además es un pasto apetecible y altamente digerible, con alto valor proteico, bajo contenido de fibra y altas propiedades nutritivas (Marais et al.,1992), también se emplea en la recuperación de suelos degradados en ambientes fríos, para el control de la erosión, aplicados como cobertura del suelo. Numerosos reportes indican que P. clandestinum es tolerante al estrés abiótico como la salinidad, la sequía, el anegamiento y la acidez del suelo (Sidari et al., 2004).
El suelo es un ecosistema con una gran variedad y cantidad de microorganismos benéficos. La fracción del suelo donde influye la proliferación de estos microorganismos por la presencia del sistema de raíces de las plantas se le conoce como rizósfera (Cassánet al., 2009). Las diferentes poblaciones bacterianas presentes en la rizósfera, se llaman rizobacterias o bacterias promotoras de crecimiento vegetal - PGPR (por su siglas en inglés Plant growth-promoting rhizobacteria) y poseen la capacidad de colonizar el sistema radicular de las plantas o su entorno más cercano; clasificándose en tres grupos principales, las que pueden colonizar el tejido de la planta formando nódulos (simbióticas), las que se hospedan en estructuras internas de la planta (endofíticas) y las que se encuentran cerca del sistema radicular de la planta (bacterias de vida libre) (Kloepper et al., 1989).
Múltiples estudios han publicado que las PGPR se asocian con cultivos importantes tales como Oryiza sativa, Triticum spp., Sorghum spp, Sacharum officinarum, Zea mays (Okon, 2005; James, 2000; Andrews et al., 2003; Berg, 2009) y pasturas (Lugtenberg y Kamilova, 2009). Dentro de las PGPR más referenciadas son Azospirillum sp., Bacillus sp., Rhizo- bium sp., Burkholderia sp., Enterobacter sp., Azotobacter sp., Erwinia sp., Herbaspirillum sp., Klebsiella sp., Pseudomonas sp. y Xanthomonas sp. (Cassánet al., 2009; Bashan et al., 2012).
Inoculaciones de PGPR en cultivos de interés agronómico han demostrado el aumento del nitrógeno, fósforo y los niveles de algunos minerales menores que se hacen disponibles para la planta (Bashan y Holguín, 1997; Egamberdieva et al., 2004). Una amplia variedad se ha encontrado que estimula mediante diversos mecanismos el desarrollo de numerosas gramíneas. El objetivo de esta investigación fue determinar de forma preliminar el efecto de la inoculación de Stenotrophomonas y Pseudomonas (PGPR) en la promoción del crecimiento de P. clandestinum en tres etapas de desarrollo de la planta bajo condiciones de invernadero.
MATERIALES Y MÉTODOS
Microorganismos y condiciones de crecimiento
Los microorganismos autóctonos de sistemas silvopastoriles previamente aislados se preservaron en el Banco de Trabajo del Laboratorio de Microbiología del CBB (Centro de Biotecnología y Bioindustria) - Corporación Colombiana de Investigación Agropecuaria (Corpoica). Para el presente trabajo se utilizaron las cepas 4K y 5B. Las cepas fueron crecidas en medio de cultivo Luria Bertani (LB) (Bertani, 1952; Bertani, 2004) durante 24 h y se agitaron a 120 rpm a 30°C para procedimientos posteriores. Los con- troles de calidad presentaron 100% de pureza y la concentración celular de 108 ufc/mL.
Identificación molecular por secuenciación parcial de 16S rDNA
El ADN bacteriano fue extraído mediante el uso de DNeasy Blood and Tissue Kit (Qiagen, Alemania) según las instrucciones del fabricante. El ADN genómico extraído se diluyó en agua estéril Milli-Q antes de llevar a cabo el análisis de PCR bajo las siguientes condiciones: 25 mL de mezcla de PCR que contenía 1X Taq DNA polimerasa tampón (Invitrogen, USA), 2,5 mM MgCl2, 0,2 mM de trifosfato de desoxinucleósido, 25 pmol de primer (forward - reverse), 1 U de ADN polimerasa (Invitrogen, USA), y 1 mL del extracto diluido de ADN como molde. Casi genes completos del 16S rADN fueron amplificados con cebador forward 27F (5'-AGAGTTTGATCCTGGCTCAG-3') y el cebador reward 1492R (5'-GGTTACCTTGTTACGACTT-3'). El ADN se amplificó con un termociclador iCycler (BioRad, USA) con el siguiente programa: 4 min de precalentamiento a 95°C, 35 ciclos de 30 s de desnaturalización a 95°C, 30 s de hibridación del cebador a 57°C, 2 min de elongación a 72°C, y 10 min de paso de extensión a 72°C. Cada mezcla de amplificación (5 mL) se analizó por gel de agarosa (1,5% w/v) de tampón de electroforesis TAE (0,04 M Tris-acetato, 0,001 M EDTA) que contenía 20 mg mL-1 (w/v) de bromuro de etidio. El ADN amplificado fue purificado utilizando el PureLink™ kit de gel extracción rápida (Invitrogen, USA) según las instrucciones del fabricante. La secuenciación automatizada de los productos de PCR purificado se realizó utilizando el kit de secuenciación BigDye Terminator y el secuenciador de ADN ABI 310 (Applied Biosystems, USA) de acuerdo a las instrucciones del fabricante. Las secuencias parciales obtenidas fueron comparadas con las secuencias de nucleótidos presentes en el GenBank utilizando el programa BLAST (Altschul et al. 1990) y las quimeras fueron detectadas utilizando el programa PINTAIL (Ashelford et al., 2005).
Caracterización de las capacidades bacterianas de promoción de crecimiento vegetal in vitro
 Fijación biológica de nitrógeno. La actividad nitrogenasa se realizó por medio del ensayo de reducción de acetileno en tubos de ensayo de 10 mL, conteniendo 5 mL de medio Ashby semisólido (libre de nitrógeno). Después se agregaron 50 mL de suspensión bacteriana y se incubaron a 30°C por 48 h. Posteriormente, se sustituyó el 10% de la atmósfera por acetileno durante 1 h. La fijación biológica de nitrógeno fue cuantificada mediante cromatografía de gases (Perkin Elmer, USA) con detector de ionización de llama y una columna Poropak N 200/300 mesh de 6 pies y 3 mm de diámetro (Eckert et al., 2001).
Producción de hormonas indólicas. A partir de la fermentación líquida en medio K - Lactato suplementado con triptofano (100 ug mL-1), se tomaron 4 mL de cultivo, se centrifugaron a 7378 G 10 min, se tomó 1 mL del sobrenadante y se llevó a reacción con 1mL del reactivo de Salkowsky modificado. La reacción se incubó por 30 min en completa oscuridad por triplicado. Una vez pasado el tiempo de reacción, se determinó la absorbancia de cada tubo en un espectrofotómetro a 540 nm. Con los datos de absorbancia se obtuvo el promedio de las réplicas y se reemplazaron los datos en la ecuación de la recta de la curva patrón para determinar la producción de índoles totales (Carreño et al., 2000).
Solubilización de fosfato. El método cuantitativo de fosfomolibdato fue empleado para determinar el fosfato disponible. Para esto, cada cepa fue crecida en medio SRS (Sundara y Sinha, 1963) sin indicador e incubada por 120 h /150 rpm. Posteriormente, se tomó 1 mL de alícuota de cada erlenmeyer, incluyendo los controles y se centrifugaron a 7378 G 10 min y finalmente 500 mL del sobrenadante se emplearon para el análisis (Fiske y Subbarow, 1925).
Ensayo en invernadero
El suelo y el material vegetal se obtuvieron de Corpoica, Centro de Investigación Tibaitatá, Mosquera (Cundinamarca). Fueron utilizadas bolsas de plástico con capacidad de 3 kg con 2,5 kg de suelo. Los estolones de P. clandestinum fueron seleccionados y desinfectados con etanol al 70% en 5 min y luego con solución de hipoclorito de sodio 3% a 5 min. Para este estudio, el suelo fue fertilizado de acuerdo al análisis de suelo, con nitrógeno (100 kg ha-1 en forma de urea) en los tratamientos que lo requerían. El análisis del suelo utilizado se describe a continuación (Tabla 1).
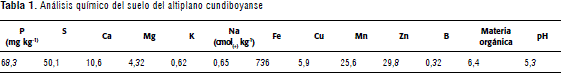
Se implementaron cuatro tratamientos para evaluar la respuesta de P. clandestinum a la inoculación de dos cepascon capacidad de promoción de crecimiento vegetal. Los tratamientos fueron los siguientes: TA: testigo absoluto, TQ: control químico, TB1: inoculación con la cepa 4K + 50% de la dosis de nitrógeno (en forma de urea) y TB2: inoculación con la cepa 5B + 50% de la dosis de nitrógeno. Los muestreos se realizaron a los 70, 100 y 130 días después de la siembra (dds) y las variables evaluadas fueron longitud aérea, peso fresco y seco de la parte aérea y radicular. Así mismo, se determinó el contenido de nitrógeno y fósforo total en el tejido vegetal a los 130 dds mediante el método Kjeldahl (Norma AOAC 988.05) y Bray II respectivamente (Bray y Kurtz, 1945).
Diseño y análisis estadístico
Para el diseño, se establecieron cuatro tratamientos con 12 réplicas mediante bloques completos al azar. Los datos fueron analizados utilizando el análisis de varianza ANOVA y Tukey HSD (P ≤ 0,05) empleando el software estadístico SPSS® 17.0 para Windows.
RESULTADOS Y DISCUSIÓN
Identificación molecular de las cepas 4K y 5B
El análisis comparativo de las secuencias obtenidas con las registradas en la base de datos del NCBI mostró que la cepa 4K se acercó a un porcentaje del 98% de identidad con la secuencia de Stenotrophomonas sp. bA22 (JF772548.1) y la cepa 5B presentó un porcentaje del 97% de identidad con la secuencia de Pseudomonas sp. KVS86 (HQ591435.1). Las Gamaproteobacterias estuvieron representadas en este estudio por el orden de las Xanthomonadales y Pseudomonadales con la cepa 4K (pertenecientes al género Stenotrophomonas) y 5B (pertenecientes al género Pseudomonas) identificadas mediante la amplificación del 16S rDNA.
Las especies del género Pseudomonas se han reportado ampliamente como PGPR de diversas plantas incluyendo gramíneas (Doty et al., 2009; Okon, 2005; Andrews et al., 2003). Con respecto a Stenotrophomonas sp., algunas especies han sido identificadas como patógenas humanas. Sin embargo, ésta especie ha sido aislada de plantas sanas y descrita como una bacteria promotora de crecimiento de varios cultivos de importancia agronómica (Idris et al., 2009).
Caracterización de las capacidades bacterianas de promoción de crecimiento vegetal in vitro
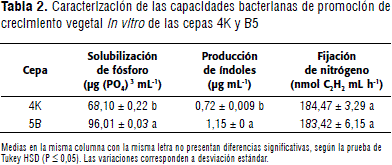
Las dos cepas en estudio son capaces de producir índoles, fijar nitrógeno y son eficientes en la solubilización de fosfato. La descripción de las capacidades de las cepas 4K y 5B se muestran en la Tabla 2.
La producción de hormonas indólicas tipo AIA, y sus efectos beneficiosos sobre la promoción del crecimiento vegetal han sido ampliamente estudiados (Sevilla et al., 2001; Shokri y Emtiazi, 2010; Obando et al., 2010). Además, la capacidad de solubilización de fosfato desempeña un papel fundamental en la interacción planta-microorganismo, por la disponibilidad de nutrientes poco móviles, así como en el control biológico sobre patógenos (Rodríguez y Fraga, 1999; Vassilev et al., 2006; Shokri y Emtiazi, 2010).
Los resultados obtenidos con la inoculación de la cepa 5B presentaron diferencias estadísticamente significativas (P ≤ 0,05) con respecto a la cepa 4K en cuanto a la capacidad de solubilización de fósforo y producción de índoles. Por otro lado, no se presentaron diferencias en la prueba de fijación de nitrógeno. No obstante, las dos cepas son eficientes en ésta capacidad de acuerdo a lo reportado por Chowdhury et al. (2011), quienes encontraron que Azospirillum sp. y Pseudomonas pseudoalkaligenes tienen capacidad de reducir acetileno en el orden de 18 y 11,2 nmol de C2H4, lo cual se evidencia en este estudio con las cepas 4K y 5B, las cuales son eficientemente superiores en relación a previos resultados referenciados (Mehnaz y Lazarovits, 2006; Eckert et al., 2001; Carcaño-Montiel et al., 2006; Cárdenas et al., 2010).
Diversos reportes evidencian la variabilidad de las capacidades de promoción de Stenotrophomonas sp. y Pseudomonas sp., como lo mencionan Tauléet al. (2011), quienes obtuvieron nueve cepas de Stenotrophomonas sp. a partir de Saccharum officinarum, con producciones de hormonas indólicas entre 6,9 - 31,8 mg mL-1 y sólo una cepa (UYSO27) presentó fijación de nitrógeno mediante actividad de reducción de acetileno. Con respecto a Pseudomonas sp., obtuvieron 8 cepas con potencial de promoción de crecimiento in vitro, de las cuales, las cepas UYSO14, UYSO19 y UYSO21 presentaron capacidad para fijar nitrógeno y UYSO16, UYSO17, UYSO18 y UYSO21 para producir índoles. De acuerdo a lo anterior, la eficiencia de estos géneros varía de acuerdo al ecotipo y a los factores edafoclimáticos que rigen su habitat y de ahí la importancia de obtener cepas nativas que garanticen su eficiencia en la promoción de crecimiento mediante diversos posibles mecanismos que actúen allí.
Caracterización de la respuesta del kikuyo a la inoculación con bacterias de promotoras de crecimiento vegetal en invernadero
En la evaluación realizada a los 70 dds, no se presentaron diferencias significativas en peso fresco de parte aérea (PFA) entre los tratamientos TQ y TB1, los mejores valores fueron obtenidos con respecto a TA y TB2. En el peso fresco radical (PFR), el TQ presentó diferencias significativas (P ≤ 0,05) con respecto a los demás tratamientos evaluados. En cuanto al peso seco en parte aérea (PSA) y radical (PSR), se presentaron diferencias significativas (P ≤ 0,05) de TQ, seguido de TB2, con respecto a los demás tratamientos evaluados. El tratamiento TB2 mostró un incremento porcentual de 21% en la longitud de la parte aérea (LA) presentando diferencias significativas (P ≤ 0,05) con respecto a los demás tratamientos.
Los resultados de 100 y 130 dds presentaron diferencias significativas (P ≤ 0,05) en los tratamientos TB1 y TB2 en todas las variables agronómicas evaluadas respecto al control no inoculado (TA) (Tabla 3). El efecto promotor de crecimiento vegetal de estos tratamientos, se evidenció cuando los valores fueron iguales al tratamiento químico en las variables agronómicas evaluadas. Después de 100 dds, los tratamientos TQ, TB1 y TB2, presentaron valores similares en el peso fresco de la parte aérea, superando en más del 80% al testigo absoluto. Así mismo, TB1 presentó diferencias significativas (P ≤ 0,05) comparadas con los demás tratamientos analizados para las variables PFR y PSA. En las variables PSR y LA, la respuesta se vio favorecida cuando los tratamientos fueron inoculados con las cepas 4K (TB1) y 5B (TB2), aumentando los valores en más del 50% y 25% respectivamente en comparación con los tratamientos TQ y TA.
Todos los tratamientos bacterianos mostraron un aumento en sus ganancias de biomasa seca en el muestreo de 100 d, pero 30 d después, el control químico elevó sus valores frente a las ganancias de biomasa seca, mostrando que los tratamientos bacterianas tienen efectos significativos en el crecimiento de P. clandestinum después de 100 d de inoculación, igualando los valores del tratamiento químico. Además, todos los tratamientos superaron el tratamiento no inoculado que muestra el efecto de modificar la acumulación de nutrientes y las actividades propias de la planta, que son estimulados significativamente con los tratamientos inoculados y químico, que incidieron en el crecimiento de P. clandestinum.
En relación al contenido de nitrógeno y fósforo total en el tejido vegetal no se presentaron diferencias estadísticamente significativas (P ≥ 0,05) a los 130 dds (Datos no mostrados).
Las PGPR, incluyendo las especies de Pseudomonas sp. y Strenotrophomona sp. identificadas en este estudio, se han reportado ampliamente por su efecto benéfico en diversas plantas incluyendo gramíneas (Doty et al., 2009; Okon, 2005; Andrews et al, 2003; Garrido et al., 2010; Cárdenas et al., 2010). Las variables más influyentes en la evaluación de acumulación de nutrientes y fotoasimilados se refleja en los incrementos de biomasa seca en los tratamientos TB1 y TB2. Mehnaz y Lazarovits (2006), encontraron un aumento de 12% en plantas de maíz inoculadas con A. lipoferum N7 con respecto a las plantas no inoculadas. Díaz et al. (2009), estudiaron la promoción de crecimiento en plantas de Eucalyptus globulus, estimulada por bacterias rizosféricas de los géneros Bacillus sp. y Stenotrophomona maltophilia aisladas de E. globulus y E. nitens, las cuales produjeron un aumento significativo en el enraizamiento en un rango de 19,4% y 69,4% con respecto al control, además de incrementar la formación de estacas y el aumento de la biomasa.
En cuanto al peso fresco, los resultados muestran que los tratamientos inoculados igualan los valores obtenidos en el control químico y superan al control sin inocular, resultados que concuerdan con los obtenidos por Rajkumar et al. (2005) quienes estudiaron la promoción de crecimiento vegetal generado por Pseudomonas sp. y Bacillus sp. en plantas de mostaza y reportaron un incremento en la longitud de la planta y el peso fresco y seco en comparación con las plantas no inoculadas, además de brindarle un efecto protector contra la absorción de Cromo.
Hassen y Labuschagne, (2010), revelaron que la inoculación individual de bacterias con potencial biofertilizante, estimulan el desarrollo de todos los estratos de la planta. La inoculación individual de cepas nativas de B. simplex, B. cereus y Paenibacillus alvei en trigo, resultó en un incremento significativo tanto en el peso fresco y seco de los brotes y raíces. En la parte aérea, y el peso fresco aumentó entre el 45% y 50% y el peso seco entre 39,7% y 45% respectivamente. De la misma forma, el aumento del peso fresco radical osciló entre el 55% y el 62% y la biomasa seca aumentó entre el 25% y el 49%. Asghar et al. (2004), encontraron que PGPR asociadas a la rizósfera de especies de Brassica napus aumentaron en un 58% la longitud de la raíz, 39% de la parte aérea, y 72% del peso seco total.
Se ha reportado el efecto de PGPR en la disponiblidad de nitrógeno, fósforo y potasio en suelos deficientes en éstos nutrientes que se ve reflejado en mayor absorción de los mismos por plantas de maíz inoculadas con cepas de Pseudomonas alcaligenes (PsA15), Bacillus polymyxa (BcP26) y Mycobacterium phlei (MbP18). (Egamberdiyeva, 2007) y en plantas de Gossipum hirsutum guisantes en una región semi- árida de Uzbekistán (Egamberdiyeva y Hoflich, 2004).
La inoculación de PGPR en pasturas y su efecto positivo en el crecimiento y nutrición vegetal ha sido demostrado previamente (Bonilla et al., 2010). En trabajos realizados por Esqueda et al. (2002) se reporta un efecto positivo sobre la emergencia de plantas en seis especies de gramíneas inoculadas con A. brasilense. Esta respuesta fue atribuida a que la bacteria propicia un ambiente benéfico, incrementando la proliferación de vellosidades de la raíz, con lo que aumenta la absorción de agua y nutrientes.
CONCLUSIÓN
Las cepas 4K y 5B promovieron capacidades de crecimiento vegetal de Pennisetum clandestinum a los 100 y 130 d de muestreo, incrementando el peso fresco y seco de la planta en relación con el control químico, bajo condiciones de invernadero.
RECOMENDACIÓN
De acuerdo con los resultados obtenidos en el presente estudio se recomienda continuar con estudios de inoculación de las especies de PGPR empleadas y dosis de fertilización nitrogenada para determinar las recomendaciones de fertilización a emplear.
AGRADECIMIENTOS
Los autores agradecen a Inés Roldán, Lady Molano y Stella Mendieta por su colaboración en el desarrollo del presente estudio y al Ministerio de Agricultura y Fedegan por su apoyo y financiación de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
Altschul S, Gish W, Miller W, Myers W, Lipman D. 1990. Basic local alignment search tool. J Mol Biol 215 (3):403-410. [ Links ]
Andrews M, James EK, Cummings SP, Zavalin AA, Vinogradova LV, McKenzie BA. 2003. Use of nitrogen fixing bacteria inoculants as a substitute for nitrogen fertiliser for dryland graminaceous crops: progress made, mechanisms of action and future potential. Symbiosis 35:209-229. [ Links ]
Asghar H, Zahir Z, Arshad M. 2004. Screening rhizobacteria for improving the growth, yield, and oil content of canola (Brassica napus L.). Aust J Agric Res 55(2):187-194. [ Links ]
AOAC, Association of Official Agriculture Chemists. 2005. Official methods of analysis 988.05. 18a ed. Washington DC. [ Links ]
Ashelford K, Chuzhanova N, Fry JA. 2005. At least one in twenty 16S rRNA sequence records currently held in public repositories estimated to contain substantial anomalies. Appl Environ Microbiol (12):7724-7736. [ Links ]
Bashan Y, Holguin G. 1997. Azospirillum/plant relationships: environmental and physiological advances (1990-1996). Can J Microb 43:103-121. [ Links ]
Bashan Y, Salazar B, Moreno M, Lopez R, Linderman R. 2012. Restoration of eroded soil in the Sonoran Desert with native leguminous trees using plant growth-promoting microorganisms and limited amounts of compost and water. J Environ Manag 102:26-36. [ Links ]
Berg G. 2009. Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture. Appl Microbiol Biotech 84:11-18. [ Links ]
Bertani G. 1952. Studies on Lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol 62:293-300. [ Links ]
Bertani G. 2004. Lysogeny at mid-twentieth century: P1, P2, and other experimental systems. J. Bacteriol 186:595-600. [ Links ]
Bonilla R, Roncallo R, Baldani V, Barros J, Murillo J, Cardenas D, Castro E, Garrido M, Rivera M. 2010. Producción de fertilizantes biológicos a partir de microorganismos nativos del género Azospirillum sp. Ciencia y tecnología para la competitividad del sector agropecuario. Bogotá: Ministerio de Agricultura y Desarrollo Rural. pp. 140-141. [ Links ]
Bray B, Kurtz L. 1945. Determination of total, organic, and available forms of phosphorus in soils. Soil Sci 59:39-45. [ Links ]
Carcaño-Montiel MG, Ferrera-Cerrato R, Pérez-Moreno J, Molina-Galán JD, Bashan Y. 2006. Actividad nitrogenasa, producción de fitohormonas, sideróforos y antibiosis en cepas de Azospirillum y Klebsiella aisladas de maíz y teocintle. Terra Latinoam 24(4):493-502. [ Links ]
Cárdenas D, Garrido MF, Bonilla M, Baldani VL. 2010. Aislamiento e identificación de cepas de Azospirillum sp. en pasto guinea (Panicum maximum Jacq.) del Valle del Cesar. Pastos y Forrajes 33(3):285-300. [ Links ]
Carreño R, Campos N, Elmerich C, Baca B. 2000. Physiological evidence for differently regulated tryptophan-dependent pathways for indole-3-acetic acid synthesis in Azospirillum brasilense. Mol Gen Genet 264:521-30. [ Links ]
Cassán F, Perrig D, Sgroy V, Masciarelli O, Penna C, Luna V. 2009. Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.). Eur J Soil Biol 45:28-35. [ Links ]
Chowdhury S, Schmid M, Hartmann A, Kumar A. 2007. Identification of diazotrophs in the culturable bacterial community associated with roots of Lasiurus sindicus, a perennial grass of thar desert, India. Microb Ecol 54:82-90. [ Links ]
Díaz K, Valiente C, Martinez M, Castillo M, Santafuetes E. 2008. Root-promoting rhizobacteria in Eucalyptus globulus cuttings. World J Microbiol Biotechnol 25(5):867-873. [ Links ]
Díaz K, Araya T, Valenzuela S, Sossa K, Martinez M, Peña-Cortés H, Santafuentes E. 2012. Production of phytohormones, siderophores and population fluctuation of two root-promoting rhizobacteria in Eucalyptus globulus cuttings. World J Microbiol Biotechnol 28(5):2003-2014. [ Links ]
Doty SL, Oakely B, Xin G, Kang JW, Singleton G, Khan Z, Vajzovic A, Staley JT. 2009. Diazotrophic endophytes of native black cottonwood and willow. Symbiosis 47:23-33. [ Links ]
Eckert B, Baller O, Kirchhof G, Halbritter A, Stoffels M, Hartmann A. 2001. Azospirillum doebereinerae sp. nov., a nitrogen-fixing bacterium associated with the C4-grass Miscanthus. Intl J Syst Evol Mcrobiol 51:17-26. [ Links ]
Egamberdiyeva D, Oflich G. 2004. Effect of plant growth-promoting bacteria on growth and nutrient uptake of cotton and pea in a semi- arid region of Uzbekistan. J Arid Environ 56:293-301. [ Links ]
Egamberdiyeva D. 2007. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Uzbekistan Appl Soil Ecol 56:184-189. [ Links ]
Esqueda MH, Carrillo RL, Sosa M, Melgoza A, Royo MH, Jiménez J. 2002. Emergencia y sobrevivencia de gramíneas inoculadas con biofertilizantes en condiciones de invernadero. Téc Pecu Méx 43(3):459-475. [ Links ]
Fiske C, Subbarow Y. 1925. The Colorimetric determination of phosphorus. J Biol Chem 66:375-400. [ Links ]
Garrido MF, Cárdenas D, Bonilla R, Baldani V. 2010. Efecto de los factores edafoclimáticos y la especie de pasto en la diversidad de bacterias diazotróficas. Pastos y Forrajes 33(4):1-7. [ Links ]
Hassen AI, Labuschagne N. 2010. Root colonization and growth enhancement in wheat and tomato by rhizobacteria isolated from the rhizoplane of grasses. World J Microbiol Biotechnol 26:1837-1846. [ Links ]
Idris A, Labuschagne N, Korsten L. 2009. Efficacy of rhizobacteria for growth promotion in sorghum under greenhouse conditions and selected modes of action studies. J Agric Sci 147:17-30. [ Links ]
James E. 2000. Nitrogen fixation in endophytic and associative symbiosis. Field Crops Res 65:197-209. [ Links ]
Kloepper JW, Lifshitz R, Zablotowicz RM. 1989. Free-living bacterial inocula for enhancing crop productivity. Trends Biotecnol 7:39-49. [ Links ]
Lugtenberg B, Kamilova F. 2009. Plant-growth-promoting rhizobacteria. Annu Rev Microbiol 63:541-556. [ Links ]
Marais JP, Figenschou DL, de Figueredo M.1992. Effect of nutrient calcium on the cell wall composition and digestibility of kikuyu grass (Pennisetum clandestinum Hochst). Afr J Range For Sci 9:72-75. [ Links ]
Mehnaz S, Lazarovits G. 2006. Inoculation effects of Pseudomonas putida, Gluconacetobacter azotocaptans, and Azospirillum lipoferum on corn plant growth under greenhouse conditions. Microb Ecol 51:326-335. [ Links ]
Obando M, Burgos L, Rivera D, Garrido M, Baldani VL, Bonilla R. 2010. Caracterización de bacterias diazotróficasasimbióticas asociadas al eucalipto (Eucalyptus sp.) en Codazzi, Cesar. Acta Biol Colomb 15(3):105-120. [ Links ]
Okon Y. 2005. PGPR - technology cases of application and futureprospects. En: Hartmann A, Schmid M, Wenzel W, Hisinger L, editores. 2004. Rhizosphere—perspectives and Challenges—a Tribute to Lorenz Hiltner. Munich, Alemania. pp. 273-274. [ Links ]
Rajkumar M, Nagendran R, Jae K, Hyu W, Zoo S. 2006. Influence of plant growth promoting bacteria and Cr6+ on the growth of Indian mustard. Chemosphere 62:741-748. [ Links ]
Rodríguez H, Fraga R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotech Adv 17:319-339. [ Links ]
Sevilla M, Gunapala N, Burris RH, Kennedy C. 2001. Enhancement of growth and N content in sugarcane plants inoculated with Acetobacter diazotrophicus. Mol Plant-Microbe Interact 14:358-366. [ Links ]
Shokri D, Emtiazi G. 2010. indole-3-acetic acid (iaa) production in symbiotic and non-symbiotic nitrogen-fixing bacteria and its optimization by taguchi design. Curr Microbiol 61(3):217-225. [ Links ]
Sidari M, Panuccio MR, Muscolo A. 2004. Influence of acidity on growth and biochemistry of Pennisetum clandestinum. Biol Plant 48(1):133-136. [ Links ]
Sundara R, Shinha M. 1963.Organis phosphate solubilizers in soil. Soil Sci Plant Nutr 9(2):45-49. [ Links ]
Taulé C, Mareque C, Barlocco C, Hackembruch F, Reis V, Sicardi V, Battistoni F. 2012. The contribution of nitrogen fixation to sugarcane (Saccharum officinarum L.), and the identification and characterization of part of the associated diazotrophic bacterial community. Plant Soil 356:35-49. [ Links ]
Vassilev N, Medina A, Azcon R, Vassileva M. 2006. Microbial solubilization of rock phosphate on media containing agro-industrial wastes and effect of the resulting products on plant growth and P uptake. Plant and Soil 287(1-2): 77-84. [ Links ]













