Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia y Tecnología Agropecuaria
versão impressa ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.14 no.1 Mosquera jan./jun. 2013
MICROBIOLOGÍA DE SUELOS
1 I.A. Coordinador de Innovación y Desarrollo. Semillas Sáenz SAS. Bogotá, Colombia. hjml182@hotmail.com
2 I.A. MSc. Investigadora. Corpoica, C.I. La Libertad, Villavicencio, Meta, Colombia. Carrosa31@hotmail.com
3 Ing. Forestal MSc. Investigador Biornata, Villavicencio, Colombia. biornata@yahoo.es
4 Microbióloga MSc. Investigadora, Corpoica, C.I. La Libertad, Villavicencio, Meta, Colombia. lmoreno@corpoica.org.co
5 I.A. PhD. Investigador. Corpoica, C.I. La Libertad, Villavicencio, Meta, Colombia. jorduz@corpoica.org.co
Fecha de recepción: 24-04-2013. Fecha de aceptación: 15-05-2013
RESUMEN
Se identificaron morfológicamente hongos formadores de micorrizas arbusculares nativos asociados a coberturas de gramíneas y leguminosas, establecidas en suelos Oxisoles del piedemonte llanero (Meta, Colombia) y se evaluó su capacidad de colonización. El área experimental se estableció en las calles de un cultivo de naranja Valencia donde se sembraron especies de Arachis pintoi (CIAT 18744), Brachiaria brizantha cv. Toledo, B. dictyoneura cv. Llanero, Desmodium ovalifolium cv. Maquenque, Panicum maximum (CIAT 36000), Paspalum notatum, un testigo químico (glifosato) y un testigo mecánico con guadaña. Se utilizó un diseño de bloques completos al azar con ocho tratamientos y tres repeticiones, que se evaluaron en la época húmeda y en la seca. Se tomaron muestras de suelo rizosférico y raíces de las gramíneas y leguminosas para identificar morfológicamente hongos formadores de micorrizas arbusculares y cuantificar el número de esporas y el porcentaje de colonización. Se identificaron 26 morfotipos de dichos hongos, incluyendo Scutellospora heterogama, Acaulospora scrobiculata y A. morrowiae que representaron 65% de la población presente en las dos épocas. La colonización radical osciló entre 47% y 94% con un contenido de esporas entre 63 y 300/100 g de suelo seco. Las coberturas con mayor porcentaje de colonización y diversidad de hongos formadores de micorrizas arbusculares fueron B. brizantha, B. dictyoneura y P. notatum; el control mecánico y los tratamientos con glifosato presentaron una influencia negativa sobre el contenido de esporas y colonización radical de dichos hongos.
Palabras claves: biodiversidad, cítricos, morfotipos, suelo ácido, trópico bajo.
ABSTRACT
Native arbuscular mycorrhizal fungi associated with grass and legume cover crops established on Oxisol soils in the Colombian piedmont (Meta) were identified morphologically and the ability to colonize was evaluated. The experimental area consisted of cover crops Arachis pintoi (CIAT 18744), Brachiaria brizantha cv. Toledo, B. dictyoneura cv. Llanero, Desmodium ovalifolium cv. Maquenque, Panicum maximum (CIAT 36000), Paspalum notatum, and a chemical control (Glyphosate and mechanical control) established in the rows in a Valencia orange grove. The experiment followed a complete randomized block design (8 cover crops) and three replications, evaluated during the wet and dry seasons. Rhizosphere soil and grass and legumes roots were sampled in order to identified AMF and quantify the number of spores and the percentage of colonization. A total of 26 species were identified, including Acaulospora scrobiculata, A. morrowiae and, Scutellospora heterogama, which accounted for over 65% of the population. The percentage of root colonization ranged between 47% and 94% with spore counts between 63 and 300/100 g of dry soil. Cover crops with the highest colonization percentage and AMF diversity were B. brizantha, B. dictyoneura and P. notatum in their respective order. Glyphosate and mechanical control had a negative influence on the sporulation and colonization of the arbuscular mycorrhizal fungi in the root system.
Key words: biodiversity, citrus, morphotypes, acid soil, tropical lowlands.
INTRODUCCIÓN
Los suelos recomendados para cítricos en el piedemonte del Meta se clasifican como Typic Haplustox, conocidos como suelos clase IV (terrazas altas) en la clasificación regional (Orduz y Baquero, 2003). Los suelos Oxisoles se caracterizan por presentar pH bajo (alrededor de 4,5), alto contenido de aluminio y manganeso, 30% de saturación de bases (Ca, Mg y K) y bajo contenido de materia orgánica (2,5%-3,0%), además de alta capacidad para la fijación de fósforo (Mejía, 1996). Estas condiciones limitan el desarrollo de los cultivos, por lo cual se hace necesario la aplicación de correctivos (cal dolomita, escorias Thomas y/o yeso agrícola) que permitan aumentar la saturación de bases hasta en 70% antes del trasplante de los cítricos (Quaggio et al., 2005). Además de proteger el suelo de la precipitación y controlar las malezas, las coberturas vegetales permiten el reciclaje de nutrientes, la descompactación y aumento de microorganismos y, a largo plazo, la formación o incremento de la capa cultivable (Román, 1996).
La adaptación de las coberturas a las condiciones de baja fertilidad de los suelos del piedemonte llanero se debe a muchos y complejos factores, dentro de los cuales el componente microbiológico desempeña un papel importante, ya que en la rizósfera existe gran diversidad de microorganismos que pueden beneficiar a las plantas para su adaptación a las condiciones adversas del suelo, dentro de los cuales se encuentran los hongos formadores de micorrizas arbusculares. La micorriza arbuscular es la asociación mutualista que se establece entre un hongo del Filo Glomeromycota y la mayoría de plantas vasculares (Schübler et al., 2001). Los hongos formadores de micorrizas arbusculares (HFMA) hacen parte de la gran diversidad de microorganismos benéficos que se encuentran en la rizósfera; según Schübler (2006) existen 10 géneros de HFMA que pueden asociarse con plantas, con aproximadamente 193 especies descritas. Sin embargo, la información sobre diversidad de HFMA en ecosistemas naturales e intervenidos es escasa, y existen evidencias de que podría ser mayor que la reportada actualmente (Opik et al., 2008). Autores como Borstler et al. (2006) reportan que en suelos de todas partes del mundo puede haber cerca de 1250 especies de HFMA; por su parte, Sieverding (1991) afirma que la diversidad de estos hongos puede cambiar de un ecosistema natural a uno que ha sido intervenido y transformado en agroecosistema.
Los HFMA se caracterizan por ser biótrofos obligados (Declerck et al., 1998), con un ciclo de vida que incluye reconocimiento, colonización e intercambio de nutrientes con la planta hospedera, y producción de estructuras reproductivas como esporas y esporocarpos y de reserva como vesículas (para los géneros que forman estas estructuras, como los pertenecientes a la familia Glominaceae (Bashan et al., 2007). El principal efecto de la micorrización en las plantas está relacionado con el aumento del volumen de suelo explorado mediante el incremento del área superficial subterránea combinada entre el sistema radical y los HFMA, orientado a mejorar la absorción de agua, nutrientes y formar puentes hifales con las raíces de las plantas cercanas como mecanismo de transferencia de nutrientes entre hospederos (Marschner y Dell, 1994; Peterson et al., 2004).
Esta asociación simbiótica entre HFMA y planta favorece la absorción de elementos poco móviles en el suelo como el fósforo, e influye directa o indirectamente en la absorción de otros nutrientes como N, K, Ca, Mg, Fe, Mn, lo cual estimula el crecimiento, desarrollo, nutrición y producción de biomasa seca en las plantas, especialmente en suelos de baja y moderada fertilidad (Barea et al., 2009; Medina y Azcón, 2010). También proporciona otros beneficios como la resistencia a condiciones de estrés cuando se presentan altas temperaturas o cuando se realizan trasplantes in vitro (en condiciones de invernadero). En esta etapa de aclimatación, la micorrización reduce el efecto negativo del trasplante y aumenta así la supervivencia de las plantas (Schultz, 2001); además, crea una barrera física que disminuye el ataque de patógenos a las raíces.
Los HFMA participan activamente en el mejoramiento de la estructura del suelo a través de la producción de una glicoproteína llamada glomalina, la cual está compuesta por moléculas recalcitrantes y tiene como función cementar los agregados del suelo (Wright et al., 2007). Estos agregados contribuyen a la estabilidad del suelo, permiten la infiltración del agua y el aire, y actúan como reservorio de carbono y nitrógeno.
Los objetivos de esta investigación fueron identificar morfológicamente los HFMA asociados con gramíneas y leguminosas utilizadas como coberturas vegetales, evaluadas en suelos ácidos mejorados químicamente con aplicación de cal dolomita; y estimar la capacidad de colonización durante las épocas seca (noviembre a marzo) y la húmeda (abril a octubre).
La especificidad de las micorrizas arbusculares asociadas a las coberturas y el impacto sobre estas poblaciones del control de malezas (químico y mecánico) permitiría contribuir al diseño de modelos sostenibles de producción con cultivos perennes en las sabanas ácidas del trópico bajo húmedo en la Orinoquia colombiana.
MATERIALES Y MÉTODOS
Localización y características del área experimental
El establecimiento de los ensayos se llevó a cabo en los huertos de cítricos de Corpoica, Centro de Investigación La Libertad, ubicado en el kilómetro 17 vía Puerto López (Villavicencio, Meta, Colombia), 04°03'35'9742'N, 73°28'8.8776' W y 366 msnm. Las condiciones climáticas medias son: precipitación 2800 mm, 26 °C y HR de 80%. Las características del suelo del lote experimental antes del trasplante fueron: pH 4,6 en los primeros 30 cm de la superficie; con saturación de bases de 24%; 24 ppm de P2 O5; 3,8% de materia orgánica; niveles bajos de Cu y B (0,22 y 0,9 ppm), medios de Zn (1,1 ppm), y altos de Fe y Mn (34 y 8 ppm). El tipo de suelo del área experimental se clasifica como Typic Haplustox, de textura franco-arcilloso-arenosa (F.Ar.A). Con el fin de elevar la saturación de bases hasta 70%, que es la recomendada para los cultivos de cítricos (Quaggio et al., 2005), dos meses antes del trasplante de los árboles de naranja Valencia, como correctivo se incorporaron 2,5 y 1,0 t/ha de cal dolomítica y de escorias Thomas, respectivamente, en los primeros 30 cm del suelo, con una rastra de dos pulgadas; posteriormente, se aplicó 1 t/ha de yeso agrícola en la superficie. La distancia de plantación usada fue de 8 m entre surcos y 6 m entre cada árbol de naranja Valencia plantado (208 plantas/ha). Las coberturas evaluadas se sembraron y trasplantaron en las calles del cultivo, un año después del trasplante de los árboles.
Coberturas evaluadas
Las coberturas de gramíneas y leguminosas evaluadas Arachis pintoi (CIAT 18744), Brachiaria brizantha cv. Toledo, Brachiaria dictyoneura cv. Llanero, Desmodium ovalifolium cv. Maquenque, Panicum maximum (CIAT 36000) y Paspalum notatum se sembraron en las calles del huerto citrícola. A una distancia de 50 cm entre surcos y entre plantas, se sembraron, a partir de semillas utilizando 20 g por parcela, Desmodium ovalifolium; y mediante propagación vegetativa, A. pintoi (CIAT 18744), B. brizantha cv. Toledo, B. dictyoneura cv. Llanero, P. maximum (CIAT 36000) y P. notatum. Se aplicó una fertilización de 50 kg/ha de potasio, 20 kg/ha de magnesio, 12 kg/ha de azufre y 50 kg/ha de nitrógeno.
Para el montaje de los ensayos se utilizó un diseño de bloques completos al azar con ocho tratamientos y tres repeticiones. Las unidades experimentales fueron parcelas de 40 m2 por cada cobertura, donde se estableció un área de 24 m2 (3 m x 8 m) en la cual se hicieron 10 divisiones de 1,5 m x 1,6 m donde se recolectaron las muestras de suelo y raíces para la evaluación (tabla 1).
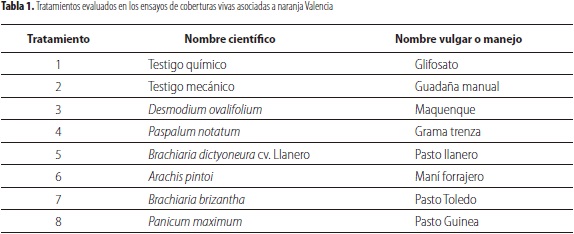
El tratamiento 7 correspondió a una cobertura nativa con aplicación de herbicida (glifosato en presentación comercial). Se realizaron dos aplicaciones anuales de glifosato (1,5 L/ha) y dos controles manuales con guadaña. Las aplicaciones y el control se realizaron al inicio y finalización de la época lluviosa.
Muestreos
En la región de los Llanos Orientales se diferencian dos épocas climáticas marcadas durante el año, húmeda y seca (Riveros, 1983). Teniendo en cuenta esta condición, se realizaron durante el año dos muestreos de suelo rizosférico y raíces de las coberturas asociadas a naranja Valencia en el piedemonte. El primero se tomó en la época húmeda comprendida entre abril y octubre con precipitaciones entre 2500 y 3000 mm y humedad relativa entre 85%-90%, brillo solar de 4,5 horas/día; el segundo muestreo se realizó en la época seca, en enero, el cual se caracterizó por presentar humedad relativa entre 67%-75%, y brillo solar de 6,3 horas/día. Los datos se tomaron de la información obtenida por la estación meteorológica ubicada en Corpoica, Centro de Investigación La Libertad.
Se colectaron 10 submuestras de 50 g de suelo que contenía raíces finas de cada una de las coberturas evaluadas, a una profundidad de 0 a 20 cm. Las submuestras se mezclaron y se homogenizaron completamente con el objeto de obtener una muestra compuesta por cada repetición. Cada unidad de muestreo correspondió a un área de 24 m2 de donde se extrajo el suelo para los análisis de laboratorio. Las muestras de suelo y raíces para el conteo de esporas, porcentaje de colonización e identificación de los HFMA se procesaron en el laboratorio de microbiología de Corpoica, C.I. La Libertad.
Conteo de esporas y clasificación por morfotipos de los hongos formadores de micorrizas arbusculares
Se empleó el método de extracción y separación de esporas del suelo, utilizando un gradiente de concentración de azúcar al 60% propuesto por Sieverding (1993). Las esporas recolectadas en papel filtro fueron cuantificadas y separadas por morfotipos con ayuda de un estereomicroscopio. Para la descripción de los morfotipos de HFMA presentes en cada parcela asociados a las coberturas, las esporas se montaron en placas de vidrio con polivinil- lacto-glicerol (PVLG), se observaron al microscopio y se identificaron teniendo en cuenta parámetros morfológicos de las esporas utilizadas en la taxonomía de los Glomales como color, tamaño, forma, diámetro y presencia de ornamentaciones. Estas características se compararon con las detalladas en las claves taxonómicas de Schenck y Pérez (1991). El color se determinó usando la tabla de colores publicada por el International Culture Collection of Arbuscular and Vesicular Mycorrhizal Fungi -INVAM-. A cada morfotipo descrito, se le asignó un código de identificación.
Determinación del porcentaje de colonización
El porcentaje de colonización en las raíces de las coberturas se determinó por medio de la técnica de colonización por campos de infección utilizando la tinción de raíces con azul de tripano propuesta por Phillips y Hayman (1970). De cada muestra, se tomaron 10 fragmentos de raíces al azar, de aproximadamente 2 cm, se montaron de forma paralela en una lámina portaobjeto con PVLG, y se visualizaron al microscopio con un aumento de 100X; para determinar el porcentaje de colonización, se utilizó la fórmula propuesta por Sieverding (1991).
Los datos obtenidos se analizaron mediante un análisis de varianza y una prueba de comparación de medias de Tukey (p < 0,05) utilizando el paquete SAS® versión 9.2. A partir de la cantidad de esporas de cada morfotipo, se calculó la diversidad de los HFMA mediante el índice de Shannon (H') (Shannon & Weaver, 1949) con la siguiente fórmula: H' = - S pi ln pi, siendo pi el número de esporas de un morfotipo dividido entre el total de esporas aisladas y una prueba de comparación de medias de Tukey (p < 0,05).
RESULTADOS Y DISCUSIÓN
Número de esporas
Al realizar el conteo del número de esporas de HFMA en el suelo en la época húmeda, se pudo observar que para esta variable no hubo diferencias estadísticamente significativas en el análisis de varianza (p > 0,05) entre las coberturas evaluadas, pero sí con respecto al testigo químico con aplicación de glifosato, donde el número de esporas fue significativamente más bajo (tabla 2). Este resultado es similar al observado por Wang et al. (1993), quienes encontraron que la aplicación de herbicidas puede tener una influencia negativa sobre la esporulación y la colonización de los HFMA, pues afecta el establecimiento de la simbiosis entre los organismos. Al aplicar al suelo glifosato, herbicida fosforado, puede ser utilizado como fuente de carbono, nitrógeno y fósforo por algunas bacterias Gram (+) y Gram (-) (Van Eerd et al., 2003). La disminución de las esporas de micorrizas parece estar asociada a la menor cantidad de materia seca producida por el tratamiento y, por tanto, al desarrollo radical de este tratamiento (Orduz-Rodríguez et al., 2011).

El uso indiscriminado de agroquímicos puede generar diferentes niveles de toxicidad que pueden inducir cambios en los procesos de colonización, formación y desarrollo de clamidiosporas, estructuras directamente relacionadas con la asociación de los HFMA y las raíces de especies vegetales (Cano y Lynch, 1990).
Al evaluar el número de esporas en la época seca, se observó mayor cantidad en las parcelas donde se establecieron A. pintoi, B. brizantha, D. ovalifolium y P. maximum, en comparación con las mismas coberturas evaluadas en la época húmeda, aunque no se evidenciaron diferencias estadísticamente significativas entre los tratamientos evaluados. La época seca mostró un efecto muy marcado con el pasto D. ovalifolium sobre la esporulación de los hongos formadores de micorrizas arbusculares; esto se evidenció con el aumento en el número de esporas formadas bajo la condición de déficit hídrico de 10% a 21% de humedad del suelo (Orduz y Fischer, 2007) mientras que en la época húmeda el número de esporas disminuyó alrededor del 70%. El déficit hídrico en el suelo no sólo tiene efecto sobre la formación de estructuras de los HFMA, sino que afecta negativamente las funciones fisiológicas de los cítricos y especies vegetales como la respiración, fotosíntesis, reacciones metabólicas, absorción de nutrientes minerales, transporte de asimilados y producción (Quiñones et al., 2007; Ortuño et al., 2004).
Bonilla (2000) observó que en la época seca, cuando las plantas están en condiciones de estrés, el número de esporas desempeña un papel importante en la formación de estructuras de colonización de raíces como las hifas, y que el déficit de agua en el suelo puede llegar a estimular la producción de estas estructuras, lo cual explica la mayor cantidad de esporas durante dicha época de evaluación.
Se encontró que el patrón de comportamiento en la mayoría de los aislamientos de HFMA fue producir esporas de resistencia debido al déficit de humedad causado por la época seca. Resultados similares obtenidos por Sieverding (1993) y Moreira-Siqueira (2002) muestran que los HFMA producen más estructuras de resistencia como las esporas cuando están expuestos a suelos con déficit de humedad, lo cual es una forma de sobrevivir o permanecer en estado de latencia por un largo período de tiempo, mientras las condiciones se tornan favorables para la germinación.
Porcentaje de colonización
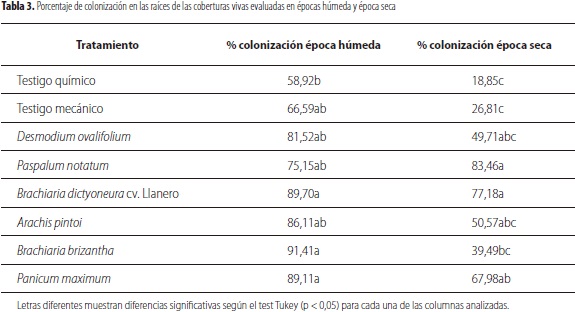
Al evaluar la colonización de los hongos formadores de micorrizas arbusculares durante la época húmeda, se observó que el control mecánico, B. brizantha, A. pintoi, D. ovalifolium y P. maximum presentaron incrementos en el porcentaje de colonización en la raíz comparado con el testigo químico con valores de 60%, 57%, 41%, 39% y 24%, respectivamente (p < 0,05). Entretanto, para la época seca P. notatum, B. dyctyoneura cv. Llanero y P. maximum mostraron los mayores porcentajes de colonización (p < 0,05) comparados con el testigo químico y mecánico (tabla 3).
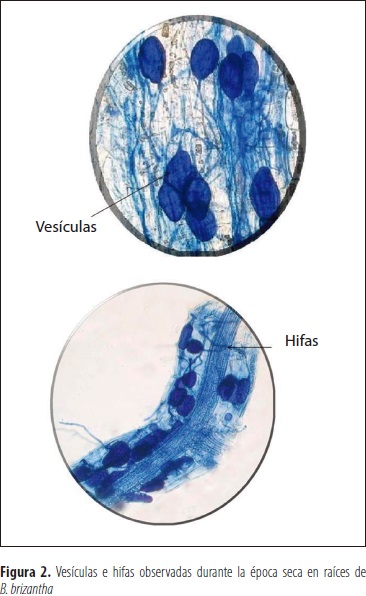
En B. brizantha se observaron estructuras similares a esporas o a vesículas dentro de las raíces colonizadas por los HFMA (figura 1). Las vesículas son estructuras de reserva que se forman en la parte terminal de las hifas y es característica de algunos géneros como Glomus y Paraglomus. En los géneros Gigaspora, Scutellospora, Racocetra y Dentiscutata no se han observado vesículas intrarradicales (Bentivenga y Morton, 1995; Oehl et al., 2008, 2011), sino células auxiliares asociadas al micelio externo (Sylvia, 1999; Peterson et al., 2004).
El control químico presentó los porcentajes de colonización de raíz más bajos en las dos épocas evaluadas, aunque la colonización de las raíces por los HFMA disminuyó drásticamente con 68 % menos en la época seca.
Las condiciones climáticas de la época seca (incremento de la temperatura máxima, disminución de la humedad relativa) y el déficit de humedad en el suelo pueden inducir un incremento en la colonización de las raíces y en la esporulación de los HFMA. Según Bagyaraj (1991), el máximo desarrollo y esporulación de los HFMA puede darse entre los 28-30 °C, mientras que la colonización micelial sobre la superficie de la raíz ocurre entre 28-34 °C.
Morfotipos e índice de biodiversidad de los HFMA encontrados en las épocas climáticas evaluadas
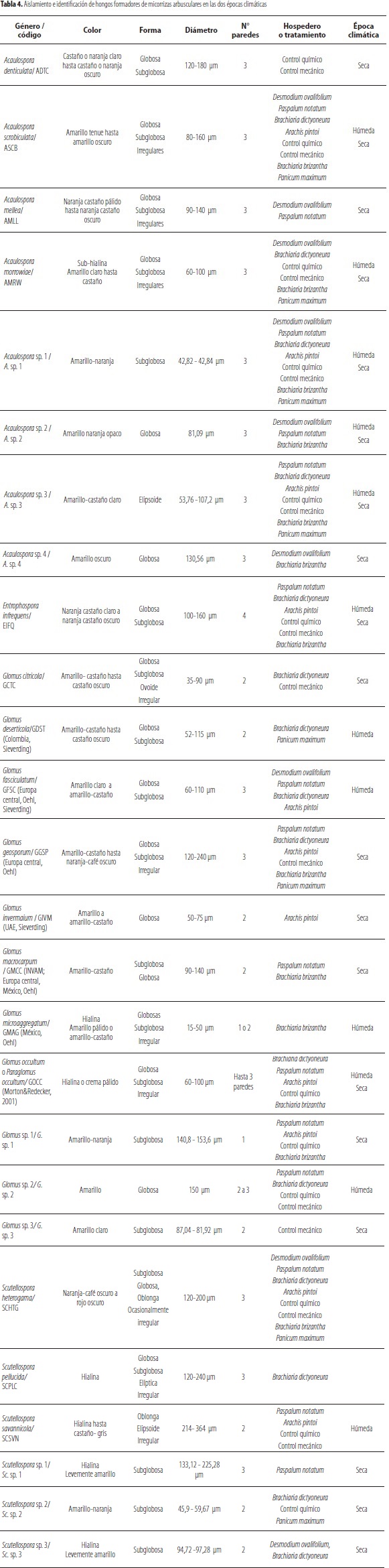
En las dos épocas de evaluación en suelo del piedemonte llanero, se identificaron 26 morfotipos de HFMA asociados a coberturas. Este número de morfotipos de HFMA encontrados en estos suelos es similar al reportado por Serralde y Ramírez (2004) en suelos ácidos del piedemonte llanero, quienes encontraron 24 morfotipos de HFMA asociados a maíz fertilizado con abonos orgánicos (gallinaza) y abonos verdes (caupí).
Las características de los 26 morfotipos de HFMA encontrados en las dos épocas climáticas se listan en la tabla 4. Dentro de los morfotipos encontrados en los suelos con coberturas, se observaron esporas con características morfológicas similares a Glomus occultum, actualmente incluido dentro del género Paraglomus, familia Paraglomeraceae, (Morton y Redecker, 2001), orden Paraglomales (Schübler et al., 2001). El morfotipo de HFMA que presentó la mayor cantidad de esporas dentro de la población fue Glomus (11 morfotipos), seguido por Acaulospora (8 morfotipos), Scutellospora (6 morfotipos) y Entrophospora (1 morfotipo).
Los HFMA identificados como Entrophospora infrequens según los análisis filogenéticos realizados por Oehl et al. (2011) pertenecen al orden Glomerales; estos aislamientos se caracterizan por formar esporas globosas y/o subglobosas constituidas por dos paredes dentro de hifas terminales y sáculos esporíferos, que pueden encontrarse en el suelo o en las raíces (figura 2).
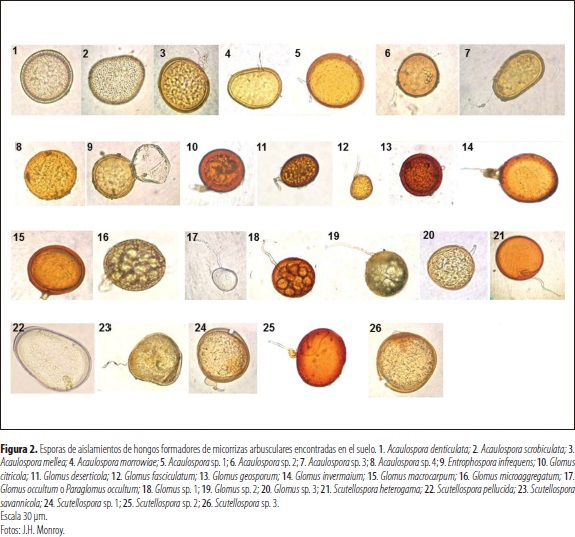
Se encontraron esporas con características similares a Scutellospora heterogama en todas las coberturas evaluadas, en las dos épocas climáticas. Los hongos formadores de micorrizas arbusculares Acaulospora scrobiculata y A. morrowiae representaron más de 65% de la población, en tres de las cinco coberturas evaluadas, excepto en A. pintoi y P. maximum en la época húmeda.
Combatt et al., (2008) han reportado que debido a las características naturales de Brachiaria decumbens, esta gramínea es reconocida por su gran facilidad de micorrización con hongos formadores de micorrizas arbusculares; estos resultados indican que las gramíneas tropicales pueden ser más dependientes de las micorrizas que las leguminosas, cuando crecen en suelos de baja fertilidad (CIAT, 1984); y en este caso suelos químicamente mejorados.
Salamanca (1999) evaluó el efecto de la inoculación de B. decumbens y B. dictyoneura con hongos formadores de micorrizas arbusculares nativas y foráneas, con o sin fertilización, en comparación con un suelo nativo (sin inoculación y sin fertilización) sobre el desarrollo, calidad nutricional y contenido de nutrientes en el tejido de las pasturas, número de esporas y porcentaje de colonización.
Los resultados mostraron que hubo mayor eficiencia con los aislamientos nativos tanto naturales e inoculadas y sin fertilización con respecto a los aislamientos introducidos; en estos ensayos, la cobertura que presentó la mayor diversidad de hongos formadores de micorrizas arbusculares fue B. decumbens con 81,8%; el género de HFMA más frecuente fue Glomus con 55,5%.
Para comparar la diversidad de los HFMA asociados a las coberturas durante cada época evaluada, se calculó el índice de Shannon (Odum, 1998). La diversidad taxonómica es una medida de las especies de HFMA presentes en el suelo, la cual puede verse influenciada por las prácticas agrícolas, el cultivo de especies no micotróficas y el establecimiento de monocultivos; la pérdida o disminución de la diversidad taxonómica, por su parte, tiene un importante impacto sobre la diversidad funcional de los HFMA (Sasvári et al., 2011).
El índice de Shannon osciló en la época húmeda entre 0,34 y 0,63 y en la época seca entre 0,36 y 0,63 (figura 3). El índice de biodiversidad promedio para las dos épocas evaluadas fue similar, no obstante, se observó un promedio de 3% mayor en la época seca. Esto señala que si bien en algunas coberturas se presentaron especies distintas en las épocas húmeda y seca, y el porcentaje de ocurrencia fue variable, la diversidad de géneros de HFMA se mantuvo casi constante durante las dos épocas evaluadas.
En cuanto a la diversidad de HFMA presentes en las coberturas evaluadas se encontró que en la época húmeda, B. dyctioneura presentó el valor más alto, y A. pintoi el inferior. En la época seca, la mayor diversidad se observó en B. brizantha; seguida por el control mecánico, B. dictyoneura y P. notatum; las parcelas con P. maximum y control químico mostraron los valores mínimos, lo que señala el efecto adverso de los herbicidas sobre la diversidad de las poblaciones de micorrizas.
CONCLUSIONES
Se encontraron 26 morfotipos de HFMA en el suelo con características similares a los géneros Acaulospora, Entrophospora, Glomus y Scutellospora; para corroborar esta identificación es necesario implementar técnicas moleculares en próximas investigaciones.
Las coberturas con mayor porcentaje de colonización y diversidad de HFMA fueron Brachiaria brizantha, B. dictyoneura y Paspalum notatum.
Estas especies vegetales asociadas a cultivos de cítricos, además de proteger el suelo, aportan nutrientes que contribuyen al crecimiento y desarrollo de las plantas, incrementando, a su vez, el número de esporas de HFMA adaptados a las condiciones edafoclimáticas de la región.
El mejoramiento de las condiciones químicas de los Oxisoles contribuye al mejor establecimiento de las coberturas y a la mayor acumulación de materia seca y desarrollo radical, lo que proporciona mejores condiciones para promover la actividad biológica de los microorganismos.
El 51% de las especies de HFMA identificadas se presentaron únicamente en la época seca; el 66% se asoció con hospederos específicos, es decir, una especie de micorriza por cada cobertura vegetal evaluada.
En comparación con los tratamientos de cobertura, la aplicación de glifosato y el control mecánico presentaron el menor número de esporas y porcentaje de colonización de los hongos formadores de micorrizas arbusculares, lo que señala la influencia negativa de estos controles dicha la población.
AGRADECIMIENTOS
Al Dr. Jaime Triana (q.e.p.d.). Al personal administrativo de Corpoica, C.I. La Libertad y a los compañeros de trabajo: Melba Mora, Heberth Velásquez, Capitolino Ciprian, David López y Alfredo Pardo.
REFERENCIAS
Bagyaraj J. 1991. Ecology of vesicular-arbuscular mycorrhizae. En: Aurora D. et al. Handbook of applied mycology: soil and plants (vol. 1). Marcel Dekker, New York Inc. 13-14. [ Links ]
Barea JM, McNeil AM, Prigent-Combaret C, Richardson AE. 2009. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms. Plant and Soil 321:305-339. [ Links ]
Bashan Y, Khaosaad T, Salazar BG, Ocampo JA, Wiemken A, Oehl F, Vierheiling H. 2007. Mycorrhizal characterization of the boojum tree, Fouquieria columnaris an endemic ancient tree from the Baja California Peninsula, Mexico. Trees-Struct Funct 21:329-335. [ Links ]
Bentivenga SP, Morton JB. 1995. A monograph of the genus Gigaspora, incorporating developmental patterns of morphological characters. Mycologia 87(5):719-731. [ Links ]
Bonilla R. 2000. Utilización de hongos micorrizógenos en la producción agrícola, Corpoica regional 3. Boletín de Investigaciones. Valledupar. [ Links ]
Borstler B, Renker C, Kahmen A, Buscot F. 2006. Species composition of arbuscular mycorrhizal fungi in two mountain meadows with differing management types and levels of plant biodiversity. Biology of Fertility and Soils 42:286-298. [ Links ]
Cano C, Lynch J. 1990. Effect of agrochemicals on vesicular arbuscular mycorrhizal fungi, CIAT-Palmira, 21 p. [ Links ]
Centro Internacional de Agricultura Tropical (CIAT). 1984. Microbiología de suelos. Programa de Pastos Tropicales, Informe anual. Cali, Colombia, p. 153-175. [ Links ]
Combatt E, Jarma A, Maza L. 2008. Crecimiento de Brachiaria decumbens Stapf y Cynodon nlemfuensis Vanderyst en suelos sulfatados ácidos de Córdoba. Rev. MVZ Córdoba 13(2):1380- 1392. [ Links ]
Declerck S, Strullu D, Plenchette C. 1998. Monoxenic culture of the intra radical forms of Glomus sp., isolated from a tropical ecosystem: a proposed methodology for germoplasm collection. Mycologia 90:579-585. [ Links ]
International Culture Collection of Vesicular Arbuscular Mycorrhizal Fungi (INVAM). General life cycle and the structures formed. URL: http://invam.caf.wvu.edu.co, Fecha consulta: enero, 2013. [ Links ]
Marschner H, Dell B. 1994. Nutrient uptake in mycorrhizal symbiosis. Plant and Soil 159:89-102. [ Links ]
Mejía L. 1996. Génesis y características de los Oxisoles y suelos óxicos de los Llanos Orientales de Colombia y su relación con la fertilidad. Suelos Ecuatoriales 26(1):7-34. [ Links ]
Moreira MS, Siqueira J. 2002. Microbiologia e bioquímica do solo. Editora UFLA. Lavras, Brazil. 625 p. [ Links ]
Morton JB, Redecker D. 2001. Two new families of Glomales, Archaeosporaceae and Paraglomaceae, with two new genera Archaeospora and Paraglomus, based on concordant molecular and morphological characters. Mycologia 93(1):181-195. [ Links ]
Odum PO. 1998. Ecología: el vínculo entre las ciencias naturales y las sociales. México. Editora Continental. p. 71-75. [ Links ]
Oehl F, Alves da Silva G, Castro I, Goto B, Maia L, Vieira E, Barea J, Sieverding EM, Palenzuela J. 2011. Revision of Glomeromycetes with entrophosphoroid and glomoidspore formation with three new genera. Mycotaxon 117:297-316. [ Links ]
Oehl F, Alves da Silva G, Goto B, Sieverding E. 2011. Glomeromycota: three new genera and glomoid species reorganized. Mycotaxon 116:75-120. [ Links ]
Oehl F, Souza FA, Sieverding E. 2008. Revision of Scutellospora and description of five new genera and three new families in the arbuscular mycorrhiza-forming Glomeromycetes. Mycotaxon 106:311-360. [ Links ]
Opink M, Moora M, Zobel U, Saks R, Wheatley F, Wright D. 2008. High diversity of arbuscular mycorrhizal fungi in a boreal herb-rich coniferous forest. New Phytologist 179(3):867-876. [ Links ]
Orduz J, Baquero J. 2003. Aspectos básicos para el cultivo de los cítricos en el piedemonte llanero. Revista Achagua 7(9):7-19. [ Links ]
Orduz J, Bueno G, Calderón C, Baquero JE. 2011. Evaluación de gramíneas y leguminosas forrajeras como coberturas y su influencia en el control de malezas en el establecimiento de cítricos en el piedemonte del Meta. Revista Corpoica Ciencia y Tecnología Agropecuaria 12(2):121-128. [ Links ]
Orduz J, Fischer G. 2007. Balance hídrico e influencia del estrés hídrico en la edición de documento de revisión de lima, inducción y desarrollo floral de la mandarina Arrayana en el piedemonte llanero de Colombia. Agronomía Colombiana 25(2):255-263. [ Links ]
Ortuño MF, Alarcón JJ, Nicolás E, Torrecilla A. 2004. Interpreting trunk diameter changes in young lemon trees under deficit irrigation. Plant Science 167:275-280. [ Links ]
Peterson L, Massicote HB y Melville LH. 2004. Mycorrhizas: Anatomy and cell biology. Research press. Otawa, Canada. 173 p. [ Links ]
Phillips JM, Hayman DS. 1970. Improved procedure for clearing roots and staining parasitic and vesicular- arbuscular fungi for rapid assessment of infection. Trans. British Mycol Soc 55:158-161. [ Links ]
Quaggio J, Mattos Junior D, Cantarella H. 2005. Manejo da Fertilidade do solo da Citricultura Citros. Governo do Estado de São Paulo, Secretaria de Agricultura e Abastecimento, Agência Paulista de Tecnologia dos Agronegócios, Instituto Agronômico, Centro Avançado de Pesquisa Tecnológica do Agronegócio de Citros Sylvio Moreira, FAPESP. Mattos Junior D, De Negri JD, Pio RM, Pompeu Junior J (eds), 484-507. [ Links ]
Quiñones A, Martínez Alcántara B, Legaz F. 2007. Influence of irrigation system and fertilization management on seasonal distribution of N in the soil profile and on N uptake by citrus trees. Agriculture: Ecosystems and Environment 122:399-409. [ Links ]
Riveros A. 1983. La Orinoquia colombiana. Boletín de la Sociedad Geográfica de Colombia 36 (118):1-9. [ Links ]
Román C. 1996. Limitaciones y ventajas de los suelos de los Llanos Orientales para el establecimiento de frutales. Suelos Ecuatoriales 26(1):54-61. [ Links ]
Salamanca C. 1999. Las micorrizas como estrategias de mejoramiento nutricional de pasturas y especies frutales en el departamento del Guaviare. Boletín Técnico Corpoica 20(1). [ Links ]
Sasvári Z, Hornok L, Posta K. 2011. The community structure of arbuscular mycorrhizal fungi in roots of maize grown in a 50-year monoculture. Biology and Fertility of Soils 47:167-176. [ Links ]
Schenck NC, Pérez Y. 1991. Manual for the identification of VA mycorrhizal fungi. Plant pathology Department. Institute of Food and Agricultural Science. University of Florida. 3rd edition, 286 p. [ Links ]
Schultz C. 2001. Effect of vesicular-arbuscular mycorrhiza on survival and post vitro development of micro propagated oil palms (Elaeis guineensis Jacq.). pp 5-14, Elektronische Dissertatioonen der Georg-Aug-Universität Göttingen. http://webdoc.sub.gwdg.de/diss/2002/schultz/schultz.pdf. Fecha consulta: diciembre, 2012. [ Links ]
Schübler A, Schwarzott D, Walker C. 2001. A new fungal phylum, the Glomeromycota: phylogeny and evolution. Mycological Research 105:1413-1421. [ Links ]
Schübler A. 2006. Phylogeny and taxonomy of Glomeromycota (arbuscular mycorrhizal (AM) and related fungi). http://AMF-phylogeny.com. Consulta: enero, 2013. [ Links ]
Serralde AM, Ramírez MM. 2004. Análisis de poblaciones de micorrizas en maíz (Zea mays) cultivado en suelos ácidos bajo diferentes tratamientos agronómicos. Revista Corpoica Ciencia y Tecnología Agropecuaria 5(1):31-40. [ Links ]
Shannon C, Weaver W. 1949. The mathematical theory of communication. University of Illinois Press, Urbana, IL.EEUU. 144 p. [ Links ]
Sieverding E. 1991. Vesicular-Arbuscular Mycorrhizal Management in Tropical Agro systems, GTZ, Eschborn Germany:10-12. [ Links ]
Sieverding E. 1993. Manual de métodos para la investigación de micorrizas vesículo-arbusculares en el laboratorio. CIAT- Palmira, 120 p. [ Links ]
Sylvia D, Fuitrmann J, Hartel P, Zubblerer D. 1999. Mycorrhizal symbioses. Principles and application of soil microbiology, Pretince Hall. New Jersey 410 p. [ Links ]
Van Eerd LL, Hoagland RE, Zamblotowicz RM, Hall JC. 2003. Pesticide metabolism in plants and microorganisms. Weed Sci. 51:472-495. [ Links ]
Wang G, Stribley D, Tinker P, Walker C. 1993. Effect of pH on arbuscular mycorrhizaI. Field observations on the long-term liming experiment at Rothamsted and Wobum. New Phytologist 124:465-472. [ Links ]
Wright SF, Green VS, Cavigelli MA. 2007. Glomalin in aggregate size classes from three different farming systems. Soil & Tillage Research 94:546-549. [ Links ]













