Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.15 no.1 Mosquera June/June 2014
MICROBIOLOGÍA DEL SUELO
Bióloga. MSc. Microbiología. Grupo de investigación Gestión Ambiental. Universidad de Boyacá. Tunja, Boyacá. mebeltran@uniboyaca.edu.co
Fecha de recepción: 17/07/2013. Fecha de aceptación: 30/01/2014
RESUMEN
Debido a la aplicación constante de insumos químicos en los agroecosistemas, el costo de producción de las cosechas y la calidad ambiental del suelo y agua se ha visto afectada. Los microorganismos realizan la mayoría de los ciclos biogeoquímicos; por tanto, su función es fundamental para mantener el equilibrio de los agroecosistemas. Uno de esos grupos funcionales son los microorganismos solubilizadores de fosfato, reconocidos promotores de crecimiento vegetal. Estas poblaciones microbianas realizan una actividad importante, ya que en muchos suelos se encuentran grandes reservas de fósforo insoluble, resultado de la fijación de gran parte de los fertilizantes fosforados aplicados, que no pueden ser asimilados por la planta. Los microorganismos solubilizadores de fosfato usan diferentes mecanismos de solubilización, como la producción de ácidos orgánicos, que solubilizan dichos fosfatos insolubles en la zona rizosférica. Los fosfatos solubles son absorbidos por la planta, lo cual mejora su crecimiento y productividad. Al utilizar esas reservas de fosfato presentes en los suelos, se disminuye la aplicación de fertilizantes químicos que, por una parte, pueden nuevamente ser fijados por iones Ca, Al o Fe volviéndolos insolubles y, por otra, incrementan los costos de producción de las cosechas. Las poblaciones microbianas han sido ampliamente estudiadas en diferentes tipos de ecosistemas, tanto naturales como agroecosistemas. Gracias a su efectividad en estudios en laboratorio y campo, el fenotipo solubilizador de fosfato es de gran interés para los ecólogos microbianos que han empezado a establecer las bases moleculares de dicho rasgo.
Palabras claves: ácidos orgánicos, microorganismos solubilizadores de fosfato, microorganismos promotores de crecimiento vegetal, suelos.
ABSTRACT
Because of the constant application of chemical inputs in Agroecosystem, the cost of crop production and environmental quality of soil and water have been affected. Microorganisms carry out most biogeochemical cycles; therefore, their role is essential for agro ecosystem balance. One such functional group is the phosphate solubilizing microorganisms, which are recognized plant growth promoters. These microbial populations perform an important activity, since in many soils there are large reserves of insoluble phosphorus, as a result of fixing much of the phosphorus fertilizer applied, which cannot be assimilated by the plant. The phosphate solubilizing microorganisms use different solubilization mechanisms such as the production of organic acids, which solubilize theses insoluble phosphates in the rhizosphere region. Soluble phosphates are absorbed by the plant, which enhances their growth and productivity. By using these phosphate reserves in soils, application of chemical fertilizers is decreased, on the one hand, can again be fixed by ions Ca, Al or Fe making them insoluble and, by the other hand, increase the costs of crop production. Microbial populations have been widely studied in different types of ecosystems, both natural and Agroecosystem. Thanks to its effectiveness, in laboratory and field studies, the phosphate solubilizing phenotype is of great interest to microbial ecologists who have begun to establish the molecular basis of the trait.
Key words: Organic acids, phosphate solubilizing microorganisms, plant growth promoting microorganisms, soils.
INTRODUCCIÓN
La agricultura intensiva en los trópicos es el resultado de la escasez de tierras agrícolas y la insuficiente producción de alimentos para satisfacer las necesidades de las poblaciones en crecimiento, lo cual ha generado que grandes áreas se vean degradadas desde el punto de vista ambiental (Beare et al., 1997). El uso indiscriminado de insumos químicos, incluidos plaguicidas y fertilizantes, ha generado graves efectos en la calidad ambiental de las aguas y el suelo; con el objetivo de preservar la calidad de dichos recursos es necesario implementar prácticas agrícolas sostenibles.
La agricultura sostenible es la principal estrategia para contrarrestar el rápido declive de la calidad ambiental por medio del mantenimiento del equilibrio de los ecosistemas (Muleta et al., 2013). En ese contexto, el uso de enmiendas microbianas representa una opción amigable desde el punto de vista ambiental como alternativa a la aplicación de fertilizantes minerales solubles. Dichas enmiendas se producen a partir de microorganismos con diferentes capacidades promotoras de crecimiento vegetal y que en su conjunto reciben el nombre de microorganismos promotores de crecimiento vegetal o PGPM (plant growth promoting microorganisms).
Los PGPM pueden afectar el crecimiento vegetal por un amplio rango de mecanismos como solubilización de fosfato inorgánico, disminución de los niveles de etileno en plantas, fijación de nitrógeno atmosférico, biocontrol de enfermedades de plantas, y producción de fitohormonas, sideróforos y ácidos orgánicos (Datta et al., 2011). Los microorganismos solubilizadores de fosfato son un grupo funcional de PGPM que incluyen no sólo bacterias, sino hongos y actinomicetos con la capacidad de solubilizar fosfatos minerales que han sido fijados en los suelos y que no pueden ser utilizados por las plantas en su nutrición; por ello su rol ecológico es esencial.
La presente revisión tiene por objetivo realizar una contextualización acerca de la importancia del fósforo en el suelo, conocer el papel de los microorganismos solubilizadores de fosfato en el ciclaje de dicho nutriente, los principales grupos microbianos con esta capacidad y sus mecanismos de acción, algunos esbozos de la genética de la solubilización de fosfatos y la recopilación de algunas aproximaciones al estudio de estos microorganismos en distintos tipos de suelo en el ámbito nacional e internacional.
El fósforo en los suelos
En los suelos la disponibilidad del fósforo es esencial para el crecimiento vegetal porque constituye más de 0,2% del peso seco de la planta (Banerjee et al., 2010). Las plantas adquieren el fosfato a partir de la solución del suelo en forma inorgánica en estado soluble como fosfatos mono y dibásicos, siendo necesario un pH de 6,5 para que el ion ortofosfato en el suelo sea aprovechable por las plantas, dado que a ese pH la precipitación de los fosfatos de aluminio y calcio disminuye (Sylvia et al., 1995).
El fósforo, después del nitrógeno, es el elemento más crítico para la producción agropecuaria; pero su disponibilidad es cada vez más limitada debido a la progresiva insuficiencia de sus fuentes naturales, su relativa escasez edáfica, elevada retención por parte de la matriz del suelo, la falta de reposición natural y su baja movilidad comparada con la de otros nutrientes (Rubio, 2002).
En general, la movilidad y concentración del fósforo en los suelos es muy baja si se compara con la de otros nutrientes; se presentan coeficientes de difusión del fosfato en el suelo de 0,3-3,3 x 10-13 m2/s y su concentración en la solución del suelo es de 0,02 ppm. Es por esto que se hace necesaria la aplicación excesiva de fertilizantes fosforados a los suelos con el objetivo de suplir la alta demanda de este nutriente por parte de las plantas; sin embargo, el exceso de aplicación de fosfatos incrementa la pérdida potencial por escorrentía superficial, lo cual puede acelerar los procesos de eutroficación en cuerpos de agua. Además, se conoce que cerca de 90% de esos insumos se precipitan como formas insolubles de fosfato tricálcico (Ca3PO4) en suelos alcalinos, y fosfato de hierro (FePO4) o fosfato de aluminio (AlPO4) en suelos ácidos (Achal et al., 2007; Banerjee et al., 2010), que no son utilizables por las plantas lo cual favorece su acumulación. Ese fosfato no disponible que está presente en los suelos sería suficiente para mantener la máxima productividad en las cosechas por cerca de 100 años (Khan et al., 2007).
Tipos de fósforo presente en los suelos
En el suelo existen diferentes fuentes de fósforo que pueden ser categorizadas como fósforo inorgánico y orgánico. La distribución de las diferentes formas de fósforo en el suelo depende de factores que incluyen tipo de suelo, pH, tipo de vegetación, actividad microbiana y entradas de fertilizantes (Rooney et al., 2009).
El fósforo inorgánico se encuentra formando parte de minerales de calcio, hierro y aluminio originados por mecanismos de precipitación y pueden liberar fósforo muy lentamente por medio de la meteorización. Los compuestos de fósforo inorgánico pueden encontrarse en forma de sales en solución, sales cristalinas o sales absorbidas por los coloides del suelo (tabla 1); también pueden formar enlaces de gran estabilidad con hidróxidos de hierro, aluminio o manganeso y son menos solubles que los compuestos de fósforo orgánico (Bobadilla et al., 2008). El fósforo disponible para las plantas se encuentra en el suelo en forma de ortofosfatos, que son formas inorgánicas solubles, encontrándose iones monobásicos (H2PO4-1) y dibásicos (HPO4-2) (Banerjee et al., 2010).
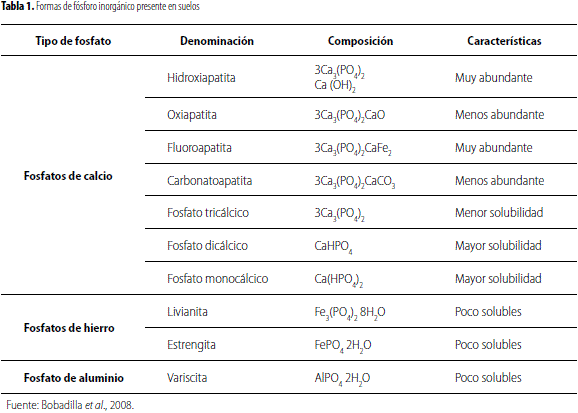
El fósforo orgánico está presente en la materia orgánica, que se origina por la degradación microbiana de restos de animales y vegetales. En diversos suelos puede representar cerca de 50% del fósforo total insoluble (Gyaneshwar et al., 2002; Oliviera et al., 2008). Una gran porción del fósforo orgánico está representada por los fosfatos de inositol y en una menor cantidad por otros ésteres de fosfato como fosfolípidos presentes en membranas biológicas (Richardson, 2001; Oliviera, 2008).
Los fosfatos de inositol, tales como el inositol hexafosfato, son los más abundantes y representan cerca de 50% del fósforo orgánico total; estos compuestos tienden a acumularse en suelos vírgenes debido a que se convierten a formas insolubles como resultado de la formación de moléculas complejas con hierro, aluminio y calcio (Gyaneshwar et al., 2002). Por otra parte, el fósforo presente en la biomasa de células microbianas representa una porción importante de P orgánico presente en los suelos; se sabe que el micelio de los hongos contiene entre 0,5% - 1,0% y las bacterias, entre 1,5% y 2,5% de fósforo por peso seco. Del fósforo presente en los microorganismos, aproximadamente de 30% a 50% está en el ARN (Pérez et al., 2012). Este tipo de fosfato puede actuar como un índice biológico potencial de la disponibilidad de fósforo en los suelos (Chen et al., 2000; Guang-Can et al., 2008).
Ciclaje del fósforo en los suelos
Debido a la baja disponibilidad del nutriente, las plantas y los microorganismos compiten por las cantidades limitadas de ese mineral a través de procesos de precipitación - solubilización y absorción (unión química del fósforo disponible) - desorción (liberación del fósforo adsorbido) (Da Silva y Vahas, 2002). En el ciclo microbiano de este mineral se producen transformaciones de formas inorgánicas a formas orgánicas y se da la conversión de formas inmóviles insolubles a compuestos solubles móviles. La conversión de fosfatos inorgánicos disponibles para la planta y microorganismos en formas orgánicas no disponibles se denomina inmovilización; el proceso contrario es la mineralización, que se define como la conversión de formas orgánicas a ortofosfatos (H2PO4 o H3PO4); el fósforo orgánico puede ser mineralizado como subproducto de la mineralización de la materia orgánica del suelo o mediante la acción de enzimas específicas que son reguladas por la demanda de este nutriente (Picone et al., 2002).
Los dos procesos anteriores pueden ocurrir coincidentemente en el suelo, pero en suelos en desarrollo predomina la inmovilización que resulta en la acumulación de compuestos de fósforo orgánico. Los fertilizantes fosforados en los suelos pueden ser tomados por las plantas o incorporados por los microorganismos del suelo; el ciclo de vida de los organismos del suelo es relativamente corto, cuando mueren, el fosfato que contienen en su biomasa es liberado en formas orgánicas e inorgánicas; algunos fosfatos orgánicos son relativamente difíciles de descomponer y tienden a acumularse en condiciones ácidas.
La acción de los microorganismos solubilizadores de fosfato es esencial para facilitar la adquisición del nutriente por parte de las plantas; cómo lo hacen, quiénes lo hacen y qué se conoce el respecto son algunos de los interrogantes que la presente revisión quiere abordar.
Los microorganismos solubilizadores de fosfato
Algunos microorganismos, especialmente los asociados con las raíces, tienen la habilidad de incrementar el crecimiento de las plantas y su productividad; estos son reconocidos como PGPM por sus siglas en inglés (Plant growth promoting microorganisms) (Rosas et al., 2006). Los microorganismos solubilizadores de fosfato (MSF) constituyen un grupo importante de PGPM, pues están involucrados en un amplio rango de procesos que afectan la transformación del fósforo, siendo componentes integrales del ciclo edáfico de este nutriente (Fankem et al., 2006).
En ambientes naturales, la rizósfera de diferentes especies de plantas es afectada por los PGPM, incluidos los MSF; estos últimos microorganismos movilizan fosfato inorgánico insoluble desde la matriz mineral hasta el suelo donde puede ser absorbido por las raíces, y las plantas les suministran compuestos carbonados que son metabolizados para el crecimiento microbiano (Pérez et al., 2007).
El papel de los MSF en la solubilización de fosfatos inorgánicos se conoció hacia 1903 (Kucey, 1983) y desde entonces han sido extensivos los estudios. La solubilización natural de fosfatos es un fenotipo natural que exhiben muchos microorganismos del suelo. Los MSF se encuentran en todos los suelos y su número varía de uno a otro (De Freitas et al., 1997); en la rizósfera se ha encontrado una concentración más alta y eficaz de MSF en comparación con los encontrados en el suelo no rizosférico (Rodríguez et al., 1999; Paul et al., 1971). En general, parece existir un efecto rizosférico sobre dichos organismos (Gómez et al., 2001), debido a que los exudados radicales y detritus vegetales proporcionan el sustrato energético para que sea posible la actividad microbiológica solubilizadora de fosfato (Valero, 2003). En esta zona de interacción se encuentran cepas aeróbicas y anaeróbicas, con prevalencia de cepas aeróbicas (Rodríguez et al., 1999).
Las bacterias son los microorganismos predominantes que solubilizan fosfato mineral en los suelos si se comparan con los hongos y los actinomicetos (Kucey, 1983; Guang-Can et al., 2008). En el suelo, las bacterias solubilizadoras de fosfato constituyen de 1% a 50% y los hongos con dicha actividad de 0,1% a 0,5 % del total de la población respectiva. En general, las bacterias solubilizadoras superan en número a los hongos de 2 a 150 veces (Banik y Day, 1983; Kucey et al., 1989; Gyaneshwar et al., 2002). Por otra parte, la mayoría de los microorganismos solubilizadores pueden solubilizar complejos de fosfato de calcio y sólo algunos pueden solubilizar fosfato de aluminio o hierro (Banik y Day, 1983; Gyaneshwar et al., 2002).
Estos microorganismos del suelo están implicados en la liberación de P desde fuentes inorgánicas por medio de la solubilización y desde fuentes orgánicas a través de la mineralización (Fankem et al., 2006). La biomasa microbiana en el suelo también contiene una cantidad significativa de fósforo inmovilizado que es potencialmente disponible para las plantas (Oberson et al., 2001).
Algunos microorganismos solubilizadores de fosfato pueden mostrar otras actividades de promoción de crecimiento vegetal como producción de ácido indol acético (AIA), ácido giberélico, citoquininas, etileno, ácido cianhídrico (HCN), fijación asimbiótica de nitrógeno y resistencia a patógenos del suelo; estas características son necesarias para que un microorganismo sea considerado un potencial y eficiente bioinsumo (Banerjee et al., 2010).
Bacterias solubilizadoras de fosfato
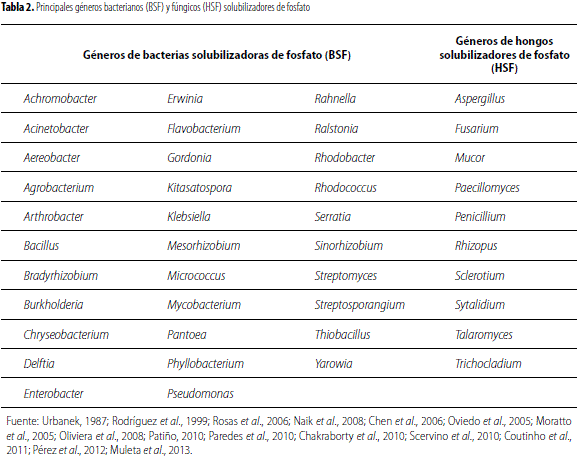
A partir del año 2000, el conocimiento sobre los microorganismos solubilizadores de fosfato ha aumentado significativamente. Dentro de este grupo funcional se encuentran las bacterias solubilizadoras de fosfato (BSF) que incluyen algunos géneros de actinomicetos. Las BSF pueden ser de vida libre en el suelo o establecer relaciones simbióticas con algunas plantas, son capaces de adaptarse, colonizar y persistir en la rizósfera de la planta y favorecer su crecimiento o desarrollo por medio de la solubilización de fosfato inorgánico de diferentes compuestos como son el fosfato bicálcico, fosfato tricálcico y rocas fosfóricas (Patiño, 2010). Existen varios géneros bacterianos reconocidos como solubilizadores que pueden evidenciarse en la tabla 2.
Hongos solubilizadores de fosfato
Los hongos son importantes componentes de la biota del suelo, su abundancia depende de la profundidad del suelo y de las condiciones nutricionales (Chakraborty et al., 2010). Una amplia cantidad de hongos del suelo han sido reportados como solubilizadores de fosfato insoluble. Los géneros de hongos solubilizadores de fosfato (HSF) se pueden observar en la tabla 2.
Mecanismos de solubilización de fosfatos
El principal mecanismo microbiológico por el cual los compuestos fosfatados son solubilizados es la disminución del pH del medio extracelular hasta valores aproximados a 2,0 que son necesarios para que se pueda llevar a cabo la solubilización (Lara et al., 2011). Este fenómeno se origina debido a la liberación de ácidos orgánicos de bajo peso molecular por parte de los microorganismos, cuyas propiedades quelantes favorecen la formación de complejos insolubles con metales, con la consecuente liberación del fosfato (Fernández et al., 2005).
Los ácidos orgánicos de bajo peso molecular provienen del metabolismo de compuestos de alto peso molecular como carbohidratos, péptidos y lípidos (Baziramakenga et al., 1995; Paredes et al., 2010). Esos ácidos son producidos en el periplasma de muchas bacterias gram negativas a través de la ruta de oxidación directa de la glucosa (DOPG por sus siglas en inglés direct oxidation pathway of glucose), cuyo papel fisiológico permanece desconocido (Pérez et al., 2007). Las enzimas de esta ruta, la quinoproteína glucosa deshidrogenasa (GDH) y la gluconato deshidrogenasa (GADH) están orientadas en la cara exterior de la membrana citoplasmática de tal forma que puedan oxidar sustratos en el espacio periplásmico; consecuentemente, los ácidos orgánicos se difunden libremente hacia el exterior de las células y pueden causar la liberación de grandes cantidades de fósforo soluble a partir de fosfatos minerales debido a que se proporcionan protones y aniones de ácidos orgánicos que se unen al metal liberando el fosfato (Pérez et al., 2007). En la tabla 3 se pueden observar los distintos tipos de ácidos orgánicos implicados en la solubilización de fosfato. Se ha reportado al ácido glucónico como el agente más frecuente en la solubilización de fosfatos, el cual es producido por especies de Pseudomonas sp. (Illmer y Schinner, 1995) Erwinia herbicola (Liu et al., 1992), Pseudomonas cepacia (Goldstein et al., 1993) y Burkholderia cepacia (Paredes et al., 2010). Otro ácido orgánico producido por bacterias solubilizadoras de fosfato es el ácido 2-cetoglucónico sintetizado por Rhizobium leguminosarum, Rhizobium meliloti (Paredes et al., 2010) y Bacillus firmus (Banik y Dey, 1983).

Algunas cepas de Bacillus liqueniformis y B. amyloliquefaciens producen mezclas de ácidos láctico, isovalérico, isobutírico y acético. También se ha reportado que las bacterias producen ácido cítrico, oxálico, propiónico, láctico, valérico, succínico y que tales ácidos están involucrados en la solubilización de minerales de calcio en concentraciones más bajas que el ácido glucónico. Este estudio apoya la hipótesis de que la calidad del ácido es más importante que la cantidad (Scervino et al., 2010).
Sin embargo, según Coyne (2000), durante procesos de oxidación de compuestos inorgánicos de nitrógeno por agentes nitrificantes, se libera ácido nítrico y por medio de la oxidación de compuestos de azufre por parte de bacterias del género Thiobacillus se genera ácido sulfúrico, el cual reacciona con los fosfatos insolubles causando igualmente su solubilización.
In vitro, en ciertos casos la solubilización de fosfatos se ha encontrado como inducible cuando hay escasez de P (Goldstein y Liu, 1987; Gyaneshwar et al., 2002).
Se ha determinado que la limitación de P resulta en la inducción de la glucosa deshidrogenasa (GDH), enzima involucrada en el metabolismo oxidativo de la glucosa, la cual se cree que conduce el proceso de solubilización en bacterias gram negativas (Muleta et al., 2013). Esos autores reportan que la actividad de la GDH aumenta cinco veces con la limitación de P y se correlaciona con una disminución del pH del medio de cultivo.
La habilidad solubilizadora de algunas bacterias puede perderse. Muleta et al. (2013) al respecto indican que la mayoría de los aislamientos gram positivos y algunos gram negativos pueden perder su capacidad de solubilizar fosfatos tras repetidos subcultivos. Pero esta situación no se ha observado en hongos solubilizadores que en general, exhiben mayor habilidad solubilizadora tanto en medio líquido como sólido (Banik y Day, 1983; Kucey, 1983; Gyaneshwar et al., 2002).
La capacidad de solubilización también depende de la naturaleza de la fuente de nitrógeno usada en el medio de cultivo; se han registrado mayores tasas de solubilización en presencia de sales de amonio que cuando el nitrato es usado como fuente de nitrógeno; esto ha sido atribuido a la extrusión de protones que compensan la toma de amonio, produciendo un pH extracelular más bajo por la acidificación del medio (Gyaneshwar et al., 2002; Scervino et al., 2010). Además, se ha encontrado que otros componentes del medio de cultivo también pueden afectar la solubilización como el contenido de potasio (Gyaneshwar et al., 2002).
En los suelos, la solubilización de fosfato por los ácidos orgánicos depende del pH y la mineralogía del mismo. Existen dos mecanismos para que esto ocurra: el primero es un intercambio del ácido, por ejemplo, los H+ provenientes del citrato se intercambian por el fósforo ligado a la superficie de los cristales del Al(OH)3 o Fe(OH)3, reduciéndolos y liberando el fósforo (Paredes et al., 2010). El segundo mecanismo depende de la concentración de los ácidos orgánicos producidos por los MSF; la cantidad y el tipo de ácidos orgánicos liberados dependen del tipo de microorganismo, el efecto quelante de estos ácidos en la solubilización consiste en que a través de sus grupos hidroxil y carboxil quelan los cationes unidos al fosfato convirtiéndolo a formas solubles (Chen et al., 2006)
Genética de la solubilización de fosfatos
Las técnicas en biología molecular son una aproximación ventajosa para obtener y caracterizar cepas PGPR mejoradas; la introducción de genes sobreexpresados para la solubilización de fosfato en bacterias de la rizósfera es una aproximación muy atractiva para mejorar la capacidad de los microorganismos como inoculantes. La inserción de genes de la solubilización de fosfatos en microorganismos que no tienen esa capacidad puede evitar la mezcla de varias poblaciones de bacterias con capacidades de promoción de crecimiento vegetal diferentes, cuando se usan como bioinoculantes (Rodríguez et al., 2006).
Las bases de la genética de la solubilización de fosfatos no están bien establecidas, ya que si bien se conoce que la producción de ácidos orgánicos es el principal mecanismo para la solubilización de fosfatos minerales, se podría asumir que cualquier gen implicado en la síntesis de ácidos orgánicos podría tener algún efecto en esta característica denominada fenotipo solubilizador (Rodríguez et al., 1999). Se ha evidenciado que la habilidad de algunas bacterias gram negativas para disolver fosfatos de calcio insolubles (fenotipo solubilizador) es el resultado de la oxidación periplásmica de la glucosa a ácido glucónico por la vía de la quinoproteína glucosa deshidrogenasa (GDH), un componente de la ruta de oxidación directa de la glucosa (Babu-Khan et al., 1995).
Las enzimas de la ruta de oxidación directa de la glucosa están localizadas en la membrana citoplasmática; en esta ruta, la glucosa sufre tres oxidaciones en el espacio periplásmico, dando como resultado la formación de ácido glucónico, 2-cetoglucónico y 2,5 dicetoglucónico, con la consecuente oxidación de ese espacio y finalmente del medio adyacente (Babu-Khan et al., 1995).
Las quinoproteínas regulan los procesos bioenergéticos en bacterias gram negativas (Liu et al., 1992). La quinoproteína glucosa deshidrogenasa (GDH) controla una etapa en la ruta metabólica de la oxidación de aldosas que es el principal mecanismo para la utilización de azúcares por parte de microorganismos. La GDH actúa en la generación de la fuerza motriz de protones durante la oxidación de los azúcares; esta enzima sólo actúa en presencia del cofactor PQQ(2,7,9- tricarboxil-1H-pirrolo[2,3-f ]quinolina-4,5-diona), que es necesario para la actividad de la quinoproteína GDH y es biosintetizado por la enzima PQQ sintasa (Rodríguez et al., 2000).
Se conoce poco acerca de la regulación génica de la solubilización, y por tanto los mecanismos genéticos o bioquímicos involucrados en la síntesis de la holoenzima GDH-PQQ; sin embargo, se han realizado varias aproximaciones a su estudio. La primera investigación que reporta aproximaciones moleculares al estudio de la solubilización de fosfatos es la de Goldstein y Liu en 1987, quienes clonaron un gen a partir de Erwinia herbicola involucrado en la solubilización de fosfatos minerales. En esa investigación se realizó una evaluación de recombinantes resistentes a antibióticos pertenecientes a una genoteca, en un medio de cultivo que contenía hidroxiapatita como fuente de fósforo. La expresión de ese gen permitió la producción de ácido glucónico y, por tanto, la solubilización de fosfatos en E. coli HB101. El análisis de la secuencia de ese gen sugirió que puede estar involucrado en la síntesis de la enzima pirroloquinolinaquinona (PQQ sintasa).
Por otra parte, se sabe que Escherichia coli no sintetiza el cofactor PQQ, pero sí sintetiza la apoenzima GHD y depende de la toma del PQQ del ambiente o del medio de cultivo para poder solubilizar fosfatos minerales. La holoenzima GDH puede formarse en E. coli cuando se introducen los genes funcionales para la biosíntesis del cofactor PQQ; esto lo realizaron Goosen et al. (1989), quienes identificaron y aislaron el gen implicado en la síntesis de la PQQ sintasa, a partir de Acinetobacter calcoaceticus; por medio de transformación bacteriana lograron que E. coli formara la holoenzima GDH en ausencia de PQQ exógeno y adquiriera la capacidad solubilizadora de fosfatos.
Liu et al. (1992) aislaron el gen de la PQQ sintasa de Erwinia herbicola EHO10 y lo introdujeron en E. coli, que no es un buen solubilizador de fosfatos, con el fin de estudiar los productos codificantes involucrados en el fenotipo solubilizador. Estos autores concluyeron que los genes responsables del fenotipo solubilizador y los genes que controlan la producción de ácido orgánico y su secreción pueden estar íntimamente relacionados.
En estudios realizados por Babu-Khan et al. (1995) se encontró un gen implicado en la solubilización de fosfatos denominado gabY, cuya secuencia completa ha sido reportada. Teniendo la secuencia del gen, se pueden deducir los aminoácidos que conforman la proteína GabY (con masa molecular de 14235 KDa), que es transmembranal con dominios periplásmicos y citoplasmáticos que hace parte de un sistema permeasa. Dicho gen puede desempeñar un papel alternativo en la expresión y regulación de la ruta de la oxidación directa de la glucosa en P. cepacia actuando como un gen funcional de esta actividad in vivo (Rodríguez et al., 1999). Como la expresión de este gen permite la inducción del fenotipo solubilizador, Rodríguez et al. (1999) construyeron un plásmido que contenía el gen funcional para la solubilización de fosfatos a partir de la cepa P. cepacia E-37, y lo expresaron en cepas de E. coli JM109 o HB101 lo que resultó en la disolución de hidroxiapatita y la producción de ácido glucónico.
Rodríguez et al. (2000) transfirieron, por medio del vector de clonación pMCG898, un gen implicado en la síntesis de PQQ sintasa presente en E. herbicola a una cepa de E. coli MC1061, la cual por conjugación transfirió el gen en cepas de Burkholderia cepacia IS16 y a una cepa de Pseudomonas sp. La expresión de ese rasgo adquirido por las cepas receptoras se evidenció con el aumento en la habilidad de solubilizar fosfatos, ya que formaron halos grandes de solubilización en medio de cultivo con fosfato insoluble, gracias a la transferencia del gen.
En estudios más recientes se realizó una integración genómica del gen pcc de Synechococcus PCC7942 en Pseudomonas fluorescens 7942, lo cual permitió la solubilización de fosfatos en la cepa receptora; sin embargo, la expresión del fenotipo solubilizador en diferentes huéspedes podría estar determinada por las características genéticas de la cepa receptora, el número de copias del plásmido y las interacciones metabólicas (Rodríguez et al., 2006).
Aunque existen esfuerzos para entender la solubilización de P a escala molecular, el mecanismo utilizado por diferentes bacterias solubilizadoras de fosfato permanece en gran medida sin identificar (Babu-Khan et al., 1995; Muleta et al., 2013). A pesar de las ventajas que puede traer la modificación genética de microorganismos, su liberación al ambiente es controversial, algunas naciones lo fomentan, mientras otras prohíben el uso de esa tecnología y exigen etiquetar los productos que contienen ingredientes modificados genéticamente; sin embargo, estudios han mostrado que siguiendo las regulaciones apropiadas, los microorganismos modificados genéticamente pueden ser usados sin riesgo en la agricultura (Rodríguez et al., 2006).
Algunas aproximaciones al estudio de los microorganismos solubilizadores de fosfato
Uno de los primeros estudios en torno a la solubilización de fosfatos fue el reportado por Pikovskaia en 1948, quien reportó bacterias productoras de ácido láctico que permiten la solubilización de fosfatos en cultivos in vitro, y estandarizó el primer medio de cultivo para el aislamiento de solubilizadores de fosfato, el cual lleva su nombre. Como resultado de estos trabajos, se generó el primer biofertilizante a base de este tipo de microorganismos denominado fosfobacterina (Cooper, 1959; Menkina, 1963). En 1982, Banik y Dey evaluaron la disponibilidad de fosfato en suelos aluviales después de la inoculación de algunos microorganismos solubilizadores de fosfato, y encontraron algunos microorganismos promisorios: dos cepas de hongos con capacidad solubilizadora Aspergillus candidus y A. fumigatus, una cepa bacteriana Bacillus firmus y un actinomiceto del género Streptomyces sp.; estos autores concluyeron que el uso de enmiendas orgánicas más la adición de bacterias solubilizadoras de fosfato favorece la disponibilidad de fósforo en suelos aluviales.
Posteriormente, se desarrolló un producto comercial de tipo fosfórico obtenido por la fusión de roca fosfórica con azufre elemental y activado con la inoculación de bacterias del género Thiobacillus (Urbanek, 1987). En 1997, Herrera reportó 40 cepas con capacidad solubilizadora, entre las que se destacan los géneros bacterianos de Bacillus, Pseudomonas y Arthrobacter, 12 cepas de hongos y 5 actinomicetos; dichas cepas son la base para la formulación de un nuevo producto denominado fosforina, que incrementa la producción de algunos cultivos entre 5% y 25% y reduce aplicación de fertilizantes fosforados entre 50% y 100%.
Se destacan investigaciones a escala mundial en torno a microorganismos solubilizadores de fosfato aislados en distintos tipos de suelo. Chung et al. (2005), a partir de muestras rizosféricas de varios cultivos incluyendo arroz, aislaron e identificaron grupos bacterianos que solubilizan fosfatos activamente in vitro, y lograron identificar aislados pertenecientes a los géneros Enterobacter, Pantoea y Klebsiella. Chen et al. (2006) aislaron bacterias solubilizadoras de suelos subtropicales y evaluaron su habilidad para solubilizar fosfato tricálcico encontrando aislados pertenecientes a los géneros Bacillus, Rhodococcus, Arthrobacter, Serratia, Chryseobacterium, Delftia, Gordonia y Phyllobacterium; además reportaron por primera vez cuatro aislados Arthrobacter ureafaciens, Phyllobacterium myrsinacearum, Rhodococcus erythropolisy Delftia sp., como bacterias solubilizadoras de fosfato.
Según Banerjee et al. (2010), los microorganismos solubilizadores de fosfato han sido aislados de suelos rizosféricos de varias plantas de interés agrícola como arroz (Chaiharn y Lumyong, 2009), trigo (Ahmad et al., 2008), soya (Son et al., 2006) mostaza (Chandra et al., 2007), berenjena y chili (Ponmurugan y Gopi, 2006). Scervino et al. (2010) evaluaron la capacidad de solubilización de varias fuentes de P por parte de aislamientos fúngicos aislados de la rizósfera de varios cultivos, que tienen la capacidad de ser agentes biocontroladores contra hongos patógenos como Sclerotinia sclerotiorum, y encontraron que cada aislado muestra diferentes patrones de producción de ácidos orgánicos, involucrados en la solubilización de sales de fosfato.
Xiao et al. (2011) estudiaron tres cepas de hongos aisladas de la rizósfera de trigo en una granja en Hubei, China, identificadas como Aspergillus niger, Aspergillus japonicus y Penicillium simplicissimum, y encontraron diferentes capacidades de solubilización de fosfato en condiciones de estrés por temperatura, pH, alta salinidad y desecación. Coutinho et al. (2011) estudiaron hongos solubilizadores de fosfato aislados de la rizósfera de melón (Cucumis melo L. cv. gold mine) en el Valle de San Francisco en Brasil, y encontraron 52 aislados con la capacidad de solubilizar fosfato pertenecientes a los órdenes Aphyllophorales y a los géneros Aspergillus, Penicillium y Rhizopus.
En 2012, Prashar y sus colaboradores estudiaron la diversidad estructural y funcional de rizobacterias asociadas al cultivo de millo perlado (Panicum glaucum) en una zona semiárida en el distrito de Faridabad, Haryana en India. En el mismo año, Muleta y sus colaboradores estudiaron rizobacterias solubilizadoras de fosfato asociadas a plantas de café (Coffea arabica) en bosques del suroeste de Etiopia.
En Suramérica sobresalen investigaciones como las realizadas por Gómez et al. (2001), quienes determinaron la capacidad y eficiencia solubilizadora de Ca3PO4 y la roca fosfórica por parte de los hongos aislados de la rizósfera del maní (Arachis hypogae L.) para establecer la posibilidad de su empleo como inóculo en suelos ácidos enmendados con fuentes insolubles de fósforo. De un total de trece organismos, sólo cinco presentaron la capacidad para solubilizar estas fuentes insolubles de fósforo. Los hongos con esta habilidad, pertenecieron en su totalidad a los géneros Penicillium y Aspergillus. La mayor capacidad solubilizadora de la fosforita correspondió a P. brevicompactum, P. chrysogenum, Penicillium sp., y A. niger.
Barroso y Nahas (2005) estudiaron suelos brasileros con bajo contenido de fósforo y ricos en óxidos de aluminio y hierro, evaluaron bosques, suelos agrícolas y la habilidad de hongos del suelo de solubilizar fosfatos de hierro y aluminio. Se aislaron 481 hongos, de los cuales 33 mostraron habilidad de solubilizar fosfatos inorgánicos y de esos, 14 fueron considerados como sobresalientes, pues solubilizaron más de 1000 mgPO4/mL. También en 2005, Fernández y sus colaboradores estudiaron la habilidad solubilizadora de aislados que provienen de suelos soyeros argentinos incluyendo cepas de Bradyrhizobium sp. En ese estudio se encontraron 14 aislamientos solubilizadores (10 de la microflora y 4 de Bradyrhizobium sp.) y concluyeron que existen aislamientos de bacterias del suelo con diferente capacidad solubilizadora de fósforo inorgánico y que las cepas de Bradyrhizobium sp. muestran capacidades de solubilización comparables a las de otros géneros bacterianos.
Pérez et al. (2007) encontraron 130 aislados bacterianos con capacidad solubilizadora en suelos del oriente de Venezuela, que pertenecen a los géneros Burkholderia, Serratia, Ralstonia y Pantoea, provenientes de suelos ácidos y ricos en hierro. Jorquera et al., (2008) estudiaron fosfobacterias (bacterias que mineralizan fitato y bacterias que solubilizan fosfato) en suelos volcánicos chilenos; estos organismos fueron aislados de la rizósfera de raigrás, trébol blanco, trigo, avena y lupino amarillo. Se seleccionaron seis fosfobacterias que pertenecen a los géneros Pseudomonas, Enterobacter y Pantoea.
Oliviera et al. (2008) aislaron, seleccionaron y evaluaron la actividad solubilizadora de microorganismos en rizósfera de maíz en suelos brasileros, con el fin de encontrar potenciales bioinoculantes; se seleccionaron los 45 mejores aislamientos que fueron identificados basándose en la secuencia de nucleótidos del 16S rDNA para bacterias y actinomicetos y en el ITS (espaciador interno transcrito) rDNA para los hongos. Se identificaron los géneros Bacillus y Burkholderia sp., como mejores bacterias; Kitasatospora, como nuevo género de actinomicetos solubilizadores de fosfato, y Aspergillus terreus como mejor hongo solubilizador.
En Colombia se han desarrollado estudios sobre la capacidad de solubilización de microorganismos rizosféricos asociados con distintos tipos de ecosistemas, tanto naturales como agroecosistemas (Vera et al., 2002; Moratto et al.; 2005, Torres et al., 2006; Beltrán, 2009) que incluyen diferentes cultivos comerciales como arazá, cebolla, papa y arroz.
En estudios como el realizado por Beltrán (2009) se realizó una aproximación para conocer el efecto del sistema de producción del cultivo del arroz (secano e inundado) sobre la población microbiana y la actividad enzimática asociada al metabolismo edáfico del fósforo en suelos del Meta. En su trabajo se realizaron los recuentos del grupo funcional y la caracterización de los microorganismos solubilizadores de fosfato de calcio aluminio y hierro; y encontró actividades sobresalientes de solubilización de fosfatos por parte de aislados fúngicos de los géneros Penicillum sp., Mucor sp., y como género bacteriano destacado a Micrococcus sp.
Pérez et al. (2012) aislaron especies de hongos solubilizadores de fosfatos endófitos y asociados a la rizósfera de pasto colosoana pertenecientes a fincas ganaderas del municipio de Sincé, Sucre, e identificaron 53 especies de hongos en suelo y 43 en raíces, de los cuales se encontraron 3 y 6 especies solubilizadoras de fosfatos respectivamente. En ese estudio, Penicillium sp. y Aspergillus niger fueron las especies solubilizadoras de fosfatos más predominantes y Paecilomyces sp., la de menor presencia.
En cuanto a investigaciones de campo, Pandey et al. (2006) han demostrado el potencial biotecnológico de la aplicación de microorganismos nativos en la promoción de crecimiento vegetal. La inoculación de suelos o semillas con microorganismos solubilizadores de fosfato ha sido ampliamente utilizada para mejorar el crecimiento y la producción de las cosechas (Banerjee et al., 2010). Por otra parte, Guang-Can et al. (2008) reportaron una correlación positiva entre el número de bacterias solubilizadoras de fosfato en la rizósfera y la toma de fosfato y rendimiento de grano en varios cultivos agrícolas.
En el norte de Bengala en la India, Chakraborty et al. (2010) evaluaron la capacidad de promover el crecimiento vegetal en plántulas de soya por parte de algunos hongos solubilizadores de fosfato aislados de suelos agrícolas, bosques y cuencas de ríos, y encontraron que todos los aislamientos promovieron el crecimiento; el más efectivo fue la cepa A. niger RSP-14. En dicho estudio el contenido de fósforo en el suelo disminuyó debido a la actividad de esos microorganismos mientras que la concentración de fósforo en las raíces mostró un incremento significativo.
En varios casos la utilización de biofertilizantes ha sido exitosa y se han podido emplear como alternativa a la fertilización tradicional. Según lo reportado por Wakelin et al. (2004) en un estudio realizado en Australia, la utilización de inoculantes a base de Penicillium bilaiae y Penicillium radicum ha mostrado efectos benéficos en los cultivos. En Canadá, un biofertilizante a base del hongo Penicillium bilaiae que se registró en 1990 para ser utilizado en trigo, fue inicialmente probado en unas pocas hectáreas con buenos resultados y en 2002, aproximadamente un millón de hectáreas sembradas con los principales cultivos de Canadá utilizaban ese biofertilizante (Patiño, 2010).
Finalmente, en Colombia se comercializa un bioinsumo producto de la investigación que se realiza sobre microorganismos solubilizadores de fosfatos en el Instituto de Biotecnología de la Universidad Nacional de Colombia sede Bogotá, cuyo ingrediente activo es Penicillium janthinellum; este producto está dirigido especialmente al cultivo del arroz, y produce incrementos del rendimiento entre 5% y 38% con respecto a cultivos no inoculados (Moreno et al., 2007).
CONCLUSIONES
El incremento de la contaminación ambiental específicamente de suelos se debe, en gran medida, a la aplicación de fertilizantes sintéticos, que si bien se utilizan para incrementar el rendimiento de cosechas en suelos con deficiencias nutricionales, su presencia tiene efectos residuales como la acumulación de metales pesados y la eutroficación de los cuerpos de agua que son fenómenos que pueden perjudicar la salud de los organismos vivos asociados.
Debido a la importancia del suelo como recurso, pues es el sustrato para el establecimiento de cultivos agronómicos a gran escala, preservar su calidad es una necesidad apremiante. Dentro de las estrategias para conseguir este propósito es urgente implementar prácticas agrícolas amigables con el medio ambiente, como programas de fertilización que incluyan el uso de insumos biológicos o biofertilizantes. Estas enmiendas microbianas pueden fabricarse a base de algunos microorganismos promotores de crecimiento vegetal, como los microorganismos solubilizadores de fosfato.
Dada la importancia de estos insumos biológicos por la reducción de los costos de producción y la disminución de la contaminación ambiental, es evidente que la investigación en este campo es promisoria.
REFERENCIAS
Achal V, Savant V, Reddy M. 2007. Phosphate solubilization by a wild type strain and UV-induced mutants of Aspergillus tubugensis, Soil. Biol. Biochem. 39:695-699. [ Links ]
Ahmad F, Ahmad I, Khan M. 2008. Screening of free-living rhizobacteria for their multiple plant growth promoting activities. Microbiol. Res. 163:173-181. [ Links ]
Babu-Khan S, Chia Yeo T, Martin W, Duron R, Goldstein, A. 1995. Cloning a mineral phosphate-solubilizing gene from Pseudomonas cepacia. Applied and environmental microbiology 61(3):972-978. [ Links ]
Banerjee S, Palit R, Sengupta C, Standing, D. 2010. Stress induced phosphate solubilization by Arthrobacter sp. and Bacillus sp. Isolated from tomato rhizosphere. Australian Journal of crop science 4(6):378-383. [ Links ]
Banik S, Dey B. 1983. Available phosphate content of an alluvial soil as influenced by inoculation of some isolated phosphate-solubilizing microorganisms. Plant and Soil. 69: 353-364. [ Links ]
Barroso C, Nahas E. 2005. The status of soil phosphate fractions and the ability of fungi to dissolve hardly soluble phosphates. Applied Soil Ecolog y 29: 73-83. [ Links ]
Baziramakenga R, Simard R, Leroux G. 1995. Determination of organic acids in soil extracts by ion chromatography. Soil. Biol. Biochem. 27(3): 349-356. [ Links ]
Beare M, Reddy M, Tian G, Srivastava S. 1997. Agricultural intensification, soil biodiversity and Agroecosystem function in the tropics: the role of descomposer biota. App. Soil. Ecol 6: 87-108. [ Links ]
Beltrán M. 2009. Evaluación del efecto del sistema de producción del cultivo del arroz (secano e inundado) sobre la población microbiana y la actividad enzimática asociada al metabolismo edáfico del fósforo (tesis de Maestría en Ciencias-Microbiología). Facultad de Ciencias. Universidad Nacional de Colombia sede Bogotá [ Links ].
Bobadilla C, Rincón S. 2008. Aislamiento y producción de bacterias fosfato solubilizadoras a partir de compost obtenido a partir de residuos de plaza (tesis de grado Microbiología Industrial). Pontificia Universidad Javeriana. Bogotá [ Links ].
Chaiharn M, Lumyong S. 2009. Phosphate solubilization potential and stress tolerance of rhizobacteria from rice soil in Northern Thailand. W J Microbiol Biotechnol 25: 305-314. [ Links ]
Chakraborty B, Chakraborty U, Sha A, Sunar K, Dey P. 2010. Evaluation of phosphate solubilizers from soils of North bengal and their diversity analysis. World Journal of Agricultural Sciences 6(2):195-200. [ Links ]
Chandra S, Choure K, Chaubey R, Maheshwari D. 2007. Rhizosphere competent Mesorhizobium loti MP6 induces root hair curling, inhibits Sclerotina sclerotiorum and enhances growth of Indian mustard (Brassica campestris). Br. J. Microbiol. 38: 124-130. [ Links ]
Chen G, He Z, Huang C. 2000. Microbial biomass phosphorus and its significance in predicting phosphorus availability in red soils. Commun. Soil. Sci. Plant Anal. 31:655-667. [ Links ]
Chen Y, Rekha A, Arun A, Shen F, Lai W, Young C. 2006. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil Ecolog y 34: 33-41. [ Links ]
Chung H, Park M, Madhaiyan M, Seshadri S, Song J, Cho H, Sa T. 2005. Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea. Soil. Biol. Biochem. 37:1970-1974. [ Links ]
Cooper R. 1959. Bacterial fertilizers in Soviet Union. Soils fertility 22: 327-333. [ Links ]
Coutinho F, De Queiroz Cavalcanti M, Mayumi A. 2011.Phosphate-solubilizing fungi isolated from a semiarid area cultivated with melon (Cucumis melo L. cv. gold mine) Acta Botánica Brasilica 25(4): 929-931. [ Links ]
Coyne M. 2000. Microbiología del suelo: un enfoque exploratorio. Madrid: Editorial panamericana, p 180 - 185. [ Links ]
Datta M, Palit R, Sengupta C, Kumar M, Banerjee S. 2011. Plant growth promoting rhizobacteria enhance growth and yield of Chilli (Capsicum annuum L.) under ï¬eld conditions. Australian Journal of Crop Science 5:531-536. [ Links ]
Da Silva P, Vahas E. 2002. Bacterial diversity on soil in response to different plants, phosphate and liming. Brazilian Journal of Microbiolog y. 33: 304-310. [ Links ]
De Freitas J, Banerjee M, Germida J. 1997. Phosphate-solubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola (Brassica napus L.) Biolog y Fertility Soils 24: 358-364. [ Links ]
Fankem H, Nwaga D, Deubel A, Dieng W, Merbach W. 2006. Occurrence and functioning of phosphate solubilizing microorganisms from oil palm tree (Elaeis guineensis) rhizosphere in Cameroon. African Journal of Biotechnolog y 5 (24): 2450-2460. [ Links ]
Fernández L, Zalba P, Gómez M. 2005. Bacterias solubilizadoras de fosfato inorgánico aisladas de suelos de la región sojera.CI. Suelo (Argentina) 23 (1):31-37. [ Links ]
Goldstein A, Liu S. 1987. Molecular cloning and regulation of a mineral phosphate solubilizing gene from Erwinia herbicola. Biotechnolog y 5:72-74. [ Links ]
Goldstein A, Rogers D, Mead G. 1993. Separating phosphate from via bioprocessing. Biotechnolog y 11:1250-1254. [ Links ]
Gómez Y, Zabala M. 2001. Determinación de la capacidad solubilizadora del P en hongos aislados de la rizósfera del maní (Arachis hypogaea L.) Saber. Universidad de Oriente, Venezuela 13(1):8-13. [ Links ]
Goosen N, Horsman H, Huinen R, Van de Putte P. 1989. Acinetobacter calcoaceticus genes involved in biosynthesis of the coenzyme pyrrolo-quinoline-quinone: nucleotide sequence and expression in Escherichia coli K-12. J. Bacteriol.171:447-455. [ Links ]
Guang-Can T, Shu-tun T, Miao-Ying C, Guang-hui. 2008. Phosphate solubilizing and mineralizing abilities of bacteria isolated from soils. Pedosphere 18(4):515-523. [ Links ]
Gyaneshwar P, Naresh G, Kumar L, Parekh J, Poole P. 2002. Role of soil microorganisms in improving P nutrition of plants. Plant and Soil 245: 83-93. [ Links ]
Herrera J. 1997. El uso de biofertilizantes en la agricultura cubana. Centro de investigaciones microbiológicas. La Habana. Cuba. [ Links ]
Illmer P, Schinner F. 1995. Solubilization of inorganic calcium phosphates-solubilization mechanisms. Soil. Biol. Biochem. 27(3): 257-263. [ Links ]
Jorquera M, Hernández M, Rengel Z, Marschner P, Mora M. 2008. Isolation of culturable phosphobacteria with both phytate-mineralization and phosphate-solubilization activity from the rhizosphere of plants grown in a volcanic soil. Soil Biology Fertility Soils 44: 1025-1034. [ Links ]
Khan M, Zaidi A, Wani P. 2007. Role of phosphate solubilizing microorganisms in agriculture- a review. Agron. Sustain. Dev. 27:29-43. [ Links ]
Kucey R. 1983. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils. Canadian Journal Soil Science 63: 671-678. [ Links ]
Kucey R, Jenzen H, Leggett M. 1989. Microbially mediated increases in plant available phosphorus. Adv. Agron. 42: 199-228. [ Links ]
Lara C, Esquivel L, Negrete J. 2011. Bacterias nativas solubilizadoras de fosfato para incrementar los cultivos en el departamento de Córdoba-Colombia. Biotecnología en el sector agropecuario y agroindustrial 9(2): 114-120. [ Links ]
Liu S, Lee L, Tai C, Hung C, Chang Y, Wolfram J, Rogers R, Golds- tein A.1992. Cloning of an Erwinia herbicola gene necessary for gluconic acid production and enhanced mineral phosphate solubilization in Escherichia coli HB101: nucleotide sequence and probable involvement in biosynthesis of coenzyme pyrrolo-quinoline quinone. Journal of Bacteriolog y 174(18): 5814-5819. [ Links ]
Menkina R. 1963. Bacterial fertilizers and their importance for agricultural plants. Microbiolog y 33: 352-358. [ Links ]
Moratto C, Martínez L, Valencia H, Sánchez J. 2005. Efecto del uso del suelo sobre hongos solubilizadores de fosfato y bacterias diazotróficas en el páramo de Guerrero (Cundinamarca). Agronomía colombiana 23(2): 299-309. [ Links ]
Moreno N, Moreno L, Uribe D. 2007. Biofertilizantes para la agricultura en Colombia. En: Izaguirre Mayoral M, Labandera C, Sanjuán J. (eds.) Biofertilizantes en Iberoamérica: Visión técnica, Científica y Empresarial vol. 1. Denad Internacional, Montevideo, p 38-45. [ Links ]
Muleta D, Assefa F, Börjessoon E, Granhall U. 2013. Phosphate-solubilising rhizobacteria associated with Coffea arabica L. in natural coffee forests of southwestern Ethiopia. Journal of the Saudi Society of Agricultural Sciences (12):73-84. [ Links ]
Naik P, Raman G, Narayanan K, Natarajan N. 2008. Assesment of genetic and functional diversity of phosphate solubilizing fluorescent pseudomonads isolated from rhizospheric soil. BCM Microbiolog y (8)230:1-14. [ Links ]
Oberson A, Friesen D, Rao I, Bühler S, Frossard E. 2001. Phosphorus transformations in an oxisol under contrasting land-use systems: The role of the microbial biomass. Plant and Soil (237):197-210. [ Links ]
Oliviera C, Alves V, Marriel I, Gómez E, Scotti M, Carneiro M, Guimaraes M, Schaffert R, Sa N. 2008. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil. Biol. Biochem. 41: 1782-1787. [ Links ]
Oviedo M, Iglesias M. 2005. Utilización de bacterias solubilizadoras de fosfato en cultivo de raygras. Resumen A053. Comunicaciones científicas y tecnológicas. Universidad Nacional del Nordeste. Argentina. 3 p. [ Links ]
Pandey A, Trivedi P, Kumar B, Palni L. 2006. Characterization of a phosphate solubilizing and antagonistic strain of Pseudomonas putida (BO) isolated from a sub-Alpine location in the Indian Central Himalaya. Current Microbiolog y 53: 102-107. [ Links ]
Paredes M, Espinosa D. 2010. Ácidos orgánicos producidos por rizobacterias que solubilizan fosfatos: una revisión crítica. Terra Latinoamericana. 28(1): 61-70. [ Links ]
Patiño C. 2010. Solubilización de fosfatos por poblaciones bacterianas aisladas de un suelo del Valle del cauca. Estudio de biodiversidad y eficiencia (tesis doctoral en Ciencias Agropecuarias - Manejo de Suelos y Aguas). Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia sede Palmira. [ Links ]
Paul N, Sundara W. 1971. Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes. Plant and Soil 35: 127-132. [ Links ] Pérez A, De la ossa J, Montes D. 2012. Hongos solubilizadores de fosfatos en fincas ganaderas del departamento de Sucre. Rev. Colombiana Cienc. Anim. 4(1):35-45. [ Links ]
Pérez E, Sulbaran M, Ball M, Yarzabal L. 2007. Isolation and characterization of mineral phosphate-solubilizing bacteria naturally colonizing a limonitic crust in the south-eastern Venezuelan region. Soil. Biol. Biochem 39: 2905-2914. [ Links ]
Picone L, Zamuner E. 2002. Fósforo orgánico y fertilidad fosfórica. Informaciones agronómicas del cono sur 16: 11-15. [ Links ]
Pikovskaya R. 1948. Mobilization of phosphorus in soil in connection with vital activity of some microbial species. Mikrobiologiya 17: 362-370. [ Links ]
Ponmurugan P, Gopi C. 2006. In vitro production of growth regulators and phosphatase activity by phosphate solubilizing bacteria. Afr. J. Biotechnol. 5:348-350. [ Links ]
Prashar P, Kapoor N, Sachdeva S. 2012. Structural and functional diversity of Rhizobacteria of pearl millet in Semi-arid Agroclimatic Zone. Asian Journal of Plant Science and Research 2 (5):599-606. [ Links ]
Richardson A. 2001. Prospects for using soil microorganisms to improve the acquisition of phosphorus by plants. Australian Journal of Plant Physiolog y 28:897-906. [ Links ]
Rodríguez H, Fraga R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Research review paper. Biotechnolog y Advances 17: 319-339. [ Links ]
Rodríguez H, González T, Selman G. 2000. Expression of a mineral phosphate solubilizing gene from Erwinia herbicola in two rhizobacterial strains. Journal of Biotechnolog y 84: 155-161. [ Links ]
Rodriguez H, Fraga R, González T, Bashan Y. 2006. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria. Plant and Soil 287:15-21. [ Links ]
Rooney D, Clipson N. 2009. Phosphate addition and plant species alters microbial community structure in acidic upland grassland soil. Microb. Ecol. 57: 4-13. [ Links ]
Rosas S, Rovera M, Correa J. 2006. Phosphate-solubilizing Pseudomonas putida can influence the rhizobia-legume simbiosis. Soil. Biol. Biochem. 38: 3502-3505. [ Links ]
Rubio G. 2002. Conectando el fósforo del suelo con la planta. Informaciones agronómicas del cono sur 16: 19:23. [ Links ]
Scervino M, Prieto M, Ivana M, Recchi M, Sarmiento N, Godeas A. 2010. Soil fungal isolates produce different organic acid patterns involved in phosphate salts solubilization. Biol. Fertil Soils. 46:755-763. [ Links ]
Son H, Park G, Cha M, Heo M. 2006. Solubilization of insoluble inorganic phosphates by a novel salt- and pH tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere. Bioresour. Technol. 97:204-210. [ Links ]
Sylvia M, Fuhrmann J, Hartel P, Zuberer D. 1995. Principles and applications on soil microbiolog y. Second Edition. Prentice Hall. New Jersey.640 p. [ Links ]
Torres M, Lizarazo L. 2006. Evaluación de grupos funcionales (C,N,P) y actividad de la fosfatasa ácida en dos suelos agrícolas del departamento de Boyacá, Colombia. Agronomía Colombiana 24(2): 317- 325. [ Links ]
Urbanek A. 1987. Technical report concerning phosphate fertilizers production from Tachira State rocks phosphate in Venezuela. Warsaw technical Univ. Varsobia. Polonia. [ Links ]
Valero N. 2003. Potencial biofertilizante de bacterias diazotróficas y solubilizadoras de fosfato asociadas al cultivo de arroz (Oriza sativa) (tesis de Maestría en Ciencias - Microbiología). Universidad Nacional de Colombia sede Bogotá [ Links ].
Vera D, Valencia H, Pérez H. 2002. Aislamiento de hongos solubilizadores de fosfatos de la rizósfera de arazá (Eugenia stipitata, myrtaceae). Acta Biológica Colombiana 7(1):33-40. [ Links ]
Wakelin S, Warren A, Harvey R, Ryder H. 2004. Phosphate solubilization by Penicillium sp. closely associated with wheat roots. Biol. Fert. Soils (40):36-43. [ Links ]
Xiao C, Chi R, Li X, Xia M, Xia Z. 2011. Biosolubilization of rock phosphate by three stress-tolerant fungal strains. Appl. Biochem. Biotechnol. (165):719-727. [ Links ]













