Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.15 no.2 Mosquera July/Dec. 2014
MANEJO FITOSANITARIO Y EPIDEMIOLOGÍA
1 I.A. PhD. Corpoica, Centro de Investigación La Libertad, Villavicencio, Colombia. gleon@corpoica.org.co
2 I.A. PhD. University of Florida, IFAS, Plant Patholog y Department, Citrus Research and Education Center, Lake Alfred, USA. avijitroy@ufl.edu
3 I.A. PhD. University of Florida, IFAS, Plant Patholog y Department, Citrus Research and Education Center, Lake Alfred, USA. nandlal@ufl.edu
4 I.A. PhD. University of Florida, IFAS, Plant Patholog y Department, Citrus Research and Education Center, Lake Alfred, USA. rhby@ufl.edu
Fecha de recepción: 09/01/2014. Fecha de aceptación: 03/04/2014
RESUMEN
Este estudio trata del diagnóstico y detección del nuevo virus de la leprosis de los cítricos tipo 2 citoplasmático (CiLV-C2) en muestras colectadas en los departamentos del Meta y Casanare, mediante técnicas moleculares RT-PCR realizadas sobre tejido vegetal y ácaros vectores Brevipalpus phoenicis (Geijskes). Para las pruebas de detección RT-PCR se utilizaron los iniciadores específicos MP y CPG. Con los iniciadores CPG, se logró la detección del CiLV-C2, en muestras de tejido vegetal con síntomas de leprosis en frutos y hojas de naranja valencia (Citrus sinensis L.) y hojas de Swinglea gluinosa Merr., lo cual confirma la presencia de este virus en Colombia. Los iniciadores MP no detectaron el virus CiLV-C2 en ninguna de las pruebas realizadas. La técnica RT-PCR permitió detectar el virus CiLV-C2 en muestras de ácaros vectores B. phoenicis, cuando se utilizaron los iniciadores específicos CPG. La detección molecular del CiLV-C2, mediante la técnica RT-PCR, se constituye en un instrumento fundamental para el diagnóstico del virus en Colombia y debe ser usada en los programas de detección y prevención de la leprosis de los cítricos en el país.
Palabras claves: cilevirus, CiLV-C2, diagnóstico, naranjo.
ABSTRACT
This study discusses the diagnosis and detection of the new citrus leprosis virus cytoplasmic type 2 (CiLV-C2) in samples collected in Meta and Casanare States, using molecular techniques performed RT-PCR on plant tissue and mite vectors Brevipalpus phoenicis (Geijskes). RT-PCR tests were carry out using specific primers MP and CPG. The use of CPG primers allows the detection of CiLV-C2, in tissue plant samples with leprosis symptoms on fruits and leaves of Valencia orange (Citrus sinensis L.) and Swinglea gluinosa Merr. leaves, which confirms the presence of this virus in Colombia. The MP primers did not detect the CiLV-C2 in any of performed tests. The RT-PCR technique allows detection of CiLV-C2 in samples of B. phoenicismite vectors, with the specific CPG primers. Molecular detection of CiLV-C2 by RT-PCR technique is a fundamental tool for the virus diagnosis in Colombia, and should be used in diagnosis and prevention programs of citrus leprosis in the country.
Key words: Cilevirus, CiLV-C2, diagnosis, orange.
INTRODUCCIÓN
La leprosis de los cítricos (citrus leprosis virus -CiLV-) está relacionada con dos tipos de virus, de acuerdo con su ubicación dentro de las células afectadas: el citoplasmático (CiLV-C) cuando se presenta en el citoplasma y el nuclear (CiLV-N) cuando se aloja en el núcleo (Guerra et al., 2007; Bastianel et al., 2006). La distribución geográfica del CiLV-C es mucho más amplia que la del CiLV-N, el cual solamente se ha encontrado en una región de Panamá y en algunos sitios del sur de Brasil (Domingues et al., 2001). El de tipo citoplasmático (CiLV-C) es frecuente en las plantaciones de cítricos, mientras que el de tipo nuclear (CiLV-N) es de muy rara ocurrencia (Rodrigues et al., 2003; Freitas et al., 2004; Kitajima et al., 2004; Rodrigues & Kitajima, 2005).
En Colombia se presenta el virus de tipo citoplasmático (CiLV-C) (León et al., 2006), verificado bajo microscopía electrónica en naranja valencia (Citrus sinensis L.), por la presencia de partículas cortas baciliformes en el retículo endoplasmático y viroplasmas de formas irregulares en el citoplasma de las células infectadas, lo cual coincide con descripciones de Kitajima et al. (1974) y Colariccio et al. (1995).
El CiLV-C no es un virus común en las plantas (Bastianel et al., 2010). De acuerdo con su morfología y por estar presente en las células del citoplasma o en el núcleo de las células infectadas, se asumía que era un virus de la familia Rhabdoviridae. Colariccio et al. (2000) y Rodrigues et al. (2000) reportaron una doble cadena de ARN asociada con el CiLV-C extraído de hojas de cítricos. Posteriormente, Locali et al. (2003), al obtener la secuencia genómica del virus, comprobaron que esa doble cadena pertenece al CiLV-C y su ARN posee un genoma bipartito, a diferencia del genoma monopartito característico de los rhabdovirus. Pascon et al. (2006) y Bastianel et al. (2006) al efectuar la secuencia del genoma completo del CiLV-C y el análisis filogenético definen que el virus pertenece a una nueva familia de virus de plantas relacionada con tobamovirus y a un nuevo género llamado cilevirus.
Los virus CiLV-C y CiLV-N son transmitidos principal- mente por ácaros del género Brevipalpus (Acarina: Tenuipalpidae). Entre las especies de Brevipalpus, el ácaro rojo plano Brevipalpus phoenicis (Geijskes) es el vector más diseminado y eficaz en el mundo; otras especies como B. californicus, B. inornatusy B. obovatus han sido relacionadas también como vectores de estos virus, pero con poca frecuencia. (Rodrigues et al., 2003; Childers et al., 2001; Rodrigues & Childers, 2013). En Colombia, el ácaro B. phoenicisha sido identificado como el principal vector de la leprosis de los cítricos CiLV-C (León et al., 2006) y se encuentra registrado y disperso en varias zonas del país (Posada, 1989; León, 2001).
La leprosis de los cítricos se encuentra reportada en Suramérica, Centro América y México. Su importancia se ha incrementado durante los últimos años, puesto que es una enfermedad de carácter cuarentenario, con restricciones que buscan proteger la industria citrícola de países citricultores que aún no están afectados. Ha causado pérdidas económicas en Argentina, Brasil, Paraguay, Uruguay, Venezuela, Costa Rica, Panamá y Honduras. La enfermedad ha sido reportada en Guatemala, Bolivia, México, Colombia (Freitas et al., 2004, 2005; Araya, 2000; Domingues et al., 2001; Mejía et al., 2005; Gómez et al., 2005; USDA, 2004; León et al., 2006; NAPPO, 2005) y recientemente en Belice (Rodrigues & Childers, 2013).
En Colombia, la leprosis CiLV-C se observó en el 2004 en el departamento de Casanare y se dispersó rápidamente; entre el 2004 y el 2006 se reportó en varios municipios de los departamentos del Meta y Casanare (León et al., 2006; Becerra et al., 2007). El Meta es el departamento de mayor producción de cítricos en los Llanos Orientales de Colombia, con 4.300 ha sembradas en cítricos, que se encuentran amenazadas por la presencia de la enfermedad y representan 10% del área nacional cultivada. En Casanare, aunque posee solo alrededor de 500 ha sembradas en cítricos, la presencia de la enfermedad continúa actualmente.
Los ácaros del género Brevipalpus, además de ser los principales transmisores del CiLV, poseen un gran número de plantas hospederas y pueden vivir en cultivos tanto cítricos como no cítricos que son exportados de Centro y Sur América hacia Norte América, Europa y Asia (Childers et al., 2003). Childers et al. (2003a) reportan 486 plantas que hospedan la especie B. phoenicis, por lo cual la leprosis CiLV-C es considerada una amenaza para la industria citrícola de varios países.
El CiLV-C afecta varias especies de cítricos, principal- mente naranjos (C. cinensis) y mandarinos (Citrus reticulata) (Domingues y Rodrigues 1999; Bastianel et al., 2006). Anteriormente, las únicas plantas reconocidas como hospederos naturales del virus de la leprosis CiLV-C eran rutáceas del género Citrus (Rodrigues et al., 2003). Colariccio et al. (1995) lograron transmitir mecánicamente el virus hacia hospederos herbáceos y plantas indicadoras como Chenopodium amaranticolor, C. quinoa (Chenopodiaceae) y Glomphrena globosa (Amaranthaceae). Lovisolo et al. (2000) ampliaron el número de hospederos alternos del virus a 13 especies, pertenecientes a las familias Amaranthaceae, Tetragoniaceae y Chenopodiaceae. Nunes et al. (2012), mediante análisis RT-PCR y microscopía electrónica, reportan a Hibiscus rosa-sinensis, Malvaviscus arboreus (Malvaceae), Grevilea robusta (Proteaceae) y Bixa Orellana (Bixaceae), como plantas hospederas del virus. En Colombia, el virus también fue detectado afectando en forma natural hojas de Swinglea gluinosa, especie ampliamente utilizada en el país como cerca viva (León et al., 2008).
Los métodos utilizados durante años para el diagnóstico de la enfermedad fueron el reconocimiento de síntomas, las pruebas de transmisión mecánica o con el ácaro vector y los análisis de tejido infectado mediante microscopía electrónica (Kitajima et al., 1972; Colariccio et al., 1995). Sin embargo, todos estos métodos tienen una o más desventajas: no tienen especificidad, son poco confiables, tienen altos costos y se requiere mucho tiempo para obtener resultados.
Kitajima et al. (1972) describen partículas virales de CiLV-C en los tejidos de hojas sintomáticas; dichas partículas no se encuentran en las áreas asintomáticas de los alrededores, lo cual indica que el virus no es sistémico en la planta y, por tanto, su diseminación depende de los hábitos de alimentación y el movimiento de los ácaros vectores infectados con el virus (Ferreira et al., 2003; Rodrigues et al., 2003).
Locali et al. (2003) desarrollaron el primer método específico molecular para el diagnóstico de la enfermedad a través de RT-PCR (transcripción reversa - reacción en cadena de la polimerasa), el cual permite una detección del virus rápida y eficiente en todos los tejidos infectados. Los diagnósticos mediante RT-PCR han sido utilizados para confirmar la presencia del virus en el vector y también para estudiar la resistencia genética o la tolerancia de genotipos de cítricos, puesto que mediante estas pruebas es posible detectar el virus en plantas asintomáticas (Freitas et al., 2003, 2005; Gómez et al., 2005; Bastianel et al., 2004). En Colombia no existen reportes sobre diagnóstico de CiLV-C en ácaros vectores. Kubo et al. (2011) reportan detección del virus CiLV-C y otros virus de plantas en ácaros Brevipalpus spp., usando la técnica RT-PCR con iniciadores específicos y resultados positivos.
La caracterización molecular del CiLV-C fue posible a través de la extracción de moléculas de ARN de hojas de cítricos con síntomas de leprosis. Colariccio et al. (2000) y Rodrigues et al. (2000) mostraron la presencia de moléculas de ARN en tejidos con leprosis, mientras que Locali et al. (2003) demostraron la naturaleza viral de estas moléculas y las usaron para construir la secuencia ADN del virus citoplasmático. Con la secuencia parcial del genoma del virus CiLV-C se obtuvieron dos pares de iniciadores que amplifican específicamente regiones dentro de la replicasa putativa (Rep) y la proteína de movimiento (MP), para la detección del CiLV-C por medio de RT-PCR. Locali et al. (2006) y Pascon et al. (2006) publicaron la secuencia completa de nucleótidos, la organización genética y el análisis filogenético del virus de la leprosis tipo citoplasmático CiLV-C.
Según Locali et al. (2004) y Freitas et al. (2005), los resultados de pruebas de detección molecular con los iniciadores que amplifican eficientemente regiones del virus citoplasmático CiLV-C no sirven para hacerlo con el virus nuclear CiLV-N, con lo cual se comprobó que los dos virus son diferentes. Guerra et al. (2007) reportan la caracterización parcial del genoma del virus citoplasmático (CiLV-C), con ARN de genoma bipartita y confirman que los síntomas causados por los dos tipos de CiLV, el nuclear y el citoplasmático, son causados por dos virus distintos.
La detección del virus de la leprosis de los cítricos (CiLV-C) en Colombia se efectuó por métodos moleculares RT-PCR y microscopía electrónica. El análisis RT-PCR fue efectuado con los iniciadores MPF (5'-CGTATTGGCGTTGGATTTCTGAC-3') y MPR (5'-TGTATACCAAGCCGCCTGTGAACT-3'), que amplificaron fragmentos específicos del genoma viral. Una de las amplificaciones de DNA citoplasmático fue secuenciada (NCBI-GenBank DQ272491) y esta secuencia coincidió 98% con la secuencia de nucleótidos del CiLV-C aislado del Brasil (GenBank AY289190.1), lo cual permitió adelantar el diagnóstico molecular del virus en Colombia (León et al., 2006a).
Colariccio et al. (2000) y Guerra et al. (2007) describieron la asociación de ARN bipartito, positivo del virus de la leprosis de los cítricos citoplasmático CiLV-C. La secuencia completa del genoma bipartito de CiLV-C muestra que el ARN1 posee dos marcos de lectura abierta (open reading frame -ORF-). El ORF1 en el ARN1 codifica una poliproteína de 276 kDa y el ORF2 en el ARN1 no muestra ninguna similitud con otras secuencias en el GenBank. El ARN2 tiene tres ORF. Si bien ORF1 y ORF3 de ARN2 no muestran ninguna similitud con las secuencias en el GenBank, el ORF2 codifica una proteína de movimiento 30,6 kDa.
Recientemente en Colombia, la detección del CiLV-C mediante la técnica RT-PCR no resultó exitosa. Lenis y Ángel (2010) evaluaron 15 parejas de iniciadores diferentes para la detección del CiLV-C por medio de pruebas RT-PCR y solamente lograron detección del virus con una pareja (LCL1/MP4), que codifican con la proteína de movimiento P32, pero los resultados no fueron reproducibles. Estos resultados confirman que el CiLV-C en Colombia presenta diferencias con las secuencias previas reportadas en la base de datos del GenBank. Por ello concluyen que el diagnóstico mediante técnicas RT-PCR, con los iniciadores que originalmente detectaron, presenta inespecificidad para la amplificación molecular de diferentes regiones del genoma y sugieren que el virus CiLV-C presente en Colombia se debe secuenciar para establecer el grado de variabilidad entre estos aislamientos.
Roy et al. (2013) confirman que durante 2010 y 2011, las pruebas de diagnóstico por RT-PCR , con los iniciadores amplificados de la secuenciación GenBank DQ272491, fallaron para detectar el virus de la leprosis en Colombia; los escasos resultados positivos obtenidos no fueron reproducibles cuando el virus se logró detectar con dichos iniciadores.
Por ello, en trabajo cooperativo con la Universidad de La Florida y USDA-APHIS, se secuenció nuevamente el genoma completo del virus, a partir de muestras con síntomas de leprosis, colectadas en los departamentos del Meta y Casanare. Con dichos trabajos, se encontró un nuevo tipo de virus de leprosis en Colombia, el cual de acuerdo con el análisis filogenético, se clasificó como miembro del género Cilevirus y se denominó virus de la leprosis de los cítricos tipo 2 (CiLV-C2). Aun cuando la estructura de los genomas de los dos virus es muy similar, el genoma completo de CiLV-C2 contiene en sus ARN 1 y 2 un total de 8.717 y 4.989 nucleótidos respectivamente, a diferencia del CiLV-C (GenBank accesión DQ157465-66), que posee 8.730 y 4.975 nucleótidos en los ARN1 y ARN2 respectivamente. El marco de lectura abierta 1 (ORF1) del CiLV-C2 codifica el módulo de replicación y contiene en su ARN1, máximo 60% de nucleótidos y aminoácidos idénticos a los que posee el ORF1 del CiLV-C; la proteína putativa (CPG) p29, del CiLV-C2, tiene en su secuencia únicamente 48% de nucleótidos y 33% de aminoácidos idénticos a los de la secuencia de la p29 del CiLV-C. Además, el ARN2 del nuevo CiLV-C2, que codifica el movimiento de proteína MP, contiene un marco de lectura abierta adicional y una proteína hipotética (p7) más que el ARN2 del CiLV-C (Roy et al., 2013).
Para efectuar la detección del virus de la leprosis CiLV-C2 mediante pruebas moleculares RT-PCR, en el presente trabajo, se utilizaron los iniciadores (CPG-F y CPG-R), desarrollados en la investigación de Roy et al. (2013) y se comparan con los iniciadores MPR y MPF, anteriormente utilizados.
MATERIALES Y MÉTODOS
Inicialmente, se realizaron pruebas moleculares con la técnica RT-PCR en muestras de hojas de naranja valencia (C. sinensis L.) y Swinglea glutinosa con lesiones de leprosis, colectadas de árboles que anteriormente habían resultado positivos a CiLV-C mediante RT-PCR con los iniciadores MPF y MPR, secuencias 5'-CGTATTGGCGTTGGATTTCTGAC-3' y 5'-TGTATACCAAGCCGCCTGTGAACT-3 ', respectivamente, que codifican la proteína de movimiento (339 bp). Posteriormente, luego de confirmar la detección negativa del virus con dichos iniciadores, se procedió a efectuar pruebas de detección molecular para el virus de la leprosis de los cítricos tipo 2 (CiLV-C2). Para la detección del virus CiLV-C2, se utilizaron los iniciadores específicos desarrollados por Roy et al. (2013) denominados iniciador especifico positivo CPG-F, secuencia 5'-ATGAGTAACATTGTGTCGTTTTCGTTGT-3', e iniciador específico negativo CPG-R, secuencia 5'-TCACTCTTCCTGTTCATCAACCTGTT-3', que codificaron exitosamente el amplicón del gen de proteína de la cubierta CPG - 795 bp, para muestras de Colombia. En las pruebas realizadas, se incluyó paralelamente la utilización de los iniciadores MP, para comparación de los diagnósticos; adicional- mente, se realizaron pruebas de detección RT-PCR en ácaros B. phoenicis, previamente colocados en alimentación sobre hojas de naranja valencia con lesiones de leprosis de los cítricos.
Obtención del material vegetal y ácaros B. phoenicis
La obtención del material vegetal se realizó mediante colecta de muestras de hojas y frutos de naranja valencia con síntomas de leprosis de los cítricos, en árboles de fincas del Meta y Casanare, así como en los huertos de cítricos de los centros de investigación La Libertad y Taluma de Corpoica. Los árboles muestreados habían resultado positivos a CiLV-C en estudios anteriores, mediante pruebas RT-PCR con los iniciadores MPR y MPF. Para S. glutinosa, se colectaron hojas con lesiones de leprosis en las localidades de Guamal y Villavicencio.
En el departamento de Casanare, las muestras se colectaron en los municipios de Aguazul (finca Villa Flor, 05°09'55,7" N y 72°4'14" O) y Yopal (finca La Parcela, 05°25'72" N y 73°59'11,04" O). En el departamento del Meta, las muestras se colectaron en los municipios de Villavicencio (C.I. La Libertad, 04°03'44,8" N y 73°27'9,6" O), Guamal (finca El Progreso, 03°52'53,1" N y 73°45'44,7" O) y Puerto Gaitán (C.I. Taluma, - 04°22'28,5" N y 72°13'37,7" O).
Los ácaros vectores, libres de virus, se obtuvieron de colonias de multiplicación de B. phoenicis, del laboratorio de entomología de Corpoica en el C.I. La Libertad. Para permitir la adquisición del virus por los ácaros, durante cinco días se alimentaron adultos y ninfas sobre hojas de naranja valencia con síntomas de leprosis, colectadas en el C.I. La Libertad en Meta y la finca Villa Flor en Casanare. En este proceso, se utilizó la metodología para adquisición del virus descrita por León, 2013. Una vez transcurrido el período de adquisición del virus, se colectaron los ácaros y se almacenaron en viales de vidrio con etanol 90% a temperatura controlada de -20 °C. Posteriormente, se procesaron los ácaros B. phoenicis y se efectuó prueba de diagnóstico molecular RT-PCR para la detección molecular del virus CiLV-C2, utilizando la metodología descrita por Kubo et al. (2011).
Procesamiento del material y pruebas RT-PCR
El diagnóstico molecular del virus mediante técnica RT-PCR de las muestras de material vegetal se realizó en el laboratorio de biotecnología de Corpoica en el Centro de Investigación Tibaitatá.
La extracción de ARN total de tejido vegetal se efectuó tomando 0,1 g de hojas o corteza de frutos con lesiones de leprosis por muestra según el caso. La muestra se maceró en nitrógeno líquido hasta obtener una proporción de polvo muy fino y se homogenizó mediante la adición de 100 ml de Trizol por cada macerado; se siguió el protocolo para extracción de ARN con Trizol® de la compañía Invitrogen. Las pruebas de RT-PCR se realizaron utilizando Superscript III First-strand Reverse Transcriptase (Invitrogen) de acuerdo con el protocolo de la casa fabricante. Para los ácaros vectores, se procesaron muestras con un mínimo de 20 individuos, de acuerdo con el protocolo de extracción de ARN con tapón (buffer) CTAB.
Para la detección de CiLV-C2 tanto en tejido vegetal como en ácaros se utilizó la técnica RT-PCR con los nuevos pares de iniciadores CPG-F y CPG-R; paralelamente se utilizaron los iniciadores MP-F y MP-R para comparar los diagnósticos.
El resumen del protocolo es el siguiente: se obtuvo la solución de trabajo (2XRT mix:10 ml; RT Mix enzima: 2 ml; ARN: 4 ml; agua DEPC hasta 20 ml); se incubó a 25 °C durante 10 min, luego a 50 °C durante 30 min. La reacción se terminó a 85 °C durante 5 min y se colocó en hielo. Se agregó 1 ml de E. coli RNase H y se incubó a 37 °C durante 20 min. Se utilizaron los siguientes reactivos y cantidades en la prueba RT-PCR para detección del CiLV-C2: buffer PCR 5X: 10 ml; MgCl2: 3 ml; dNTPs: 1 ml; iniciador CPG-F: 1 ml; iniciador CPG-R: 1 ml; Taq polimerasa: 0,4 ml; agua ultrapura: 32,6 ml; cDNA: 1 ml.
El programa de termociclado utilizado en la prueba fue: un ciclo de desnaturización inicial a 94 °C por 2 min; 35 ciclos de desnaturización a 94 °C por 15 s, anillamiento a 55 °C por 30 s y extensión a 68 °C por 1 min; y un ciclo de extensión final de 72 °C por 5 min y conservación final a 4 °C por 1 min. Se tomaron alícuotas de 8 ml de los productos RT-PCR y se utilizó el marcador de peso molecular Hyperladder IV para visualización por electroforesis en gel agarosa 1%, buffer TAE 1X, a 80 voltios durante 1 hora.
Las pruebas de diagnóstico molecular RT-PCR que se exponen en la presente investigación son las siguientes:
1. Prueba RT-PCR con iniciadores MP: detección de CiLV-C con iniciadores MP, para muestras de hojas de naranja (C. sinensis) y Swinglea gluinosa colectadas en los departamentos del Meta (localidades La Libertad, Guamal, Taluma) y Casanare (localidad de Yopal).
2. Prueba RT-PCR en Meta y Casanare: comparación de los iniciadores MP y CPG, para detección de CiLV-C y CiLV-C2, por medio de una prueba de RT-PCR. Esta prueba se realizó con muestras de lesiones de hojas de naranja valencia (C. sinensis), colectadas en Meta y Casanare.
3. Prueba RT-PCR en tejido vegetal: detección de CiLV-C2 con el nuevo iniciador específico CPG, para muestras de lesiones de hojas de S. glutinosa, y lesiones de hojas y frutos de naranja valencia colectadas en Meta y Casanare. Los amplicones obtenidos en la prueba 2 se utilizaron como controles positivos para Meta y Casanare.
4. Prueba RT-PCR según tamaño de lesiones en cítricos y S. glutinosa: detección de CiLV-C2 con el nuevo iniciador específico CPG, para hojas de naranja valencia y S. glutinosa, colectadas en Meta y Casanare, comparando muestras de lesiones de diferente tamaño. Para el control positivo se utilizó el producto RT-PCR correspondiente a la muestra Casanare obtenido en la prueba 2.
5. Prueba RT-PCR en ácaros B. phoenicis: detección de CiLV-C2 con iniciadores MP y CPG, para ácaros Brevipalpus phoeniciscon período previo de tres días de alimentación sobre hojas de naranja valencia, colectadas de árboles positivos a CiLV-C2 en los departamentos de Meta y Casanare. Los productos amplificados en la prueba 2 se utilizaron como controles positivos.
RESULTADOS Y DISCUSIÓN
1. Prueba RT-PCR con iniciadores MP
Al desarrollar la prueba RT-PCR con los iniciadores MP (339 pb) para la detección del virus de la leprosis de los cítricos en muestras de naranja valencia (C. sinensis) y Swinglea glutinosa colectadas en los departamentos de Meta y Casanare, localidades La Libertad, Guamal, Taluma y Yopal, el resultado fue negativo para todas las muestras analizadas, a pesar que en estudios de diagnóstico previos habían funcionado para el diagnóstico del virus CiLV-C en Colombia (León et al., 2006a). En el gel de agarosa 1%, obtenido de las muestras evaluadas con los productos de PCR, como resultado de la prueba, no se observa amplificación de los fragmentos esperados para ninguno de los casos. Esto demuestra que el virus de la leprosis de los cítricos citoplasmático tipo 2 (CiLV-C2), el cual fue utilizado como control positivo en la línea 10 del gel, no es detectado con los iniciadores MP (figura 1).

2. Prueba RT-PCR en los departamentos de Meta y Casanare
Al comparar los iniciadores específicos CPG y MP, por medio de la prueba molecular RT-PCR para la detección del virus de la leprosis CiLV, en lesiones de leprosis de muestras de hojas de naranjo (C. sinensis L.), colectadas en Meta y Casanare, se encontró que únicamente los nuevos iniciadores CPG lograron la amplificación de la secuencia genética esperada al nivel 795 bp, mientras que con los iniciadores MP no se logró ninguna amplificación (figura 2). La concentración viral de las extracciones obtenidas fue de 335,9 ng/ml para la muestra del Meta y de 558,3 ng/ml para la muestra de Casanare.
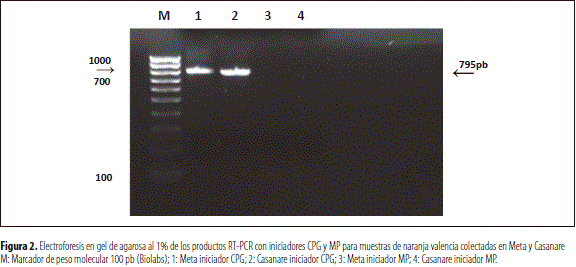
Este resultado explica los diagnósticos negativos de detección para el virus de la leprosis de los cítricos obtenidos por Lenis y Ángel (2010) y demuestra que el virus presente en las muestras analizadas en localidades de Meta y Casanare corresponde al nuevo virus citoplas- mático de la leprosis de los cítricos tipo 2 (CiLV-C2), reportado por Roy et al. (2013).
3. Prueba RT-PCR en tejido vegetal
En esta prueba de detección del virus de la leprosis de los cítricos tipo 2 (CiLV-C2), usando el nuevo iniciador específico CPG, sobre lesiones de hojas de S. glutinosa, y lesiones de hojas y frutos de naranja valencia colectadas en Meta y Casanare, únicamente se encontraron detecciones positivas para las muestras analizadas de lesiones de frutos de Yopal, Casanare y lesiones de hojas del C.I. La Libertad, Meta.
Teniendo en cuenta que los controles positivos utilizados en esta prueba fueron amplificados exitosamente, se esperaba detección positiva para la totalidad de las muestras analizadas, pero esto no sucedió de acuerdo con lo esperado. Las concentraciones de ARN total obtenidas con espectrofotómetro NanoDrop 1000 Thermo Scientific presentan diferencias considerables para cada una de las extracciones (tabla 1), lo cual permitiría explicar en parte los resultados obtenidos.
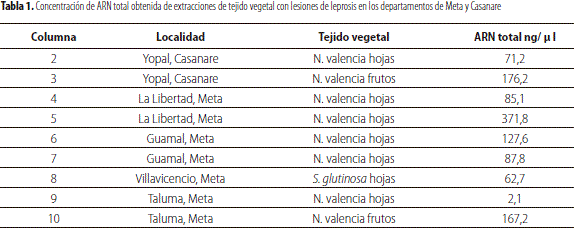
La mínima concentración de ARN total detectable en el presente estudio fue de 132,7 ng/ml. Dado que las muestras de frutos de Yopal y Taluma, y hojas de La Libertad 5 (figura 3, líneas 3, 5 y 10) superan esta concentración, con 176,2; 167,2 y 371,8 ng/ ml (tabla 1), resultaron positivas para el virus de la leprosis de los cítricos tipo 2 (CiLV-C2) con la técnica de diagnóstico RT-PCR utilizada (figura 3).
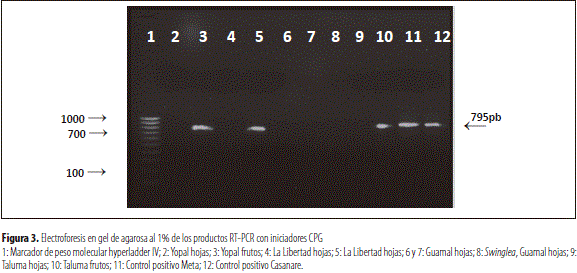
Estos resultados se explican también porque posteriormente Roy et al. (2014) registraron el virus de la leprosis de los cítricos tipo nuclear (CiLV-N) en Colombia, en infección mixta con el CiLV-C y el CiLV-C2. Estos autores encontraron que dicho tipo de virus afecta hojas y frutos de naranja valencia y naranja común (C. sinensis) y S. glutinosa, lo cual implica que las muestras examinadas en la presente investigación pudieron estar afectadas por lesiones de leprosis del tipo CiLV y CiLV-N, pero no fueron detectadas en la prueba RT-PCR, puesto que la prueba utilizada detecta únicamente CiLV-C2.
4. Prueba RT-PCR según tamaño de lesiones de cítricos y S. glutinosa
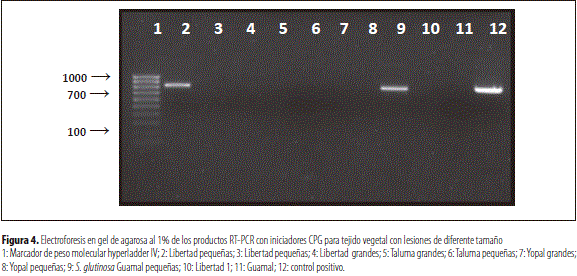
Esta prueba se realizó con el fin de lograr el diagnóstico del virus tipo 2 (CiLV-C2), a partir de muestras de hojas de naranja valencia y S. glutinosa, comparando lesiones de leprosis grandes (mayores a 1,0 cm de diámetro) y pequeñas (menores de 0,5 cm de diámetro). Para el control positivo, se utilizó el producto correspondiente a la muestra positiva de Casanare obtenido en la prueba 2.
Los resultados muestran detección únicamente en dos de las diez muestras evaluadas. Se obtuvo amplificación para las muestras de hojas de naranjo (C. sinensis) con lesiones menores de 0,5 cm colectadas de árboles del C.I. La Libertad, y para la muestra de S. glutinosa con lesiones pequeñas colectada en Guamal, Meta. Parece haber una mejor detección sobre las lesiones con diámetros menores de 0,5 cm, pero los resultados no permiten concluir con seguridad acerca del tamaño apropiado para el diagnóstico positivo del CiLV-C2, con el método RT-PCR utilizado en este estudio. Las concentraciones virales obtenidas por cuantificación con espectrofotómetro NanoDrop 1000 Thermo Scientific, para cada extracción se presentan en la tabla 2.
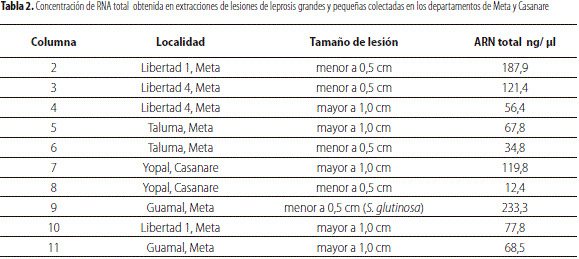
Se destaca la amplificación obtenida para la muestra de S. glutinosa con lesiones pequeñas, lo cual permite afirmar que esta planta no cítrica es susceptible a la infección por virus de la leprosis tipo 2 (CiLV-C2), y se constituye en el primer registro de detección de este tipo de virus en una planta no cítrica (figura 4).
5. Prueba RT-PCR en ácaros B. phoenicis
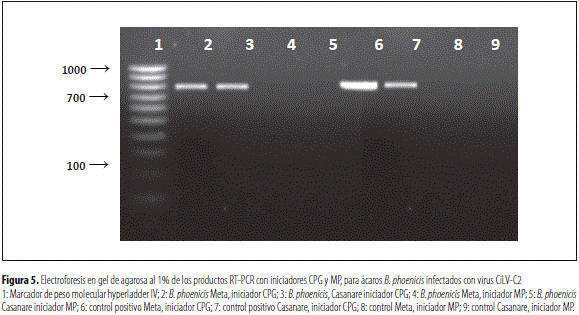
El diagnóstico RT-PCR utilizando los iniciadores específicos CPG permitió la detección exitosa del virus de la leprosis de los cítricos (CiLV-C2) para muestras de ácaros B. phoenicisinfectados con virus CiLV-C2 de árboles de Meta y Casanare (líneas 2 y 3). Los iniciadores MP no lograron la amplificación de ninguna de las muestras de ácaros evaluadas, ni tampoco de los controles utilizados en esta prueba. Los resultados de esta prueba se presentan en la figura 5.
CONCLUSIONES
Se logró detección positiva del virus de la leprosis de los cítricos Tipo 2 (CiLV-C2), mediante la técnica RT-PCR utilizando los iniciadores específicos CPG-F y CPG-R, para muestras de tejido vegetal de naranjo (C. sinensis) y Swinglea glutinosa, así como para ácaros vectores Brevipalpus phoeniciscolectados en los departamentos del Meta y Casanare, lo cual confirma la presencia del virus citoplasmático de la leprosis de los cítricos tipo 2 en Colombia.
Los iniciadores MP que venían siendo utilizados para detección del virus de la leprosis de los cítricos en Colombia, no detectan el virus de la leprosis de los cítricos tipo 2 (CiLV-C2); con dichos iniciadores tampoco fue positiva la detección de este tipo de virus en ácaros vectores B. phoenicis.
El diagnóstico positivo del virus de la leprosis tipo 2 (CiLV-C2) en Swinglea glutinosa se constituye en el primer registro de detección de este tipo de virus en una planta no cítrica; demuestra además que S. glutinosa es una planta hospedera alternativa de este tipo de virus, lo cual puede contribuir a la diseminación de la enfermedad en Colombia.
La detección positiva del CiLV-C2, en ácaros vectores B. phoenicispor medio de técnicas RT-PCR utilizadas en el presente estudio, utilizando los iniciadores específicos CPG-F y CPG-R, se constituye en una herramienta importante para el diagnóstico y la prevención de la diseminación del virus en Colombia.
REFERENCIAS
Araya G. 2000. Informe sobre la prospección de la "leprosis de los cítricos" en la zona fronteriza (Costa Rica/Panamá). Ministerio de Agricultura y Ganadería, Panamá [ Links ].
Bastianel M, Freitas J, Kitajima E, Machado M. 2006. The citrus leprosis pathosystem. Summa Phytophatol. 32 (3): 211-220. [ Links ]
Bastianel M, Bassanezi R, Freitas J, Kitajima E, Kubo K, Machado M. 2010. Citrus Leprosis Centennial of an unusual mite - virus pathosystem. Plant Disease 94 (3): 284 -293. [ Links ]
Becerra H, López V, Matheus H, Batidas A, Esteban A. 2007. Monitoreo de Brevipalpus phoenicis (Acari: Tenuipalpidae) vector de La leprosis de los cítricos en el Meta y Casanare. En: Resúmenes XXXIV Congreso Sociedad Colombiana de Entomología Socolen. p. 142. [ Links ]
Bitancourt A. 1955. Estudos sobre a leprose dos citros. Arquivos do Instituto Biológico, São Paulo. 22: 161-231. [ Links ]
Childers C, Kitajima E, Welbourn C, Rivera C, Ochoa R. 2001. Brevipalpus mites on citrus and their status as vectors of citrus leprosis. Manejo Integrado de Plagas (Costa Rica). 60: 66 - 70. [ Links ]
Childers C, Rodrigues J, Derrick K, Achor D, French J, Welbourn C, Ochoa R, Kitajima E. 2003. The status of citrus leprosis in Florida and Texas: past and present. Experimental and Applied Acarolog y. 30: 181 - 202. [ Links ]
Childers C, Rodrigues J, Wellbourn, W. 2003a. Host plants of Brevipalpus californicus, B. obovatus, and B. phoenicis (Acari: Tenuipalpidae) and their potential involvement in the spread of viral diseases vectored by these mites. Experimental and Applied Acarolog y. 30: 29 -105. [ Links ]
Colariccio A, Lovisolo O, Chagas C, Galetti S, Rossetti V, Kitajima E. 1995. Mechanical transmission and ultrastructural aspects of citrus leprosis virus. Fitopatologia Brasileira 20: 208-213. [ Links ]
Domingues A, Rodrigues J. 1999. Ocorrência de leprose dos citros em Paraíso do Tocantins (TO). Laranja, Cordeirópolis, 20 (1): 35-50. [ Links ]
Domingues F, Bernal A, Childers C, Kitajima E. 2001. First report of citrus leprosis on Panama. Plant Disease, St. Paul. 85: 228. [ Links ]
Ferreira P, Freitas-A J, Rodrigues J, Kitajima E. 2003. Dados preliminares de transmissãomecânica e por ácaros de alguns dos vírus transmitidos por Brevipalpus (Acari: Tenuipalpidae). Fitopatologia Brasileira, Fortaleza. 28: 250. [ Links ]
Freitas-A J, Locali E, Antonioli R, Rodrigues V, Kitajima E, Machado M. 2003. Detection of citrus leprosis virus in citrus stems, fruits and the mite vector. Virus Reviews & Research. 8 (1): 196. [ Links ]
Freitas-A J, Cavalcante M, Locali E, Antonioli R, Domingues A, Machado M. 2004. RT-PCR detection of citrus leprosis virus in samples from the Northern region of Brazil. Virus Reviews & Research 9 (1): 246-247. [ Links ]
Freitas-A J, Kitajima E, Locali E, Antonioli L, Bastianel M, Machado M. 2005. Further evidence to support that citrus leprosis virus-cytoplasmic and nuclear types are different viruses. In: Annals XLV Annual Meeting of the American Phytopathological Society (APS). Caribbean Division. San Jose. pp. 93. [ Links ]
Gómez E, Rivadameira V, Locali E, Freitas A, Astúa G, Rodrigues J, Mesa N, Kitajima E. 2005. First report of citrus leprosis virus on citrus in Santa Cruz, Bolivia. Plant Dis. 89(6): 686. [ Links ]
Guerra-M, Keremane M, Brlansky R, Lee R. 2007. Citrus leprosis symptoms can be associated with the presence of two different viruses : Cytoplasmic and Nuclear, the Former Having a Multipartite RNA Genome. International Organization of Citrus Virologists Proceedings, 16th Conference, p. 230-239. [ Links ]
Kitajima E, Müller G, Costa A, Yuki W. 1972. Short, rod-like particles associated with citrus leprosis. Virolog y. 50: 254-258. [ Links ]
Kitajima E, Rosillo M, Portillo M, Muller G, Costa A. 1974. Microscopia eletrônica de tecidos foliares de laranjeiras infectadas pela lepra explosiva da Argentina. Fitopatologia, Lima, 9: 55-56. [ Links ]
Kitajima E, Ferreira P, Freitas-A J, Machado M. 2004. Ocorrência da leprose dos citros, tipo nuclear (CiLV-N) nos municípios paulistas de Monte Alegre do Sul e Amparo. Summa Phytopathologica 30: 68. [ Links ]
Kubo K, Novelli V, Bastianel M, Locali E, Antonioli R, Machado M, Freitas-A J. 2011. Detection of Brevipalpus transmitted viruses in their mite vectors by RT-PCR . Experimental and Applied Acarolog y. 54: 33-39. [ Links ]
Lenis B, Ángel J. 2010. Evaluación de iniciadores para la detección del virus de la leprosis de los cítricos mediante la técnica Transmisión Reversa Reacción en Cadena de La Polimerasa. Universidad Francisco de Paula Santander. Tesis de Grado. Facultad de Ciencias Agrarias y del Ambiente. 134 p. [ Links ]
León G. 2001. Insectos de los cítricos. Guía ilustrada de plagas y benéficos con técnicas para el manejo de los insectos dañinos. Produmedios. Bogotá. 81 p. [ Links ]
León G, Kitajima E, Freitas-A J, Childers C, Achor D, Salarolli R, y Mesa N. 2006. Occurrence of Citrus leprosis virus in Llanos Orientales, Colombia. American Phytopathological Society. Plant Dis. Note. 90(5):682. [ Links ]
León G, Kitajima E, Freitas A, Machado M, Meza N. 2006a. Detección del virus de la leprosis de los cítricos tipo citoplasmático en los Llanos Orientales de Colombia. Rev. Corpoica 7(2):67-72. [ Links ]
León G, Becerra H, Salarolli R y Kitajima K. 2008. Natural infection of Swinglea glutinosa by the Citrus leprosis virus Cytoplasmatic type (CiLV-C) in Colombia. American Phytopathological Society. APS. Plant Disease, Disease Note 92 (9):1364. [ Links ]
León G. 2013. Eficiencia de transmisión del virus de la leprosis de los cítricos (CiLV-C) por ácaros vectores Brevipalpus phoenicis(Geijskes) en Colombia. Tesis doctoral en Ciencias Agropecuarias con énfasis en Entomología. Universidad Nacional de Colombia. Facultad de Agronomía, Bogotá. 105 p. http://www.bdigital.unal.edu.co/11114/1/797064.2013.pdf [ Links ]
Locali-F E, Freitas-A J, Souza M, Takita M, Astúa G, Antonioli R, Kitajima E, Machado M. 2003. Development of a molecular tool for the diagnosis of leprosis, a major threat to Citrus production in the Americas. Plant Disease 87(11):1317-1321. [ Links ]
Locali-F E, Freitas-A J, Machado M. 2004. Leprose dos citros: Biologia e diagnóstico. Laranja 25(1):53-68. [ Links ]
Locali-F E, Freitas-A J, Souza A, Takita M, Astua G, Antonioli-L R, Rodrigues V, Targon N, Machado M. 2006. Complete nucleotide sequence genomic organization and phylogenetic analysis of Citrus leprosis virus cytoplasmic type. Journal of General Virology. 87: 2721-2729. [ Links ]
Lovisolo O, Colariccio A, Masenga V. 2000. New Experimental Hosts and Further Information on Citrus Leprosis Virus. Fourteenth IOCV Conference, 2000-Other Viruses. 164-173. [ Links ]
Mejia L, Paniagua N, Cruz M, Porras M, Palmieri M. 2005. Citrus leprosis, disease that endangers plantations in Guatemala. pp. 17-19. En: Annals Annual Meeting of American Phytopathological Society, Caribbean Division. [ Links ]
Nunes A, Kitajima E, Hilf M, Gottwald T, and Freitas-A J. 2012. Transmission of Citrus leprosis virus C by Brevipalpus phoenicis (Geijskes) to alternative host plants found in citrus orchards. Plant Dis. 96: 968-972. [ Links ]
Organización Norteamericana de Protección a las Plantas (NAPPO). 2005. Sistema de Alerta Fitosanitaria. Detección de la leprosis en el estado de Chiapas, México, http://www.pestalert.org/espanol/oprDetail.cfm?oprID=165; consulta: enero de 2010. [ Links ]
Pascon R, Kitajima J, Breton M, Assumpção L, Greggio C, Zanca A, Okura V, Alegria M, Camargo M, Silva G, Cardozo J, Vallim M, Franco S, Silva V, Giachetto P, Silva J, Ferro J, Reinach F, Silva A. 2006. The complete nucleotide sequence and genomic organization of Citrus Leprosis associated Virus, Cytoplasmatic type (CiLVC). Virus Gene 32: 289 - 298. [ Links ]
Posada L. 1989. Lista de insectos dañinos y otras plagas en Colombia. Instituto Colombiano Agropecuario ICA. Boletín técnico No. 43. 622 p. [ Links ]
Rodrigues J, Targon M, Machado M. 2000. dsRNA associado a lesões de leprose dos citros. Fitopatol. Bras. 25: 447-448. [ Links ]
Rodrigues C, Derrick K, Achor D, French J, Welbourn W, Ochoa R, y Kitajima E. 2003. Citrus leprosis and its status in Florida and Texas: past and present. Exp. Appl. Acarol. 30 (1-3): 181-202. [ Links ]
Rodrigues J, Kitajima E. 2005. Levantamento de virus transmitidos por Brevipalpus (Acari: Tenuipalpidae) na região de Manaus e Urucu, AM. Summa Phytopathologica, Botucatu. 31: 26. [ Links ]
Rodrigues J, Childers C. 2013. Brevipalpus mites (Acari: Tenuipalpidae): vectors of invasive, non-systemic cytoplasmic and nuclear viruses in plants. Experimental and Applied Acarolog y. 59:165-175. [ Links ]
Roy A, Choudhary N, León G, Shao J, Govindarajulu A, Achor D, Wei G, Picton D, Levy L, Nakhla M, Hartung J, Brlansky R. 2013. A Novel Virus of the Genus Cilevirus Causing Symptoms Similar to Citrus Leprosis. Phytopatholog y. 103(5):488-500. [ Links ]
Roy A, Leon G, Hartung J, Brlansky RH, Stone AL, Schneider WL. 2014. First report of citrus leprosis virus nuclear type in sweet orange in Colombia. Plant Disease American Phytopathological Society 98:1162-1163. [ Links ]
United States Department of Agriculture (USDA). 2004. Targeting a threat to U.S. Citrus Mite-Borne disease already has foothold in South America. http://www.ars.usda.gov/is/AR/archive/mar04/citrus0304.htm. Consulta: febrero 2010. [ Links ]













