Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.15 no.2 Mosquera July/Dec. 2014
MANEJO INTEGRADO DE PLAGAS
1 Microbióloga Industrial. MSc. Laboratorio de Control Biológico. Corpoica. Mosquera, Colombia. asantos@corpoica.org.co
2 Microbióloga Industrial. C.MSc. Laboratorio de Control Biológico. Corpoica. Mosquera, Colombia. luribe@corpoica.org.co
3 Microbióloga Industrial. Laboratorio de Control Biológico. Corpoica. Mosquera, Colombia. jcruiz@corpoica.org.co
4 Microbióloga Industrial. Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá. lizeth0490@hotmail.com
5 Microbióloga Industrial. C.PhD. Laboratorio de Control Biológico. Corpoica. Mosquera, Colombia. jagomez@corpoica.org.co
6 Química Farmacéutica. MSc. PhD. Laboratorio de Control Biológico. Corpoica. Mosquera, Colombia. lvillamizar@corpoica.org.co
Fecha de recepción: 30/10/2013. Fecha de aceptación: 24/02/2014
RESUMEN
Con un aislamiento colombiano del nucleopoliedrovirus de Spodptera frugiperdaSf NPV003 se desarrolló una formulación en polvo mediante un proceso de micro-encapsulación con un polímero del ácido metacrílico, el cual aumentó la fotoestabilidad del virus. Con el fin de generar las recomendaciones para el uso de este bioplaguicida, el objetivo de la presente investigación fue establecer la compatibilidad in vitro con los productos químicos (insecticidas y fungicidas) que se utilizan con mayor frecuencia en el cultivo de maíz y determinar la estabilidad del producto durante 15 meses de almacenamiento a 8, 18 y 28 °C. El virus fue compatible con ocho agroquímicos evaluados y presentó una actividad insecticida superior a 80%. Cuando el bioplaguicida fue almacenado a 8, 18 y 28 °C, la actividad insecticida y el contenido de contaminantes se mantuvieron dentro de los límites de aceptación establecidos para estos parámetros. Con base en los resultados obtenidos se recomendó el almacenamiento del bioplaguicida a base del Sf NPV003 en temperaturas inferiores a 28 °C, lo que garantiza la calidad del producto durante mínimo 17 meses, tiempo adecuado para su distribución y uso.
Palabras claves: baculovirus, fungicidas, gusano cogollero, insecticida biológico, insecticidas, vida útil.
ABSTRACT
A Colombian isolate of Spodoptera frugiperda nucleopolyhedrovirus Sf NPV003 was formulated as a powder by microencapsulating it with a methacrylic acid polymer, which increased the photostability of the virus. In order to generate recommendations for the use of this biopesticide, the objective of this study was to establish in vitro compatibility with chemicals (insecticides and fungicides) and to determine the product stability during 15 months at 8 °C, 18 °C and 28 °C. The virus was compatible with eight chemicals tested, with an insecticidal activity greater than 80%. When the biopesticide was stored at 8 °C, 18 °C and 28 °C, the insecticidal activity and the content of contaminants were within acceptance limits established for each property. Results indicated that microencapsulated Sf MNPV can be stored at temperatures below 28 °C, thus ensuring product quality for at least 17 months, enough time for its distribution and use.
Key words: baculovirus, fungicides, fall armyworm, biological insecticide, insecticides, shelf-life.
INTRODUCCIÓN
Entre las limitantes fitosanitarias de mayor impacto asociadas al cultivo de maíz (Zea mays L.), se destaca el gusano cogollero Spodoptera frugiperda (J.E. Smith, 1797) (Lepidoptera: Noctuidae), considerado el insecto plaga más importante del cultivo en Centroamérica y Sudamérica (Farias et al., 2008). En Colombia, este insecto afecta otros cultivos como sorgo, arroz, caña de azúcar, algodón, tomate de huerta, melón y girasol (De Polanía et al., 2007; ICA, 2008). En la actualidad, se estima que puede reducir los rendimientos del cultivo de maíz hasta en 60%, debido a su amplia distribución y a su gran número de hospederos ( ICA, 2008).
Tradicionalmente, el control de este insecto se realiza con productos químicos como los organofosforados, los carbamatos y los piretroides, compuestos altamente tóxicos (Morillo y Notz, 2001; De Polanía et al., 2007). Como una alternativa ecológicamente sostenible surge el control biológico mediante el uso de virus entomopatógenos (baculovirus), microorganismos con un potencial interesante para ser incluidos en programas de manejo integrado de plagas (MIP) (Szewczyk et al., 2006). Dentro de la familia Baculoviridae, se encuentran los alfabaculovirus que han demostrado una alta efectividad contra diferentes especies de Spodoptera sp., tanto en cultivos agrícolas como en ecosistemas agroforestales (Caballero y Murillo, 2009; Moscardi, 1999).
Los alfabaculovirus se caracterizan por que los viriones se encuentran incluidos dentro de una matriz proteica denominada cuerpo de inclusión (CI), que tiene forma poliédrica y los protege de condiciones ambientales adversas (Caballero et al., 2001). A pesar de la formación de los CI, una de las principales limitantes del uso de estos virus como bioinsecticidas es su susceptibilidad a factores ambientales como la radiación ultravioleta, la temperatura, la humedad, el pH y las condiciones de almacenamiento (Tamez-Guerra et al., 2006; Sajap et al., 2009), factores que en conjunto limitan el uso y la comercialización de dichos productos (Ravensberg, 2011). Con base en estas limitantes, es necesario desarrollar sistemas de producción y formulación que permitan contar con productos de igual o mayor eficacia que los productos químicos; dos de los requisitos para la aceptación y comercialización de un producto biológico son su compatibilidad con agroquímicos y su estabilidad en condiciones de almacenamiento (Szewczyk et al., 2005; ICA, 2011) .
Teniendo en cuenta el potencial de los nucleopoliedrovirus para el control de S. frugiperday que en Colombia no existe ningún producto biológico registrado para tal fin (ICA, 2013), el aislamiento colombiano codificado como Sf NPV003, perteneciente a la colección de trabajo del Laboratorio de Control Biológico de Corpoica, fue seleccionado para el desarrollo de un bioplaguicida debido a su alta patogenicidad (Gómez et al., 2010). La formulación consiste en un polvo mojable (wettable powder -WP-) donde el virus fue microencapsulado usando un copolímero del ácido metacrílico, proceso que aumentó cuatro veces la foto-estabilidad del virus (Villamizar et al., 2010).
Con el fin de generar las recomendaciones para el uso de este bioplaguicida, el objetivo del presente trabajo fue establecer la compatibilidad in vitro con insecticidas y fungicidas químicos que se utilizan con mayor frecuencia en el cultivo de maíz y determinar la estabilidad del producto mediante la estimación de su vida útil, a las temperaturas de 8 °C, 18 °C y 28 °C durante 15 meses de almacenamiento.
MATERIALES Y MÉTODOS
Propagación viral
Para obtener la cantidad requerida de inóculo viral, se utilizaron larvas de tercer ínstar de S. frugiperdaobtenidas a partir de una colonia mantenida en condiciones de laboratorio, que fueron establecidas a partir de huevos y larvas colectadas de un cultivo de maíz en el Tolima (Colombia). Esta colonia fue renovada con insectos obtenidos en campo cada seis meses (F6). Las larvas fueron mantenidas a 28 ± 2 °C, a 60% de humedad relativa (RH) y con un fotoperiodo natural de 12:12 h (luz:oscuridad) en una dieta semisintética basada en germen de trigo, descrita por Greene et al. (1976). Las larvas se colocaron individualmente en vasos plásticos de 15 mL, en los cuales se adicionaron 10 µL de una suspensión viral (Sf NPV003) a una concentración de 1,0 x 107 CI/mL y una vez consumido el inóculo viral se adicionó un cubo de dieta semisintética (Gómez et al., 2010). Los recipientes se incubaron a 28 ± 2 °C y a partir del quinto día se realizó la recolección de larvas muertas que presentaron sintomatología típica de infección viral.
Principio activo
Las larvas infectadas obtenidas de la propagación viral de Sf NPV003 se homogenizaron con un Ultra-Turrax; la suspensión obtenida se filtró por una muselina estéril con el fin de eliminar el tejido del insecto y posteriormente se cuantificó mediante recuento en cámara de Neubauer el número de CI. La suspensión viral se liofilizó a -50 °C durante 48 horas, obteniéndose una humedad final inferior a 5%.
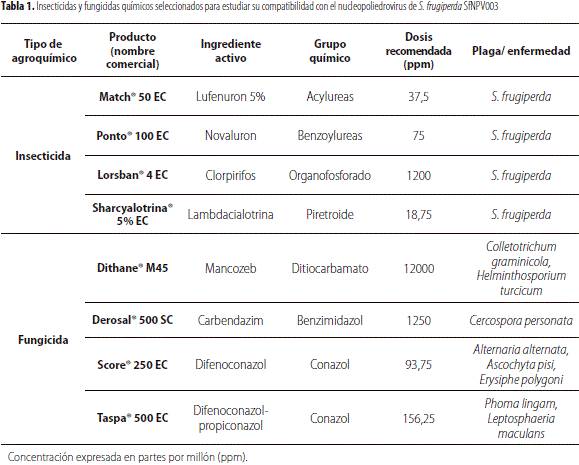
Compatibilidad con agroquímicos
Para la prueba de compatibilidad con agroquímicos, se seleccionaron 4 insecticidas y 4 fungicidas (tabla 1) comúnmente utilizados en el cultivo de maíz. Se tomaron 5 mL del virus purificado a una concentración de 2 x 108 CI/mL y se mezclaron con 5 mL de cada uno de los productos a evaluar, ajustando la concentración al doble de la dosis recomendada. Las mezclas se incubaron a 20 °C durante 24 h en un baño termostatado. Como tratamiento control se utilizó el virus mezclado con agua.
Purificación del nucleopoliedrovirus mezclado con los agroquímicos
Para garantizar que la mortalidad obtenida en los bioensayos es causada únicamente por la infección del Sf NPV003 y no por la mezcla con los agroquímicos, se realizó una purificación, para lo cual cada mezcla se centrifugó a 12000 rpm durante 30 minutos a 10 °C, recuperándose el sedimento que se resuspendió en 1 mL de tampón tris (pH 7,4; 0,1 M) y se ubicó sobre una solución de sacarosa de 60%. La muestra se centrifugó nuevamente a 12000 rpm durante 30 minutos y se recuperó el sedimento formado, el cual corresponde al virus. Por último se realizaron 10 lavados con agua destilada, se resuspendió el sedimento en 500 µL de agua destilada estéril y posteriormente se ajustó la concentración a 4,0 x 107 CI/mL.
Evaluación del efecto de agroquímicos sobre la actividad biocontroladora de Sf NPV003
La actividad insecticida del nucleopoliedrovirus Sf NPV003 purificado se evaluó mediante el método de la gota (Hughes y Wood, 1981). Para tal fin, cada tratamiento se mezcló en una proporción 50:50 con una solución de sacarosa al 4% y azul de alimentos al 1% obteniendo una concentración viral final de 2,0 x 107 CI/mL. A partir de esta suspensión se dispensaron gotas de 2 µL en forma circular en un disco plástico de color blanco. Posteriormente, se ubicaron en el interior del círculo 60 larvas de 24 h de edad de S. frugiperda sometidas a 12 h de ayuno. Mediante observación al estereoscopio, se seleccionaron 45 larvas que presentaron coloración azul como consecuencia de la ingestión del tratamiento (virus + colorante) y se ubicaron individualmente en recipientes plásticos de 15 mL que contenían un cubo de dieta semisintética. Cada tratamiento contó con tres repeticiones, cada una compuesta por 15 unidades experimentales, las cuales consistieron en un recipiente plástico con una larva neonata de S. frugiperda. Se contó con un testigo absoluto que consistió en larvas de 24 h de edad de S. frugiperda que no fueron sometidas a ningún tratamiento. Siete días después se determinó la mortalidad y se calculó la eficacia mediante la fórmula de Schneider - Orelli (Zar, 1999).
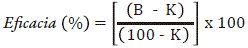
Donde K es el porcentaje de mortalidad en el testigo y B es el porcentaje de mortalidad en el tratamiento.
Estudio de estabilidad en condiciones de almacenamiento
Elaboración del bioplaguicida
El polvo obtenido después de liofilizar la suspensión viral fue utilizado como núcleo central en el proceso de microencapsulación y para tal fin fue mezclado con una solución del copolímero del ácido metacrílicoEudragit® S100. Esta mezcla de polímero y núcleo se utilizó para el procesodemicroencapsulaciónutilizandolametodología descrita por Villamizar et al. (2010) con modificaciones, ya que las microcápsulas fueron secadas por liofilización.
Estabilidad en condiciones de almacenamiento
Para un lote de bioplaguicida se empacaron muestras de 0,5 g en bolsas metalizadas de 2 cm de ancho x 4 cm de largo y se sellaron al vacío. Como tratamiento control se utilizó virus liofilizado sin formular. Treinta muestras de cada tratamiento se almacenaron en incubadoras ajustadas a las temperaturas correspondientes a 8±2 °C, 18±2 °C y 28±2 °C. El contenido de contaminantes (bacterias, mohos y levaduras) y la actividad insecticida fueron los parámetros evaluados al producto manufacturado después de 3, 9 y 15 meses de almacenamiento.
Para medir el contenido de contaminantes, a una de las muestras se adicionaron 9 mL de Tween 80® al 0,1% y se realizaron diluciones decimales hasta 10-5. De las tres últimas diluciones se sembraron 100 µL en cajas de Petri: para la evaluación de mohos en medio agar-papa- dextrosa suplementado con Tritón al 0,1% (agar PDA + Tritón), para la cuantificación de levaduras en medio agar extracto de levadura y malta (agar YM), y para el recuento de bacterias contaminantes en medio agar nutritivo. Cada dilución se sembró por triplicado. El resultado se expresó como recuento de unidades formadoras de colonia de contaminantes por gramo de producto (UFC/g ). La determinación de la actividad insecticida se realizó mediante la metodología anteriormente descrita. El diseño experimental fue completamente al azar, con medidas repetidas en el tiempo y todas las mediciones se realizaron por triplicado.
Análisis de resultados
La normalidad y homocedasticidad de los resultados se determinaron mediante las pruebas de Shapiro Wilks (95%) y Bartlett (95%) respectivamente. Una vez demostrados estos principios, se aplicó a un análisis de varianza (anova) y a una prueba de comparación de medias de Tukey (95%) utilizando el programa Statistix versión 8.1 (Analytical Software, Florida, USA). La variable eficacia obtenida en el estudio de estabilidad se correlacionó con el tiempo utilizando diferentes modelos matemáticos para determinar la vida útil del bioplaguicida a base del nucleopoliedrovirus de S. frugiperda Sf NPV003, que se definió como el tiempo en el cual la eficacia fue igual a 80%. En esta investigación se evaluaron los modelos descritos por Santos et al. (2012):
Orden cero: 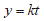
Primer orden: 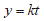
Segundo orden: 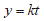
Modelo de Higuchi: 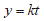
Modelo de Kosmeyer and Peppas: 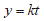
Modelo polinomial: 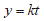
Donde: y corresponde a la variable eficacia, t al tiempo de almacenamiento y k a una constante.
RESULTADOS Y DISCUSIÓN
Compatibilidad con agroquímicos
Los resultados del efecto de los ocho agroquímicos evaluados sobre la actividad insecticida de Sf NPV003 se describen en la tabla 2. El rango de la eficacia del virus expuesto tanto a los insecticidas como a los fungicidas fue de 88,6% a 100%; lo cual evidenció que el nucleopoliedrovirus no mostró incompatibilidad con ninguno de los agroquímicos empleados, ya que no se presentaron diferencias significativas entre el virus mezclado con los tratamientos y el virus usado como control, mezclado con agua (F = 0,85; gl = 8; p = 0,5727).
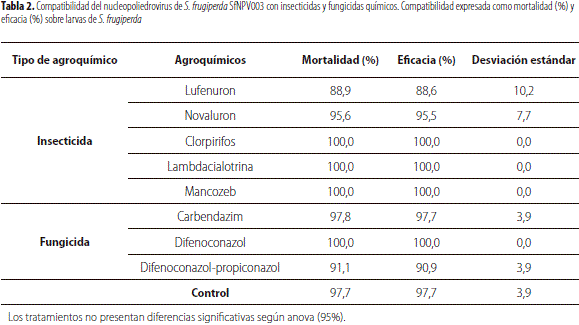
La estabilidad del nucleopoliedrovirus ante los agroquímicos empleados posiblemente se deba a la protección brindada por los cuerpos de inclusión que lo hace estable durante largos periodos de tiempo, asegurando una alta resistencia a los efectos de factores como el agua, agentes químicos y fenómenos físicos como deshidratación, radiación y cambios bruscos de temperatura ( Jacques y Morris, 1981; Benz, 1987). Dicho efecto protector también fue observado por Gómez y Villamizar (2009), al evaluar la compatibilidad de un granulovirus aislado de Tecia solanivora(Lepidoptera: Gelechiidae) con ocho agro- químicos, donde no se detectaron diferencias significativas entre los tratamientos en los que el virus fue expuesto a los agroquímicos, ni entre éstos y el virus puro no expuesto; esto sugiere la compatibilidad con los productos evaluados.
Batista et al. (2001) encontraron resultados semejantes donde un baculovirus de Anticarsia gemmatalis (AgNPV) fue compatible después de 12 horas de contacto con el insecticida Thiamethoxam. Igualmente, Jacques y Morris (1981) demostraron que de diez combinaciones de virus con plaguicidas, nueve resultaron en un efecto sinérgico en la mortalidad del insecto. Moscardi y Sosa-Gómez (1992) no observaron reducción en la actividad insecticida del AgNPV mezclado con varios insecticidas, al igual que Crébio y Melhorança (1999), quienes concluyeron que los herbicidas ensayados en campo no interfirieron con la eficacia de AgNPV en el control de la oruga de las leguminosas A. gemmatalis.
El uso combinado del nucleopoliedrovirus Sf NPV003 con fungicidas e insecticidas se convierte en una herramienta clave en el desarrollo de MIP, considerando que las enfermedades y los insectos plaga llegan a afectar entre 11% y 44% del área total sembrada de maíz en los trópicos bajos, causando altas pérdidas económicas y siendo necesario el uso de diferentes productos para el manejo fitosanitario de este cultivo. Teniendo en cuenta que los agroquímicos evaluados en el presente trabajo no ejercieron ningún efecto perjudicial en la acción insecticida del nucleopoliedrovirus Sf NPV003, se puede recomendar su intervención en estrategias de manejo integrado, donde se reemplacen los insecticidas para el control del cogollero por el bioplaguicida a base de baculovirus.
Estabilidad en condiciones de almacenamiento
Contenido de contaminantes
El bioplaguicida recién manufacturado presentó un contenido de contaminantes bacterianos inicial de 1,40 x 104 UFC/g de producto, el cual disminuyó significativamente a través del tiempo (F = 19,9; gl = 11; p <0,0001) (tabla 3), lo que indica que no se presentó crecimiento bacteriano sino una reducción en la viabilidad de los microorganismos contaminantes.
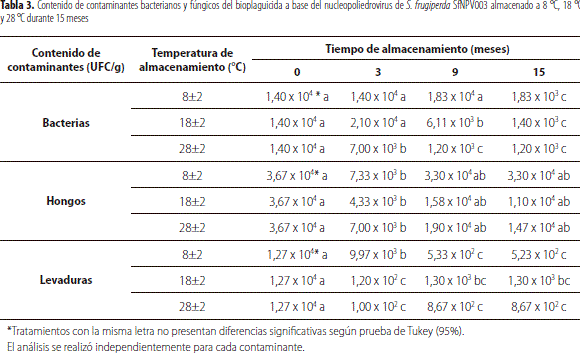
El contenido de contaminantes fúngicos incluyendo mohos y levaduras presentó un comportamiento similar. El bioplaguicida recién manufacturado presentó un contenido de mohos contaminantes de 3,67 x 104 UFC/g de producto y un contenido de levaduras de 1,27 x 104 UFC/g (tabla 3), valores que disminuyeron a través del tiempo de almacenamiento a las diferentes temperaturas (tabla 3). En general, los tres tipos de contaminantes cuantificados en el producto (bacterias, mohos y levaduras) se mantuvieron durante los 15 meses de almacenamiento para las tres temperaturas, en valores inferiores al límite máximo de aceptación establecido en la caracterización del producto (106 UFC/g) (Gómez et al., 2013), lo que permite sugerir que este parámetro fue estable durante el tiempo y no afectó la calidad microbiológica del bioplaguicida durante su vida de anaquel.
La contaminación microbiana inicial del producto pudo ser aportada por el ingrediente activo viral cuya producción se realiza en condiciones in vivo, lo que genera una carga importante de bacterias y hongos saprófitos que colonizan las dietas, la superficie del insecto, el intestino y las heces del mismo (Caballero et al., 2001). Jenkins y Grzywacz (2000) y Guillon (1997) argumentan que la mayoría de estos microorganismos son generalmente especies comunes de Pseudomonas, Enterococcus, especies coliformes de la familia Enterobacteriaceae y Bacillus cereus.
La estabilidad del contenido de contaminantes a través del tiempo posiblemente se debió a la baja humedad del producto (1,84%) y a la poca disponibilidad de nutrientes presentes en la formulación. Según Costa et al. (2002), una baja humedad (inferior al 5%) estabiliza los microorganismos debido a que entran en un estado de latencia donde el metabolismo disminuye significativamente. Este comportamiento favorece la estabilidad del bioplaguicida porque las bacterias contaminantes, al presentar una actividad metabólica baja, reducen la producción de metabolitos de carácter ácido o básico que podrían causar la proteólisis de los cuerpos de inclusión, afectando directamente la eficacia del producto (Jenkins y Grzywacz, 2000). En la actualidad, para los productos a base de los baculovirus no existen estándares de calidad internacionalmente aceptados por la industria o por los entes regulatorios (Ravensberg, 2011).
Actividad insecticida
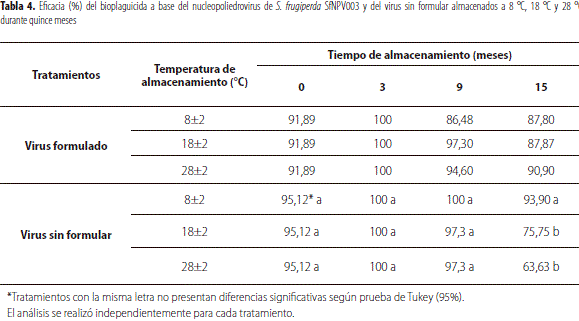
El bioplaguicida recién manufacturado presentó una eficacia de 91,89%, valor que no fue significativamente diferente al presentado por el virus liofilizado sin formular (94,4%) (F = 0,23; gl = 1; P = 0,6574). Este resultado sugiere que la formulación no mejoró la actividad insecticida del virus, pero tampoco tuvo un efecto negativo sobre ésta, lo que indica que durante el desarrollo del producto se realizó una selección adecuada de excipientes compatibles y se ajustaron las condiciones del proceso para no generar inactivación de las partículas virales (Villamizar et al., 2010).
El comportamiento de la eficacia del bioplaguicida y del virus sin formular almacenados durante 15 meses a 8 °C, 18 °C y 28 °C se describe en la tabla 4, donde se puede observar que el producto formulado no presentó una disminución significativa en la actividad insecticida durante los quince meses del estudio (F = 1,11; gl = 11; P = 0,3952). Por el contrario, el virus liofilizado sin formular presentó una reducción significativa de la eficacia (F = 11,3; gl = 11; P < 0,0001) en el mes quince de almacenamiento a las temperaturas de 18 °C y 28 °C, con valores de 75,76% y 63,63% respectivamente (tabla 4). Este resultado indica que el producto formulado mejoró la estabilidad biológica del virus, manteniéndolo activo mínimo durante los 15 meses, sin evidenciarse un efecto de la temperatura, mientras que el virus liofilizado sin formular solo se mantuvo estable durante nueve meses a 18 °C y 28 °C. Esta mayor estabilidad de un baculovirus formulado con respecto al sin formular también fue evidenciada por Batista et al. (2001), quienes evaluaron el nucleopoliedrovirus de Anticarsia gemmatalissin formular y dos formulaciones diseñadas como un concentrado emulsionable (CE) y un polvo mojable (WP). Los autores evidenciaron que después de 20 meses de almacenamiento el CE causaba una mortalidad cercana a 80%, mientras que el virus sin formular mostró una reducción de 40% en la actividad biológica después del mismo tiempo de almacenamiento.
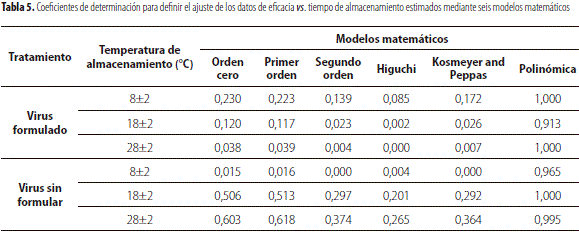
Para estimar la vida útil del bioplaguicida a base del Sf NPV, se evaluó el ajuste de la eficacia versus el tiempo de almacenamiento con varios modelos matemáticos (tabla 5). El mejor ajuste correspondió al modelo polinomial (tablas 5 y 6) de forma similar a lo observado en trabajos previos con otros bioproductos (Lahlalia et al., 2006; Santos et al., 2012). Una vez definido el modelo más adecuado para interpretar el comportamiento de los datos, se procedió a establecer la vida útil de los productos calculando, mediante la ecuación determinada, el tiempo en el cual la eficacia alcanza un valor igual a 80%. Este límite se definió con base en lo recomendado por diferentes autores como Jenkins y Grzywacz (2000), Villamizar et al. (2005) y Ravensberg (2011), quienes establecieron que, para garantizar la calidad y eficacia de bioplaguicidas a base de baculovirus durante el almacenamiento, se requiere una actividad biocontroladora expresada como eficacia mínima de 80%.

Los valores de vida útil estimados para el bioplaguicida a base de Sf NPV y para el virus sin formular se muestran en la tabla 6, donde se observa que los mayores tiempos de vida útil se obtuvieron a la temperatura de almacenamiento de 8 °C, con valores de 23,4 meses y 20,7 meses respectivamente; y en la temperatura más alta evaluada se obtuvieron las menores vidas útiles. Behle et al. (2003) encontraron un comportamiento similar para una formulación del nucleopoliedrovirus de A. falcifera (Af MNPV), que presentó una vida útil de 30 meses almacenado a 4 °C y de 3 meses cuando se almacenó a 30 °C.
El efecto positivo de la formulación sobre un baculovirus durante el tiempo de almacenamiento también fue observado por Quiroga et al. (2011), quienes evaluaron la estabilidad de la actividad insecticida del granulovirus de Phthorimaea operculella formulado como un granulado dispersable (WG) y un concentrado emulsionable. Los autores encontraron que el virus formulado utilizando los dos sistemas de entrega presentó una alta estabilidad cuando se almacenó a 6 °C y 20 °C, manteniendo su eficacia por encima de 80% por 6 meses, resultado que se atribuyó a la adecuada selección de los excipientes utilizados en la formulación.
El bioplaguicida a base del nucleopoliedrovirus (SfNPV003) evaluado en el presente estudio es competitivo comparado con los disponibles comercialmente y se recomendaría su almacenamiento a temperaturas inferiores a 28 °C hasta por 17 meses, tiempo durante el cual se garantiza su calidad microbiológica y su actividad insecticida. Teniendo en cuenta que a escala mundial existen varios productos a base de baculovirus como Elcar®, Biovirus-H®, TM Biocontrol-1®, Spod-X® y Spodo-lure®, para los cuales los fabricantes estimaron una vida útil de entre un año y dos años a temperaturas entre 4 °C y 25 °C (Copping, 2009).
CONCLUSIONES
El bioplaguicida a base del nucleopoliedrovirus de S. frugiperda(Sf NPV003) presenta un alto potencial para ser incluido dentro de programas de manejo integrado del cultivo de maíz, dado que es compatible con los agroquímicos comúnmente empleados para este. Además, el bioplaguicida es estable hasta 17 meses en condiciones de almacenamiento sin necesidad de refrigeración, lo cual le otorga una ventaja competitiva frente a bioproductos a base de hongos o bacterias cuya vida útil es inferior a estos períodos y requieren cadena de frío para su distribución y comercialización.
REFERENCIAS
Batista A, Almeida J, Lamas C. 2001. Effect of Thiamethoxam on Entomopathogenic Microorganisms. Neotrop. Entomol. 30:437-447. [ Links ]
Batista A, Alves SB, Augusto N, Pereira RM, Alves L. 2001. Stability and persistence of two formulations containing Anticarsia gemmatalis nuclear polyhedrovirus (AgMNPV). Neotrop. Entomol. 30:411-416. [ Links ]
Behle RW, Tamez-Guerra P, McGuire MR. 2003. Field activity and storage stability of Anagrapha falcifera Nucleopolyhedrovirus (Af MNPV) in spray-dried lignin-based formulations. J. Econ. Entomol. 96:1066-1075. [ Links ]
Benz G. 1987. Environment. In: Epizootiology of infectious diseases. Editors: Fuxa J, Tanada Y. New York, USA. p. 150. [ Links ]
Caballero P, Murillo R. 2009. El nucleopoliedrovirus de Spodoptera exigua (Lepidoptera: Noctuidae) como bioplaguicida: análisis de avances recientes en España. Rev. Colomb. Entomol. 35:105-115. [ Links ]
Caballero P, Williams T, López-Ferber M. 2001. Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Madrid, España, Phytoma. [ Links ]
Copping L. 2009. The Manual of Biocontrol Agents, The Biopesticide Manual. 4th ed. Hampshire, Reino Unido: The British Crop Protection Council. [ Links ]
Costa E, Usall J, Teixidó N, Torres R, Viñas I. 2002. Effect of package and storage conditions on viability and efficacy of the freeze-dried biocontrol agent Pantoea agglomerans strain CPA-2. J. Appl. Microbiol. 92:873-878. [ Links ]
Crébio JA, Melhorança A. 1999. Eficiência do vírus de poliedrose nuclear em mistura com herbicidas pósemergentes, no controle de Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae). An. da Soc. Entomológica do Bras. 28:339-341. [ Links ]
De Polanía I, Arévalo H, Mejía R. 2007. El gusano cogollero del maíz Spodoptera frugiperda (J. E. Smith) (Lepidoptera:Noctuidae) y algunas plantas transgénicas. Rev. Colomb. Ciencias Hortícolas 1:103-113. [ Links ]
Farias PR, Barbosa J, Busoli C, Overal W, Miranda V, Ribeiro S. 2008. Spatial analysis of the distribution of Spodoptera frugiperda (J. E. Smith) (Lepidoptera: Noctuidae) and losses in maize crop productivity using geostatistics. Neotrop. Entomol. 37:321-327. [ Links ]
Gómez J, Guevara E, Barrera G, Cotes AM, Villamizar L. 2010. Aislamiento, identificación y caracterización de nucleopoliedrovirus nativos de Spodoptera frugiperda en Colombia. Rev. Fac. Nac. Agron. 63:5511-5520. [ Links ]
Gómez J, Guevara J, Cuartas P, Espinel C, Villamizar L. 2013. Microencapsulated Spodoptera frugiperda nucleopolyhedrovirus: insecticidal activity and effect on arthropod populations in maize. Biocontrol Sci. Technol. 23:829-846. [ Links ]
Gómez J, Villamizar L. 2009. Actividad insecticida y compatibilidad con agroquímicos de un granulovirus aislado de Tecia solanivora (Lepidoptera: Gelechiidae). Resúmenes del XXXVII Congreso Sociedad Colombiana de Entomología - Socolen -. Bogotá. p. 116. [ Links ]
Greene G, Leppla N, Dickerson W. 1976. Velvetbean caterpillar (Lepidoptera : Noctuidae) rearing procedure and artificial medium. Journal of Economic Entomolog y 69:487-488. [ Links ]
Guillon M. 1997. Quantification of biopesticide activity - a rapid survey of methods and standardization problems. EPPO Bull. 27:123-125. [ Links ]
Hughes P, Wood H. 1981. A synchronous peroral technique for the bioassay of insect viruses. Journal of Invertebrate Patholog y. 37(2): 154-159. [ Links ]
Instituto Colombiano Agropecuario (ICA). 2008. Resolución ICA No. 000879. Colombia. Instituto Colombiano Agropecuario (ICA). 2011. Resolución 0698 del 4 de febrero de 2011. Colombia. [ Links ]
Instituto Colombiano Agropecuario (ICA). 2013. Bioinsumos registrados al 20 de junio de 2013. En: http://www.ica.gov.co/Areas/Agricola/Servicios/Fertilizantes-y-Bio-insumos-Agricolas/Listado-de-Bioinsumos/2009/Productos-bioinsumos-mayo-13-de-2008.aspx. Consultado: marzo 2014. [ Links ]
Jacques R, Morris O. 1981. Compatibility of pathogens with other methods of pest control and crop protection. En: Burges HD, editor. Microbial Control of Pests and Plant Diseases. London, Academic Press. p. 230. [ Links ]
Jenkins NE, Grzywacz D. 2000. Quality control of fungal and viral biocontrol agents - assurance of product performance. Biocontrol Sci. Technol. 10:753-777. [ Links ]
Lahlalia R, Serrhinib M, Jijakl M. 2006. Studying and modelling the combined effect of temperature and water activity on the growth rate of P. expansum. Int. J. Food Microbiol. 103:315-322. [ Links ]
Morillo F, Notz A. 2001. Resistencia de Spodoptera frugiperda (Smith) (Lepidoptera : Noctuidae) a lambdacihalotrina y metomil. Entomotropica 16:79-87. [ Links ]
Moscardi F, Sosa-Gómez D. 1992. Use of viruses against soybean caterpillars in Brazil. In: Copping MB, Green M, Rees R, editors. Pest management in soybean. London, Elsevier Applied Science. p. 369. [ Links ]
Moscardi F. 1999. Assessment of the application of baculoviruses for control of Lepidoptera. Annu. Rev. Entomol. 44:257-289. [ Links ]
Quiroga I, Gómez M, Villamizar L. 2011. Estabilidad de formulaciones a base de granulovirus para controlar Tecia solanivora (Lepidoptera: Gelechiidae) en campo. Rev. Colomb. Entomol. 37:27-35. [ Links ]
Ravensberg W. 2011. A roadmap to the successful development and commercialization of microbial pest control products for control of arthropods. Springer Netherlands. London. U.K. p. 410. [ Links ]
Sajap A, Bakir M, Kadir H, Samad K. 2009. Efficacy of selected adjuvants for protecting Spodoptera litura nucleopoliedrovirus from sunlight inactivation. J. Asia-Pacif Entomol. 12:85-88. [ Links ]
Santos A, García M, Cotes AM, Villamizar L. 2012. Efecto de la formulación sobre la vida útil de bioplaguicidas a base de dos aislamientos colombianos de Trichoderma koningiopsisTh003 y Trichoderma asperellum Th034. Rev. Iberoam. Micol. 29:150-156. [ Links ]
Szewczyk B, Hoyos-Carvajal L, Paluszek M, Skrzecz I, Lobo de Souza M. 2006. Baculoviruses re-emerging biopesticides. Biotechnol. Adv. 24:143-160. [ Links ]
Szewczyk B, Souza ML, Elita M, Castro B, Moscardi ML, Moscardi F. 2005. Baculovirus Biopesticides. In: Stoytcheva M, editor. Pesticides - Formulations, Effects, Fate. 2nd ed. New York, USA: inTech. p. 450. [ Links ]
Tamez-Guerra P, Zamudio V, Martínez J. 2006. Formulaciones granulares de baculovirus en combinación con abrillantadores ópticos para su empleo como bioinsecticida. Cienc. UANL IX:149-156. [ Links ]
Villamizar L, Barrera G, Cotes AM, Martínez F. 2010. Eudragit S100 microparticles containing Spodoptera frugiperda nucleopolyehedrovirus: physicochemical characterization, photostability and in vitro virus release. J. Microencapsulation 27:314-324. [ Links ]
Villamizar L, Zeddam JL, Espinel C, Cotes AM. 2005. Implementación de técnica de control de calidad para la producción de un bioplaguicida a base del granulovirus de Phthorimaea operculellaPhopGV. Rev. Colomb. Entomol. 31:127-132. [ Links ]
Zar J. 1999. Biostatistical Analysis. 4a. ed. New Jersey, Estados Unidos: Prentice Hall. [ Links ]













