Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.15 no.2 Mosquera July/Dec. 2014
SANIDAD VEGETAL Y PROTECCIÓN DE CULTIVOS
1 I.A. Grupo de Investigación de Sanidad Vegetal. Universidad de Nariño, Pasto, Colombia. christianer90@hotmail.com
2 I.A. Grupo de Investigación de Sanidad Vegetal. Universidad de Nariño, Pasto, Colombia. jacor630@hotmail.com
3 I.A. MSc. Grupo de Investigación de Sanidad Vegetal. Universidad de Nariño, Pasto, Colombia. claudiasalazarg@yahoo.com
4 I.A. MSc Grupo de Investigación de Sanidad Vegetal. Universidad de Nariño, Pasto, Colombia. cbet70@yahoo.com
Fecha de recepción: 09/12/2013. Fecha de aceptación: 03/03/2014
RESUMEN
El amarillamiento de arveja (Pisum sativum L.), causado por Fusarium oxysporumf. sp. pisi), es la enfermedad más limitante de este cultivo. Este estudio se desarrolló en el laboratorio de fitopatología, invernadero y granja experimental Botana de la Universidad de Nariño; su objetivo fue evaluar la capacidad antagónica del hongo Trichoderma sobre F. oxysporum. El aislamiento de F. oxysporum se realizó a partir de tejido enfermo; las cepas de Trichoderma se obtuvieron de la rizósfera de plantas sanas (colectadas en los municipios de Potosí, Córdoba, Gualmatán, Ipiales y Puerres, Nariño, Colombia) y de una cepa comercial del laboratorio Perkins Ltda. En laboratorio, se utilizó un diseño irrestrictamente al azar con 21 tratamientos (cepas). Se evaluó el crecimiento micelial y halo de inhibición en siembras duales, que sirvieron como criterio de selección para pruebas en invernadero, donde se evaluaron la altura de planta, longitud de raíces, materia seca de raíces y porcentaje de incidencia. En campo se usó un diseño de bloques al azar, para evaluar componentes de rendimiento, altura de la planta y longitud de raíz con las mejores cepas. En laboratorio, se seleccionaron C2 (Córdoba 2), C7 (Gualmatán 3), C14 (Puerres 2), C20 (Potosí 4) y C21 (Lab. Perkins) por presentar mejor actividad antagonística; en invernadero, C7, C14 y C21 fueron las cepas más antagonísticas; en campo, se obtuvieron diferencias significativas entre C14 y C21, respecto a C7 y el testigo. Las cepas C14 y C21 tienen capacidad antagónica consistente y pueden usarse en el manejo del hongo F. oxysporumen arveja.
Palabras claves: antagonismo, control biológico, patógeno del suelo, Pisum sativum L.
ABSTRACT
The yellowing of pea caused by the fungus Fusarium oxysporum f. sp. pisi is considered the most damaging disease of this crop. This study took place at the plant health laboratory and greenhouse of the Universidad de Nariño, and the experimental stage was conducted at the Granja experimental Botana. Its purpose was to evaluate the antagonistic ability of the fungi Trichoderma spp. to F. oxysporum. Isolation of F. oxysporumwas made from diseased tissue; Trichoderma strains were obtained from the rhizosphere of healthy plants (collected in the towns of Potosi, Córdoba, Gualmatán, Ipiales and Puerres in the state of Nariño, Colombia), and a commercial strain from laboratory Perkins Ltda. In laboratory, unrestrictedly randomized design with 21 treatments (strains) was used. Mycelial growth and inhibition zone were evaluated in dual plantings, which served as selection criteria for greenhouse test where plant height, root length, root dry matter and percentage of incidence were evaluated. In the field, a randomized block design was used to evaluate yield components, plant height and root length with the best strains. In the laboratory, C2 (Córdoba 2), C7 (Gualmatán 3), C14 (Puerres 2), C20 (Potosi 4) and C21 (Perkins Lab.) showed antagonistic activity in the greenhouse, C7, C14 and C21 were the best; in field, significant differences between C14 and C21, compared to C7 and the control, were obtained. Strains C14 and C21 have consistent antagonistic capacity and can be used to control F. oxysporumin pea.
Key words: biological control, soil pathogen, antagonism, Pisum sativum L.
INTRODUCCIÓN
El cultivo de arveja (Pisum sativum L.) en Colombia ha sido por varios años el regulador de la economía de pequeños y medianos productores de zonas andinas y su producción se concentra en Cundinamarca, Boyacá, Nariño y Tolima (Ministerio de Agricultura y Desarrollo Rural, 2012). La arveja se cultiva en minifundios localizados principalmente en zonas de ladera, con temperaturas promedio entre 12 y 18 °C (Nutrimon, 2007). Esta leguminosa se adapta a una gran variedad de suelos como los franco arenosos e incluso los franco arcillosos, siempre y cuando éstos presenten un buen drenaje (Fenalce, 2012).
En Nariño, se cultivan diferentes variedades entre las que sobresalen Andina, Sindamanoy, San Isidro, Piquinegra y Santa Isabel por el área de siembra. En este estudio se utilizó la variedad Santa Isabel que se adapta entre 2400 y 2700 msnm y se cosecha entre los 115 y 150 días en grano verde y a los 170 días en grano seco. Su rendimiento comercial en vaina verde varía desde 4000 a 8000 kg/ha (Fenalce, 2012; Buitrago et al., 2006).
El área cultivada de arveja en Nariño durante el 2011 fue de 13809 ha, con una producción de 60178 t y un rendimiento de 4,4 t/ha en vaina verde (Ministerio de Agricultura y Desarrollo Rural, 2012).
El rendimiento del cultivo puede ser afectado por diferentes problemas fitosanitarios; según Tamayo (2000) la limitante en la producción de arveja en Colombia es la enfermedad denominada marchitez vascular, causada por F. oxysporum; y en el departamento de Nariño se encuentran afectados los municipios de mayor producción de arveja como: Ipiales, Puerres, Potosí, Córdoba y Gualmatán (Sañudo et al., 2007).
El hongo ataca diferentes variedades de plantas y es capaz de sobrevivir en los rastrojos de cultivos anteriores y permanecer en el suelo por varios años (Argüello et al., 2007). Fusarium sp. crece casi en cualquier grado de humedad del suelo, pero las condiciones muy húmedas reducen su infección debido a la presencia de bacterias anaeróbicas (Ocaña, 2008).
Los síntomas de la enfermedad causada por Fusarium sp. generalmente se observan en etapas cercanas a la floración; las plantas son raquíticas, con un amarillamiento blanquecino ascendente, con posterior marchitamiento.
En los tejidos internos de las raíces y de la base del tallo, se observa una pudrición seca de coloración rojiza (Sañudo et al., 2007), causada por las toxinas producidas por el hongo, ya que el xilema es obstruido causando la muerte de la planta (Booth, 1971; Nelson, 1983).
La baja eficiencia de productos químicos para el control de esta enfermedad promueve la búsqueda de otras alternativas como el control biológico. Una respuesta positiva es la utilización de microorganismos antagónicos competitivos para proteger los cultivos de patógenos del suelo; en particular especies del género Trichoderma han merecido la atención máxima como agente de biocontrol (Rosero, 2008).
Trichoderma es un hongo que se encuentra frecuente- mente sobre tejidos vegetales en descomposición. Es un organismo dominante en los suelos, debido a su naturaleza agresiva y su capacidad metabólica para competir con otros microorganismos (Rosero, 2008). Además, Trichoderma tiene la capacidad de parasitar a otros hongos lo que se conoce como hiperparasitismo o micoparasitismo. El modo de acción de Trichoderma es complejo e incluye quimiotaxismo, antibiosis y parasitismo (Elósegui, 2006).
El manejo preventivo con el uso del control biológico con Trichoderma es una alternativa importante para el control del amarillamiento causado por F. oxysporum, ya que una vez se hayan manifestado los síntomas de esta enfermedad ni siquiera el control químico es eficiente (González et al., 2005).
Se planteó como objetivo de la presente investigación contribuir al manejo del amarillamiento en arveja (P. sativum L.) causado por el hongo F. oxysporum, a través de la evaluación de cepas de Trichoderma spp. antagónicas al patógeno, realizada en condiciones de laboratorio, invernadero y campo.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el laboratorio de Sanidad Vegetal y en el invernadero de la Universidad de Nariño, a una altitud de 2540 msnm, 01°12'13" LN y 77°15'23" LO. La fase de campo se estableció en la granja experimental Botana, ubicada a una altitud de 2820 msnm, 01°09'28" LN y 77°16'29" LO, con una temperatura promedio de 13 °C.
Teniendo en cuenta las zonas productoras de arveja del sur de Nariño donde se presenta la mayor incidencia de la enfermedad, como son los municipios de Potosí, Córdoba, Gualmatán, Ipiales y Puerres, se procedió a colectar plantas con síntomas de amarillamiento, crecimiento reducido y coloración rojiza en los haces vasculares característicos del ataque de F. oxysporum. Para el caso de Trichoderma se trabajó con una cepa comercial de laboratorios Perkins y cuatro muestras por municipio, tomando suelo de la rizósfera de plantas aparentemente sanas y se depositaron 500 g en bolsas de polietileno, para un total de 21 tratamientos. El material se trasladó al laboratorio de la Universidad de Nariño para su análisis y procesamiento.
En el proceso de aislamiento y purificación de F. oxysporum, el material vegetal recolectado de los diferentes municipios se lavó con agua corriente, tomando trozos de tejidos de raíz y tallos sintomáticos de tamaño 5 x 5 mm, los cuales fueron sometidos a un lavado con agua destilada durante 2 minutos, luego para desinfestarlos se utilizó una solución de hipoclorito de sodio al 3% durante 1 minuto y se enjuagó en agua destilada durante 1 minuto. Estas muestras de tejido fueron sembradas cada una en cajas Petri con medio de cultivo PDA y se incubó a temperatura ambiente hasta el desarrollo de colonias fungosas (Rojas, 2011); luego se purificó este hongo en el mismo medio escogiendo la cepa más agresiva según su crecimiento micelial que correspondía a la cepa de Potosí.
La identificación del patógeno se realizó siguiendo las claves taxonómicas descritas por Booth (1971), con base en la coloración de colonias y en las estructuras reproductivas como: conidias, macroconidias, clamidosporas y esporodoquios.
Para el aislamiento y purificación de Trichoderma spp. se pesaron 10 g de suelo por muestra, se agregó agua destilada estéril hasta 100 mL, obteniendo la primera dilución de 10-1, se realizaron diluciones seriadas base 10 hasta 10-6. Posteriormente en cajas Petri con medio de cultivo PDA acidificado con ácido sulfúrico al 5 %, se depositó 1 mL de cada dilución a partir de 10-2 (Rojas, 2011), las cuales se incubaron a temperatura ambiente hasta la aparición de colonias fungosas.
La identificación de Trichoderma spp. se realizó teniendo en cuenta la morfología y disposición de las fiálides, conidias, su esporulación verde y olor típico a coco (Rifai, 1969).
Se trabajó con 20 cepas de Trichoderma spp. aisladas de diferentes localidades de los municipios del sur de Nariño y una comercial (tabla 1).
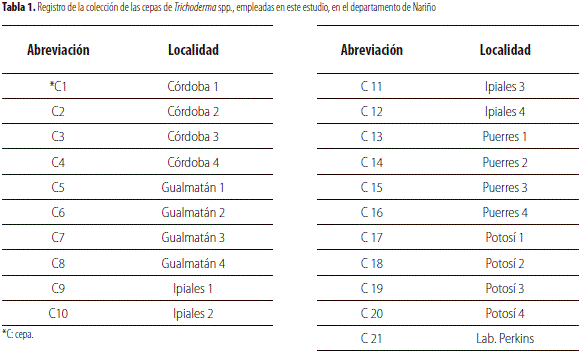
Pruebas de antagonismo in vitro. Se usó un diseño irrestrictamente al azar con 21 tratamientos correspondientes a cepas de Trichoderma spp. frente al hongo F. oxysporum con diez repeticiones, siendo la unidad experimental una caja Petri. Se realizaron pruebas de antagonismo in vitro, para lo cual se sembraron discos de un centímetro de diámetro de la colonia pura de cada hongo extraída con sacabocados y sembrada en los extremos de la caja Petri con medio PDA, de tal manera que se situó el antagónico frente al patógeno teniendo en cuenta que F. oxysporumse sembró un día antes que el antagonista, con el objetivo de que Trichoderma spp. facilitara la presencia del patógeno al compartir el medio (Howell, 2003).
Se realizó un seguimiento durante 21 días, con lecturas cada 24 horas a partir de la siembra, con el fin de medir el crecimiento micelial de los hongos Trichoderma spp. y F. oxysporum. Las lecturas se suspendieron cuando el aislamiento del antagónico logró crecer hasta el extremo opuesto sobre el crecimiento micelial del patógeno. Además, cuando fue posible se determinó el halo de inhibición, los resultados obtenidos se estudiaron mediante análisis de varianza y prueba de significancia de Duncan.
Como criterio de selección para la fase de invernadero se tuvo en cuenta el crecimiento micelial y el halo de inhibición. Se eligieron cinco cepas del total evaluadas, de las cuales una era la cepa comercial de Perkins.
Pruebas de antagonismo en invernadero. Las cuatro cepas de Trichoderma spp. elegidas en el laboratorio por su respuesta antagónica (C2, C7, C14 y C20), más la cepa comercial (Perkins-C21), se evaluaron en invernadero en un diseño irrestrictamente al azar, adicionándole un testigo inoculado con F. oxysporumpero sin Trichoderma spp. y un testigo absoluto para un total de siete tratamientos, con cuatro repeticiones; la unidad experimental correspondió a ocho plantas de arveja sembradas en bolsas de 3 kg.
En esta prueba se manejó suelo esterilizado para evitar contaminación con otros microorganismos. Con cada tratamiento de Trichoderma spp. se aplicó la solución directamente en el suelo (drench) en el momento de la siembra de la arveja variedad Santa Isabel, a excepción de los dos testigos, con una dosis de 50 mL de solución por bolsa, a una concentración de 1 x 106 conidias/mL. Luego de esta inoculación se procedió a aplicar la misma cantidad y concentración de F. oxysporum, excepto en el testigo absoluto.
A partir del momento de siembra, se midió la altura de la planta cada 30 días durante tres meses, para así determinar el crecimiento vegetativo; evaluaciones que se usaron para graficar las curvas de desarrollo. Al final del ensayo se evaluó la incidencia, teniendo en cuenta el número de plantas muertas, por presencia de síntomas aéreos y/o en la raíz (revisando los haces vasculares) y verificando el diagnóstico con reaislamiento del patógeno; además, se evaluó la altura de planta, longitud de raíz y materia seca de raíces. Los datos obtenidos se interpretaron mediante análisis de varianza y prueba de significancia de Tukey.
Prueba de antagonismo en campo. Se estableció en un lote de la granja experimental Botana con antecedentes históricos de incidencia en amarillamiento de arveja. Se utilizó un diseño de bloques completos al azar con 3 repeticiones, con las cepas C7, C14 y C21 obtenidas en la fase de invernadero y un testigo absoluto. Los tratamientos con Trichoderma spp. se aplicaron al momento de la siembra de arveja variedad Santa Isabel, a los 15 días y a los 30 días (figura 1) con una dosis de 50 mL por planta, a una concentración de 1 x 106 conidias/mL, excepto en el testigo absoluto.

Las unidades experimentales se establecieron en un área de 10 m2 (4 m x 2,5 m) correspondiente a cuatro surcos sembrados a una distancia de 1 m entre surcos y 15 cm entre plantas. El área útil de la parcela fue de 4,4 m2 (2 m x 2,2 m) (figura 1).
Los componentes de rendimiento evaluados fueron: número de vainas por planta en 28 plantas, peso de vaina verde y número de granos por vaina en 20 vainas muestreados al azar. Los datos obtenidos se interpretaron mediante análisis de varianza y prueba de significancia de Tukey.
Así mismo, se valoró la altura de la planta tomando las 28 plantas de la parcela útil, midiendo su longitud en metros desde el cuello de la raíz hasta el último foliolo y se obtuvo el promedio. También se evaluó longitud de raíces en centímetros medidos desde la base del tallo hasta la parte terminal de las raíces. Los datos obtenidos se interpretaron mediante análisis de varianza y prueba de significancia de Tukey.
Al final del ensayo se determinó el porcentaje de incidencia, realizando un muestreo destructivo de las plantas para revisar la presencia de síntomas en raíz; posteriormente se verificó el diagnóstico con reaislamiento del patógeno.
RESULTADOS Y DISCUSIÓN
Pruebas de antagonismo in vitro
Al realizar el análisis de varianza se evidenciaron diferencias significativas (p ≤ 0,01) tanto para crecimiento micelial como para el halo de inhibición (tabla 2), y un efecto diferencial de los tratamientos sobre la cepa de F. oxysporum (figura 2), obtenida en el municipio de Potosí, seleccionada por su agresivo y rápido crecimiento micelial.
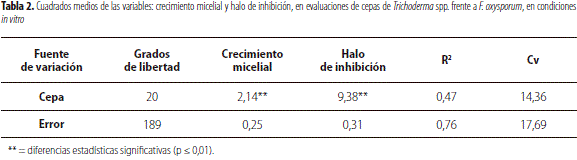

Esta actividad antagónica ha sido reportada en varios estudios, en los cuales se exponen los diferentes mecanismos empleados por el agente biocontrolador Trichoderma spp., como micoparasitismo, antibiosis, competencia por nutrientes y espacio (Kulling, 2000; Valencia y Arbeláez, 1999; Chet et al., 1997), para la disminución o eliminación de la población de hongos fitopatógenos.
Al analizar los resultados obtenidos en la prueba de Duncan respecto a la capacidad antagónica de cepas de Trichoderma spp. sobre F. oxysporum, se observó que la cepa 20 (Potosí 4) obtuvo el mayor promedio de crecimiento micelial con diferencias significativas en relación con los demás tratamientos (tabla 3), a excepción de las cepas C7 (Gualmatán 3) y C14 (Puerres 2) que hacen parte del grupo de las de mayor crecimiento en términos generales. Esto debido a la capacidad antagónica de las cepas, que durante el proceso de micoparasitismo crecen quimiotrópicamente hacia el hospedante, se adhieren a las hifas del mismo, se enrollan en ellas y las penetran (Carsolio et al., 1999), lo cual conlleva al debilitamiento casi total del fitopatógeno.
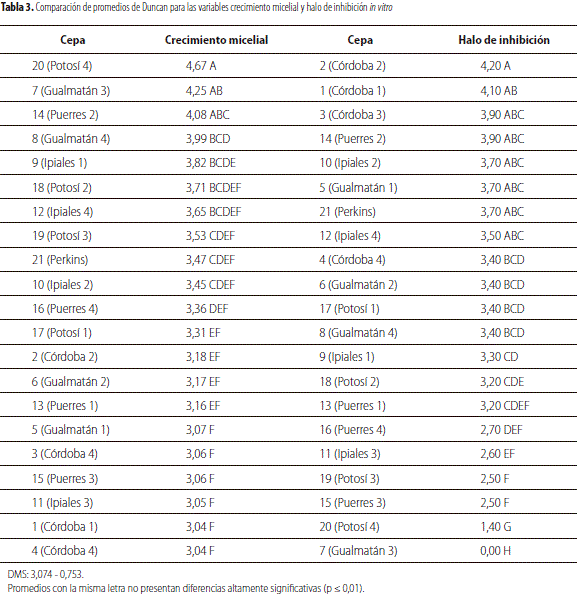
Romo y Ávila (2000) sustentan que Trichoderma spp. tiene propiedades antifungosas y antibacteriales, gracias a que produce sustancias tales como: trichodermina, dermadina, sequisterpeno, suzukacillina, alamethicina, trichotoxina y acetaldehído; adicionalmente están implicadas enzimas extracelulares como b-1,3 glucanasa, quitinasa y celulasa que degradan las paredes celulares del hospedante y posibilitan la penetración de las hifas del antagonista.
Trichoderma tiene diferentes tipos de interacción hifal -como parasitismo-, la cual es potencialmente usada como biorregulador de otros hongos del suelo (Correa, 1997). Bernal (2004) encontró enrollamiento y penetración de hifas de Trichoderma spp. en hifas de F. oxysporum f. sp. cubense; por su parte, Harman (2001) observó penetración en hifas de Pythium sp. y Rhizoctonia solani. Así mismo, Rivero (2008) evaluó cuatro aislamientos de Trichoderma spp. sobre Alternaria padwickii (Ganguly), donde obtuvo una alta capacidad competitiva, con dos o más tipos de interacción hifal.
La prueba de Duncan para halo de inhibición muestra que se destacó la cepa C2 (Córdoba 2) con 4,2 mm, sin diferencias significativas con el grupo comprendido por C1, C3, C14, C10, C5, C21 y C12 con promedios que varían desde 3,5 hasta 4,1 mm; pero con diferencias significativas con los demás tratamientos (p ≤ 0,01); se demostró la mayor capacidad de micoparasitismo de algunas cepas como C2. Este mecanismo comienza cuando las cepas de Trichoderma spp. detectan otros hongos y crecen trópicamente hacia estos (Harman et al., 2004). Además, Trichoderma produce una variedad de metabolitos secundarios volátiles y no volátiles; algunas especies inhiben otros organismos con los que no establecen contacto físico. Entre las sustancias inhibidoras para contrarrestar a F. oxysporumse encuentran la gliotoxina, viridina y gliovirina (Howell, 2003).
Cabe destacar que la cepa C14 presentó resultados positivos tanto en crecimiento micelial como en halo de inhibición debido a su agresividad.
Stefanova et al. (1999) informaron la presencia de metabolitos no volátiles con actividad antifúngica en cuatro aislamientos de Trichoderma y concluyeron que los mismos reducen el crecimiento micelial de Phytophthora nicotianae. Por otro método, Rivero (2008) evaluó el efecto de antibiosis de dos aislados de Trichoderma spp. en cultivo dual con Alternaria padwickii, Bipolaris oryzae, Curvularia lunatay Phoma sp., y observó inhibición significativa del crecimiento radial de estos patógenos.
La competencia por nutrientes es un mecanismo empleado por Trichoderma para el control de F. oxysporum(Benítez et al., 2004). Un ejemplo de competencia por nutrientes es el notificado por Durman et al. (2003), quienes encontraron una disminución del crecimiento de R. solaniy de la viabilidad de los esclerocios por la acción de diferentes aislamientos de Trichoderma spp.
Durante esta investigación se observó el antagonismo entre un controlador biológico y un patógeno, concordando con lo expresado por Mroginski y Roca (1993). Lo cual lleva a verificar que controladores biológicos como las cepas de Trichoderma spp. usadas en esta investigación inhiben el desarrollo de F. oxysporum; por tal razón fue necesario continuar con la investigación en invernadero y campo.
Antagonismo en invernadero
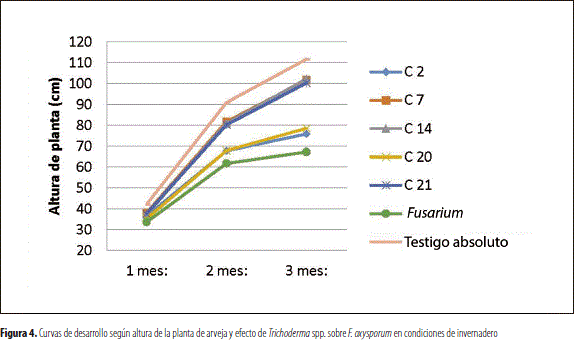
Se evaluaron los tratamientos C2, C7, C14, C20 y el testigo comercial C21 (Perkins). Además, se estableció un tratamiento testigo con aplicación de F. oxysporumy un testigo absoluto. En la figura 3 se puede observar mejor desarrollo fisiológico representado en una mayor altura de la planta para el testigo absoluto, respecto a los demás tratamientos; sin embargo, las plantas de arveja inoculadas con Trichoderma spp. que arrojaron los mejores resultados fueron las tratadas con las cepas C7, C14 y C21, en relación con las cepas C2 y C20. El antagonismo encontrado con el tratamiento F. oxysporum fue menor en relación con los tratamientos anteriormente mencionados.

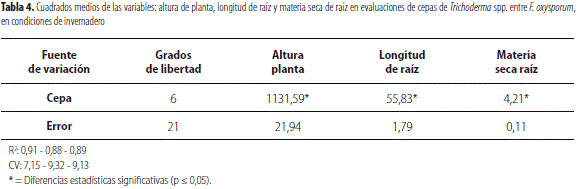
El análisis de varianza de altura de la planta presenta diferencias significativas entre los tratamientos (tabla 4). La altura del testigo absoluto (111,59 cm), de C7 (101,66 cm), de C14 (102,19 cm) y de C21 (100,16 cm) presentó diferencias respecto a la de C20 (78,53 cm), C2 (75,84 cm) y testigo de F. oxysporum (67,22 cm). Las plantas afectadas por Fusarium sp. reducen su crecimiento debido a la capacidad del patógeno de colonizar raíces, lo que impide una adecuada nutrición de la planta (Agrios, 2006).
Las curvas de desarrollo (figura 4) muestran el comportamiento de las plantas al efecto de los tratamientos, observando mejor respuesta del testigo absoluto, C7, C14 y C21 en comparación con C2 y C20; y una notable diferencia con el testigo inoculado únicamente con F. oxysporum. Además, se observó mayor efecto diferencial sobre la altura de plantas al finalizar el ciclo del cultivo. En relación con esto, Agrios (2006) indica que el patógeno al ingresar a la raíz extiende su micelio por los vasos xilemáticos dificultando el desarrollo de la planta; además, Ochoa y Fonseca (1998) afirman que la mayoría de los síntomas se presentan en una porción longitudinal de la planta que corresponde a la raíz afectada, para luego avanzar a toda la planta.
El análisis de varianza de la longitud de raíces muestra diferencias altamente significativas entre tratamientos, lo cual indica el efecto diferencial de los tratamientos sobre F. oxysporum; igualmente, dicho análisis en materia seca de raíces se evidencian resultados similares al de longitud de raíces (tabla 4).
La prueba de Tukey (tabla 5) muestra mayor longitud de raíces tanto en el testigo absoluto como en C7, C14 y C21 con una longitud promedio de 23,87 cm, 20,64 cm, 20,00 cm y 19,59 cm respectivamente; con diferencias altamente significativas con respecto a los tratamientos C2, C20 y testigo F. oxysporumcon 15,43 cm, 14,83 cm y 13,58 cm respectivamente (tabla 4). Este bajo desarrollo radicular es un indicio de la pudrición de la raíz, causada por el efecto de F. oxysporumcomo lo describe Agrios (2006), y se puede verificar en los tejidos internos de las raíces y de la base del tallo una pudrición seca de coloración rojiza (Sañudo et al., 2007).
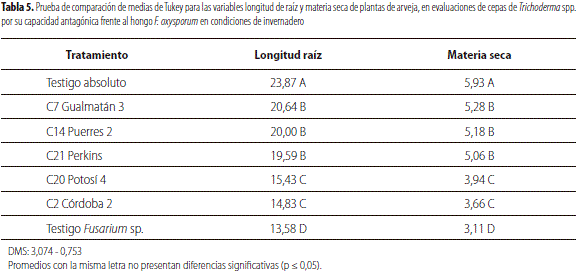
La materia seca de raíces según la prueba de Tukey evidencia que los diferentes tratamientos presentaron un comportamiento similar al de longitud de la raíz (tabla 5). Estos resultados concuerdan con lo reportado por Lewis et al. (1990) en trabajos realizados en condiciones de invernadero y campo, donde Trichoderma spp. ejercía un control biológico sobre hongos en un cultivo de tomate; esto puede deberse a que tiene la capacidad de crear un ambiente favorable al desarrollo radicular (Harman et al., 2004), incrementando el crecimiento de raíces y su desarrollo, productividad del cultivo, resistencia a estrés abiótico y la toma y uso de nutrientes (Elander, 1992). Ezziyyani et al. (2004) reportan que en plántulas de pimiento tratadas con Trichoderma spp., el peso seco y la longitud de las plantas fueron superiores a las no tratadas, lo que significa una mayor absorción de nutrientes parcialmente atribuida al empleo de este inoculante, la cual depende de las comunidades microbianas asociadas a la rizósfera, la especie de planta, el tipo de sustrato y prácticas culturales empleadas durante el cultivo.
El análisis de varianza de incidencia causada por F. oxysporumsobre las plantas de arveja muestra diferencias significativas entre los tratamientos: testigo absoluto (0,0), C7 (5,39), C21 (7,18) y C14 (7,18) con relación a C20 (43,64), C2 (59,58) y testigo Fusarium (82,76). Las cepas C7, C14 y C21 presentaron menor índice de enfermedad, de lo cual se infiere que la baja incidencia de F. oxysporumse presenta por la penetración de Trichoderma spp. en la epidermis y en la corteza externa de las raíces, lo que estimula el sistema de defensa en las plantas llevando a la producción de compuestos bioquímicos y estructurales de defensa (Yedidia et al., 1999).
Inbar et al. (1994) observaron que aplicando T. harzianumen semilleros de pepino y de pimentón se incrementó significativamente el crecimiento de las plántulas, comparadas con aquellas que no recibieron la adición del hongo antagonista. Estos trabajos muestran el beneficio de aplicar hongos, como Trichoderma spp., desde la etapa de germinación para obtener plantas vigorosas y sanas.
Antagonismo en campo
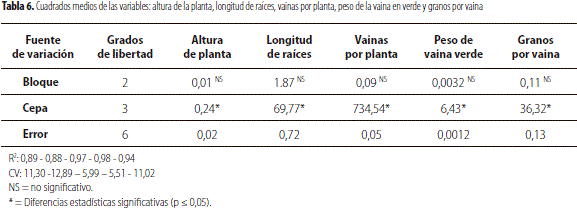
Los análisis de varianza para los componentes de rendimiento (vainas por planta, peso de vaina verde y granos por vaina) indicaron diferencias significativas entre tratamientos, lo cual se corrobora con las pruebas de comparación de medias (tabla 7). Así, según el análisis de varianza (tabla 6) y las pruebas de Tukey (tabla 7), es claro que el tratamiento con mayor efecto sobre F. oxysporum es el tratamiento C14, seguido de C21; esto debido a la buena adaptabilidad que presentaron estas cepas de Trichoderma spp. en campo y de su agresividad para contrarrestar al patógeno.
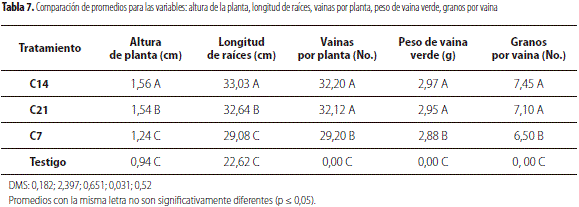
Los tratamientos C14 y C21 presentaron los mayores promedios para la variable número de vainas por planta con 32,20 vainas y 32,12 vainas respectivamente, con diferencias significativas respecto a C7 con 29,20 vainas y testigo que no tuvo producción de vainas; resultados similares presentaron las variables de peso de vaina verde y granos por vaina (tabla 7).
No obstante, y a pesar de conocer los efectos positivos generados por las cepas de Trichoderma spp., los fenómenos en la rizósfera son complejos y las diferencias obtenidas entre los tratamientos evaluados son difíciles de atribuir a un solo factor. Debido a que las variables de rendimiento presentan baja heredabilidad y por tanto muestran alta interacción con el ambiente (Muñoz, 2012), cabe destacar que Trichoderma spp. posee habilidades que le permiten tanto ser un eficiente biocontrolador como favorecer a las plantas tratadas por medio de la solubilización de nutrientes (Altomare et al., 1999).
En cuanto a longitud de raíz, se observó que los tratamientos C14 (33,03 cm) y C21 (32,64 cm) mostraron diferencias significativas (p ≤ 0,01), respecto a C7 y el testigo que presentaron un promedio de 29,08 cm y 22,62 cm, respectivamente (tabla 7). Elander (1992) afirma que la colonización de raíces por cepas de Trichoderma spp. frecuentemente incrementa su crecimiento en muchos cultivos.
Las cepas de Trichoderma spp. están asociadas con raíces y sus ecosistemas, con capacidad de colonizar raíces de plantas por mecanismos similares a los de los hongos micorrizales y producir compuestos que estimulan el crecimiento como citoquininas, zeatinas y giberilinas (GA3); así como promover mecanismos de defensa en plantas (Harman et al., 2004).
Con relación a la variable altura de la planta se destaca el tratamiento C14 con un promedio de altura de 1,56 m, seguido por C21 con 1,54 m, C7 con 1,24 m y el testigo con un promedio de 0,94 m. Los resultados anteriores son similares a los obtenidos por Valencia y Arbeláez (1999), quienes reportan que el empleo de antagonistas como Trichoderma spp. estimula el crecimiento y desarrollo de las plantas en comparación con tratamientos testigo. Estos resultados coinciden con los expuestos por otros autores quienes establecen que algunas especies de Trichoderma han sido reportadas como estimuladoras de crecimiento en especies como clavel, crisantemo, arveja, frijol (Soil-fertility, 2008).
Sin embargo, se puede pensar que la variabilidad en la altura de la planta está determinada por factores ambientales. Makasheva (1983) afirma que la longitud del tallo de la planta de arveja en una misma variedad puede variar ampliamente dependiendo de las condiciones de crecimiento (suelo, clima, manejo agronómico, localización geográfica). Al respecto, en la granja Botana los suelos son compactados y de mala estructura, propiedades físicas inadecuadas que impiden el desarrollo radicular de las plantas afectando la altura total.
En el análisis de varianza y prueba de significancia de Tukey en la variable de incidencia causada por F. oxysporumsobre las plantas de arveja, se evidencian diferencias significativas entre los tratamientos: C14 (1,36), C21 (2,73) y C7 (4,78), con relación al testigo absoluto (68,96). Estos resultados constatan la presencia y agresividad de F. oxysporum hacia las plantas de arveja y el efecto de las cepas de Trichoderma spp. como organismo biocontrolador, protegiendo y minimizando el ataque causado por F. oxysporum.
CONCLUSIONES
Las cepas C2 (Córdoba 2), C7 (Gualmatán 3), C14 (Puerres 2), C20 (Potosí 4) mostraron antagonismo sobre F. oxysporum en las variables de halo de inhibición y crecimiento micelial en condiciones in vitro.
En condiciones de invernadero, las cepas C7, C14 y C21 presentaron mejor respuesta en el control de F. oxysporumf. sp. pisi. en plantas de arveja, específicamente en porcentaje de incidencia, altura de planta, longitud y materia seca de raíces.
Las evaluaciones en componentes de rendimiento en campo indican que las cepas C14 y C21 fueron los mejores tratamientos en el control de F. oxysporumen plantas de arveja, confirmando los resultados obtenidos en las pruebas de antagonismo tanto en laboratorio como en invernadero.
REFERENCIAS
Agrios G. 2006. Plant disease. New York. American Phytopatholog y Society. 850 p. [ Links ]
Altomare C, Norvell W, Bjorman T, Harman Y. 1999. Solubilization of Phosphates and Micronutrients by the Plant-Growth-Promoting and Biocontrol Fungus Trichoderma harzianum Applied and Environmental Microbiolog y. http://gredos.usal.es/jspui/bitstream/10366/22506/3/DMG_.pdf. Consultado: agosto 2012. [ Links ]
Argüello H, Lastres L, Rueda A. 2007. Programa de manejo integrado de plagas en América Central (Promipac-Zamorano-Cosude) (Ed). Manual MIP en cucúrbitas. Carrera de Ciencia y Producción Agropecuaria. Escuela Agrícola Panamericana, Honduras. 244 p. [ Links ]
Benítez T, Rincón A, Limón C, Codón A. 2004. Biocontrol mechanism of Trichoderma strains. International Microbiolog y 7: 249-260. [ Links ]
Bernal A, Andreu C, Moya M. 2004. Utilización de Trichoderma spp. como alternativa ecológica para el control de Fusarium oxysporumsp. cubense (EF Smith) Snyd & Hans. Cuba. Consultado: abril 2007. http://www.virtualcentr.org/es/enllBTJ%20Tallr/bernalalezander.htm. Consultado: agosto 2012. [ Links ]
Booth C. 1971. The Genus Fusarium. Common wealth Mycological Institute. Kew, Surrey, England. 237 p. [ Links ]
Buitrago J, Duarte C, Sarmiento A. 2006. El cultivo de la arveja en Colombia. Federación Nacional de Cultivadores de Cereales y Leguminosas-Fenalce y Fondo Nacional Cerealista. Produmedios. Bogotá, Colombia. 102 p. [ Links ]
Carsolio C, Benhamou N, Haran S, Cortés C, Gutiérrez A, Chet I, Herrera-Estrella A. 1999. Role of the Trichoderma harzianum endochitinase gene, ech42, in mycoparasitim. Appl Environ Microbiol. 65:929-935. [ Links ]
Chet I, Inbar J, Hadar I. 1997. Fungal antagonists and mycoparasites. In: Wicklow DT, Soderstrom B. (Eds.). The Mycota IV: Environmental and microbial relationships. Springer-Verlag, Berlin. 165-184. [ Links ]
Correa F. 1997. Principales enfermedades del arroz. MIP en arroz. Manejo integrado de plagas. Artrópodos, enfermedades y malezas. Fundación Polar Venezuela, Fedearroz Colombia, FLAR, CIAT, Caracas, Venezuela. 123-141 p. [ Links ]
Druzhinina IS, Seidl-Seiboth V, Herrera-Estrella A, Horwitz BA, Kenerley CM, Monte E, Kubicek CP. 2011. Trichoderma: the genomics of opportunistic success. Nature Reviews Microbiology, 9(10), 749-759. [ Links ]
Durman S, Menéndez A, Godeas A. 2003. Evaluación de Trichoderma spp. como antagonista de Rhizoctonia solani in vitro y como biocontrolador del damping off de plantas de tomate en invernadero. Revista Argentina de Microbiología. 31(1):13-18. [ Links ]
Elander A. 1992. Laccase production by some whime rot fungi under different nutritional. Biotechinol. http://www.javeriana.edu.co/biblos/tesis/ciencias/tesis98.pdf. Consultado: julio 2012. [ Links ]
Elósegui O. 2006. Métodos artesanales de producción de bioplaguicidas a partir de hongos entomopatógenos y antagonistas. Instituto de Investigaciones de Sanidad Vegetal. La Habana, 2006. [ Links ]
Ezziyyani M, Pérez C, Ahmed A, Requena M, Candela M. 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophtora capsicien plantas de pimiento (Capsicum annuum L.). Anales de Biología. Vol. 26. 35-45. [ Links ]
Fenalce. 2012. Especificaciones técnicas de semillas. Semillas de Arveja. Arveja Santa Isabel. http://www.finagro.com.co/html/cache/HTML/SIS/Arveja/EspecificacionesTecnicasdesemillas.pdf. Consultado: febrero 2012. [ Links ]
González JC, Maruri JM, González A. 2005. Evaluación de diferentes concentraciones de Trichoderma spp. contra Fusarium oxysporum agente causal de la pudrición de plántulas en papaya (Carica papaya L.) en Tuxpan, Veracruz, México. Facultad de Ciencias Biológicas y Agropecuarias de la Universidad Veracruzana. Revista UDO Agrícola 45-47. [ Links ]
Harman GE, Howell CR, Viterbo A, Chet I, Lorito M. 2004. Trichoderma Species-Opportunistic, Avirulent Plant Symbionts. Nature Reviews. 43-56. [ Links ]
Harman GE. 2001. Trichoderma spp., including T. harzianum, T. viride, T. koningii, T. hamatum and other spp. Deuteromycetes, moniliales (asexual classification system). http://www.birdhybrids.com/t-22.htm. Consultado: febrero 2007. [ Links ]
Hermosa R, Viterbo A, Chet I, Monte E. 2012. Plant-beneficial effects of Trichoderma and of its genes. Microbiolog y, 158(1):17-25. [ Links ]
Howell C. 2003. Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts. Plant Dis. 87: 4-10. [ Links ]
Hoyos-Carvajal L, Chaparro P, Abrams K, Chet I, Orduz S. 2008. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solaniy Scleorotium rolfisii bajo condiciones in vitro y de invernadero. Agron. Colomb. 26(3): 451-458. [ Links ]
Hoyos-Carvajal L, Orduz S, Bissett J. 2009. Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma. Biological Control 51:409-416. [ Links ]
Inbar J, Abramsky M, Cohen D, Chet I. 1994. Plant growth enhan-cement and disease control by Trichoderma harzianumin vegetable seedlings grown under commercial conditions. European Journal of Patholog y 100:337-346. [ Links ]
Inta. 1987. Recomendaciones prácticas para el cultivo de la arveja. 1-50. Eea inta san Pedro. http://es.scribd.com/doc/60330824/pautas-para-el-manejo-del-cultivo-de-arveja-final. Consultado: marzo 2011. [ Links ]
Kubicek CP, Herrera-Estrella A, Seidl-Seiboth V, Martínez D, Druzhinina IS, Thon M, Salamov A. 2011. Comparative genome sequence analysis underscores mycoparasitism as the ancestral life style of Trichoderma. Genome Biolog y, 12(4), R40. [ Links ]
Kulling C. 2000. Enzyme diffusion from Trichoderma atroviride (T. harzianump1) to Rhizoctonia solani is a prerequisite for triggering of Trichoderma ech42 gene expression before mycoparasitic contect. Applied and Environmental Microbiology. Vol 66, 2232-2234. [ Links ]
Lewis J, Barkadale T, Papavizas G. 1990. Greenhouse and field studies on the biological control of tomato fruit rot caused by Rhizoctonia solani. Crop Prot. 9:8-14. [ Links ]
Makasheva R. 1983. The pea. Published for the US Departament of Agriculture and The National Science Foundation, Washington. Amerind Publishing. Pvt. Ltd, New Delhi. 128 p. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2012. Encuesta nacional agropecuaria. http://www.agronet.gov.co/www/htm3b/reportesajax/verreporte.aspx. Consultado: enero 2013. [ Links ]
Mroginski l, Roca W. 1993. Establecimiento de cultivos de tejidos vegetales in vitro. En: cultivo de tejidos en la agricultura. Fundamentos y aplicaciones. Cali, Colombia: Ciat. http://www.revistas.unal.edu.co/index.php/biotecnologia/article/view/575/1112. Consultado: febrero 2012. [ Links ]
Muñoz M. 2012. Interacción genotipo ambiente de 20 líneas de arveja arbustiva Pisum sativumL. para cinco municipios de la zona sur del departamento de Nariño. Pasto, Colombia. 34-41 p. [ Links ]
Nelson PE, Toussoun TA, Marasas W. 1983. Fusarium species. An illustrated manual for identification. The Pennsilvania State University Press. University Park of London. [ Links ]
Nutrimon. 2007. Ensayo comercial en el cultivo de la arveja. Informativo productivo. Vol 3. 7 p. [ Links ]
Ocaña A. 2008. Alerta Fusarium raza 4 amenaza los cultivos. http://http://www.freshplaza.es/news_detail.asp?id=8711 Consultado: febrero de 2010. [ Links ]
Ochoa J, Fonseca G. 1998. Enfermedades del babaco. Cultivo del babaco bajo invernadero (Memorias Seminario Frutícola). Quito, INIAP. 8 p. [ Links ]
Rifai M. 1969. A revision of the genus Trichoderma. Mycological papers. Vol 2. 116. [ Links ]
Rivero D. 2008. Identificación y control in vitro con quitosana y Trichoderma spp. de hongos que causan el manchado del grano (Oryza sativa L.). Rev Protección Veg. 23(1): 67 p. [ Links ]
Rojas A. 2011. Conceptos y prácticas de microbiología general. Universidad Nacional Sede Palmira, Colombia. 155 p. [ Links ]
Romo J, Ávila C. 2000. Trichoderma spp. como agente de control biológico (parte I). Avances Agropecuarios. Órgano Informativo del departamento de agricultura y ganadería de la Universidad de Sonora, Hermosillo, Sonora. México. 2 p. www.chapingo.mx/dicifo/.../don-juan-macias-bonificacio2206.pdf. Consultado: agosto 2012. [ Links ]
Rosero GA. 2008. Evaluación de cuatro cepas de Trichoderma sp. y sus combinaciones para el control de Fusarium oxysporum en sandía (Citrullus lannatus). Proyecto especial presentado para optar al título de Ingeniero Agrónomo en el grado académico de Licenciatura. Honduras. 26 p. [ Links ]
Sañudo B, Arteaga G, Betancourth C, Coral S, Orozco C. 2007. La arveja como opción competitiva en la Región Andina. Universidad de Nariño. San Juan de Pasto, 92 p. [ Links ]













