Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia y Tecnología Agropecuaria
versão impressa ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.16 no.1 Mosquera jan./jun. 2015
1 Ingeniero de Producción Biotecnológica, Msc. Investigador Corpoica CI Tibaitatá. Mosquera, Colombia. uperez@corpoica.org.co
2 Agrónoma, PhD. Investigador Corpoica CI Tibaitatá. Mosquera, Colombia. mmramirez@corpoica.org.co
3 Microbiólogo. Profesional de investigación Corpoica CI Tibaitatá. Mosquera, Colombia. jzapatan@corpoica.org.co
4 Bióloga, MsC. Investigador Corpoica CI Tibaitatá. Mosquera, Colombia. jcordoba@corpoica.org.co
Fecha de recepción: 07/10/2014. Fecha de aceptación: 13/01/2015
Resumen
El objetivo de este estudio fue la obtención de plántulas de tres ecotipos de mora (monterrico, sin espinas y castilla), procedentes de cultivos in vitro inoculados en forma individual y combinada con el Hongo Formador de Micorriza Arbuscular (HFMA) Glomus sp. (GEV02) y las Rizobacterias Promotoras de Crecimiento Vegetal Pseudomonas migulae cepa Pf014 y Bacillus amyloliquefaciens cepa Bs006. Las variables de crecimiento evaluadas fueron longitud aérea y radical (cm), peso fresco y seco foliar y radical (g), así como volumen radical (cm3) y área foliar (cm2). A nivel simbiótico, se midió el porcentaje de colonización por parte del HFMA. Los resultados obtenidos muestran un posible sinergismo entre GEV02 y las rizobacterias evaluadas en forma combinada ya que estas presentaron los mayores valores en todas las variables analizadas. Con el uso de la mezcla de estos microorga- nismos se observó un mejor establecimiento, desarrollo y vigor de las plántulas de mora en los tres ecotipos considerados y se mejoró su supervivencia (≥80 %) en las etapas de endurecimiento y aclimatación.
Palabras claves: Hongos Formadores de Micorriza Arbuscular (HFMA), Bacterias Promotoras de Crecimiento Vegetal (BPCV), Rubus glaucus, cultivo in vitro.
Abstract
The aim of this study was to obtain blackberry seedlings of three ecotypes of blackberry (monterrico, sin espinas and castilla), from in vitro cultures inoculated individually and combined with Arbuscular Mycorrhiza Fungi (AMF) Glomus sp. (GEV02) and plant growth promoting rhizobacteria strains of Pseudomonas migulae (Pf014) and Bacillus amyloliquefaciens (Bs006). The growth variables were aerial and root length (cm), leaf and root fresh and dry weight (g), root volume (cm3) and leaf area (cm2). The symbiotic variables were root colonization (%) by the AMF. The results show a possible synergism between Glomus sp. (GEV02) and rhizobacteria evaluated in combination as these showed the highest values in all variables analyzed. Using the mixture of these organisms a better establishment, development and seedling vigor of default in the three ecotypes was observed, improving survival (≥80 %) in the stages of hardening and acclimatization.
Key words: Arbuscular Mycorrhizal Fungi (AMF), Plant Growth Promoting Rhizobacteria (PGPR), Rubus glaucus, in vitro culture
Introducción
La mora (Rubus glaucus L.) pertenece a la familia de las rosáceas y es una especie originaria de los Andes tropicales de América. En Colombia, se han identificado por lo menos 10 especies cultivables (Castaño et al. 2008). De acuerdo con el Ministerio de Agricultura y Desarrollo Rural, la producción nacional de mora en 2011 fue de 94.303 toneladas/año con un área sembrada de 11.673 hectáreas, siendo los departamentos de Cundinamarca, Santander y Antioquia los mejor posicionados en extensión y producción (Agronet 2012). No obstante, el material utilizado para la siembra corresponde, en su mayoría, a ecotipos locales que son propagados asexualmente por los mismos agricultores sin seguir ninguno de los requerimientos mínimos para la obtención de material de siembra con calidad sanitaria (Barrero 2009), situación que ha favorecido la diseminación de enfermedades como la antracnosis y algunos virus que afectan la producción de la fruta (Marulanda et al. 2011). La disponibilidad de plántulas con calidad genética y fitosanitaria es un requisito indispensable para el establecimiento de cultivos sanos y con buena capacidad de adaptación. Una estrategia para la obtención de plántulas-semilla con características de calidad, homogeneidad e inocuidad es el cultivo de tejidos in vitro o micropropagación (Raaman y Patharajan 2006). Esta técnica permite la producción de plántulas con alta homogeneidad genética y calidad fitosanitaria. Sin embargo, la tasa de supervivencia de plántulas de mora micropropagadas, durante la fase de endurecimiento y aclimatación, es inferior al 50 % (Valderrama et al. 2009), debido a que presentan un sistema radical débil con baja capacidad para captar nutrientes en las etapas iniciales del desarrollo vegetal (Elmeskaoui et al. 1995; Alarcón y Ferrera-Cerrato 2000; Schultz 2001). A pesar de la utilización en el pasado de varias metodologías para mejorar el crecimiento y reducir las tasas de mortalidad de plántulas durante el trasplante, la mayoría de ellas, básicamente tienen por objeto el control de las condiciones del medio ambiente, por ejemplo, el aumento de intensidad de la luz y la modificación de la concentración de CO2. Sin embargo, estos protocolos deben estar acompañados de otras estrategias que garanticen la sobrevivencia del material en las fases posteriores del proceso, como la asociación con microorganismos benéficos como los Hongos Formadores de Micorrizas Arbusculares (HFMA) y Rizobacterias Promotoras de Crecimiento Vegetal (de las siglas en ingles PGPR) ( Jaizme-Vega y Rodríguez- Romero 2004), bien sea in vitro o en etapas tempranas de aclimatación. Estos dos tipos de microorganismos juegan un papel importante en agroecosistemas sostenibles y pueden facilitar la aclimatación de las plantas que se crecen en condiciones de invernadero, lo que mejora los rendimientos de las plantas sometidas a estrés ambiental (Smith y Read 1997; Nowak 1998). Los HFMA son simbiontes obligados que colonizan las raíces de las especies de plantas más cultivadas, esta asociación favorece el establecimiento de las plantas, la absorción de nutrientes y la protección contra algunos tipos de estrés bióticos y abióticos (Barea et al. 1997; Kapoor et al. 2008).
Las PGPR son capaces de colonizar, sobrevivir y multiplicarse en microhábitats asociados a la superficie de la raíz, promoviendo el crecimiento de las plantas (Kloepper 1996). Se ha demostrado que los HFMA y las PGPR pueden interactuar durante los procesos de colonización de la raíz; las PGPR pueden influir en el funcionamiento y formación de la micorriza y, en consecuencia, las micorrizas pueden afectar las poblaciones de PGPR en la rizósfera (Barea et al. 2002; Bonfante y Anca 2009)
En este estudio se evaluó de forma individual y combinada un aislamiento de HFMA, provenientes de cultivos de mora establecidos en los departamentos de Cundinamarca y Antioquia, con un alto potencial para aclimatación y crecimiento de plantas de mora en invernadero en trabajos previos (Pérez-Moncada et al. 2012) y las rizobacterias Bacilllus amyloliquefaciens cepa Bs006 y Pseudomonas migulae cepa Pf14 reconocidas por promover el crecimiento de plantas de uchuva (Physalis peruviana L.) hasta en un 100 % en invernadero (Díaz et al. 2013), con el fin de aumentar la supervivencia de vitroplántulas de mora en etapas de endurecimiento o aclimatación.
Materiales y métodos
Material vegetal
Las plántulas de mora utilizadas corresponden a los ecotipos monterrico (ILS2367), sin espinas (ILS3400) y castilla, propagadas por el Centro de Investigación Tibaitatá.
En el establecimiento de los ecotipos de mora bajo condiciones in vitro se utilizaron como explantes meristemos. Para el enraizamiento se utilizó un medio de cultivo sólido complementado con sales de Lepoivre, tiamina (0,04 mg L-1), IBA (0,1 mg L-1), inositol (0,1 g L-1) y sacarosa (20 g L-1). Cuando las plántulas alcanzaron una altura promedio de 5 cm, con buen porte y desarrollo radical, fueron trasplantadas a un sustrato de turba para comenzar el proceso de aclimatación.
Microorganismos
Se utilizó el HFMA Glomus sp., accesión GEV02 aislados de la rizósfera de plantas de mora (Roveda et al. 2007). La multiplicación del HFMA se realizó utilizando como hospedero cebolla de bulbo (Allium cepa L.) sembradas en materos de 500 g usando como sustrato suelo:arena (proporción 2:1) e inoculando 70 esporas por plántula directamente al sustrato. La recuperación del inóculo se realizó cinco meses después mediante la técnica de tamizado húmedo y decantación propuesta por Gendermann y Nicholson (1963) con modificaciones.
Las rizobacterias evaluadas fueron Pseudomonas migulae cepa Pf014 y Bacillus amyloliquefaciens cepa Bs006 aisladas de la filósfera de uchuva, cuyo inóculo se produjo en un biorreactor STR de 13 L en medios estandarizados por Díaz et al. (2012).
Diseño experimental
La investigación se realizó en los invernaderos y laboratorios de ecofisiología vegetal y micropropagación de plantas de Corpoica-CI Tibaitatá. El diseño experimental empleado fue de bloques completos al azar con tres repeticiones y diez plántulas como unidad experimental para cada tratamiento. Se evaluaron ocho tratamientos correspondientes a T1: Testigo absoluto; T2: 100 % fertilización química (FQ 100 %); T3: Glomus sp. (GEV02); T4: Bacillus amyloliquefaciens (Bs006); T5: Pseudomonas migulae (Pf014); T6: GEV02 + Pf014; T7: GEV02 + Bs006; y T8: GEV02 + Pf014 + Bs006.
Las plántulas de mora obtenidas bajo condiciones in vitro de los ecotipos monterrico (ILS2367), sin espinas (ILS3400) y castilla fueron sembradas en recipientes plásticos de 22 cm2 x 10 cm de alto ocupadas con turba canadiense; en cada sitio de siembra, se inocularon 70 esporas de HFMA plántula-1. Las rizobacterias se incorporaron al sustrato (vol/peso del sustrato) mediante aspersión de suspensiones a una concentración de 1x109 células mL-1, realizando refuerzos a los 15 y 30 días después de la siembra (dds). Las plántulas fueron mantenidas en un cuarto de crecimiento a 22 °C con un fotoperiodo de 16 h luz/8 h de oscuridad, durante 20 días. Pasado este tiempo, las plantas se trasplantaron a materas con capacidad de 1 kg que contenían un sustrato compuesto por suelo, arena y turba (proporción 2:1:1) y mantenidas bajo condiciones de invernadero. A todos los tratamientos se les aplicó una vez por semana solución nutritiva de Hoagland (1950), de acuerdo a cada tratamiento.
Sistema de muestreo y variables analizadas
Se realizaron tres muestreos destructivos a los 20, 60 y 80 días después de la siembra (dds). En cada uno, se midieron las siguientes variables de respuesta: altura de la planta, peso fresco y seco de la parte aérea y de la raíz, longitud y volumen de raíz, así como área foliar. Adicionalmente, se analizó la asociación simbiótica mora-HFMA a través del porcentaje de colonización en raíz de micorrizas arbusculares, empleando la metodología de tinción con azul de tripán propuesta por Phillips y Hayman (1970), para lo cual se tomaron muestras de raíces a los 20, 60 y 80 dds. Al igual que se evaluaron los porcentajes de supervivencia de las plantas en los mismos lapsos.
Análisis estadístico
Se utilizó el paquete estadístico Statistix 9 y se realizó un análisis de varianza (Anova) para los datos que presentaban distribución normal y homogeneidad de varianzas. Posteriormente, se hizo la prueba a posteriori de Tukey para observar diferencias significativas entre tratamientos (p≤0,05).
Resultados y discusión
Promoción de crecimiento en los ecotipos de mora monterrico (ILS2367), sin espinas (ILS3400) y castilla durante la fase de aclimatación
El suelo es un sistema ambiental complejo y los efectos benéficos de las interacciones con los HFMA y las PGPR dependen tanto de las cepas como de la planta. En este sentido, el efecto de la inoculación de Glomus sp. (GEV02), B. amyloliquefaciens (Bs006), P. migulae (Pf014) y sus respectivas mezclas, en la etapa de aclimatación de vitroplantas de los tres ecotipos de mora, presentaron efectos positivos sobre el crecimiento, siendo similar e incluso superior, en algunos casos, al tratamiento donde se aplicó la fertilización química al 100 %.
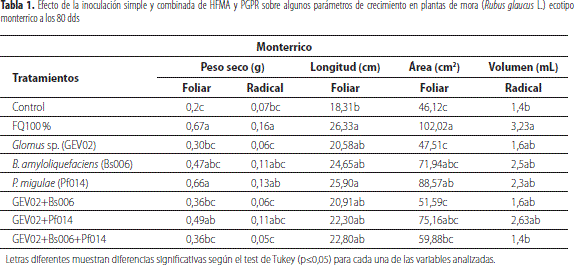
Para el ecotipo monterrico se encontró que los tratamientos inoculados de forma simple con Pf014 y combinada GEV02+Pf014 presentaron valores promedios de peso seco foliar (0,66 g y 0,49 g, respectivamente) y radical (0,13 g para Pf014), longitud foliar (25,90 cm para Pf014 y 22,30 cm para la mezcla), volumen radical (2,3 mL para Pf014 y 2,63 mL para la mezcla) y área foliar (88,57 cm2 para Pf014 y 75,16 cm2 para la mezcla) similares a los obtenidos con el tratamiento de fertilización al 100 % y mayores a los demás tratamientos evaluados, a los 80 dds, de acuerdo con la prueba de comparación de medias de Tukey (tabla 1).
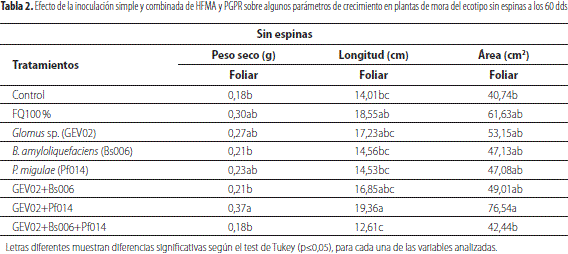
En el caso del ecotipo sin espinas con la aplicación de GEV02+Pf014 se obtuvieron valores en las variables de crecimiento superiores a los registrados con el tratamiento de fertilización química al 100 %. Sin embargo, con la aplicación de solo HFMA los resultados fueron muy cercanos a los obtenidos con esta misma fertilización. Igual tendencia se presentó para los otros parámetros evaluados como longitud foliar y área foliar (tabla 2), donde el tratamiento coinoculado con Glomus sp. (GEV02) y P. migulae (Pf014) presentó los mayores valores promedios en las variables mencionadas anteriormente, de acuerdo con el test de Tukey, en comparación con los testigos (FQ 100 % y control).
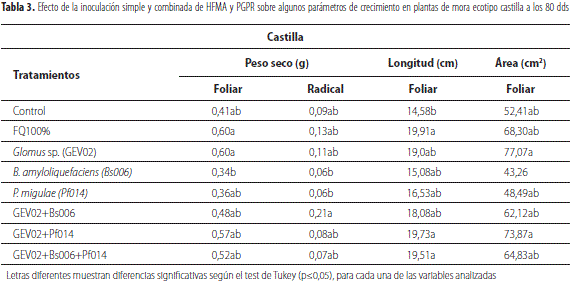
Por otra parte, para el ecotipo castilla se encontró que los tratamientos inoculados de forma simple con GEV02 y combinada GEV02+Bs006, presentaron valores promedios en peso seco foliar (0,60 g) y radical (0,21 g) mayores o iguales al fertilizado químicamente al 100 %, en comparación con los demás tratamientos. Para la longitud foliar se observó que los tratamientos coinoculados con GEV02+Pf014 y GEV02+Bs006+Pf014, obtuvieron valores iguales al FQ 100 %. Sin embargo, los demás tratamientos inoculados con los microorgamismos presentaron valores similares a los obtenidos por los mencionados anteriormente, en comparación, con el tratamiento control, de acuerdo con el test de Tukey (p≤0,05). Finalmente, para el área foliar, el tratamiento coinoculado con GEV02+Pf014 y el inoculado de forma simple con Glomus sp. obtuvieron los mayores valores de área foliar (tabla 3).
Los resultados obtenidos muestran que, para cada ecotipo, se lograron resultados más eficientes con diferentes mezclas de microorganismos. Esto se puede dar porque la rizósfera es un entorno dinámico en donde ocurren interacciones importantes que incluyen interacción planta-planta, planta-microorganismos y microorganismos-microorganismos, la respuesta de estas interacciones puede representar un posible antagonismo o sinergismo, el cual depende de las cepas microbianas implicadas en la interacción, así como de la especie vegetal (Bais et al. 2008; Adesemoye y Kloepper 2009; Lau y Lennon 2011; Nadeem et al. 2013). Todas las interacciones sinérgicas que se observaron en este estudio, repercuten en un aumento en el crecimiento de las plantas debido a los mecanismos de promoción de crecimiento utilizados por los microorganismos tales como la producción de sustancias reguladoras de crecimiento, supresión de patógenos, fijación de nitrógeno y solubilización de fósforo (Ahmad et al. 2008; Hayat et al. 2010; Saharan y Nehra 2011; Bootkotr y Mongkolthanaruk 2012; Nadeem et al. 2013).
En estudios previos se ha observado que estas interacciones también varían entre especies de plantas y una misma bacteria puede reaccionar de manera diferente con otras especies de HFMA. En un estudio realizado en trigo, Jaderlund et al. (2008), se utilizaron dos cepas bacterianas (P. fluorescens SBW25 y P. brasiliensis PB177), y dos HFMA (Glomus mosseae y Glomus intraradices) y un hongo patógeno (Microdochium nivale) para analizar el efecto sobre las plantas bajo invernadero. Estos autores observaron que ambas bacterias afectaban los niveles de colonización de los HFMA de diferentes maneras. El hongo G. intraradices aumentó el peso seco de la planta cuando fue inoculado de forma simple y coinoculado con P. fluorescens, sin embargo, cuando este estuvo coinoculado con P. brasiliensis no se observaron los mismos efectos positivos. Esto es también apoyado por el estudio efectuado por Requena et al. (1997) donde la coinoculación de G. coronatum nativo con la cepa bacteriana P. fluorescens fue más eficaz que con un G. intraradices foráneo.
Adicionalmente, en un estudio que hicieron Rodríguez et al. (2005) en plantas microproapagadas de banano durante la fase de aclimatación, apreciaron que la coinoculación de G. manihotis y un consorcio de rizobacterias del género Bacillus spp., tuvieron los mayores valores en crecimiento y absorción de nutrientes (N, P, K) en comparación con los demás tratamientos. Lo que demuestra aún más los efectos benéficos que pueden tener estos microorganismos en plantas micropropagadas.
Índices de asociación simbiótica en los ecotipos de mora monterrico (ILS2367), sin espinas (ILS3400) y castilla durante las etapas de aclimatación o endurecimiento
Las raíces de las plantas de los tres ecotipos de mora inoculados con Glomus sp. y coinoculados con las rizobacterias fueron colonizadas, obteniéndose los mayores porcentajes de colonización en el tratamiento donde el HFMA se inoculó junto a P. migulae alcanzando valores ≥40 % (figura 1 y 2). Estos resultados concuerdan con los conseguidos en evaluaciones realizadas en el año 2012 dentro del marco del proyecto Manejo Integrado del Cultivo de la Mora de la agenda de Corpoica, en donde el HFMA Glomus sp. (GEV02) fue el que registró los mayores valores de colonización en las raíces de mora.

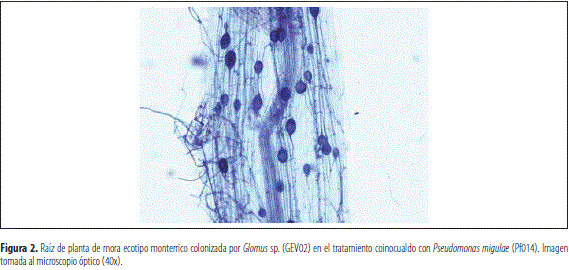
Las interacciones planta-micorrizas ocurren en la zona del suelo que rodea las raíces e hifas del hongo, denominado como micorrizósfera ( Johansson et al. 2004). La colonización de las raíces de las plantas por parte de los HFMA puede influenciar la composición de las comunidades bacterianas en la micorrizósfera; de acuerdo con esto, se plantea un posible efecto sinérgico entre Glomus sp., y P. migulae en comparación con los tratamientos coinoculados con GEV02+Bs006 y el GEV02+Bs006+Pf014. Aunque hay muy poca información sobre los mecanismos que controlan la interacción entre los HFMA y las PGPR, en esta zona (micorrizósfera), los HFMA pueden interactuar con otros microorganismos como bacterias y la interacción sinérgica entre ellos, no solo promueve el crecimiento de las plantas sino que también mejora la población de cada microorganismo (Artursson et al. 2006; Yusran et al. 2009). Las bacterias pueden producir compuestos para aumentar la permeabilidad celular así como para mejorar la tasa de exudación de la raíz, la cual estimula el crecimiento hifal y facilita la penetración de las raíces por parte del hongo ( Jeffries et al. 2003). Por otro lado, los HFMA ayudan a la planta a tolerar algunos estreses bióticos y abióticos aumentando la superficie de las raíces de las plantas para la adquisición de nutrientes (Artursson et al. 2006; Miransari 2010; Sikes 2010; Asif y Bhabatosh 2013).
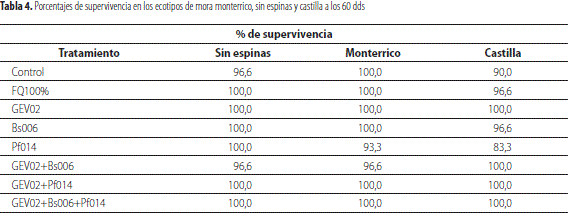
Porcentajes de supervivencia en los ecotipos de mora monterrico (ILS2367), sin espinas (ILS3400) y castilla durante las etapas de aclimatación o endurecimiento
Se obtuvo un alto porcentaje de supervivencia a los 60 dds, encontrándose que los tratamientos inoculados de forma simple con Glomus sp. (GEV02) y combinada, GEV02+Pf014 y GEV02+Bs006+Pf014 obtuvieron los mejores valores (100 %) de supervivencia en todos los 3 ecotipos evaluados, en comparación con los testigos y demás tratamientos (tabla 4).
La transferencia de plántulas cultivadas in vitro a condiciones de invernadero (fase de aclimatación) es uno de los pasos más importantes durante la producción de plántulas. Esta fase es el comienzo de una etapa autotrófica para la planta, en donde tiene que activar los procesos fisiológicos necesarios para su supervivencia. Durante la aclimatación, las plantas deben aumentar la absorción de agua y nutrientes, así como su tasa fotosintética. En diferentes estudios que se han realizado inoculando HFMA y BPCV de forma simple y combinada (Marulanda et al. 2006; Kohler et al. 2010; Ordookhani et al. 2010; Liu et al. 2012; Dohroo y Sharma 2012), se ha podido observar que la interacción entre estos microorganismos podría ser muy útil para reducir el efecto negativo que representa un estrés biótico o abiótico sobre el crecimiento y desarrollo de las plantas, tal y como se pudo observar con los resultados obtenidos en este estudio. Aunque las inoculaciones simples podrían ser útiles en ciertas condiciones, las combinadas con HFMA y BPCV han demostrado ser más eficientes en la toma de agua y la absorción de nutrientes por parte de las plantas (Nadeem et al. 2013).
Conclusiones
Se confirma que la inoculación de HFMA y bacterias promotoras de crecimiento vegetal de forma individual y combinada pueden mejorar el crecimiento y desarrollo de plantas de mora en la fase de aclimatación.
Se encontró un posible efecto sinérgico entre Glomus sp. (GEV02), y las rizobacterias P. migulae (Pf014) y B. amyloliquefaciens (Bs006) y muestra en las variables evaluadas rendimientos similares o superiores al tratamiento de fertilización química en las plantas micropropagadas de los ecotipos monterrico, sin espinas y castilla.
Glomus sp. (GEV02) colonizó tanto en forma individual como combinada todos los ecotipos de mora, y presentó un efecto superior al combinarse con las rizobacterias, lo que permitiría reducir la fertilización de síntesis química hasta en un 50 %.
Se obtuvieron porcentajes de supervivencia superiores al 80 % en los tratamientos que se encontraban coinoculados con el HFMA y las rizobacterias, lo que permite ver el efecto benéfico que tienen estos microorganismos en el crecimiento y el desarrollo de las plantas de mora, dependiendo del ecotipo.
La inoculación adecuada de estos microorganismos benéficos representa una estrategia viable para los procesos de micropropagación de plantas de mora en la fase de aclimatación, las plantas micropropagadas podrían ser llevadas a campo con una rizósfera microbiana ya establecida lo que contribuiría a una fácil adaptación de dichas plantas a estas condiciones. Sin embargo, debido a la alta variación en la respuesta funcional de la planta asociada con estos microorganismos se debería realizar más investigación para poder seleccionar la mejor combinación y optimizar los resultados aquí mostrados, ya que en algunos estudios se ha observado una baja incompatibilidad entre ciertas cepas de BPCV con HFMA; por lo tanto, se debe ser cuidadoso con la selección de microorganismos.
Referencias
Adesemoye AO, Kloepper JW. 2009. Plant-microbes interactions in enhanced fertilizer-use efficiency. Appl Microbiol Biotechnol. 85(1):1-12. [ Links ]
Ahmad F, Ahmad I, Khan MS. 2008. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities. Microbiol Res. 163(2):173-181. [ Links ]
Alarcón A, Ferrera-Cerrato R. 2000. Ecología, fisiología y biotecnología de la micorriza arbuscular. México: Mundi-Prensa. [ Links ]
Artursson V, Finlay RD, Jansson JK. 2006. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environ Microbiol. 8(1):1-10. [ Links ]
Asif M, Bhabatosh M. 2013. Effects of inoculation with stress-adapted arbuscular mycorrhizal fungus Glomus deserticola on growth of Solanum melogena L. and Sorghum sudanese Staph. seedlings under salinity and heavy metal stress conditions. Arch Agron Soil Sci. 59(2):173-183. [ Links ]
Bais HP, Broeckling CD, Vivanco JB. 2008. Root exudates modulates plant-microbe interaction in the rhizosphere. En: Karlovsky P, editor. Secondary metabolites in soil ecology. Heidleberg: Springer-Verlag. [ Links ]
Barea JM, Azcón-Aguilar C, Azcón R. 1997. Interactions between mycorrhizal fungi and rhizosphere microorganisms within the context of sustainable soil-plant systems. En: Gange AC, Brown VK, editores. Multitrophic interactions in terrestrial systems. Oxford: Blackwell Science. pp. 65-77. [ Links ]
Barea JM, Gryndler M, Lemanceau P, Schüepp H, Azcón R. 2002. The rhizosphere of mycorrhizal plants. En: Gianinazzi S, Schüepp H, Barea JM, Haselwandter K, editores. Mycorrhizal technology in agriculture: from genes to bioproducts. Basel: BirkhäuserVerlag. pp. 1-18. [ Links ]
Barrero M, editor. 2009. Caracterización, evaluación y producción de material limpio de mora con alto valor agregado. Mosquera: Corpoica. [ Links ]
Bonfante P, Anca IA. 2009. Plants, mycorrhizal fungi, and bacteria: a network of interactions. Annu Rev Microbiol. 63:363-383. [ Links ]
Bootkotr W, Mongkolthanaruk W. 2012. Properties of bacteria beneficial to the promotion of plant growth. Ponencia presentada en: International Conference on Life Science & Biological Engineering ; Singapur. [ Links ]
Castaño CA, Morales CS, Obando FH. 2008. Evaluación de las deficiencias nutricionales en el cultivo de la mora (Rubus glaucus) en condiciones controladas para bosque montano bajo. Agron. 16(1):75-88. [ Links ]
Díaz A, Smith A, Mesa, P, Zapata J, Caviedes D, Cotes AM. 2013. Control of Fusarium wilt in cape gooseberry by Trichoderma koningiopsis and PGPR. En: Pertot I, Elad Y, Barka EA, Clément C, editores. Working group biological control of fungal and bacterial plant pathogens. IOBC bulletin. Volumen 86. pp. 89-94. [ Links ]
Dohroo A, Sharma DR. 2012. Role of plant growth promoting rhizobacteria, arbuscular mycorrhizal fungi and their helper bacteria on growth parameters and root rot of apple. WJST. 2(12):35-38. [ Links ]
Elmeskaoui A, Damont J, Poulin M, Piché Y, Desjardins Y. 1995.A tripartite culture system for endomycorrhizal inoculation of micropropagated strawberry plantlets in vitro. Mycorrhiza. 5:313-319. [ Links ]
Gendermann JW, Nicholson TH. 1963. Spores of mycorrhizal endogone species extracted from soil by wet sieving and decanting. T Brit Mycol Soc. 46(2):235-244. [ Links ]
Hayat R, Ali S, Amara U, Khalid R, Ahmed I. 2010. Soil beneficial bacteria and their role in plant growth promotion: a review. Ann Microbiol. 60:579-598. [ Links ]
Hoagland DR, Arnon DI. 1950. The water culture method for growing plants without soil. California Agricultural Experiment Station Circular 347. Berkeley: College of Agriculture, University of California. [ Links ]
Jaderlund L, Arthurson V, Granhall U, Jansson JK. 2008. Specific interactions between arbuscular mycorrhizal fungi and plant growth-promoting bacteria: as revealed by different combinations. FEMS Microbiol Lett. 287(2):174-180. [ Links ]
Jaizme-Vega MC, Rodríguez-Romero AS. 2004. Usos de micorrizas en banano: logros y perspectivas. En: Orozco-Santos M, Orozco-Romero J, Robles-González M, Velázquez-Monreal J, Medina-Urrutia V, Hernández-Bautista JA, editores. XVI Reunión Internacional Acorbat. Oaxaca: Acorbat. pp. 143-160. [ Links ]
Jeffries P, Gianinazzi S, Perotto S, Turnau K, Barea JM. 2003. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biol Fertil Soils. 37:1-16. [ Links ]
Johansson JF, Paul LR, Finlay RD. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. FEMS Microbiol Ecol. 48(1):1-13. [ Links ]
Kapoor R, Sharma D, Bhatnagar AK. 2008. Arbuscular mycorrhizae in micropropagation systems and their potential applications. Sci Hort. 116(3):227-239. [ Links ]
Kohler J, Caravaca F, Roldan A. 2010. An AM fungus and a PGPR intensify the adverse effects of salinity on the stability of rhizosphere soil aggregates of Lactuca sativa. Soil Biol Biochem. 42(3):429-434. [ Links ]
Kloepper JW. 1996. Host specificity in microbe-microbe interactions. Bio Science. 46(6):406-409. [ Links ]
Lau JA, Lennon JT. 2011. Evolutionary ecolog y of plant-microbe interactions: soil microbial structure alters selection on plant traits. New Phytol. 192(1):215-224. [ Links ]
Liu R, Dai M, Wu X, Li M, Liu X. 2012. Suppression of the root-knot nematode [Meloidog yne incognita (Kofoid & White) Chitwood] on tomato by dual inoculation with arbuscular mycorrhizal fungi and plant growth-promoting rhizobacteria. Mycorrhiza. 22(4):289-296. [ Links ]
Marulanda A, Barea JM, Azcón R. 2006. An indigenous drought-tolerant strain of Glomus intraradices associated with a native bacterium improves water transport and root development in Retama sphaerocarpa. Microb Ecol. 52(4):670-678. [ Links ]
Marulanda ML, López AM, Arias J, López JM. 2011. Biodiversidad y biotecnología en la evaluación y selección de cultivares promisorios de mora de castilla. Pereira: Pibliprint Ltda. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2012. Anuario estadístico de frutas y hortalizas. Agronet [consultado 2014 feb]. http://www.agronet.gov.co/www/htm3b/public/Anuario/ANUARIO%20ESTADISTICO%20DE%20FRUTAS%20Y%20HORTALIZAS%202011.pdf. [ Links ]
Miransari M. 2010. Contribution of arbuscular mycorrhizal symbiosis to plant growth under different types of soil stress. Plant Biol. 12(4):563569. [ Links ]
Nadeem SM, Ahmad M, Zahir AZ, Javaid A, Ashraf M. 2013. The role of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving crop productivity under stressful environments. Biotech Adv. 32(2):429-448. [ Links ]
Nowak J. 1998. Benefits of in vitro biotization of plant tissue cultures with microbial inoculants. In Vitro Cell Dev Biol Plant. 34(2):122-130. [ Links ]
Ordookhani K, Khavazi K, Moezzi A, Rejali F. 2010. Influence of PGPR and AMF on antioxidant activity, lycopene and potassium contents in tomato. Afr J Agric Res. 5(10):1108-1116. [ Links ]
Pérez-Moncada UA, Ramírez-Gómez MM, Nuñez-Zarante VM, Franco-Correa M, Roveda-Hoyos G. 2012. Evaluación de un sistema para la micorrización in vitro en plantas de mora de castilla (Rubus glaucus Benth). Univ Sci. 17(2):140-151. [ Links ]
Phillips JM, Hayman DS. 1970. Improved procedure of clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. T Brit Mycol Soc. 55(1):159-161. [ Links ]
Raaman N, Patharajan S. 2006. Integration of arbuscular mycorrhizal fungi with micropropagated plants. En: Mukerji KG, Manoharachary C, editores. Current concepts in botany. Delhi: IK International Publishing House. pp. 235-250. [ Links ]
Requena N, Jimenez I, Toro M, Barea JM. 1997. Interactions between plant-growth-promoting rhizobacteria (PGPR), arbuscular mycorrhizal fungi and Rhizobium spp. in the rhizosphere of Anthyllis cytisoides, a model legume for revegetation in mediterranean semi-arid ecosystems. New Phytol. 136(4):667-677. [ Links ]
Rodríguez-Romero AS, Guerra MSP, Jaizme-Vega MC. 2005. Effect of arbuscular mycorrhizal fungi and rhizobacteria on banana growth and nutrition. Agron Sustain Dev. 25(3):395-399. [ Links ]
Roveda G, Cabra L, Ramírez MM, Peñaranda A. 2007. Efecto de las micorrizas arbusculares sobre la aclimatación y endurecimiento de microplántulas de mora (Rubus glaucus). Corpoica Cienc Tecnol Agropecu. 8(1):28-36. [ Links ]
Saharan BS, Nehra V. 2011. Plant growth promoting rhizobacteria: a critical review. Life Sci Med Res. LSMR-21. [ Links ]
Schultz C. 2001. Effect of vesicular-arbuscular mycorrhiza on survival and post vitro development of micropropagated oil palms (Elaeis guineensis Jacq.) [tesis doctoral]. [Göttingen]: Universidad Göttingen. [ Links ]
Sikes BA. 2010. When do arbuscular mycorrhizal fungi protect plant roots from pathogens? Plant Signal Behav. 5(6):763-765. [ Links ]
Smith SE, Read DJ. 1997. Mycorrhizal symbiosis. Londres: Academic Press. [ Links ]
Valderrama AM, Álvarez R, Barrero LS, Robayo M, Núñez V. 2009. Validación y escalamiento de plántulas de mora in vitro y manejo ex vitro para entrega a agricultores de Silvania. En: Barrero LS, editor. Caracterización, evaluación y producción de material limpio de mora con alto valor agregado. Bogotá: Produmedios. pp. 64-75. [ Links ]
Yusran Y, Roemheld V, Mueller T. 2009. Effects of plant growth- promoting rhizobacteria and Rhizobium on mycorrhizal development and growth of Paraserianthes falcataria (L.) nielsen seedlings in two types of soils with contrasting levels of pH. Publicaciónpresentada en la conferencia: The Proceedings of the XVI International Plant Nutrition Colloquium; Davis, Estados Unidos. [ Links ]













