Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.16 no.2 Mosquera July/Dec. 2015
Entomopatógenos asociados a cítricos y su patogenicidad sobre Compsus viridivittatus Guérin-Méneville (Coleoptera: Curculionidae)
Entomopathogens Associated to Citrus and Their Pathogenicity on Compsus viridivittatus Guérin-Méneville (Coleoptera: Curculionidae: Entiminae)
Paola Andrea Zuluaga-Cárdenas,1 Ana Milena Caicedo-Vallejo,2 Nancy Cardozo-Santamaría,3 Jaime Eduardo Muñoz-Flórez,4 Arturo Carabalí-Muñoz5
1 Ingeniera agronómica, Universidad Nacional de Colombia Sede Palmira. Asistente técnico, independiente. Roldanillo, Colombia. paolaazuluaga@gmail.com
2 PhD, Universidad del Valle. Coordinadora Proyecto Plagas Cuarentenarias de Aguacate Hass, Instituto Colombiano Agropecuario-ICA. Rionegro, Colombia. ana.caicedo@ica.gov.co/anam.caicedo@gmail.com
3 Técnica agropecuaria, Instituto Técnico Agrícola Sede Buga. Técnico en producción de entomopatógenos, Agricultura Biológica. Buga, Colombia. bioecologicos1@hotmail.com
4 PhD, Universidad Nacional de Colombia Sede Palmira. Profesor Asociado, Universidad Nacional de Colombia Sede Palmira. Palmira, Colombia. jemunozf@unal.edu.co
5 PhD, Universidad del Valle. Investigador PhD, Corpoica. Palmira, Colombia. acarabali@corpoica.org.co
Fecha de recepción: 13/05/2014 Fecha de aceptación: 20/04/2015
Para citar este artículo: Zuluaga-Cárdenas PA, Caicedo-Vallejo AM, Cardozo-Santamaría N, Muñoz-Flórez JE, Carabalí-Muñoz A. Entomopatógenos asociados a cítricos y su patogenicidad sobre Compsus viridivittatus Guérin-Méneville (Coleoptera: Curculionidae). Corpoica Cienc Tecnol Agropecu. 16(2): 293-305
Resumen
C. viridivittatus, picudo de los cítricos está distribuido en región andina y cafetera de Colombia. Las larvas se alimentan de raíces y los adultos de hojas y flores. En tres fincas citrícolas del Valle del Cauca se aislaron y evaluaron hongos y nematodos entomopatógenos M. anisopliae y B. bassiana y Steinernema sp. y Heterorabditis sp. sobre larvas de C. viridivittatus 26, 36, 48 y 53 días de edad. En 120 de 132 muestras de suelo se encontraron 21 aislamientos de Metarhizium y Beauveria y ninguna con nematodos entomopatógenos. B. bassiana comercial, B9 y B10 causaron el 100 % de mortalidad en adultos en 4 y 4,3 días. M. anisopliae M6 y M7 causaron el 94 % y 97 % de mortalidad a los 4,3 y 5 días. Steinernema sp. UNS09 causó 65 % de mortalidad sobre larvas de 48 y 53 días de edad en siete días. No hubo diferencia entre Steinernema UNS09 y Heterorhabditis UNH16. Steinernema sp. UNS09 causó 85,7 % mortalidad a larvas de 53 días y 81,9 % y 81,1 % a larvas de 36 y 26 días y Heterorhabditis sp. UNH16 con 79 %, 81 % y 75,4 % de mortalidad sobre larvas de 36, 26 y 56 días a los siete días. En síntesis, los hongos y nematodos entomopatógenos pueden considerarse como alternativa de manejo de larvas de C. viridivittatus.
Palabras clave: Beauveria bassiana, Metarhizium anisopliae, Steinernema, Heterorhabditis, hongos entomopatógenos, control de plagas, aislamiento.
Abstract
C. viridivittatus, citrus weevil distributed throughout the coffee maker and Andean region of Colombia. The larvae feed on roots and adults on leaves and flowers. On three citrus farms of the Valley were isolate and evaluated fungi and entompathogenic nematodes M. anisopliae and B. bassiana and Steinernema sp. and Heterorabditis sp. on larvae of C. viridivittatus 26, 36, 48 and 53 days of age. In 120 from 132 soil samples were found 21 fungi and none nematodes. Commercial B. bassiana B9 and B10 caused 100 % adult mortality in a time of 4.3 and 4 days. M. anisopliae M6 y M7 caused 94 % and 97 % of mortality to the 4.3 and 5 days. Steinernema sp. UNS09 caused 65 % of mortality on larvae of 48 and 53 days of age, seven days later. No were differences between UNS09 Steinernema and Heterorhabditis UNH16. Steinernema sp. UNS09 caused 85.7 % of mortality on 53 days larvae and 81.9 % and 81.1 % to larvae of 36 and 26 days. Heterorhabditis sp. UNH16 killed larvae of 36, 26 and 56 days was 79 %, 81 % and 75.4 % seven days later. In conclusion, fungi and nematodes can be an alternative to management of C. viridivittatus larvae.
Key words: Beauveria bassiana, Metarhizium anisopliae, Steinernema, Heterorhabditis, Entomogenous fungis, Pest control, Isolation.
Introducción
El picudo de los cítricos, C. viridivittatus Guérin-Méneville 1855, es considerado una de las principales especies-plaga de los cítricos en Colombia. Se encuentra distribuida en los departamentos de Antioquia, Caldas, Cundinamarca, Quindío, Risaralda, Santander, Tolima y Valle del Cauca (O'Brien y Peña 2012).
Según Cano et al. (2002), el adulto permanece en promedio entre 9 y 12 meses, se alimentan de hojas del tercio medio de las ramas durante todo el día, realizando cortes irregulares en las márgenes de las hojas, ovarios, pétalos y frutos recién formados. Se ha observado daño en hojas nuevas y viejas ubicadas en la parte media inferior externa del árbol. Las posturas en campo no son fáciles de detectar, aunque la hembra las pega entre dos hojas. Las pérdidas ocasionadas por daño foliar se estiman mayores al 50 % en árboles jóvenes y hasta 15-25 % en árboles en producción (Roa 2001).
Las larvas recién emergidas caen al suelo, se profundizan e inician el proceso de alimentación sobre la corteza y el interior de las raíces jóvenes, durante 5-10 meses, lo que causa debilitamiento de la planta, disminución del crecimiento, muerte de brotes terminales, reducción del tamaño de frutos, floraciones abundantes y bajo porcentaje de formación de frutos (Roa et al. 2001; Cano et al. 2002). Además, las heridas que ocasionan favorecen el ingreso de hongos causantes de pudriciones, Ceratocystis fimbriata, Rosellinia spp. y Phytophthora spp., lo que reduce el ciclo productivo y genera el deterioro de las plantaciones en dos o tres años (Roa 2001).
Desde el año 1995 se han registrado aumentos de la población de C. viridivittatus en los departamentos del Quindío, Valle del Cauca, Tolima, Antioquia, Cundinamarca y Risaralda, en cultivos de lima ácida Tahití, Citrus reticulata L., naranja valencia, Citrus sinensis L. Osbeck y otros cítricos (Roa 2001). Desde entonces, las recomendaciones de manejo se han enfocado principalmente en el uso de insecticidas para controlar las poblaciones de adultos y como disuasores de la oviposición, lo que ocasiona desequilibrio ambiental, y reduce las poblaciones de los principales enemigos naturales, que se refleja en el aumento de adultos capturados por árbol de 1 a 20 individuos y con la posibilidad de adquirir resistencia a los insecticidas usados (Cano 2000).
Entre las opciones para el manejo de poblaciones de adultos y larvas de varias especies de curculiónidosfitófagos que cumplen gran parte de su ciclo de vida en el suelo como Diaprepes abbreviatus en cítricos (Duncan y McCoy 1996; Bullock et al. 1999) y el picudo de los viñedos Otiorhynchus sulcatus (F.) (Bedding y Miller 1981; Simons 1981; Shanks y Agudelo-Silva 1990), los hongos y nematodos entomopatógenos, habitantes naturales del suelo, ofrecen gran potencial para el control biológico de los primeros estadios larvales (McCoy et al. 2003).
Hongos entomopatógenos como Beauveria bassiana (Balsamo) Vuillemin y Metarhizium anisopliae (Metchnikoff ) Sorokin y nematodos de los géneros Steinernema y Heterorhabditis, estos últimos poseen una asociación mutualista con bacterias de los géneros Xenorhabdus y Photorhabdus, que conservan en su intestino (Kaya y Stock 1997) y son considerados como la única herramienta disponible para el control de larvas de la especie D. abbreviatus en plantaciones de cítricos del estado de la Florida, en Estados Unidos (McCoy et al. 2003).
En Colombia, solo se conoce el registro de entomopatógenos asociados a C. viridivittatus realizado por Cano et al. (2002), quienes mencionan los hongos entomopatógenos M. anisopliae y B. bassiana aislados naturalmente de larvas, adultos y pupas en los departamentos de Quindío y Tolima. Con nematodos, los mismos autores solo hacen referencia al hallazgo de un adulto sin emerger del suelo afectado posiblemente por un Heterorhabditis.
Ante la escasez de trabajos científicos que contribuyan a la implementación de programas de manejo integrado con microorganismos de las poblaciones de C. viridivittatus en campo, se propuso realizar el reconocimiento de hongos y nematodos entomopatógenos presentes en el suelo de tres fincas productoras de cítricos del municipio de Caicedonia y evaluar la patogenicidad de cuatro aislamientos nativos de B. bassiana y M. anisopliae sobre adultos y tres aislamientos nativos de Steinernema sp. y uno de Heterorhabditis sp. sobre larvas en laboratorio.
Materiales y métodos
El estudio se realizó entre enero de 2009 y marzo de 2011 en la Universidad Nacional de Colombia, sede Palmira, Valle del Cauca, Colombia (1.001 msnm, 3° 34' 60,0" N 76° 15' 0,0" O; temperatura promedio 23,5 °C; humedad relativa del 77%; precipitación anual de 1.174 mm; evaporación de 1.640,4 mm por año) en alianza con la Corporación Colombiana de Investigación Agropecuaria (Corpoica) CI Palmira en el marco del proyecto de manejo integrado de C. viridivittatus financiado por el Ministerio de Agricultura y Desarrollo Rural (MADR) y tres fincas productoras de cítricos del municipio de Caicedonia.
Colecta de muestras
Las muestras de suelo se colectaron aleatoriamente en tres fincas productoras de cítricos ubicadas en el municipio de Caicedonia: Las Brisas, lote 14: 4° 23' 48.00” N 75° 50' 58.44” O a 1.067 msnm y lote 11: 4° 23' 29.93” N 75° 50' 42.59” O a 1.092 msnm; Casa Brava, lote 5: 4°21'48.72”N- 75°50'40.18”O a 1108 msnm; y El Recreo, lote 5: 4° 19' 31.63” N 75° 49' 29.88” O a 1.182 msnm.
De cada finca se seleccionaron diez sitios al azar y de cada uno se tomaron de tres a cinco muestras de suelo con un barreno de 10 cm de diámetro, a una distancia de 30 m aproximadamente, 30 cm de la base del tallo de los árboles y una profundidad 40 cm. Entre muestras, el barreno se limpió con agua y después se sumergió en una solución de hipoclorito de sodio (NaClO) al 5 % y se secó al aire para prevenir contaminación entre muestras. El suelo se mezcló completamente y se colocó en una bolsa plástica previamente rotulada con toda la información pertinente a cada muestra.
Aislamiento, identificación y reproducción de entomopatógenos
Las muestras de suelo de cada sitio se mezclaron y se procesaron diez submuestras de 300 g, con diez larvas de Diatraea saccharalis en último instar larval (Fabricius) (Lep: Pyralidae) como insecto-trampa y se almacenaron a temperatura ambiente (25 ± 3 ºC y HR 65 ± 5 %) durante siete días de acuerdo a la metodología de Zimmerman (1986). Cada muestra se procesó tres veces.
A partir de las larvas de D. saccharalis que se utilizaron como cebo, se seleccionaron las larvas que presentaron signos de infección por hongos entomopatógenos, se desinfectaron con hipoclorito de sodio al 1 % durante tres minutos y tres lavados con agua destilada estéril (ADE). Se secaron en toalla estéril, se sembraron en Sabouraud dextrose agar (SDA) en cámara de flujo laminar y se incubaron a 27 ºC durante siete días. Los hongos se aislaron y purificaron en (SDA) a 27 ± 2 °C bajo condiciones de luz natural. La identificación se realizó con el uso de claves taxonómicas de acuerdo a las características morfológicas de las conidias (Hanlin 1990; Barnett y Hunter 1998; Leslie y Summerell 2006). El almacenamiento se efectuó en glicerol al 10 % a 20 ºC. La producción masiva se realizó en el laboratorio en botellas con arroz precocido (Vélez et al. 1997).
Aislamiento, identificación y multiplicación de nematodos entomopatógenos (NEP)
Las muestras de suelo previamente humedecido de cada sitio se mezclaron y se tomaron diez submuestras de 300 g. A cada una se le adicionaron diez larvas de último instar larval de D. saccharalis y se almacenaron a temperatura ambiente (25 ± 3ºC y HR 65 ± 5 %) durante siete días de acuerdo al método descrito por Bedding y Akhurst (1975). Las larvas se revisaron cada dos días. Las larvas muertas de cada muestra se revisaron y se colocaron en trampas White para la colecta de los infectivos juveniles (IJS) y se reemplazaron por larvas sanas. Los IJS recuperados se decantaron tres veces con agua destilada estéril (ADE) y se desinfectaron con formaldehído al 0,001 %. Posteriormente, se sometieron a los postulados de Koch para comprobar su patogenicidad utilizando larvas sanas de último instar larval de D. saccharalis. La identificación de los nematodos entomopatógenos se realizó con la clave taxonómica de Kaya y Stock (1997).
Selección de hongos entomopatógenos
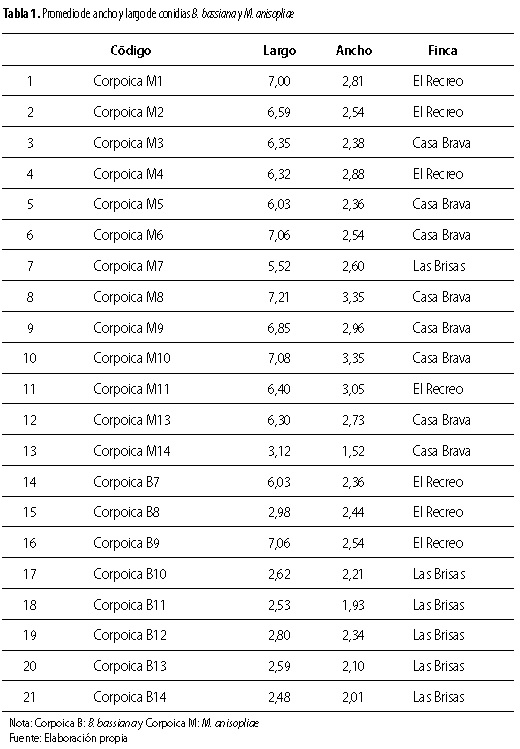
Teniendo en cuenta que el tamaño de las conidias es una característica importante para la producción masiva, se seleccionaron dos aislamientos de cada género de hongo, uno con conidias pequeñas y otro con grandes de M. anisopliae Corpoica M6, Corpoica M7 y de B. bassiana Corpoica B9 y Corpoica B10. El largo y ancho se midió con la ayuda del software Nikon Image Analyzer v. 2008 (tabla 1).
Adultos de C. viridivittatus
Los adultos de Compsus sp. recién emergidos se colectaron de trampas de emergencia tipo cono (Cardona 2010), instaladas en cada una de las fincas seleccionadas del municipio de Caicedonia (Las Brisas, El Recreo y Casa Brava) y trasladados al laboratorio. Antes de realizar su confinación en bandejas plásticas (20x20x20 cm), se realizó el proceso de confirmación taxonómica de la especie con el uso de la clave para la identificación de adultos descrita por O'Brien y Peña (2012).
Los adultos se alimentaron con hojas frescas de limón pajarito, C. aurantifolia (Christ.), previamente desinfectadas con una solución de hipoclorito al 3 % y para oviposición se le adicionaron tiras de 1 cm de ancho x 3 cm de largo de papel Parafilm®.
Cría de larvas C. viridivittatus
La cría se estableció en el laboratorio de insectos de la Universidad Nacional de Colombia, sede Palmira, con temperatura de 23 °C ± 5 y humedad relativa de 66% ± 7 a partir de posturas colectadas de los adultos confinados en laboratorio y previa identificación de la especie. Se revisó diariamente la presencia de posturas para su seguimiento y desarrollo en cámaras de emergencia consistentes en bandejas plásticas (20x20x20 cm), tapa con un área cubierta de muselina para permitir el intercambio de oxígeno y papel toalla para prevenir la acumulación de humedad y facilitar la limpieza de la unidad de cría.
Las larvas recién emergidas (figura 1a) se distribuyeron en vasos plásticos de 23 onzas con 10 g de arena estéril (120 °C durante 15 minutos) y trozos de zanahoria durante 70 días (figura 1b y c). El suministro de alimento se realizó cada tres días.
Patogenicidad de hongos entomopatógenos sobre adultos de C. viridivittatus
Se evaluó la patogenicidad de cuatro aislamientos nativos de B. bassiana y M. anisopliae, un testigo comercial de B. bassiana a una concentración estándar de 1x1010 esporas/ml. El tratamiento testigo fue agua destilada estéril (ADE). Los hongos se multiplicaron en arroz precocido y las conidias se cosecharon a los 25 días en una solución de Tween® al 1 %. Las suspensiones se homogenizaron con vórtex durante cinco minutos.
La cuantificación de esporas se realizó con un hematocímetro mediante diluciones seriales hasta obtener la concentración óptima para conteo. La viabilidad de las conidias se determinó antes de cada ensayo, sembrando 0,1 ml de la concentración 1 x 1010 sobre placas de SDA e incubados a 27 ± 2 °C. La germinación se evaluó 12 horas después. El porcentaje de germinación se determinó del conteo de 100 esporas a una magnificación de 40x y tres repeticiones, de acuerdo a la metodología de Vélez et al. (1997).
Los insectos se desinfectaron en una solución de hipoclorito de sodio al 3% durante tres minutos y tres lavados sucesivos con ADE y su posterior secado se hizo en toallas de papel estéril. El tratamiento consistió en la inmersión de diez insectos en cada solución de hongo con una concentración de 1x1010 esporas/ml e individualizados en vasos plásticos (3x2x2 cm), con un disco de papel estéril y una rama con hojas de limón pajarito. El tratamiento control contó con el mismo número de insectos inoculados con ADE. El diseño experimental fue de bloques al azar y tres repeticiones en el tiempo.
La evaluación se realizó diariamente durante cinco días y se adicionó alimento nuevo cuando fue necesario. Se registraron individuos vivos o muertos con o sin signos de micosis, los cuales se individualizaron en cámaras húmedas en vasos plásticos con papel toalla estéril y humedecida con ADE hasta observar la esporulación del hongo para confirmar el agente causal de la muerte.
Los datos obtenidos se examinaron mediante un análisis de varianza y los promedios se compararon con la prueba de rango múltiple de Duncan (SAS Institute 2003).
Patogenicidad de nematodos entomopatógenos nativos sobre larvas
Los nematodos entomopatógenos se reactivaron sobre larvas de último instar de D. saccharalis siguiendo la metodología de Kaya y Stock (1997); se almacenaron en nevera a una temperatura de 6-7 °C máximo ocho días antes de la inoculación.
Los aislamientos nativos de Steinernema sp. UNPS09, UNPS12 y UNP01 fueron obtenidos en trabajos previos de reconocimiento realizados por Caicedo et al. (2011) y Méndez, Riascos y Caicedo (2011), quienes identificaron el género con la clave de Kaya y Stock (1997).
Se realizó un primer ensayo para evaluar la patogenicidad sobre larvas de C. viridivittatus de 48 y 53 días de edad. La unidad experimental consistió de un vaso (23 oz) con 40 g de arena estéril, un trozo de zanahoria, una larva de C. viridivittatus (desinfectada previamente con hipoclorito de sodio al 3 %, durante 3 minutos y 3 lavados con ADE) y una concentración de nematodos, 1.000 IJS/ml de cada aislamiento. Los nematodos se aplicaron en el centro del sustrato. Al tratamiento testigo se le adicionó un ml de ADE.
Cada tratamiento contó con diez larvas por aislamiento y tres repeticiones en el tiempo, en un diseño de bloques al azar. Se evaluó el número de larvas vivas o muertas diariamente durante siete días. Los datos obtenidos se analizaron mediante un análisis de varianza y los promedios se compararon con la prueba de rango múltiple de Duncan (SAS Institute 2003).
Evaluación de Steinernema sp. y Heterorabditis sp. sobre larvas de C. viridivittatus
Se seleccionó el aislamiento del género Steinernema sp. que causó el mayor porcentaje de mortalidad a las larvas de C. viridivittatus. El aislamiento UNS09 fue el seleccionado y se adicionó el nematodo nativo del género Heterorabditis sp. UNH16 sobre larvas de 53, 36 y 26 días.
La unidad experimental fue la misma del ensayo pero con dos concentraciones de nematodos, 500 y 4.000 IJS/ml de cada aislamiento; los nematodos se aplicaron en el centro del sustrato; y al tratamiento testigo se le adicionó un ml de ADE.
Cada tratamiento contó con diez larvas por aislamiento y tres repeticiones en el tiempo en un diseño de bloques al azar. Se evaluó el número de larvas vivas o muertas diariamente durante siete días con la concentración de 4.000 IJS/ml y nueve días con la concentración de 500 IJS/ml. Los datos obtenidos se analizaron mediante un análisis de varianza y los promedios se compararon con la prueba de rango múltiple de Duncan (SAS Institute 2003).
Resultados
Aislamiento de hongos entomopatógenos nativos
Se colectaron 132 muestras de suelo, de las cuales 120 resultaron positivas para hongos entomopatógenos. Se recuperaron 21 aislamientos, 13 de M. anisopliae y 8 de B. bassiana. Esta última se recuperó en mayor proporción de la finca Las Brisas con cinco aislamientos y tres de la finca El Recreo. M. anisopliae se recuperó principalmente de la finca Casa Brava (tabla 1).
La recuperación de NEP de las muestras de suelo fue negativa en todas las muestras procesadas. No fue posible obtener larvas de D. saccharallis con sintomatología de infección de NEP, en cambio, predominó la sintomatología por hongos entomopatógenos.
Evaluación de patogenicidad de hongos entomopatógenos sobre adultos de C. viridivittatus
C. viridivittatus resultó susceptible a todos los aislamientos de hongos entomopatógenos evaluados (figura 2a) y no se observó diferencia significativa entre los aislamientos evaluados. El 100 % de mortalidad se presentó con las cepas Corpoica B9, Corpoica B10 (figura 2b) de las fincas El Recreo y Las Brisas y la cepa comercial de B. bassiana en un tiempo de 4 y 4,3 días, respectivamente. Las cepas Corpoica M6 y Corpoica M7 (figura 2c) de M. anisopliae de las fincas Casa Brava y Las Brisas causaron mortalidades de 94 % y 97 % a los 4,3 y 5 días, respectivamente.
Patogenicidad de NEP sobre larvas de C. viridivittatus
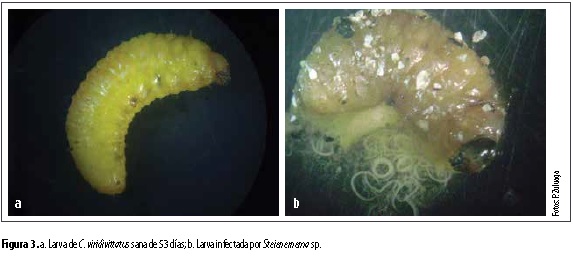
Los tres aislamientos nativos de nematodos entomopatógenos del género Steinernema fueron capaces de causar mortalidad sobre larvas de C. viridivittatus (figura 3a). Este es el primer registro de evaluación de aislamientos nativos de nematodos entomopatógenos sobre larvas del picudo de los cítricos obtenidas en cría de laboratorio (figura 3b).
No se presentaron diferencias entre los aislamientos de Steinernema evaluados. El aislamiento UNS09 causó el 65% de mortalidad sobre larvas de 48 y 53 días de edad, 7 días después de inoculados. Los aislamientos UNS01 y UNS12 causaron 56% y 42,5% de mortalidad, respectivamente.
Evaluación de patogenicidad de Steinernema sp. y Heterorhabditis sp.
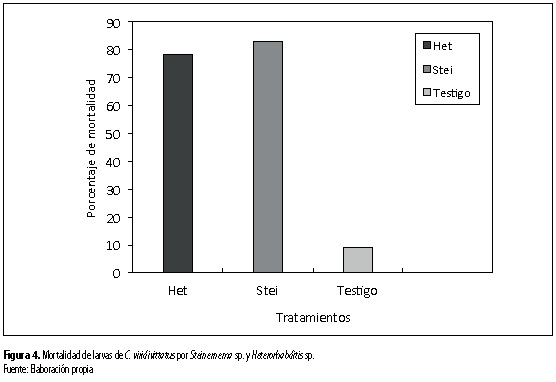
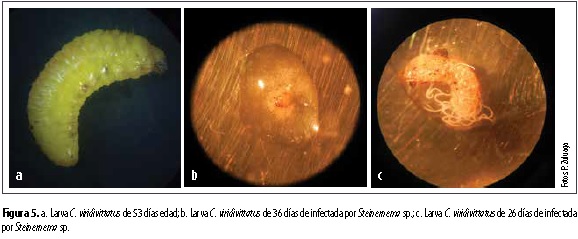
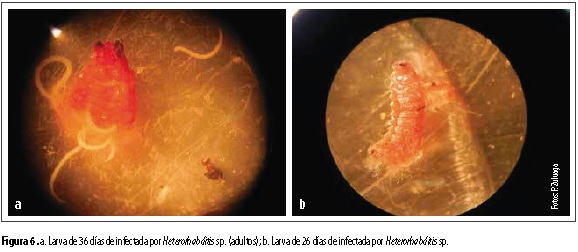
Los aislamientos de los dos géneros de NEP fueron capaces de causar mortalidad a las larvas de C. viridivittatus sin presentar diferencias (figura 4). Steinernema sp. UNS09 causó 85,7 % de mortalidad sobre larvas de 53 días (figura 5a), 81,9 % sobre larvas de 36 días (figura 5b) y 81,1 % de mortalidad sobre larvas de 26 días (figura 5c), respectivamente. Mientras que Heterorhabditis sp. UNH16 causó 81 %, 79 % y 75,4 % sobre larvas de 36 (figura 6a), 26 (figura 6b) y 56 días, respectivamente. En la figura 7 se observa la diferencia en coloración de las larvas de C. viridivittatus de diferentes edades de desarrollo (53, 36 y 26 días) causada por la infección de los nematodos entomopatógenos de los géneros Heterorhabditis y Steinernema.
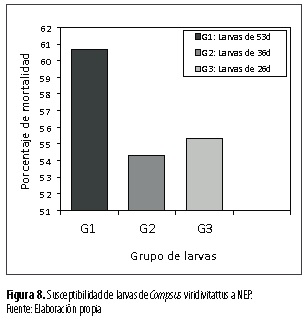
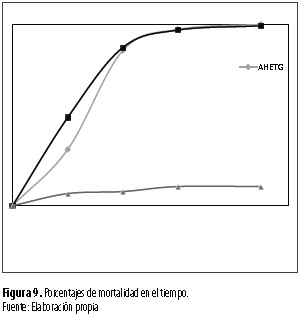
Se destaca que las larvas de 53 días de edad se observaron como las más susceptibles a las dos especies de nematodos con 60,6 % de mortalidad (figura 8) siete días después de inoculados (figura 9).
Discusión
El hallazgo y la disponibilidad de 21 aislamientos de hongos entomopatógenos en tres fincas productoras de cítricos del municipio de Caicedonia (Valle del Cauca), permiten considerar que las condiciones ecológicas son aptas para su uso como alternativa viable en la implementación de programas de manejo integrado de C. viridivittatus. Esta oferta de hongos contrasta con lo reportado por Cano et al. (2002), en los departamentos de Quindío y Tolima, con solo 6 aislamientos de B. bassiana y M. anisopliae.
Asimismo, los rangos de mortalidad obtenidos de 94 % y 100% sobre adultos de C. viridivittatus con los aislamientos nativos de B. bassiana y M. anisopliae en un rango de tiempo de cuatro a cinco días, supera los obtenidos por Marín y Bustillo (1997), con B. bassiana sobre adultos C. viridivittatus quienes obtuvieron un rango amplio entre 42 % y 100 % de mortalidad en un período de cinco a seis días.
Los resultados de Orozco (2011) contrastan notoriamente a los obtenidos en este trabajo, al obtener porcentajes de mortalidad sobre adultos de tan solo 17-19 % con M. anisopliae y de 27-44 % con B. bassiana después de 15 días de inoculación con concentraciones seriadas de 108 hasta 104 conidias/ml. Es importante mencionar que los resultados obtenidos son bajos si se considera, además, que la unidad experimental utilizada constaba de cinco individuos por tratamiento en lugar de un solo insecto por unidad experimental, así como la influencia de las condiciones bióticas y abióticas como lo menciona Butt y Goettel (2000).
Rice y Cogburn (1999) evaluaron el aislamiento 22292A de Beauveria bassiana obtenido de Lissorhoptrus oryzophilus Kuschel (Coleoptera: Curculionidae), sobre tres especies de coleóptera plagas de granos almacenados: Sitophilus oryzae (L.) (Coleoptera: Curculionidae); Rhyzopertha dominica (F.) (Coleoptera: Bostrichidae); yTribolium castaneum (Herbst) (Coleoptera: Tenebrionidae). La mortalidad de los adultos fue del 80-100 % en un tiempo de 21 días después de inoculados. De este ensayo, se destaca la evaluación de la emergencia de la progenie de los adultos que sobrevivieron, la cual se redujo en 83-99 % con la mayor dosis utilizada.
De la misma forma, Truddel et al. (2007) evaluaron el potencial de seis aislamientos de B. bassiana para el control del picudo blanco del pine Pissodes strobi (Peck) (Col: Curculionidae). Dos aislamientos resultaron los más virulentos con mortalidades de 73 % y 85 % después de tres semanas de aplicados a una concentración de 1 x 106 conidias/ml.
Otros autores como Ondiaka et al. (2008) reportaron mortalidades sobre adultos del picudo de la patata Cylas puncticollis (Coleoptera: Curculionidae) con aislamientos de M. anisopliae de 62,5% y 89,2% y con B. bassiana 77,5 % y 84,2 %. Carballo et al. (2001) evaluaron 12 aislamientos de B. bassiana para el control de adultos del picudo del ají Anthonomus eugenii y mostraron la eficiencia del uso de aceite agrícola al 3% en la suspensión de conidias, lo que aumentó la mortalidad de 20% al 100 %.
Patogenicidad de Steinernema sp. y Heterorhabditis sp. sobre larvas de C. viridivittatus
Steinernema sp. UNS09 causó una mortalidad superior al 80 % sobre larvas de 53, 36 y 26 días, 9 días después de inoculadas. Los resultados contrastan con los obtenidos por otros autores sobre especies de curculiónidos, como Shapiro-Ilan (2001) quien evaluó la virulencia de 9 % especies de hongos entomopatógenos y 15 aislamientos de Steinernema y Heterorhabditis, en condiciones de laboratorio, sobre larvas del picudo de la nuez Curculio caryae y encontró una mortalidad variable entre 35,5 % y 55,3 %, posiblemente por la edad de las larvas y la pérdida de virulencia de los nematodos.
McCoy et al. (2000) mencionan que el producto comercial BioVector 355 compuesto de IJS de Steinernema feltiae, para el control de larvas de D. abbreviatus en cultivos de cítricos en La Florida, causó una mortalidad de 57,7 % en larvas de 35 y 60 días de edad con una concentración de 200 infectivos juveniles/ml, valor muy cercano al causado por el aislamiento UNPS100 del Tolima sobre larvas de C. viridivittatus, con 56 % de mortalidad.
Posteriormente, Stuart et al. (2004) evaluaron 12 aislamientos de nematodos y los compararon con BioVector 355 y una mezcla de este con todos los aislamientos. La mortalidad de las larvas estuvo entre 57,7 y 84,1 %, siendo el aislamiento comercial y su mezcla los que presentaron los porcentajes extremos. La baja mortalidad del producto comercial posiblemente se deba a la multiplicación sucesiva del nematodo en condiciones de laboratorio.
Resultados que contrastan con los obtenidos por Shapiro et al. (2004a), quienes evaluaron la eficacia de S. riobrave y S. feltiae para el control de las larvas de Conotrachelus nenuphar (Col.: Curculionidae) y un tratamiento químico con imidacloprid. De todos los tratamientos, S. riobrave fue el único que causó una reducción significativa en la emergencia del insecto del 97 %.
En concordancia con los trabajos realizados por diferentes autores con otras especies de coleópteros, es posible que existan especies o aislamientos de nematodos más patogénicos que los aquí evaluados, por tanto, se debe considerar la selección de los mejores aislamientos y la posibilidad de la combinación de hongos y nematodos entomopatógenos para la implementación de un programa de manejo integrado.
Las evaluaciones realizadas por Shapiro et al. (2004b), para determinar el efecto de la combinación de microorganismos para el control de larvas de Curculio caryae (Coleoptera: Curculionidae) con los nematodos H. indica y S. carpocapsae, los hongos B. bassiana, M. anisopliae, Paecilomyces fumosoroseus y la bacteria Serratia marcescens observaron antagonismo en todas las combinaciones de patógenos, con excepción de H. indica combinado con M. anisopliae, con la cual se obtuvo un efecto aditivo. Con esto se concluyó que, dependiendo de la tasa de aplicación, S. carpocapsae combinada con B. bassiana o S. marcescens presenta un efecto aditivo. Mientras que S. carpocapsae (aplicado solo) causó mayor mortalidad a las larvas de C. caryae comparado con otros patógenos aplicados solos.
Se considera que es importante realizar una evaluación con un mayor número de aislamientos nativos provenientes de diferentes ecosistemas e involucrar otros del género Heterorhabditis, lo cual podría contribuir al hallazgo de aislamientos con mayor potencial para el control de larvas de C. viridivittatus, como lo realizado por Shapiro y McCoy (2000), quienes evaluaron nueve especies de nematodos entomopatógenos y 15 aislamientos de Steinernema y Heterorhabditis sobre larvas de D. abbreviatus de octavo y noveno instar (un año de edad aprox.) y mostraron que la especie S. riobrave causó una mortalidad del 90 %, con una concentración de 500 infectivos/ml en un periodo de siete días.
Asimismo, es necesario evaluar la potencialidad de cada uno de los aislamientos en su condición ambiental original en rangos de temperatura entre 15 y 30 °C, teniendo en cuenta que las condiciones ambientales del bioensayo son contrastantes con la temperatura de origen de cada aislamiento, lo cual puede influir negativamente en la respuesta de la patogenicidad, como lo mencionan Grewal et al. (1994) y Shapiro et al. (1999), quienes, al evaluar aislamientos de H. bacteriophora (HP88 y Hbl), mostraron una reducción en la patogenicidad dentro de rangos de temperatura de 15 a 25 °C.
Glazer (1992) y Shapiro et al. (1999) afirman que existe un mayor grado de susceptibilidad al ataque por nematodos entomopatógenos en larvas jóvenes por su sistema inmune poco desarrollado, lo cual contrasta con los resultados obtenidos, siendo las larvas de 53 días de edad las más susceptibles al ataque por nematodos.
Se recomienda continuar con la evaluación de especies y aislamientos de hongos y nematodos entomopatógenos con un amplio rango de adaptabilidad tanto a temperatura como humedad para las aplicaciones en los diferentes agroecosistemas donde se distribuye el C. viridivittatus en el país. Es importante evaluar, además de la patogenicidad, las características como la capacidad de búsqueda, dispersión y persistencia, y la profundidad del suelo, las cuales son muy atractivas para el control de larvas de insectos-plaga que permanecen durante largos periodos en el suelo como las especies de curculiónidos (Schroeder y Beavers 1987).
Otros autores, como Mannion y Jansson (1992), Ricci et al. (1996) y Patterson y Lacey (1999), consideran que la evaluación de la patogenicidad en laboratorio de los nematodos entomopatógenos, es un factor relativo entre las especies de nematodos, por tanto, es muy importante completar su evaluación en condiciones de invernadero y campo.
Conclusiones
Se destaca la importancia de este primer trabajo en el cual fue posible comprobar que las larvas de C. viridivittatus de tres edades diferentes fueron susceptibles a los aislamientos nativos de Steinernema y Heterorhabditis evaluados y que presentaron porcentajes de mortalidad muy similares a los obtenidos sobre especies de la misma familia. Asimismo, se resalta la importancia de los aislamientos de hongos entomopatógenos que causaron más del 80% de mortalidad sobre los adultos. La obtención y evaluación de aislamientos de hongos y nematodos entomopatógenos es el primer requisito para la implementación del programa de manejo de C. viridivittatus, ante la escasez de alternativas biológicas disponibles para los productores.
Agradecimientos
Los autores agradecen la colaboración de los empleados de cada una de las fincas donde se realizaron los muestreos. Al personal técnico del Laboratorio de Biología Molecular de la Universidad Nacional de Colombia sede Palmira y al personal técnico del Laboratorio de Entomología de Corpoica CI Palmira, Adolfo Arias y Humberto Rodríguez. También extienden los agradecimientos al MADR por el soporte económico del proyecto.
Referencias
Barnett HL, Hunter BB. 1998. Illustrated Genera of Imperfect Fungi. 4.a edición. Saint Paul: American Phytopathological Society. [ Links ]
Bedding RA, Miller LA. 1981. Use of a nematode, Heterorhabditis heliothidis, to control black vine weevil, Otiorhynchus sulcatus, in potted plants. Ann Appl Biol. 99(3):211-216. [ Links ]
Bedding RA, Akhurst RJ. 1975. A simple technique for the detection of insect parasitic Rhabditid nematodes in soil. Nematologica. 21:109-110. [ Links ]
Bullock RC, Pelosi RR, Kille EE. 1999. Management of citrus root weevils (Coleoptera: Curculionidae) on Florida citrus with soil-applied entomopathogenic nematodes (Nematoda: Rhabditida). Fla Entomol. 82(1):1-7. [ Links ]
Butt TM, Goettel MS. 2000. Bioassays of entomogenous fungi. En: Navon A, Ascher KRS, editores. Bioassays of entomopathogenic microbes and nematodes. Wallingford: CAB International. [ Links ]
Caicedo AM, Orobio MR, Muñoz JE, Torres GA. 2011. Caracterización morfológica de aislamientos nativos de Steinernema spp. de dos localidades del Valle del Cauca. Cartel presentado en: XXXVIII Congreso de la Sociedad Colombiana de Entomología. Manizales, Colombia. [ Links ]
Cano DM. 2000. Biología, comportamiento y enemigos nativos del picudo de los cítricos Compsus sp. (Coleoptera: Curculionidae), en la zona central cafetera. Ponencia presentada en: Seminario Nacional sobre el Picudo de los Cítricos. Pereira, Colombia. [ Links ]
Cano DM, Bustillo AE, Cárdenas R, Orozco L. 2002. Biología y enemigos nativos del picudo de los cítricos Compsus n. sp. (Coleoptera: Curculionidae). Rev Colomb Entomol. 28(1): 43-52. [ Links ]
Carballo M, Rodríguez L, Durán. 2001. Evaluación de Beauveria bassiana para el control del picudo del chile en laboratorio. Manejo Integrado de Plagas (Costa Rica). 62:54-59. [ Links ]
Cardona DA. 2010. Monitoreo de poblaciones de adultos de Compsus viridivittatus (Coleoptera: Curculionidae) en cultivos de cítricos del Valle del Cauca [trabajo de grado]. [Armenia]: Universidad del Quindío. [ Links ]
Duncan LW, McCoy CW. 1996. Vertical distribution in soil, persistence, and efficacy against citrus root weevil (Coleoptera: Curculionidae) of two species of entomogenous nematodes (Rhabditida: Steinernematidae; Heterorhabditidae). Environ Entomol. 25(1):174-178. [ Links ]
Grewal PS, Selvan S, Gaugler R. 1994. Thermal adaptation of entomopathogenic nematodes: niche breadth for infection, establishment, and reproduction. J Therm Biol. 19(4):245-253. [ Links ]
Glazer I. 1992. Invasion rate as a measure of infectivity of Steinernematid and Heterorhabditid nematodes to insects. J Invertebr Pathol. 59(1):90-94. [ Links ]
Hanlin RT. 1990. Illustrated genera of ascomycetes. Saint Paul: APS Press. [ Links ]
Kaya HK, Stock SP. 1997. Techniques of insect nematology. En: Lacey L, editor. Manual of techniques in insect pathology. Biological Techniques Series. San Diego: Academic Press. pp. 281-324. [ Links ]
Leslie JF, Summerell BA. 2006. The Fusarium Laboratoy Manual. Ames: Blackwell Publishing. [ Links ]
Marín MP, Bustillo P. 1997. Selección de aislamientos de Beauveria bassiana virulentos a Compsus n. sp. Cenicafé. 59(2):165-173. [ Links ]
Mannion CM, Jansson RK. 1992. Comparison of ten entomopathogenic nematodes for control of sweet potato weevil (Coleoptera: Apionidae). J Econ Entomol. 85:1642-1650. [ Links ]
Méndez AA, Olaya G, Caicedo AM. 2011. Aislamiento de nematodos entomopatógenos en áreas de Buenaventura, Valle del Cauca, Colombia. Fitosanidad. 15(3):153-157. [ Links ]
McCoy CW, Shapiro DI, Duncan LW, Nguyen K. 2000. Entomopathogenic nematodes and other natural enemies as mortality factors for larvae of Diaprepes abbreviatus (Coleoptera: Curculionidae). Biol Control. 19:182-190. [ Links ]
McCoy CW, Futch SH, Graham JH, Duncan LW, Nigg HN. 2003. Florida citrus pest management guide: Citrus root weevils. Gainesville: Florida Cooperative Extension Service, Institute of food and agricultural Sciences, University of Florida. [ Links ]
O'Brien CW, Peña J. 2012. Two species of Compsus Schoenherr, new citrus pests from Colombia (Coleoptera: Curculionidae: Entiminae). Insecta Mundi. 0227:1-13. [ Links ]
Ondiaka S, Maniania NK, Nyamasyo GHN, Nderitu JH. 2008. Virulence of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae to sweet potato weevil Cylas puncticollis and effects on fecundity and egg viability. Ann Appl Biol. 153(1):41-48. [ Links ]
Orozco SC. 2011. Susceptibilidad de Compsus n. sp. a Beauveria bassiana (Bals.) Vuill y Metarhizium anisopliae (Metsch.) Sorokin [tesis de maestría]. [Medellín]: Universidad Nacional de Colombia. [ Links ]
Patterson JE, Lacey LA. 1999. Susceptibility of western cherry fruit fly (Diptera: Tephritidae) to five species of entomopathogenic nematodes in laboratory studies. J Invertebr Pathol. 74(2):206- 208. [ Links ]
Roa M, Sánchez G, Montoya CA, Gómez CE, Vargas JE, Guerrero CE, Zambrano G. 2001. Manejo del picudo de los cítricos Compsus sp. Bogotá: ICA. [ Links ]
Ricci M, Glazer I, Campbell JF, Gaugler R. 1996. Comparison of bioassays to measure virulence of different entomopathogenic nematodes. Biocontrol Sci Techn. 6(2):235-245. [ Links ]
Rice WC, Cogburn RR. 1999. Activity of the entomopathogenic fungus Beauveria bassiana (Deuteromycota: Hyphomycetes) against three coleopteran pests of stored grain. J Econ Entomol. 92(3):691-694. [ Links ]
SAS Institute. 2003. Version 9.1 for Windows. SAS Institute: Cary. [ Links ]
Simons WR. 1981. Biological control of Otiorhynchus sulcatus with Heterorhabditid nematodes in the glasshouse. Neth J Plant Pathol. 87:149-158. [ Links ]
Stuart RJ, Shapiro-Ilan DI, James RR, Nguyen KB, McCoy CW. 2004. Virulence of new and mixed strains of the entomopathogenic nematode Steinernema riobrave to larvae of the citrus root weevil Diaprepes abbreviates. Biol Control. 30(2):439-445. [ Links ]
Shanks CH, Agudelo-Silva F.1990. Field pathogenicity and persistence of heterorhabditid and steinernematid nematodes (Nematoda) infecting black vine weevil larvae (Coleoptera: Curculionidae) in cranberry bogs. J Econ Entomol. 83:107-110. [ Links ]
Shapiro DI, Cate JR, Pena J, Hunsberger A, McCoy CW. 1999. Effects of temperature and host age on suppression of Diaprepes abbreviatus (Coleoptera: Curculionidae) by entomopathogenic nematodes. J Econ Entomol. 92(5):1088-1092. [ Links ]
Shapiro DI, McCoy CW. 2000. Virulence of entomopathogenic nematodes to Diaprepes abbreviatus (Coleoptera: Curculionidae) in the laboratory. J Econ Entomol. 93(4):1090-1095. [ Links ]
Shapiro-Ilan DI. 2001. Virulence of entomopathogenic nematodes to pecan weevil larvae, Curculio caryae (Coleoptera: Curculionidae), in the laboratory. J Econ Entomol. 94(1):7-13. [ Links ]
Shapiro-Ilan DI, Mizell III RF, Cottrell TE, Horton DL. 2004a. Measuring field efficacy of Steinernema feltiae and Steinernema riobrave for suppression of plum curculio, Conotrachelus nenuphar, larvae. Biol Control. 30(2):496-503. [ Links ]
Shapiro-Ilan DI, Jackson M, Reilly C, Hotchkiss MW. 2004b. Effects of combining an entomopathogenic fungi or bacterium with entomopathogenic nematodes on mortality of Curculio caryae (Coleoptera: Curculionidae). Biol Control. 30(1):119-126. [ Links ]
Schroeder WJ, Beavers JB. 1987. Movement of the entomogenous nematodes of the families Heterorhabditidae and Steinernematidae in soil. J Nematol. 19(2):257-259. [ Links ]
Truddel R, Lavallée R, Guertin C, Coté C, Todorova SI, Alfaro R, Kope H. 2007. Potential of Beauveria bassiana (Hyphomycetes: Moniliales) for controlling the white pine weevil, Pissodes strobi (Col., Curculionidae). J Appl Entomol. 131(2):90-97. [ Links ]
Vélez PA, Posada FJ, Marín P, González MT, Osorio E, Bustillo AE. (1997). Técnicas para el control de calidad de formulaciones de hongos entomopatógenos. Boletín Técnico 17. Chinchiná: Cenicafé [ Links ].
Zimmermann G. 1986. The 'Galleria bait method' for detection of entomopathogenic fungi in soil. J Appl Entomol. 102(1-5): 213-215. [ Links ]