Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.18 no.1 Mosquera Jan./Apr. 2017
https://doi.org/10.21930/rcta.vol18_num1_art:564
Artículo de revisión
DOI: http://dx.doi.org/10.21930/rcta.vol18_num1_art:564
Biorremediación de organofosforados por hongos y bacterias en suelos agrícolas: revisión sistemática
Bioremediation of organophosphates by fungi and bacteria in agricultural soils. A systematic review
Biorremediação de organofosforados por fungos e bactérias em solos agrícolas: revisão sistemática
Gina María Hernández-Ruiz,1 Natalia Andrea Álvarez-Orozco,2 Leonardo Alberto Ríos-Osorio3
1 Microbióloga industrial y ambiental, Universidad de Antioquia. Investigadora Grupo de Investigación Salud y Sostenibilidad, Universidad de Antioquia. Medellín, Colombia. ginamaria.hernandezr@udea.edu.co
2 Microbióloga industrial y ambiental, Universidad de Antioquia. Investigadora Grupo de Investigación Salud y Sostenibilidad, Universidad de Antioquia. Medellín, Colombia. nandrea.alvarez@udea.edu.co
3 PhD, Universitat Politècnica de Catalunya. Docente e investigador, Grupo de Investigación Salud y Sostenibilidad, Universidad de Antioquia. Medellín, Colombia. leonardo.rios@udea.edu.co
Fecha de recepción: 19/11/2015 Fecha de aceptación: 13/07/2016
Para citar este artículo: Hernández-Ruiz GM, Álvarez-Orozco NA, Ríos-Osorio LA. 2017. Biorremediación de organofosforados por hongos y bacterias en suelos agrícolas: revisión sistemática. CORPOICA Cienc Tecnol Agropecuaria. 18(1):139-159
Resumen
Los organofosforados son un tipo de plaguicidas ampliamente utilizados en el sector agrícola para el control de plagas. Dado que estos son compuestos químicos altamente tóxicos, su uso excesivo ha causado gran deterioro en los suelos cultivables, así como graves daños para los ecosistemas y la salud humana. La biorremediación surge como una alternativa para transformar los plaguicidas en compuestos más simples y poco contaminantes mediante el uso del potencial metabólico de los microorganismos. Por lo anterior, el objetivo de esta investigación fue describir los hongos y bacterias involucrados en la biorremediación de los principales plaguicidas organofosforados empleados en suelos agrícolas por medio de una revisión sistemática de la literatura científica, con el fin de aportar información útil para la realización de estudios posteriores. Se obtuvo información científica de las bases de datos ScienceDirect y Springer Link, y también información no indexada del buscador Google Scholar. Se encontró que el organofosforado que más se ha estudiado es el clorpirifós (categoría toxicológica III) y los microorganismos que más se utilizan como biorremediadores de organofosforados son los géneros Serratia, Bacillus y Pseudomonas. Se concluye que el éxito de la biorremediación depende de la capacidad competitiva de los microorganismos, de la biodisponibilidad y la concentración del organofosforado, del pH, la temperatura y el tipo de suelo, así como de la presencia de suplementos nutricionales y de la concentración alta del inóculo.
Palabras clave: degradación, microorganismos, plaguicidas, suelos agrícolas
Abstract
Organophosphates are a type of pesticides widely used in agriculture for pest control. Since these are highly toxic compounds, their excessive use has caused great deterioration of arable soils, as well as serious damage to ecosystems and human health. Bioremediation is used as an alternative way to transform pesticides into simple, less polluting compounds, using the metabolic potential of microorganisms. Therefore, the objective of this study was to summarize the fungi and bacteria involved in bioremediation of the main organophosphorus pesticides used in agricultural soils through a systematic review of the scientific literature, in order to provide useful information for conducting further studies. Scientific information was obtained through the use of databases such as ScienceDirect and Springer Link and unindexed information was also gathered from Google Scholar, as a result of this study, it was found that the most studied organophosphate pesticide is chlorpyrifos (Toxicity category III) and microorganisms most commonly used in the bioremediation of organophosphate pesticides belongs to the genera Serratia, Bacillus and Pseudomonas. It is concluded that the success of bioremediation is influenced by the competitive ability of microorganisms, bioavailability and concentration of the organophosphate pesticide in the soil, pH, temperature and soil type, presence of nutritional supplements and high inoculum concentration.
Keywords: degradation, microorganisms, pesticides, agricultural soils.
Resumo
Os organofosforados são um tipo de praguicidas amplamente utilizados no setor agrícola para o controle de pragas. Dado que estes são compostos químicos altamente tóxicos, o uso excessivo destes há causado grande deterioro nos solos cultiváveis, assim como graves danos contra os ecossistemas e na saúde humana. A biorremediação surge como uma alternativa para transformar os praguicidas em compostos mais simples e pouco contaminantes mediante o uso do potencial metabólico dos microrganismos. Pelo anterior, o objetivo desta pesquisa foi descrever os fungos e bactérias envolvidos na biorremediação dos principais praguicidas organofosforados empregados em solos agrícolas por meio de uma revisão sistemática da literatura científica, com o fim de aportar informação útil para a realização de estudos posteriores. Obtevese informação científica das bases de datos ScienceDirect e Springer Link, e também informação não indexada do buscador Google Scholar. Encontrou-se que o organofosforado que mais tem-se estudado é clorpirifós (categoria toxicológica III) e os microrganismos que mais se utilizam como biorremediadores de organofosforados são os géneros Serratia, Bacillus e Pseudomonas. Concluise que o sucesso da biorremediação depende da capacidade competitiva dos microrganismos, da biodisponibilidade e a concentração do organofosforado, do pH, a temperatura e o tipo de solo, assim como da presença de suplementos nutricionais e da concentração alta do inóculo.
Palavras chave: degradação, microrganismos, praguicidas, solos agrícolas.
Introducción
Los compuestos organofosforados son ésteres del ácido fosfórico y de sus derivados, empleados en el sector agrícola con el propósito de combatir y controlar diversas plagas para asegurar la producción agrícola y la inversión económica. Son utilizados como insecticidas, acaricidas, nematicidas y fungicidas. Algunos actúan como plaguicidas de contacto y otros como plaguicidas sistémicos. Son sustancias químicas altamente tóxicas, liposolubles y volátiles, características que facilitan su absorción y causan graves daños para la salud humana y el ambiente (Argumedo et al. 2009; Fernández et al. 2010).
Se estima que actualmente el 40% de las cosechas son tratadas con este tipo de compuestos (Cycoń et al. 2013), y de acuerdo con un estudio realizado en diferentes países de Centroamérica, se considera que el 3% de los trabajadores agrícolas que están expuestos a los plaguicidas sufren cada año una intoxicación aguda. La tasa de incidencia para estas intoxicaciones en la región centroamericana ha mostrado un progresivo aumento del riesgo, que pasa de tasas del 6,3 por 100.000 habitantes al 19,5 en 8 años. Igualmente, las tasas de mortalidad presentan una tendencia al ascenso, pues pasan de un riesgo de muerte del 0,3 por 100.000 habitantes al 2,10 (Fernández et al. 2010). En el caso de Colombia, los plaguicidas inhibidores de colinesterasa (organofosforados y carbamatos) son el grupo de insecticidas más utilizados en el control de plagas. En el 2005 se notificaron en Colombia 4.234 casos de intoxicación causados por plaguicidas, la gran mayoría de los cuales ocurrió por los inhibidores de colinesterasa (Vásquez 2010).
El uso excesivo que se ha hecho de los organofosforados ha causado gran deterioro en los suelos cultivables. Desafortunadamente, los beneficios aportados por estos compuestos han ido acompañados de daños, algunos de ellos tan graves que ahora representan una amenaza para la supervivencia de importantes ecosistemas a largo plazo, como consecuencia de la perturbación de las relaciones depredador-presa y la pérdida de biodiversidad (fao 1997; Maceda-Veiga et al. 2012).
Existen tecnologías utilizadas para recuperar suelos contaminados, entre las cuales se encuentra la biorremediación como una alternativa. Esta aprovecha el potencial metabólico de los microorganismos (bacterias y hongos) para transformar contaminantes orgánicos en compuestos más simples, poco o nada contaminantes. Dentro de los contaminantes que se ven modificados por esta tecnología están los plaguicidas organofosforados (Torres y Zuluaga 2009).
Algunos de los microorganismos que disminuyen el grado de toxicidad de los compuestos organofosforados son los siguientes: diversos tipos de hongos como Hypholoma fasciculare y Coriolus versicolor y bacterias del género Lactobacillus (que incluyen especies como L. bulgaricus, L. paracasei y L. plantarum) que demostraron tener una fuerte aceleración de la degradación de estos compuestos (Zhao y Wang 2012).
Otro de los microorganismos estudiados para la biorremediación es el hongo Phanerochaetechrysosporium, también denominado "el hongo de la pudrición blanca", que por su capacidad ligninolítica ha sido probado para la degradación de una gran variedad de compuestos (Lopera et al. 2005; Quintero 2011). Igualmente, se han encontrado algunas bacterias marinas que son capaces de usar los insecticidas como única fuente de carbono; tal es el caso de Serratia liquefaciens, Serratia plymuthica, Pseudomonas putida y Pseudomonas radiora. Así mismo, Pseudomonas aeruginosa ch7 es una posible cepa promisoria en la biorremediación de suelos contaminados por organofosforados (Antolinez et al. 2001).
Es necesario reunir la literatura científica relacionada con la biorremediación microbiana de los principales plaguicidas organofosforados y agruparla, con el fin de facilitar el acceso a ella. En efecto, dado que el uso de este tipo de agroquímicos ha crecido abundantemente en los últimos años, se ha incrementado también el interés por conocer cómo actúan en los suelos cultivables y cómo se pueden eliminar los residuos de plaguicidas por biorremediación.
Por lo anterior, el objetivo de esta revisión sistemática
es describir los hongos y bacterias involucrados en la biorremediación de los principales plaguicidas organofosforados empleados en suelos agrícolas referenciados en la literatura científica.
Materiales y métodos
Se diseñó una investigación teórica bajo la metodología Prisma (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (Urrútia y Bonfill 2010). Esta investigación se fundamentó en la siguiente pregunta: ¿Cuáles especies de hongos y bacterias participan en la biorremediación de plaguicidas organofosforados en suelos agrícolas de acuerdo con la revisión sistemática de la literatura científica?
Con base en esta pregunta de investigación se definieron los términos utilizados para buscar los descriptores en la biblioteca virtual: Descriptores en Ciencias de la Salud (DeCS). Con el fin de garantizar la sensibilidad del proceso metodológico, se utilizaron los siguientes descriptores: degradation, environmental, fungi, bacteria, soil, agriculture y organophosphorus. Para este último se utilizaron los organofosforados de mayor uso en Colombia (Fernández et al. 2010): dichlorvos, fenitrotion, dimetoato, parathion, chlorpyrifos, diazinon y malathion.
Además de diseñar la ruta de búsqueda con base en los anteriores descriptores, se emplearon los términos booleanos con el fin de asegurar la especificidad de la investigación: [("degradation, environmental" and (fungi or bacteria)) and (Dichlorvos or Fenitrotion or Dimetoato or Parathion or Chlorpyrifos or Diazinon or Malathion) and (Soil and agriculture)]. La búsqueda se realizó en la base de datos Springer Link y en el motor de búsqueda ScienceDirect, y solo se tuvieron en cuenta los artículos originales de investigación publicados entre los años 2004 y 2014 que cumplieran con los siguientes criterios de inclusión: nombre genérico del organofosforado, descripción del nivel de degradación, descripción del proceso biológico para la degradación del plaguicida organofosforado y mención del género del microorganismo. A su vez, el criterio de exclusión fue "degradación del organofosforado que no se atribuye directamente al microorganismo". Para garantizar la exhaustividad, se incluyeron en la ruta de búsqueda términos "No DeCS" y se complementó con la literatura científica no indexada.
Plan de análisis
Los artículos de investigación se revisaron por autores con el fin de extraer y discriminar la información necesaria para desarrollar los objetivos específicos de la investigación. Para el primer objetivo, se buscó la información que diera cuenta de las características químicas, el mecanismo de acción y la vida media del organofosforado. Esta información se encontró en la introducción de los artículos de investigación y se complementó con otra literatura. Posteriormente, con base en los resultados de las investigaciones y los microorganismos identificados en estas, se describió el proceso de remediación biológica de los organofosforados arriba descritos. Por último, se realizó un cuadro con los microorganismos y el respectivo organofosforado degradado por estos.
Resultados
La consulta de los artículos de investigación se realizó en las bases de datos propuestas, en agosto de 2014. Se obtuvieron 361 resultados en ScienceDirect y 155 en Springer Link, para un total de 516 resultados. A partir de estos últimos, se buscaron los duplicados en el gestor de referencias EndNote® sin encontrar ninguno; luego se eliminaron aquellos resultados que no fueron artículos originales de investigación y capítulos de libro, para un total de 440 artículos resultantes. Posteriormente, se aplicaron los criterios de inclusión y de exclusión para eliminar los artículos que no correspondieran; de esta forma, se obtuvieron 27 artículos de investigación originales. En cuanto a la literatura científica no indexada, se encontró en Google Scholar un (1) artículo de investigación original. Finalmente, en cumplimiento de los criterios de sensibilidad, especificidad y exhaustividad, la revisión sistemática se realizó con 28 artículos de investigación originales (figura 1).
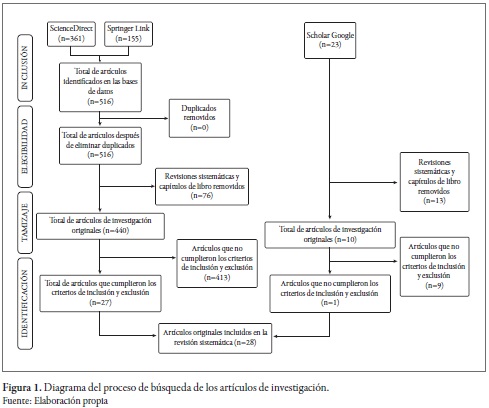
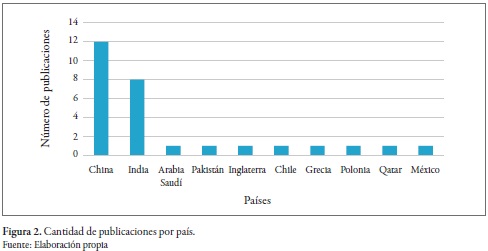
Dentro de las 28 publicaciones utilizadas para la revisión sistemática, se encontró que la mayoría de estas provenían de China e India (figura 2).
Plaguicidas
Los plaguicidas son sustancias destinadas a prevenir, destruir o controlar plagas, lo cual incluye los vectores de enfermedad humana o animal, las especies no deseadas de plantas o animales que ocasionan un daño duradero u otras que interfieran con la producción, procesamiento, almacenamiento, transporte y comercialización de alimentos. De acuerdo con su estructura química, los plaguicidas se clasifican en diversas familias: organoclorados, organofosforados, carbamatos, tiocarbamatos y piretroides, entre otros (Ramírez y Lacasaña 2001). Los plaguicidas organofosforados (OPP) son el grupo más extendido, pues representan más del 36% del mercado mundial y son utilizados ampliamente desde hace más de sesenta años (Briceño et al. 2012; Cycoń et al. 2013).
Los compuestos organofosforados son ésteres, amidas o tioles derivados de los ácidos fosfórico, fosfónico y fosfortoico. Se clasifican en función de algunas de sus características principales como la toxicidad aguda, la vida media, la estructura química y su uso (Ramírez y Lacasaña 2001). A temperatura ambiente, los organofosforados son liposolubles y tienen una elevada tensión de vapor, lo cual permite su penetración rápida por las vías digestiva, cutánea y respiratoria, característica que genera fácilmente intoxicaciones en humanos (Ferrer 2003). Por otra parte, los organofosforados inhiben la actividad normal de la acetilcolina esterasa mediante la unión covalente con esta enzima, de manera que modifican su estructura y función. Como la regeneración de la acetilcolinesterasa fosforilada es muy lenta (dura horas o días), se pueden presentar convulsiones, parálisis y finalmente la muerte de insectos y mamíferos (Fernández et al. 2010).
Los plaguicidas en el suelo y el agua pueden ser degradados por vía biótica y abiótica, sin embargo, la biorremediación por microorganismos es el principal mecanismo de degradación de plaguicidas y de desintoxicación en suelos (Ortiz-Hernández y Sánchez-Salinas 2010). Los principales organofosforados degradados por microorganismos reportados en la literatura científica son clorpirifós, malatión, fenamifos, diazinón, diclorvos, paratión, metil paratión, etoprofos, dimetoato, fosfato de tributilo, fenitrotión, profenofos, forato, metamidofos, triazofos, cadusafos y tetraclorvinfos (Imran y Kim 2003; Zhang et al. 2006; Anwar et al. 2009; Goda et al. 2010; Chanika et al. 2011).
Clorpirifós
Clorpirifós (CP) es uno de los insecticidas organofosforados clorados más ampliamente utilizados en la industria agrícola y es eficiente contra un amplio espectro de plagas (Anwar et al. 2009). El CP tiene una toxicidad intermedia para los mamíferos, por lo tanto, cada vez es más utilizado en la agricultura, pues no cuenta con las restricciones impuestas a los compuestos organofosforados altamente tóxicos como el diclorvos y el forato, entre otros (Fernández et al. 2010; Lu et al. 2013). Este organofosforado se caracteriza por ser moderadamente persistente, con una vida media en el suelo de 10 a 120 días. Posee muy baja solubilidad en agua, sin embargo, es fácilmente soluble en la mayoría de disolventes orgánicos, por lo que puede penetrar fácilmente las membranas celulares (Anwar et al. 2009; Briceño et al. 2012).
De acuerdo con la literatura científica, existe un amplio rango de microorganismos que tienen la capacidad de degradar clorpirifós. Algunos de estos son Bacillus pumilus, Streptomyces sp., Serratia marcescens, Alcaligenes sp., Penicillium sp. y Pseudomonas putida (tabla 1) (Anwar et al. 2009; Briceño et al. 2012; Cycoń et al. 2013; Silambarasan y Abraham 2013).

Algunas de estas especies tienen la capacidad de degradar altas concentraciones de clorpirifós, como es el caso de B. pumilus C2A1, que tuvo la capacidad de degradar 900 mg/L en 14 días (Anwar et al. 2009). No obstante, Streptomyces <chattanoogensis puede degradar 50 mg/L en tan solo 24 horas (figura 3) (Briceño et al. 2012).
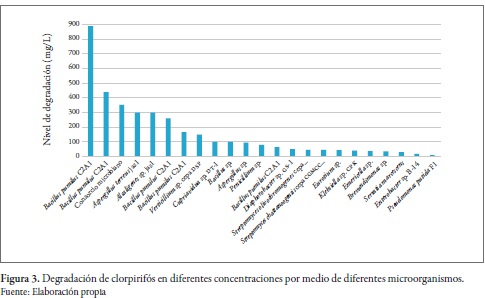
El clorpirifós se hidroliza rápidamente en su metabolito primario, 3,5,6-tricloro-2-piridinol (TCP). Este es persistente en el ambiente y su vida media es de 42 a 49 días (Liang et al. 2011). El TCP es más móvil que la molécula parental debido a su mayor solubilidad en agua, lo cual causa la contaminación generalizada de ambientes acuáticos y suelos (Silambarasan y Abraham 2013). En consecuencia, la Agencia de Protección Ambiental de EE. UU. lo ha listado como un contaminante persistente (Lu et al. 2013).
El TCP muestra altos efectos antimicrobianos, lo que impide su propia degradación por microorganismos y limita, además, la degradación del clorpirifós (Anwar et al. 2009; Lu et al. 2013). Sin embargo, se ha reportado en la literatura científica la degradación de TCP por algunos microorganismos como B. pumilus, Streptomyces chattanoogensis, Alcaligenes sp., Cupriavidus sp., Aspergillus terreus y un consorcio formado por Aspergillus sp., Penicillium sp., Eurotium sp. y Emericella sp. (Anwar et al. 2009; Briceño et al. 2012; Lu et al. 2013; Silambarasan y Abraham 2013). Dentro de estas especies, B. pumilus tiene la capacidad de degradar 300 mg/L de TCP en 8 días y A. terreus, la misma cantidad en 24 horas, lo cual evidencia que el hongo tiene una mayor capacidad para degradar el organofosforado (Anwar et al. 2009; Silambarasan y Abraham 2012).
Los microorganismos son capaces de degradar CP a través del TCP, mediante la generación de ácido pirúvico antes de la iniciación de ciclo de Krebs y la consiguiente liberación de dióxido de carbono y agua (Maya et al. 2012). La degradación de TCP por la misma cepa que degrada clorpirifós es importante, ya que, si este no fuese degradado, se acumularía y suprimiría el crecimiento microbiano. Por lo tanto, la degradación del compuesto original se ve obstaculizada a través de la represión catabólica (Silambarasan y Abraham 2012).
Cycoń et al. (2013) demostraron que la degradación de clorpirifós en medio mineral es mucho más rápida que en suelo, y que la degradación de este organofosforado en suelos limosos (68,9%) y francoarenosos (61,4%) es mejor que en suelos arenosos (45,3%). Esto puede deberse a que la degradación de los organofosforados depende de algunos factores edáficos. En cuanto a la suplementación con nutrientes, Silambarasan y Abraham (2013) evidenciaron que Alcaligenes sp. tuvo la capacidad de degradar 300 mg/L de clorpirifós completamente en 24 horas en suelo suplementado con nutrientes, mientras que, en suelo sin adición de nutrientes, la degradación se completó en 48 horas. No obstante, A. terreus jas1 prefiere utilizar clorpirifós incluso sin adición de nutrientes; esto podría deberse a que, potencialmente, las enzimas degradadoras de clorpirifós en A. terreus jas1 se expresan inclusoen ausencia de fuentes de nutrientes fácilmente disponibles (Silambarasan y Abraham 2012).
Otros estudios han reportado la capacidad de S. marcescens de utilizar diferentes organofosforados como fuente de carbono y energía para crecer en diferentes matrices (figura 4).
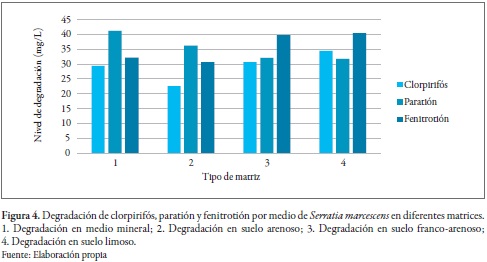
En suelo esterilizado, esta bacteria mostró un potencial de degradación superior en la hidrólisis de clorpirifós, en comparación con el potencial observado en suelos no esterilizados sin inocular. Esto se explica por el hecho de que la cepa inoculada tuvo contacto anteriormente con diazinón y podría, por lo tanto, adaptarse más rápidamente a otros OPP diferentes a la microflora autóctona de los suelos sin ningún contacto con los OPP (Cycoń et al. 2013).
La degradación de clorpirifós también se ve afectada por las condiciones ambientales durante este proceso. Algunos autores indicaron que el pH alcalino fue esencial para lograr la degradación de clorpirifós, puesto que en este se dio la mayor degradación, sin embargo, bacterias como B. pumilus y Enterobacter sp. tienen la capacidad de degradar clorpirifós tanto en pH alcalino como en pH ácido. Esta característica es importante en un organismo que va a ser empleado para la biorremediación de ambientes variables (Singh et al. 2006; Anwar et al. 2009).
Adicionalmente, la biodiversidad microbiana del suelo a biorremediar influye en la degradación de clorpirifós. Según Sasikala et al. (2012), algunos microorganismos como Pseudomonas sp., Micrococcus sp., Rhizobium sp., Comamonas aquatica, Staphylococcus hominis, Klebsiella sp., Aspergillus niger, Trichophyton sp. y Streptomyces radiopugnans tuvieron la capacidad de degradar clorpirifós en 24 horas, de hecho, estos microorganismos en consorcio tuvieron una tasa de degradación mucho más alta que en su actuación individual (Ochoa y Montoya 2010).
Briceño et al. (2012) afirman que los microorganismos degradadores de organofosforados poseen la enzima fosfatasa alcalina. Esta enzima es una fosfomonoesterasa que hidroliza los enlaces O-P, deja el átomo de fósforo disponible para la absorción como fuente de fósforo y libera etanol para su utilización como fuente de carbono. Lu et al. (2013) proponen que el gen mpd es el responsable de la hidrólisis de clorpirifós a TCP. Por otro lado, Silambarasan y Abraham (2013) manifiestan que las razones exactas de la degradación de clorpirifós no están claras, pero hay una posibilidad de que los mecanismos genéticos y enzimáticos hayan participado en los procesos de degradación que, o bien se rigen por las enzimas codificadas por los genes opd y mpd, o bien por la presencia de la enzima fosfotriesterasa.
Fenamifos
Fenamifos (FEN) es un plaguicida organofosforado usado como insecticida, específicamente, como nematicida en cultivos hortícolas. Posee una vida media de 12 a 90 días. Es sistémico, fuertemente tóxico para animales y puede absorberse a través de la piel. Estudios previos han sugerido que, en condiciones ambientales favorables, el FEN podría acumularse y filtrarse en las aguas subterráneas, donde podría persistir (Singh et al. 2006; Chanika et al. 2011).
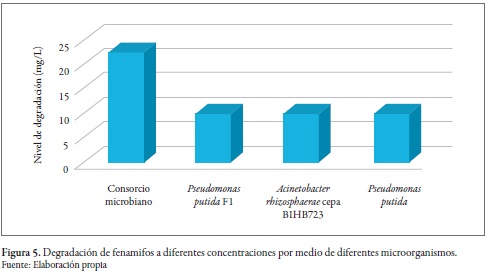
Existe poca información sobre microorganismos degradadores de fenamifos aislados de suelos agrícolas, a pesar de su uso extendido contra nematodos. No obstante, se han reportado en la literatura científica los siguientes microorganismos degradadores de FEN: Pseudomonas putida, Acinetobacter rhizosphaerae y un consorcio microbiano. En la figura 5 se observa una degradación significativamente mayor por parte del consorcio frente a las cepas individuales (Megharaj et al. 2003; Singh et al. 2006; Chanika et al. 2011).
Chanika et al. (2011) demostraron que P. putida y A. rhizosphaerae oxidan gradualmente el FEN con sus metabolitos intermediarios, sulfóxido (FOE) y sulfona (FSO2), que también poseen una alta actividad nematicida y son igualmente tóxicos para los vertebrados no objetivo. El FEN y sus intermediarios muestran una moderada afinidad por adsorción en el suelo, cuya acumulación en este podría resultar en su eventual movimiento a las aguas subterráneas. Las bacterias aisladas degradaron FOE y FSO2 en FOE-OH y FSO2-OH, respectivamente. Además, P. putida fue capaz de degradar completamente FEN-OH por medio del ciclo de Krebs.
Singh et al. (2006) probaron que para la degradación de fenamifos es necesario inocular el suelo con más de 104 células/g. Los autores explicaron que cuando se utilizan densidades de inóculo más bajas, el pequeño número de bacterias no es capaz de sobrevivir a la competencia inicial y a la disminución de la población que por lo general se produce después de la inoculación.
Tributil fosfato
El tributil fosfato o fosfato de tributilo (tbp) es un compuesto organofosforado que posee amplias aplicaciones como agente complejante, solvente, herbicida y fungicida, entre otros. Estas grandes aplicaciones han dado lugar a la producción mundial de 3.000 a 5.000 toneladas por año. El tbp es un compuesto muy estable en el medio ambiente natural (suelo y agua) y tiene una toxicidad aguda aun en concentraciones bajas (2 a 10 ppm), en las que causa afecciones en los riñones y en la vejiga urinaria; irritación de la piel, los ojos y las vías respiratorias; así como hepatomegalia, papilomas y carcinomas de células de transición (Chaudhari et al. 2012; Ahire et al. 2012).
Existen evidencias de degradación de tributil fosfato por parte de diferentes cepas como Pseudomonas pseudoalcaligenes, Delftia sp., Alcaligenes sp., Providencia sp., Ralstonia sp. y Bacillus sp. (Ahire et al. 2012; Chaudhari et al. 2012).
Pseudomonas pseudoalcaligenes cepa mhf env utiliza el tbp como única fuente de carbono a diferentes concentraciones. Chaudhari et al. (2012) compararon la degradación de este compuesto por parte de este microorganismo en células inmovilizadas y en células libres. Se reportó que esta cepa degrada el tbp mucho mejor en forma inmovilizada que como células libres, lo cual se puede atribuir al aumento del crecimiento celular en esta condición. Como resultado, las células inmovilizadas pueden degradar completamente el tbp en cinco días, mientras que las células libres lo hacen en seis días.
Los demás microorganismos fueron capaces de utilizar el tbp como única fuente de carbono y fósforo, lo que se evidenció por la degradación de este entre el 21% y el 61% en cuatro días. Delftia sp. y Providencia sp. mostraron mayor actividad degradativa y estabilidad durante la degradación, ya que presentaron capacidad constante para degradar TBP incluso después de dos años (Ahire et al. 2012).
Malatión
El malatión —también conocido como carbofos, maldison y mercaptotion (Singh et al. 2012)— es un insecticida no sistémico utilizado para el control de insectos chupadores y masticadores en frutas y verduras. El malatión también se utiliza como un agente antiinfeccioso para el control de enfermedades transmitidas por insectos, como la malaria (Anopheles), el dengue (Aedes aegypti) y la fiebre amarilla (Aedes) (Imran y Kim 2003).
Fue reconocido como el primer insecticida organofosforado con una toxicidad altamente selectiva (Singh et al. 2012). La mayoría de los estudios indican que la principal vía de degradación en el suelo, el agua, los sedimentos y los ambientes salinos es mediada biológicamente (Imran y Kim 2003).
El malatión es absorbido por el tracto gastrointestinal, la piel, las membranas mucosas y los pulmones de los humanos (Singh et al. 2012). La Agencia de Protección Ambiental de los EE. UU. (EPA) ha clasificado al malatión como pesticida de toxicidad clase III y permite un máximo de ocho partes por millón (ppm) de malatión presente como un residuo en los cultivos específicos utilizados como alimentos (Goda et al. 2010).
Se han reportado en la literatura científica algunos microorganismos capaces de degradar el malatión, como Pseudomonas putida cepa is168, Brevibacillus sp. cepa kb2 y Bacillus cereus cepa PU (figura 6).
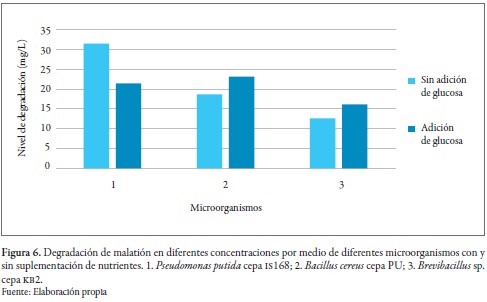
Goda et al. (2010) demostraron que la P. putida en presencia de glucosa degrada el malatión con mayor lentitud que sin adición de esta, lo cual puede ser explicado por el uso preferencial de la glucosa como fuente de carbono en lugar del malatión durante los primeros dos días. Después de cuatro días, la degradación del malatión, ya sea en presencia o en ausencia de glucosa, no mostró diferencias significativas. Por lo tanto, puede ser que el consumo de malatión por la cepa comience después de 48 h, cuando los niveles de glucosa se hayan agotado. Por el contrario, Singh et al. (2012) señalaron que Brevibacillus sp. y B. cereus aumentaron su crecimiento con adición de extracto de levadura y glucosa en comparación con su crecimiento sin adición de nutrientes, además, proponen que la biorremediación de malatión se podría mejorar mediante la adición de succinato de sodio y acetato de sodio. El malatión además puede ser oxidado a malaoxón, que es 40 veces más tóxico que su precursor, pero se degrada más rápidamente que este por medio de microorganismos. En efecto, Singh et al. (2012) demostraron que Brevibacillus sp. y B. cereus degradaron malaoxón en mayor porcentaje que el mismo malatión debido a su estado oxidado.
Metamidofos
El metamidofos es un compuesto altamente tóxico para humanos y animales, reconocido por su amplia actividad insecticida y acaricida en cultivos de arroz, algodón y maíz. Este posee una alta solubilidad en el agua, por lo que puede contaminar fácilmente aguas subterráneas y superficiales y, por ende, el agua potable y los alimentos (Zhao et al. 2010).
Existe poca información sobre microorganismos degradadores de este compuesto, debido a su alta toxicidad y prohibición en muchos países, sin embargo, algunos microorganismos aislados del suelo pueden degradarlo. Zhao et al. (2010) demostraron que el Penicillium oxalicum zhj6 pudo degradar metamidofos en diferentes condiciones de temperatura y pH, las cuales mostraron ejercer un efecto determinante en el tiempo y el porcentaje de degradación del metamidofos. Wang et al. (2010) coinciden en que es necesario garantizar condiciones especiales para la biorremediación y señalan que Hyphomicrobium sp. MAP-1 tiene la capacidad de degradar altas concentraciones de metamidofos (4.000 mg/L) con metanol como suplemento para la degradación.
Wang et al. (2010) propusieron una vía de degradaciónbioquímica de metamidofos en la cual se rompen los enlaces p-n, p-o y p-s en diferentes etapas hasta que el metamidofos es transformado en ácido fosfórico. Se ha informado, además, que durante la transformación de otros insecticidas organofosforados también se sigue esta ruta de biorremediación.
Forato
El forato es uno de los insecticidas más tóxicos ampliamente utilizado en la agricultura y en bosques para controlar insectos chupadores y masticadores ornamentales. La Organización Mundial de la Salud (OMS) clasifica el forato como plaguicida extremadamente peligroso y la Organización para la Agricultura y la Alimentación (fao) ha prohibido su uso en los países en desarrollo, por lo tanto, su uso continuo es una preocupación creciente (Rani y Juwarkar 2012).
Rani y Juwarkar (2012) demostraron la degradación de forato por un consorcio microbiano conformado por Ralstonia eutropha, Pseudomonas aeruginosa y Enterobacter cloacae. Este organofosforado fue degradado en un 73% en siete días en medio mineral, mientras que en suelo la degradación de un 55% tomó 30 días. Esto mostró, una vez más, la dificultad que tienen los microorganismos para degradar estos compuestos en matrices complejas como el suelo. De hecho, se evidencia que el tipo de matriz en la que se lleva a cabo la degradación del organofosforado es más influyente que la variación en la concentración del compuesto, dado que para una concentración de 10 y 20 mg/L, el porcentaje y el tiempo de degradación en el suelo fue el mismo.Debido a que el forato es un fosfotriéster, requiere la enzima hidrolasa —comúnmente conocida como fosfotriesterasa— que conduce a la formación de dietil ditiofosfato. Este último es un fosfodiéster y es susceptible al ataque por la enzima fosfodiesterasa para formar etil-tiofosfato. Posteriormente, la enzima fosfomonoesterasa hidroliza el compuesto anterior y forma fosfato, el cual es un compuesto fácilmente asimilable por microorganismos y plantas (Rani et al. 2012; Rani y Juwarkar 2012).
Dimetoato
El dimetoato es un insecticida sistémico y acaricida que se considera también como un pesticida carbamato, debido a la existencia de un grupo carbamato en su estructura química. Se utiliza bastante en muchos países, en un gran número de cultivos, para el control de una amplia gama de insectos. El dimetoato causa la muerte de estos por contacto e ingestión y en los humanos se absorbe fácilmente a través de la piel y por ingestión. Este organofosforado se clasifica como un compuesto "moderadamente peligroso" por la OMS. Se han detectado residuos de dimetoato y sus análogos oxidados en el suelo, frutas, verduras e incluso en leche de vaca. Su vida media es de 12 a 206 días a 25 °C (Li et al. 2010).
Paracoccus sp. cepa Lgjj-3 demostró ser una gran alternativa para la biorremediación de dimetoato porque tiene la capacidad de degradarlo a niveles indetectables en seis días, en un amplio rango de pH y temperatura, sin embargo, los valores óptimos para este proceso son 35 °C y pH 7. Li et al. (2010) propusieron por primera vez la ruta de degradación: el primer paso es la escisión del enlace amida para formar el ácido carboxílico dimetoato y, luego, por medio de oxidaciones o descarboxilaciones, se degrada hasta formarse el ácido fosforotioico.
Paratión - metil paratión
El paratión es un insecticida no sistémico que se emplea en muchos países del mundo como fungicida y acaricida, tanto al aire libre como en invernaderos (OMS 2004). El metil paratión (MP), por su parte, es un plaguicida de amplio espectro también conocido como metafos, el cual tiene una vida media de 6,5 a 13 días, a 40 ºC, con un pH menor a 8. Al igual que el paratión, el metil paratión y sus metabolitos tienen una movilidad poco apreciable por la alta afinidad con las partículas del suelo, lo que implica poco riesgo de contaminación para los mantos acuíferos subterráneos. Son contaminantes orgánicos persistentes y disruptores endocrinos, que son absorbidos por los animales después de la ingestión, inhalación o exposición por vía dérmica, por lo tanto, sus usos han sido prohibidos en muchos países (Papa et al. 1987; González et al. 2007; Liu et al. 2007; Cycoń et al. 2013).
Serratia marcescens mostró tener la capacidad de degradar el paratión en diferentes matrices de suelo; se observó la mejor degradación en suelo arenoso (figura 4). Acinetobacter radioresistens ustb-04, por su parte, puede degradar el 41% de 1.200 mg/L de metil paration; no obstante, este porcentaje aumenta al 100% cuando se suplementa con fosfato y urea. Liu et al. (2007) demostraron que A. radioresistens incrementó del 20% al 90% la eficiencia de degradación de MP con el aumento de pH. A su vez, Cycoń et al. (2013) coincidieron en esta misma tesis y demostraron que la actividad de las enzimas requiere un ambiente alcalino para la degradación de este organofosforado.
La hidrólisis enzimática del metil paratión se puede realizar biológicamente a partir de la enzima fosfotriesterasa, para dar lugar a la formación de p-nitrofenol (PNP). Sin embargo, Liu et al. (2007) reportaron que el PNP no se forma durante la biorremediación de MP, lo que sugiere que A. radioresistens puede degradar MP por otras vías. Yang et al. (2007) demostraron que la degradación microbiana de paratión se puede producir a través de tres vías: en primer lugar, la formación de p-nitrofenol por la hidrólisis del enlace fosfotriéster; en segundo lugar, la reducción del grupo nitro en condiciones bajas de oxígeno y, después, la hidrólisis para producir p-aminofenol; y, en tercer lugar, la conversión del paratión en paraoxón antes de la hidrólisis del enlace fosfotriéster.
Fenitrotión
El fenitrotión es un organofosforado nitrofenólico no sistémico muy utilizado como insecticida y acaricida de amplio espectro en cultivos, especialmente, de arroz. En general, en condiciones aerobias, el principal metabolito es 3-metil-4-nitrofenol (MNP), que es un producto químico artificial que no se produce en el entorno natural. La mayoría de los nitrofenoles, incluyendo MNP, se descomponen en las aguas superficiales, pero tardan mucho tiempo en el suelo profundo y en el agua subterránea, además, son tóxicos para muchos organismos vivos, por lo que es común encontrar acumulación de nitrofenoles en suelos rociados con este plaguicida (Hong et al. 2007).
Serratia marcescens, además de degradar el clorpirifós y el paratión, tiene la capacidad de degradar el fenitrotión (figura 4). Cycoń et al. (2013) demostraron que S. marcescens degrada alrededor del 70% de 50 mg/L de este organofosforado en diferentes tipos de suelo, con mejores resultados en suelos limosos. No obstante, Hong et al. (2007) probaron la degradación de este plaguicida por la bacteria Burkholderia sp. cepa FDS-1 también en suelo y con la misma concentración inicial, sin embargo, el porcentaje de degradación fue mayor en condiciones especiales de temperatura y pH.
Burkholderia sp. tiene la capacidad de degradar fenitrotión en un amplio rango de temperatura, pH y concentración de inóculo, con la mejor degradación a 30 °C, pH 7 y 2*106ufc/g de suelo. Cabe resaltar que las mejores condiciones para eliminar este pesticida dependen de la degradación de MNP (su metabolito principal), puesto que este también es un contaminante. Burkholderia sp. degrada tanto el fenitrotión como el MNP bajo las condiciones descritas anteriormente (Hong et al. 2007).
Diclorvos
El diclorvos representa una de las clases principales de plaguicidas organofosforados. Es de moderado a sumamente tóxico en los mamíferos, se absorbe fácilmente en el cuerpo por todas las vías de exposición y se metaboliza sin dificultad en el hígado. Tiene una fuerte tendencia de alquilación, lo que podría dañar el ADN y causar mutaciones o cáncer.
La pérdida accidental o la aplicación directa de diclorvos en suelos o en agua no genera efectos a largo plazo, debido a su rápida degradación y evaporación (pissq 1996; Zhang et al. 2006).
A pesar del gran reconocimiento que tiene este organofosforado como plaguicida en la agricultura, existen pocas investigaciones sobre microorganismos que lo degraden. No obstante, Zhang et al. (2006) encontraron que Ochrobactrum sp. cepa DDV-1 tuvo la capacidad de degradarlo en diferentes pH, con mejores resultados en pH neutro y a 30 °C. Además, tuvo la capacidad de degradar el 100% de altas concentraciones de este organofosforado (500 mg/L) en muestras de suelo en un día.
Otros
De acuerdo con la literatura científica, otros organofosforados utilizados en la agricultura han sido degradados por algunos microorganismos, sin embargo, existen pocos reportes de estos hallazgos. Algunos de estos son profenofos (utilizado en cultivos de algodón para el control de plagas), triazofos (que posee un amplio espectro de actividad), cadusafos (insecticida de amplio espectro utilizado contra nematodos e insectos), etoprofos, isofenfos, isazofos, fentión y tetraclorvinfos (utilizado contra parásitos externos del ganado y aves de corral) (Ortiz y Sánchez 2010; Chanika et al. 2011; Abo-Amer 2012).
Abo-Amer (2012) reportó la degradación de cadusafos, etoprofos, isofenofos e isazofos por medio de Pseudomonas putida (tabla 1). La degradación de estos organofosforados se disminuye con la suplementación de succinato y glucosa. Esto indica que el microorganismo utiliza inicialmente las fuentes de carbono fácilmente asimilables y posteriormente el organofosforado, para el cual necesita generar una mayor maquinaria enzimática.
Otros autores reportaron la degradación del triazofos por Diaphorobacter sp.; del fentión, por P. putida; del profenofos, por P. aeruginosa; y de tetraclorvinfos, por un consorcio conformado por seis microorganismos (tabla 1) (Malghani et al. 2009; Ortiz y Sánchez 2010; Chanika et al. 2011; Liang et al. 2011). Cabe resaltar que, a pesar de la poca información encontrada sobre estos organofosforados, en general, se presenta la misma tendencia encontrada en otros: mejor degradación en suelos sin esterilizar (en comparación con suelos estériles), también en medios enriquecidos y en temperaturas entre los 25 °C y los 30 °C, pH neutro e inóculos altos.
Algunos de estos organofosforados generan metabolitos primarios o intermediarios también altamente contaminantes para el ambiente, tal es el caso del tetraclorvinfos, que produce 2,4,5 cloro triclorofenacil, que es un compuesto de cloruro que puede convertirse en recalcitrante y permanecer en el ambiente durante un tiempo más largo que el mismo compuesto parental. No obstante, se pueden generar también metabolitos poco contaminantes que los microorganismos pueden utilizar como fuente de fósforo. En el caso del tetraclorvinfos, se genera dimetil fosfato que es fácilmente asimilable como fuente de fósforo (Ortiz y Sánchez 2010).
Discusión
En el sector agrícola, los organoclorados —con su baja degradabilidad y gran bioacumulación— dieron paso al uso extendido de organofosforados, que se destacan por su alta toxicidad, su baja estabilidad química y su nula acumulación en los tejidos (Yufra 2013). En la literatura se reporta que los organofosforados más utilizados en la agricultura son diclorvos, fenitrotión, dimetoato, paratión, clorpirifós, diazinón y malatión (Fernández et al. 2010). Adicionalmente, de acuerdo con los resultados obtenidos por la revisión sistemática de la literatura científica, se demuestra que los organofosforados más estudiados en las investigaciones sobre su degradación por microorganismos son clorpirifós, fenamifos, tributil fosfato, malatión, metil paratión y fenitrotión (Chanika et al. 2011; Briceño et al. 2012; Cycoń et al. 2013). Las coincidencias evidenciadas en estos estudios muestran que los organofosforados más utilizados en el sector agrícola también han sido los más investigados en cuanto a su degradación por microorganismos.
Por otra parte, se destacan en las investigaciones algunos organofosforados altamente tóxicos como forato y metamidofos, sobre los cuales es poca la información que se encuentra, mientras que, para los organofosforados medianamente tóxicos y muy utilizados (como clorpirifós, fenamifos, malatión y tributil fosfato) se encuentra mayor información.
En la literatura se han reportado algunos microorganismos degradadores de organofosforados, como algunas especies del género Lactobacillus; algunos hongos, como Hypholoma fasciculare, Coriolus versicolor y Phanerochaete chrysosporium; y algunas bacterias, como Serratia liquefaciens, Serratia plymuthica, Pseudomonas putida y Pseudomonas radiora (Antolinez et al. 2001; Zhao y Wang 2011).
No obstante, los microorganismos encontrados en este estudio son muy variados (tabla 1). Entre ellos se encuentran algunos hongos como Penicillium sp., Verticillium sp. y Aspergillus sp., y bacterias de los géneros Bacillus, Streptomyces, Acinetobacter, Pseudomonas y Serratia, así como algunas enterobacterias, entre otras. Igualmente, los resultados obtenidos en esta revisión sistemática confirman a Serratia, Bacillus y Pseudomonas, como los géneros más estudiados como degradadores de organofosforados, y, este último, con las especies P. putida (la más encontrada), P. pseudoalcaligenes y P. aeruginosa. Este grupo final es el que presenta mayor potencial para el uso en biorremediación (Chanika et al. 2011; Abo-Amer 2012; Chaudhari et al. 2012; Cycoń et al. 2013).
Se destaca dentro de los resultados que los géneros de hongos encontrados fueron Aspergillus, Penicillium, Verticillium, Eurotium y Emericella (Maya et al. 2012; Silambarasan y Abraham 2012; Sasikala et al. 2012). Estos se caracterizan por ser comunes en
el ambiente; ciertas especies son fitopatógenas y producen micotoxinas. Algunos se encontraron participando en consorcios y otros en forma libre, mientras que todos ellos degradan clorpirifós. Adicionalmente, se observa en los resultados la presencia de algunos microorganismos patógenos como Bacillus cereus y algunas enterobacterias como Klebsiella sp. y Enterobacter sp. No se recomienda el uso de estos últimos para biorremediación en campos abiertos (Singh et al. 2006; Rani y Juwarkar 2012; Singh et al. 2012).
En este estudio se demostró que muchos de estos microorganismos presentaron mejor degradación en consorcio que en poblaciones individuales. Sasikala et al. (2012), Rani y Juwarkar (2012) y Ortiz-Hernández y Sánchez-Salinas (2010) demostraron que la capacidad degradadora de un consorcio microbiano es equiparable con la sumatoria de la capacidad degradadora de los microorganismos que lo conforman. Los estudios de estos autores sugieren que los miembros de un consorcio mantienen la compatibilidad metabólica y ecológica siempre y cuando las transformaciones ambientales que se generan permitan que ellos coexistan cercanamente. Un consorcio puede desempeñar funciones complejas que poblaciones individuales no podrían; además, la vida en asociación puede generar mayor resistencia a las fluctuaciones del ambiente y promover la estabilidad de los miembros en el tiempo (Ochoa y Montoya 2010). Existe mucha variación entre las poblaciones descritas por estos autores, sin embargo, es de destacar la presencia frecuente de especies del género Pseudomonas entre ellos.
Se ha demostrado que la ventaja de un consorcio aislado con el pesticida como única fuente de carbono es que una cepa bacteriana puede llevar a cabo primero la hidrólisis, mientras otras son capaces de utilizar los compuestos resultantes como fuente de fósforo y carbono. Por lo tanto, es aconsejable llevar a cabo más estudios para evaluar cuáles bacterias del consorcio hacen la hidrólisis inicial y si hay otras que produzcan la mineralización completa (Ortiz y Sánchez 2010).
Se encontró, además, que la biorremediación de organofosforados está limitada por una gran cantidad de factores físicos y químicos que afectan los micro-organismos y la disponibilidad de organofosforados como tal. Entre estos factores se encuentran el pH, la temperatura, la concentración del plaguicida, el tipo de suelo, la presencia o ausencia de suplementos nutricionales y la concentración del inóculo.
El medio en el cual se evaluó la capacidad degradativa de los microorganismos fue el factor más definitorio. La degradación de organofosforados en el suelo es un proceso de atenuación fundamental gobernado por factores tanto abióticos como bióticos, que se ve afectado por una variedad de interacciones entre los microorganismos y los constituyentes del suelo. Por otra parte, la sorción limita el transporte, la transformación y la bioacumulación de OPP (Liang et al. 2011).
Serratia marcescens, Cupriavidus sp., Ochrobactrum sp., P. aeruginosa y algunos consorcios demostraron menor porcentaje de degradación cuando fueron evaluados en suelos y mayor cuando fueron evaluados en medio mineral. Betancur (2013) señaló que esto puede deberse a los diferentes mecanismos que debe utilizar el microorganismo para acceder al organofosforado; mecanismos como la adaptación morfológica por medio del desarrollo de estructuras que permitan un mejor aprovechamiento del espacio tridimensional que contiene el sustrato, en este caso el suelo; las adaptaciones fisiológicas como la adquisición de sistemas de asimilación de alta afinidad por el contaminante; y la quimiotaxis, que le permite localizar fuentes de contaminantes e incrementar su biodisponibilidad mediante el movimiento en dirección a un gradiente superior.
Sumado a lo anterior, el tipo de suelo, el contenido de materia orgánica, el contenido y la naturaleza de los minerales de arcillas presentes en el suelo, y la composición granulométrica pueden influir decisivamente en el grado de remediación del organofosforado. Adicionalmente, los organofosforados son los plaguicidas más fuertemente inactivados en el suelo, debido a que son los más fácilmente adsorbidos (Sánchez y Sánchez 1984).
Se revela, además, que muchos autores coinciden en cuanto a las condiciones de temperatura, la concentración del organofosforado e inóculo y la presencia de suplementos nutricionales. Zhao et al. (2010), Hong et al. (2007), Zhang et al. (2006) y Abo-Amer (2012) coinciden en que la mejor temperatura para degradar organofosforados se encuentra entre 25 °C y 37 °C, y la óptima es de 30 °C. Hong et al. (2007) y Abo-Amer (2012) convienen en una concentración de inóculo ideal de 2*10⁶ ufc/g suelo.
El tamaño del inóculo es un factor determinante, debido a que los microorganismos exógenos cuando se añaden al suelo, corren el riesgo de quedar fuera de competencia por las comunidades microbianas autóctonas, en especial por protozoos. La aplicación de inóculo en cantidades óptimas no solo aumenta las posibilidades de éxito de la biorremediación, sino que también disminuye el costo del proceso (Hong et al. 2007).
La concentración del organofosforado fue determinante en la actividad degradativa de los diferentes plaguicidas estudiados. La mayoría de los estudios evaluaron concentraciones entre 10 y 100 mg/L, en las cuales se encontraron porcentajes de degradación altos. Las concentraciones superiores a 500 mg/L inhibieron algunos microorganismos, mientras que otros tuvieron la capacidad de degradar hasta 4.000 mg/L; no obstante, esta capacidad está ligada al tipo de cepa y al organofosforado degradado. Hyphomicrobium sp., por ejemplo, tuvo la capacidad de degradar 4.000 mg/L de metamidofos, mientras que Penicillium oxalicum solo degradó 0,8 mg/L. Cabe resaltar que la degradación de concentraciones altas, por lo general, se encontró ligada a la suplementación con nutrientes (Zhao et al. 2010; Wang et al. 2010).
Las investigaciones revelaron que, en el caso de suplementación con nutrientes, se presenta una degradación más rápida en comparación con tratamientos sin adición. Esto podría deberse al hecho de que los organofosforados sujetos a la acción microbiana no generan un crecimiento sustancial de las poblaciones responsables, lo cual ha llevado a considerar el FENómeno denominado cometabolismo o cooxidación. Por tanto, es probable que los microorganismos estén consumiendo el sustrato fácilmente biodegradable (nutrientes adicionados), mientras degradan el organofosforado (Betancur 2013), lo que explica la rápida degradación con adición de nutrientes.
En cuanto al pH, este fue muy variable entre las investigaciones. En general, los investigadores reportaron que las bacterias tienen la capacidad de degradar los organofosforados en un rango de 5 a 8, con un pH óptimo de 7. Sin embargo, Anwar et al. (2009), Liu et al. (2007) y Zhang et al. (2006) indicaron que la degradación aumentó cuando el pH también lo hizo (8,0-10,0). Paradójicamente, Zhao et al. (2010) indicaron que el organofosforado fue degradado en mayor porcentaje en pH ácido. El pH en el cual el microorganismo tiene mayor capacidad degradativa demuestra el proceso metabólico por el cual realiza la degradación del organofosforado.
El número y la variedad de plaguicidas organofosforados con los cuales los microorganismos están implicados en los suelos agrícolas aumentan el número de sistemas enzimáticos básicos que pueden estar relacionados con estos microorganismos. Debido al gran número de microorganismos involucrados en procesos de biorremediación, numerosas vías enzimáticas se han desarrollado para metabolizar los compuestos organofosforados (Imran y Kim 2003). La bioquímica de degradación de los organofosforados por la mayoría de los microorganismos parece ser idéntica. Los autores coinciden en que, en general, la enzima utilizada para la degradación de organofosforados es la fosfotriesterasa, que se caracteriza por catalizar la primera etapa de la degradación, es decir, la hidrólisis de triésteres del ácido fosfórico. Esta enzima, de acuerdo con el pH óptimo para su actividad catalítica, es denominada fosfatasa alcalina (Dalurzo et al. 2010), sin embargo, Singh et al. (2012) y Picco (2009) reportan que la degradación del malatión se realiza por medio de la enzima carboxilesterasa, la cual hidroliza ésteres carboxílicos. Cabe resaltar que muchas vías metabólicas dependen de enzimas que están codificadas en un plásmido, por lo cual, la capacidad de los microorganismos para degradar compuestos orgánicos depende de la estabilidad de los plásmidos o genes del microorganismo (Ortiz y Sánchez 2010).
Conclusiones
Los métodos de laboratorio solo pueden aislar del 1% al 10% de todos los microorganismos que crecen en el suelo, razón por la cual algunos microorganismos que interfieren en los procesos de degradación en ambientes naturales no se pueden obtener a escala de laboratorio. Por lo tanto, quedan sin identificar algunas de las bacterias, hongos y consorcios microbianos que pudieron haber estado implicados en la restauración de los ambientes contaminados.
El éxito o el fracaso de la biorremediación depende de varios factores, tales como la capacidad competitiva de los microorganismos, la biodisponibilidad, la concentración del organofosforado, la humedad, el pH, la temperatura del suelo, el tipo de suelo, la presencia o ausencia de suplementos nutricionales y la concentración del inóculo.
La bioquímica de la degradación por microorganismos de los plaguicidas organofosforados sigue, en la mayoría de los casos, una ruta principal que es la degradación por medio de la enzima fosfotriesterasa y, excepcionalmente, por enzimas carboxilesterasas.
Los consorcios microbianos demostraron tener mayor potencial de degradación de organofosforados que las poblaciones individuales, puesto que un consorcio actúa por la suma de sus partes. En efecto, las relaciones fisiológicas y ecológicas compatibles entre los individuos permiten que estos coexistan y desarrollen funciones complejas que garantizan la metabolización de sustratos difíciles de asimilar en mayores porcentajes para poblaciones individuales.
Debido a la alta variabilidad entre las metodologías empleadas en los estudios, no se pueden desarrollar metaanálisis con los datos encontrados.
Se recomienda investigar con mayor profundidad la ruta de degradación de los organofosforados y el nivel de degradación de los metabolitos intermediarios, puesto que algunos de estos últimos son más contaminantes que su molécula parental.
Dentro de los consorcios microbianos se recomienda investigar cuáles microorganismos llevan a cabo la hidrólisis inicial de los organofosforados y cuáles la mineralización completa.
Agradecimientos
El proyecto de investigación (acta ciemtg-02-13) agradece al Centro de Investigaciones y al Grupo de Investigación Salud y Sostenibilidad, de la Escuela de Microbiología de la Universidad de Antioquia.
Descargos de responsabilidad
Los autores declaran que no existieron conflictos de interés que comprometieran la validez de los resultados presentados en esta investigación.
Referencias
Abo-Amer AE. 2012. Characterization of a strain of Pseudomonas putida isolated from agricultural soil that degrades cadusafos (an organophosphorus pesticide). World J Microbiol Biotechnol. 28(3):805-814. [ Links ]
Ahire KC, Kapadnis BP, Kulkarni GJ, Shouche YS, Deopurkar RL. 2012. Biodegradation of tributyl phosphate by novel bacteria isolated from enrichment cultures. Biodegradation. 23(1):165-176. [ Links ]
Antolinez N, Acero S, Mertinez-Nieto P, Bernal-Castillo J. 2001. Biodegradation of Malathion by marine bacteria isolated from the Colombian Cartagena-Bay. Regulación de la fertilidad en agroecosistemas de los Andes tropicales. Ponencia presentada en: IV Simposio Internacional Desarrollo Sustentable en los Andes. La estrategia para el siglo XXI; Mérida, Venezuela. [ Links ]
Anwar S, Liaquat F, Khan QM, Khalid ZM, Iqbal S. 2009. Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol by Bacillus pumilus strain C2A1. J Hazard Mater. 168(1):400-405. [ Links ]
Argumedo-Delira R, Alarcón A, Ferrera-Cerrato R, Peña- Cabriales JJ. 2009. El género fúngico Trichoderma y su relación con contaminantes orgánicos e inorgánicos. Rev Int Contam Ambient. 25(4):257-269. [ Links ]
Betancur B. 2013. Biorremediación de suelo contaminado con el pesticida 1,1,1-tricloro-2,2'bis(p-clorofenil)etano (DDT) mediante protocolos de bioestimulación y adición de surfactante [tesis de grado]. [Medellín, Colombia]: Universidad Nacional de Colombia. [ Links ]
Briceño G, Fuentes MS, Palma G, Jorquera MA, Amoroso MJ, Diez MC. 2012. Chlorpyrifos biodegradation and 3,5,6-trichloro-2-pyridinol production by actinobacteria isolated from soil. Int Biodeterior Biodegradation. 73:1-7. [ Links ]
Chanika E, Georgiadou D, Soueref E, Karas P, Karanasios E, Tsiropoulos NG, Tzortzakakis EA, Karpouzas DG. 2011. Isolation of soil bacteria able to hydrolyze both organophosphate and carbamate pesticides. Bioresour Technol. 102(3):3184-3192. [ Links ]
Chaudhari TD, Melo JS, Fulekar MH, D'Souza SF. 2012. Tributyl phosphate degradation in batch and continuous processes using Pseudomonas pseudoalcaligenes MHF ENV. Int Biodeterior Biodegradation. 74:87-92. [ Links ]
Cycoń, M, Żmijowska A, Wójcik M, Piotrowska-Seget Z. 2013. Biodegradation and bioremediation potential of diazinon-degrading Serratia marcescens to remove other organophosphorus pesticides from soils. J Environ Manage. 117:7-16. [ Links ]
Dalurzo H, Toledo DM, Vázquez S. 2000. Efecto del uso del suelo sobre la actividad de la fosfatasa ácida en ultisoles del sur de Misiones. Universidad Nacional del Nordeste. [consultado 2014 jun 21] http://www.unne.edu.ar/unnevieja/Web/cyt/cyt/2000/5_agrarias/a_pdf/a_021.pdf. [ Links ]
Fang H, Qin Xiang Y, Jie Hao Y, Qiang Chu X, Dong Pan X, Quan Yu J, Long Yu Y. 2008. Fungal degradation of chlorpyrifos by Verticillium sp. dsp in pure cultures and its use in bioremediation of contaminated soil and pakchoi. Int Biodeterior Biodegradation. 61(4):294-303. [ Links ]
[FAO] Organización de las Naciones Unidas para la Alimentación y la Agricultura. 1997. Departamento de desarrollo sostenible. Depósito de documentos de la FAO. Capítulo 4. Los plaguicidas, en cuanto contaminantes del agua; [consultado 2013 mar 13]. http://www.fao.org/docrep/W2598S/w2598s06.htm. [ Links ]
Fernández DG, Mancipe LC, Fernández DC. 2010. Intoxicación por organofosforados. Rev Med. 18(1):84-92. [ Links ]
Ferrer A. 2003. Intoxicación por plaguicidas. Anales Sis San Navarra. 26(1supl.):155-171. [ Links ]
Goda SK, Elsayed IE, Khodair TA, El-Sayed W, Mohamed ME. 2010. Screening for and isolation and identification of malathion-degrading bacteria: cloning and sequencing a gene that potentially encodes the malathion-degrading enzyme, carboxylestrase in soil bacteria. Biodegradation. 21(6):903-913. [ Links ]
González UM, Dávila, Pinedo JA Serrano B. 2007. Degradación fotocatalítica de metil paratión y paraquat. Rev Digit Univ Auton Zacatecas. 3(1):1-16. [ Links ]
Hong Q, Zhang Z, Hong Y, Li S. 2007. A microcosm study on bioremediation of fenitrothion-contaminated soil using Burkholderia sp. FDS-1. Int Biodeterior Biodegradation. 59(1):55-61. [ Links ]
Imran H, Kim J-G. 2003. Comparison of growth kinetics in Pseudomonas using two different sets of conditions. Environmentalist. 23(1):71-80. [ Links ]
Li R, Zheng J, Wang R, Song Y, Chen Q, Yang X, Li S, Jiang J. 2010. Biochemical degradation pathway of dimethoate by Paracoccus sp. Lgjj-3 isolated from treatment wastewater. Int Biodeterior Biodegradation. 64(1):51-57. [ Links ]
Li X, Jiang J, Gu L, Ali SW, He J, Li S. 2008. Diversity of chlorpyrifos-degrading bacteria isolated from chlorpyrifos- contaminated samples. Int Biodeterior Biodegradation. 62(4):331-335. [ Links ]
Liang B, Yang C, Gong M, Zhao Y, Zhang J, Zhu C, Jiang J, Li S. 2011. Adsorption and degradation of triazophos, chlorpyrifos and their main hydrolytic metabolites in paddy soil from Chaohu Lake, China. J Environ Manage. 92(9):2229-2234. [ Links ]
Liu FY, Hong MZ, Liu DM, Li YW, Shou PS, Yan H, Shi GQ. 2007. Biodegradation of methyl parathion by Acinetobacter radioresistens ustb-04. J Environ Sci (China). 19(10):1257-1260. [ Links ]
Lopera MM, Peñuela GA, Domínguez MC, Mejía GM. 2005. Evaluación de la degradación del plaguicida clorpirifós en muestras de suelo utilizando el hongo Phanerochaete chrysosporium. Rev Fac Ing Univ Antioq. 33:58-69. [ Links ]
Lu P, Li Q, Liu H, Feng Z, Yan X, Hong Q, Li S. 2013. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by Cupriavidus sp. dt-1. Bioresour Technol. 127:337-342Maceda-Veiga A, Monroy M, De Sostoa M. 2012. Metal bioaccumulation in the mediterranean barbel (Barbus meridionalis) in a Mediterranean river receiving effluents from urban and industrial wastewater treatment plants. Ecotoxicol Environ Safe. 76(2):93-101. [ Links ]
Malghani S, Chatterjee N, Hu X, Zejiao L. 2009. Isolation and characterization of a profenofos degrading bacterium. J Environ Sci (China). 21(11):1591-1597. [ Links ]
Maya K, Upadhyay SN, Singh RS, Dubey SK. 2012. Degradation kinetics of chlorpyrifos and 3,5,6-trichloro- 2-pyridinol (TCP) by fungal communities. Bioresour Technol. 126:216-223. [ Links ]
Megharaj M, Singh N, Kookana RS, Naidu R, Sethunathan N. 2003. Hydrolysis of fenamiphos and its oxidation products by a soil bacterium in pure culture, soil and water. Appl Microbiol Biotechnol. 61(3):252-256. [ Links ]
Ochoa DC, Montoya A. 2010. Consorcios microbianos: una metáfora biológica aplicada a la asociatividad empresarial en cadenas productivas agropecuarias. Rev Fac Cienc Econ. 18(2):55-74. [ Links ]
[OMS] Organización Mundial de la Salud. 2004. Guías de la OMS para la calidad del agua potable; [consultado 2014 may 14]. http://goo.gl/3rgqUp. [ Links ]
Ortiz-Hernández ML, Sánchez-Salinas E. 2010. Biodegradation of the organophosphate pesticide tetrachlorvinphos by bacteria isolated from agricultural soils in México. Rev Int Contam Ambient. 26(1):27-38. [ Links ]
Papa L, Derosa C, Stara J. 1987. Metil paration: efectos sobre la salud y el ambiente. Metepec (México): [EPA] Enviromental Protection Agency. [ Links ]
Picco EJ. 2009. Influencia de los estados fisiológicos en la disposición cinética de clorpirifós en bovinos [tesis doctoral]. [Santa Fe, Argentina]: Universidad Nacional del Litoral. [ Links ]
[PISSQ] Programa Internacional de Seguridad de las Sustancias Químicas. 1996. Diclorvós. Guía para la salud y la seguridad No. 18. Metepec, México: Centro Panamericano de Ecología Humana y Salud, Organización Panamericana de la Salud, Organización Mundial de la Salud. [ Links ]
Quintero JC. 2011. Revisión: degradación de plaguicidas mediante hongos de la pudrición blanca de la madera. Rev Fac Nac Agron. 64(1):5867-5882. [ Links ]
Ramírez JA, Lacasaña M. 2001. Plaguicidas: clasificación, uso, toxicología y medición de la exposición. Arch Prev Riesgos Labor. 4(2):67-75. [ Links ]
Rani R, Juwarkar A. 2012. Biodegradation of phorate in soil and rhizosphere of Brassica juncea (L.) (Indian Mustard) by a microbial consortium. Int Biodeterior Biodegradation. 71:36-42. [ Links ]
Rani R, Padole P, Juwarkar A, Chakrabarti T. 2012. Phytotransformation of phorate by Brassica juncea (Indian Mustard). Water Air Soil Pollut. 223(3):1383-1392. [ Links ]
Sánchez MJ, Sánchez M. 1984. Los plaguicidas. Adsorción y evolución en el suelo. CeresNet; [consultado 2014 jun 6]. http://www.ceresnet.com/ceresnet/esp/servicios/teleformacion /agroambiente/plaguicidas.pdf. [ Links ]
Sasikala C, Jiwal S, Rout P, Ramya M. 2012. Biodegradation of chlorpyrifos by bacterial consortium isolated from agriculture soil. World J Microbiol Biotechnol. 28(3):1301-1308. [ Links ]
Silambarasan S, Abraham J. 2012. Ecofriendly method for bioremediation of chlorpyrifos from agricultural soil by novel fungus Aspergillus terreus jas1. Water Air Soil Pollut. 224:1369. [ Links ]
Silambarasan S, Abraham J. 2013. Kinetic studies on enhancement of degradation of chlorpyrifos and its hydrolyzing metabolite TCP by a newly isolated Alcaligenes sp. jas1. J Taiwan Inst Chem Eng. 44(3):438-445. [ Links ]
Singh B, Kaur J, Singh K. 2012. Biodegradation of malathion by Brevibacillus sp. strain KB2 and Bacillus cereus strain PU. World J Microbiol Biotechnol. 28(3):1133-1141. [ Links ]
Singh BK, Walker A, Wright DJ. 2006. Bioremedial potential of fenamiphos and chlorpyrifos degrading isolates: influence of different environmental conditions. Soil Biol Biochem. 38(9):2682-2693. [ Links ]
Torres K, Zuluaga T. 2009. Biorremediación de suelos contaminados por hidrocarburos [tesis de grado]. [Medellín, Colombia]: Universidad Nacional de Colombia. [ Links ]
Urrútia G, Bonfill X. 2010. Prisma declaration: a proposal to improve the publication of systematic reviews and meta- analyses. Med Clin (Barc). 135(11):507-511. [ Links ]
Vásquez LA. 2010. Análisis de peligros químicos en los sistemas de producción de mora (Rubus glaucus B.) en los departamentos de Antioquia y Caldas (Colombia) [tesis de grado]. [San José, Costa Rica]: Universidad para la Cooperación Internacional (UCI). [ Links ]
Wang L, Wen Y, Guo X, Wang G, Li S, Jiang J. 2010. Degradation of methamidophos by Hyphomicrobium species MAP-1 and the biochemical degradation pathway. Biodegradation. 21(4):513-523. [ Links ]
Wang S, Zhang C, Li K, Qu J, Shi Y, Yan Y. 2013. Chlorpyrifos- induced stress response in the chlorpyrifos-degrader Klebsiella sp. CPK. Int Biodeterior Biodegradation. 82:17-23. [ Links ]
Yang C, Dong M, Yuan Y, Huang Y, Guo X, Qiao C. 2007. Reductive transformation of parathion and methyl parathion by Bacillus sp. Biotechnol Lett. 29(3):487-493. [ Links ]
Yufra VM. 2013. Evaluación del tratamiento con radiación UV para la eliminación de residuos de plaguicidas en aceite de oliva virgen [tesis doctoral]. [Jaén, España]: Universidad de Jaén. [ Links ]
Zhang XH, Zhang GS, Zhang ZH, Xu JH, Li SP. 2006. Isolation and characterization of a dichlorvos-degrading strain ddv-1 of Ochrobactrum sp. Pedosphere. 16(1):64-71. [ Links ]
Zhao RB, Bao HY, Liu YX. 2010. Isolation and characterization of Penicillium oxalicum zhj6 for biodegradation of methamidophos. Agric Sci China. 9(5):695-703. [ Links ]
Zhao XH, Wang J. 2012. A brief study on the degradation kinetics of seven organophosphorus pesticides in skimmed milk cultured with Lactobacillus spp. at 42 °C. Food Chem. 131(1):300-304. [ Links ]














