Introducción
Debido a su valor nutritivo, alto rendimiento y beneficio económico, el cultivo del aguacate, (Persea americana Mill., Lauraceae), en el Ecuador se ha convertido en un producto con alto potencial de exportación. Su producción está localizada principalmente en los valles interandinos de las provincias del Carchi, Imbabura, Pichincha, Tungurahua, Azuay y Loja (Viera et al. 2016a). El producto se oferta en el mercado local casi en su totalidad, sin embargo, una pequeña parte se exporta a Colombia y, en menor proporción, a EE. UU. y Europa (Viera et al. 2016b).
La pudrición radicular causada por Phytophthora cinnamomi Rands es uno de los principales factores que limita la producción del cultivo de aguacate a nivel mundial (Engelbrecht et al. 2013; Ochoa et al. 2015). Fue identificada por primera vez en Burma (Sumatra) por Rands, en 1922 (Erwin y Ribeiro 1996). El primer informe publicado de esta enfermedad en América, en árboles de aguacate, fue realizado por Tucker en Puerto Rico, en 1929 (Zentmyer 1984).
En 1942, la enfermedad fue identificada en California (Zentmyer 1985). En el Ecuador, su presencia se evidencia en 1986 y es catalogada como una enfermedad de alta incidencia, limitada a ciertas regiones y de control obligatorio (MAG 1986).
La enfermedad causa un progresivo decaimiento que eventualmente conduce a la muerte de los árboles severamente atacados. Inicialmente, la planta presenta defoliación parcial y clorosis que se manifiesta de forma leve a moderada. El crecimiento vegetativo se detiene y, por ende, la producción de fruta, lo cual afecta tanto la calidad como la cantidad de los frutos (Erwin y Ribeiro 1996). Al examinar las raíces, se puede evidenciar necrosis y pudrición parcial o total de las raicillas (Besoain et al. 2005).
P. cinnamomi se ubica en el reino Stramenopila, sin embargo, es clasificado dentro de los Peronos poromycetos, con los Oomycota (Blair et al. 2008; Dunstan et al. 2010; Castillo-Reyes et al. 2015). Es considerado uno de los patógenos más destructivos para el cultivo del aguacate, que afecta a especies de plantas en ecosistemas agrícolas y forestales a nivel mundial (Pérez-Jiménez 2008; García et al. 2009). Puede desarrollarse como un saprófito y permanecer como clamidospora o, en menor grado, como oospora por largos periodos en el suelo. Cuando las condiciones son favorables, el ciclo de esporulación asexual inicia. De esta forma, puede permanecer hasta por seis años en el suelo con presencia de humedad constante, factor clave para su estableci miento, diseminación y longevidad (Hardham 2005).
La tradicional descripción taxonómica de las especies del género Phytophthora se ha basado predominante mente en su morfología, características estructurales del esporangio, anteridio, oogonio o micelio (Hardham 2005; Drenth et al. 2006; Engelbrecht et al. 2013). En el diagnóstico convencional, se aísla Phytophthora spp., a partir de tejidos enfermos, usando medios de cultivo que contienen un coctel de antibióticos. Se induce la formación de zoosporas u otras mor fologías (clamidosporas o hifas) y se las evalúa por microscopio. Sin embargo, la dificultad para inducir la producción de estructuras informativas en medio de cultivo puede provocar errores en la identificación (Drenth et al. 2006).
Desde 1980, estudios genéticos basados en métodos moleculares han mejorado la capacidad para identi ficar este tipo de especies (Cooke et al. 2001). Estos estudios abrieron nuevas vías para la identificación de patógenos, con el desarrollo de la biología molecular y análisis de secuencias de ADN (Drenth e Irwin 2001). El diseño de marcadores obtenidos por la reacción en cadena de la polimeraza (PCR), específicos para el género y la digestión con enzimas de restricción, genera patrones de distinción específicos, que se usan como huellas digitales para cada especie (Drenth et al. 2006).
En el Ecuador existen pocos estudios relacionados con P. cinnamomi respecto del cultivo de aguacate, por lo que un diagnóstico temprano como medida de prevención es una estrategia importante para el control de la enfermedad. Los síntomas de este patógeno no se hacen evidentes hasta que las raíces están seriamente infectadas (García et al. 2009), por esto la identificación basada en la sintomatología del árbol puede ser equivoca. El objetivo de este estudio es diagnosticar e identificar la presencia de P. cinnamomi en zonas productoras de aguacate en Ecuador utilizando la técnica molecular de polimorfismos de longitud de fragmentos de restricción (PCR-RFLP).
Materiales y métodos
Aislamiento y purificación del patógeno
La toma de muestras se realizó en fincas y huertos de pequeños productores en las provincias de Tungurahua y Pichincha, tomando raíces de árboles (a una profundidad de 20 cm) que presentaban la sintomatología asociada a la pudrición radicular: secamiento de ramas y de hojas, momificación de frutos y caída de hojas, tal como se indica en la figura 1.

Figura 1 Árboles de aguacate con sintomatología asociada a pudrición radicular (Puéllaro, Pichincha). a. Momificación de frutos y secamiento de hojas; b. Marchitez general del árbol y caída de hojas.
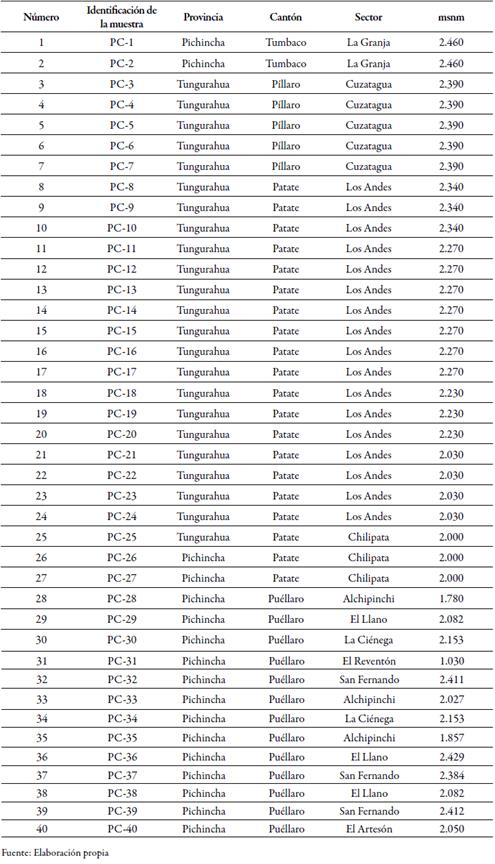
El primer muestreo se realizó en los cantones de Píllaro y Patate (Tungurahua), localidades en las que se obtuvieron 25 muestras; luego se tomaron 13 de Puéllaro (Pichincha) y dos de la Granja Experimental Tumbaco (Pichincha), para un total de 40 muestras (tabla 1). Las raíces con presencia de necrosis inicial fueron cortadas y colocadas en fundas de polietileno negras. Para el aislamiento y purificación del patógeno, se tomaron raíces con tejido enfermo necrótico, las cuales se lavaron y se cortaron en pedazos de dos centímetros cúbicos.
Tabla 1 Sitios de colecta en dos zonas productoras de aguacate de las provincias de Pichincha y Tungurahua (Ecuador)
Se desinfectó el material con una solución de hipoclorito de sodio al 1 % por un minuto, seguido de tres lavados con agua destilada estéril. Los tejidos se colocaron en cajas Petri con 20 ml de medio de cultivo agar-centeno. Cada litro de medio de cultivo contenía los siguientes antibióticos: Rifampicina 20 mg/l, Polimixina B sulfato 50 mg/l y Ampicilina 200 mg/l, y los fungicidas PCNB 67 mg/l y Benlate 100 mg/l. Posteriormente, las cajas Petri fueron llevadas a incubación, a una temperatura de 27 °C, por un periodo de siete días (Forbes 1997).
Multiplicación de aislamientos
De 40 muestras colectadas se lograron obtener 10 aislamientos. Es evidente la dificultad de aislar Phytophthora spp., a partir de muestras de raíces de árboles de aguacate, según lo informado por Drenth e Irwin (2001). En las muestras recogidas por los autores, la identificación morfológica determinó la presencia del patógeno, cuyas colonias se caracterizaron por su color y morfología: micelio cenocítico, hifas abundantes, densas y largas, y coraloides con presencia de protuberancias. Dichas colonias se subcultivaron en medio agar-centeno (60 g/l de centeno, 20 g/l de glucosa y 15 g/l de agar) y se replicaron en medio-alverja (120 g/l de alverjas) sin antibióticos durante siete días en incubación a 24 °C (Forbes 1997).
Extracción y cuantificación del ADN
Se utilizaron 50 mg del micelio liofilizado de los aislamientos replicados para extracción del ADN genómico con el protocolo de Morillo y Miño (2011), utilizando ctab 1X. Realizada la cuantificación con el Kit Qubit Quant-iT™ dsDNA br Assay y el Qubit Fluorometer de Invitrogen, la concentración del ADN se estandarizó a 50 ng de ADN/μl para la PCR.
Amplificación de marcadores its
Validada la amplificación del ADN con un primer RAPD (opaa18), se utilizaron los cebadores para Phytophthora A2 (actttccacgtgaaccgtttcaa) e I2 (gatatcaggtccaattgagatgc) (Drenth et al. 2006). El coctel de reacción de 25 μl contenía 1 μl de ADN (50 ng/μl), 5 μl de Buffer Gotag Promega 5X, dNTPs 10 mM, 1,2 μl de primers 20 μM, 2,5 μl de GoTaq (5 U/ul) y agua ultrapura.
Las reacciones PCR se corrieron en un Termociclador Biometra Gradient. Las condiciones de amplificación consistieron en una incubación inicial a 94 °C (2 min) para desnaturalizar, seguida de 40 ciclos de 94 °C (30 s), 60 °C (30 s), 72 °C (1 min) y una extensión final a 72 °C (10 min). Los productos PCR se visualizaron mediante electroforesis en geles de agarosa al 1 %, teñidos con bromuro de etidio y con tampón tae 1X, y se utilizó como referencia de talla el Low Mass Ladder 100 bp de Invitrogen.
Restricción del fragmento its
Conforme a lo descrito por Drenth et al. (2006), se digirió el ADN amplificado y purificado con las enzimas de restricción TaqI y RsaI (Invitrogen). El fragmento PCR fue purificado utilizando el kit Purelink PCR purification (Invitrogen Cat. K3100-01) y digerido a 65 °C por 30 min. Los productos digeridos se visualizaron mediante electroforesis en geles de agarosa al 2 %, en un fotodocumentador UV Dolphin View. Para la estimación del peso molecular de los fragmentos de restricción se utilizó la aplicación Length (Botstein et al. 1980), que calculó los tamaños de las bandas obtenidas luego de la restricción. Los patrones de bandas fueron comparados con los fragmentos obtenidos por Drenth et al. (2006) para la asignación de cada aislamiento.
Resultados y discusión
Identificación del agente causal
Se logró identificar a Phytophthora en los diez aisla mientos obtenidos. Las colonias se caracterizaron por presentar un color blanquecino, micelio cenocítico de crecimiento irregular y ramificado, hifas densas, largas y coraloides. No presentaron emisión de anteridio, formación de oogonios y emisión de oosporas, y se observó presencia de clamidosporas globosas e intercalares, tal como se indica en la figura 2.
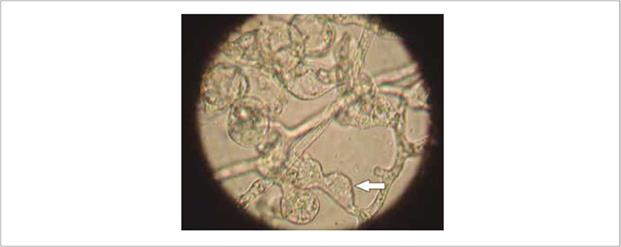
Figura 2 Fotografía del aislamiento PC38. Nótese la presencia de hinchazones hifales (flecha) con formación de clamidosporas características del género Phytophthora sp.
Varios de los aislamientos presentaron estructuras morfológicas de otro patógeno, posiblemente Pythium sp., de características morfológicas similares a P. cinnamomi en medio de cultivo. Pythium con frecuencia forma complejos con otros hongos del suelo u opera como parte de un complejo de la enfermedad involucrando otros patógenos de raíces (Hendrix y Cambell 1973). Estudios realizados indican que existen diversos patógenos presentes en el suelo que pueden ocasionar problemas radiculares en aguacate como Phytophthora citrícola, Armillaria sp., Verticillum sp., Rhizoctonia sp., Rosellinia sp., Cylindrocarpon sp., Fusarium sp., y Pythium sp. (Wagner 1942; Zentmyer 1976; Coffey 1987; Latorre et al. 1998; Besoain y Piotelli 1999; Pérez-Jiménez 2008).
La sintomatología de estos patógenos puede ser similar a la causada por P. cinnamomi, con caracte rísticas de marchitez generalizada, estancamiento en el desarrollo del árbol, pérdida de vigor, color y brillo, y amarillamiento de hojas (Ramírez et al. 2013). Phytophthora sp. está asociado con esta enfermedad, debido a que el patógeno ataca tejido vivo y es un invasor primario, por lo tanto, no invade tejido ya invadido por otros microorganismos (Drenth y Sendall 2001). Sin embargo, no se descarta la posibilidad de que la enfermedad esté relacionada con un complejo de microorganismos que causen la pudrición radicular en aguacate.
Otra de las posibles causas de la incidencia de esta enfermedad en los valles interandinos del Ecuador (Pichincha y Tungurahua) son los sistemas de riego utilizados por los agricultores. Los más empleados son riego por inundación o por surcos (Huaraca et al. 2016), lo que facilita encharcamientos y exceso de humedad en los suelos. La saturación de humedad en el suelo favorece la pudrición radicular (Besoain et al. 2005), de modo que aquella es un factor clave para el establecimiento, diseminación y permanencia del patógeno (Camilo-Alves et al. 2013). El agua facilita la movilidad de las zoosporas, lo cual mejora la habilidad del patógeno para infectar las raíces (Reeksting et al. 2013).
Identificación molecular
Se obtuvo ADN genómico de los aislamientos PC1, PC2, PC7, PC9, PC15, PC18, PC29, PC33, PC35 y PC38, identificados morfológicamente como Phytophthora sp., además de la muestra control de P. infestans (P1). Se obtuvieron rendimientos de ADN superiores a los 50 por muestra. El mar cador utilizado amplificó el fragmento esperado de 800 pb en cuatro aislamientos (PC1, PC15, PC29 y PC38), correspondientes a Phytophthora sp. (Drenth et al. 2006). Esta ampliación estuvo presente así mismo en la muestra control de P. infestans. La PCR fue eficiente y no se observó presencia de fragmentos en el control negativo de la reacción, tal como se observa en la figura 3.
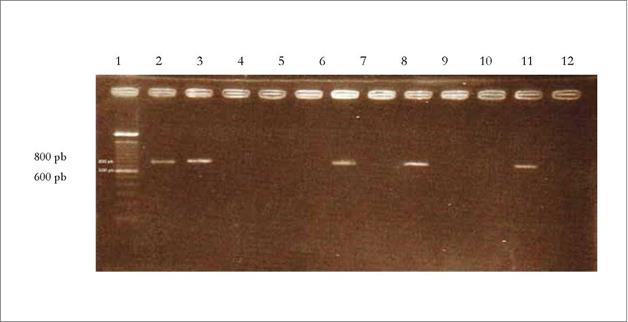
Figura 3 Amplificación del fragmento de 800 pb de la región ITS obtenidos a partir de ADN de aislados de Phytophthora sp. Marcador 100 bp, 1: P1 (P infestans), 2: PC1, 3: PC2, 4: PC7, 5: PC9, 6: PC15, 7: PC18, 8: PC29, 9: PC33, 10: PC35, 11: PC38, 12: control negativo de la PCR.
Con este resultado se confirmó la presencia de Phytophthora en cuatro aislamientos, de acuerdo con la identificación morfológica. En las muestras restantes (PC2, PC7, PC9, PC18, PC33 y PC35) no se obtuvo amplificación del marcador its. Por otro lado, de los patrones de restricción Taql resultaron fragmentos estimados de 285 y 250 pb en P. infestans, de acuerdo con lo descrito por Drenth et al. (2006).
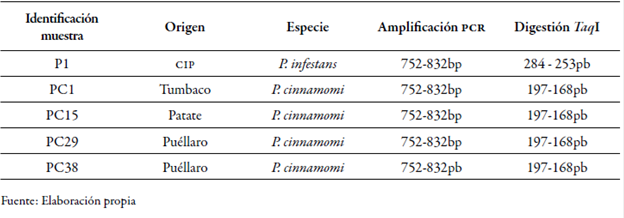
También se obtuvieron 197 pb y 168 pb para las muestras PC1, PC15, PC29 y PC38 de P. cinnamo mi, tal como se indica en la tabla 2. En concordancia con lo descrito por Drenth et al. (2006), los fragmentos obtenidos fueron de 194 y 150 pb, considerando un margen de error aceptable por el método de estimación de peso utilizado. No se observaron patrones de restricción con la enzima Rsal.
Tabla 2 Resultados de la amplificación de la región del ADN del its y su restricción con la enzima Taq I
Las técnicas moleculares que detectan patógenos de suelo a nivel de género y especie ayudan a mejorar el diagnóstico basado en la sintomatología del árbol. Al utilizar una secuencia de amplificación específica para un solo género y no un par de cebadores para una especie en particular (Drenth et al. 2006), rápidamente se puede discriminar este género respecto de otros patógenos presentes en el suelo o raíces.
Los cuatro aislamientos que fueron identificados mediante PCR-RFLP -tal como lo describe Drenth et al. (2006)- fueron encontrados en tres de las cuatro localidades que formaron parte del estudio, lo que indica la presencia del patógeno en las zonas de cultivo muestreadas.
Conclusión
En el 40 % de los aislamientos analizados, la identificación morfológica y molecular confirmó la presencia de P. cinnamomi, mientras que en el porcentaje restante de muestras se identificó la presencia de Pythium sp. Esto nos indica que otros patógenos presentes en el suelo o rizosfera de los árboles presentan una sintomatología similar a la ocasionada por P. cinnamomi. Los resultados confirman la presencia de P. cinnamomi en raíces tomadas de árboles de aguacate con sintomatología asociada a la pudrición radicular, en tres de las cuatro localidades analizadas.
Por otro lado, la tecnología de identificación mole cular utilizada (PCR y restricción de fragmentos ITS del ADN ribosomal) se mostró útil para discriminar P. cinnamomi respecto de otras especies de patógenos presentes en el suelo. Será importante, sin embargo, estandarizar una técnica para detectar el patógeno sin necesidad del aislamiento, pues este último procedimiento muestra sus limitaciones en cuanto a eficiencia, lo cual se corrobora con los resultados obtenidos en éste trabajo: 10 aislamientos de 40 muestras obtenidas. Obviar el paso del aislamiento permitiría un diagnóstico inmediato y posibilitaría una identificación molecular rápida y precisa con los consiguientes beneficios para el control oportuno de esta patología en el cultivo del aguacate en el Ecuador.














