Introducción
La leprosis de los cítricos es una enfermedad de importancia económica y cuarentenaria, que afecta principalmente naranjos y mandarinos. En Brasil es considerada la enfermedad viral más importante en cítricos, porque los costos del control del ácaro transmisor suman alrededor de 90 millones de dólares al año (Rodrigues et al. 2001; Freitas et al. 2004). La diseminación del virus de la leprosis de los cítricos (CiLV) se ha ampliado recientemente hacia países de Centro, Sur América y el sur de México (Rodrigues et al. 2001; Kitajima et al. 2004; Freitas et al. 2005; onpp 2005). Debido a esta dispersión, se han incrementado las restricciones para el mercadeo internacional de cítricos y de algunos productos agropecuarios, y se han desarrollado programas de manejo y erradicación.
Los naranjos dulces Citrus x sinensis (L.) Osbeck y los mandarinos Citrus reticulata Blanco son afecta dos frecuentemente por la leprosis de los cítricos (CiLV) (Salvo 1997; Domíngues y Rodrigues 1999; Locali et al. 2003). Las limas Citrus x latifolia Tanaka ex Q. Jiménez y los limones Citrus limon (L.) Osbeck son considerados inmunes a la leprosis, mientras que el tangor Murcott, un híbrido entre naranjo dulce y mandarino, muy utilizado en Brasil, puede hospedar el virus de la leprosis de los cítricos y ser asintomático (Bastianel et al. 2004). Las toronjas Citrus x paradisi Macfad., y algunos tangores muestran niveles variables de resistencia al virus de la leprosis (Rodrigues et al. 2001; Bastianel et al. 2004; Locali et al. 2004).
En Colombia, el virus de la leprosis de los cítricos citoplasmático (CiLV-C) fue registrado en el departa mento del Casanare en 2004. Para 2005 se registró ampliamente distribuido en varios municipios de los departamentos del Meta y el Casanare (León et al. 2006a; Becerra et al. 2007). Posteriormente, se encuentra un reporte de presencia de leprosis de los cítricos en Ibagué, Tolima (Bastianel et al. 2010), lo cual indica la dispersión de la enfermedad en el país.
Para 2012, en Colombia fue detectado un nuevo tipo de virus denominado "virus de la leprosis de los cítricos citoplasmático - tipo 2" (CiLV-C2), el cual provoca síntomas muy similares a los producidos por el CiLV-C (Roy et al. 2013; León et al. 2014). Tras la identificación del genoma completo de este virus, se desarrolló un nuevo set de cebadores para su diagnóstico molecular por medio de RT-PCR. Los resultados muestran que el CiLV-C2 en Colombia está asociado con plantas sintomáticas de leprosis colectadas en los departamentos del Meta y el Casanare, lo cual sugiere que los dos tipos de virus CiLV-C y CiLV-C2 están presentes en el país.
De acuerdo con Chagas y Rosseti (1983), el principal transmisor del virus de la leprosis de los cítricos es el ácaro rojo plano Brevipalpusphoenicis (Geijskes) (Acari: Tenuipalpidae). Esta es una especie polífaga, distribuida en muchas regiones tropicales y sub tropicales del mundo (Chagas et al. 1983; Salvo 1997; Rodrigues et al. 2001; Maia y Oliveira 2002).
Childers et al. (2003) reportan más de 486 plantas hospederas que incluyen muchas plantas cultivadas y malezas. Entre las plantas cultivadas, además de los cítricos, mencionan marañón (Anacardium occidentale L., Anacardiaceae), papaya (Carica papaya L., Caricaceae), yuca (Manihot esculenta Crantz, Euphorbiaceae), algodón (Gossypium sp., Malvaceae), guayaba (Psidium guajava L., Myrtaceae), maracuyá (Passiflora sp., Passifloraceae), café (Coffea arabica L., Rubiaceae), cacao (Theobroma cacao L., Malvaceae) y vid (Vitis vinifera L., Vitaceae).
Chiavegato (1996) menciona 34 especies diferentes de plantas hospederas de B. phoenicis.Ulian y Oliveira (2002) evaluaron la habilidad de B. phoenicis para vivir en barreras rompe vientos de cultivos de cítricos y concluyeron que Hibiscus sp. (Malvaceae) y Bixa orellana L. (Bixaceae) no deben ser usadas como barreras vivas, porque proveen condiciones favorables para el ácaro vector del CiLV. Maia y Oliveira (2002; 2005) identificaron plantas hospederas que son reservorios del ácaro B. phoenicis en plantaciones de cítricos en Brasil, las cuales incluyen malezas como Bidens pilosa L. y barreras rompe vientos como Mimosa caesalpiniifolia Benth. (Fabaceae) y Malvaviscus arboreus Cav. (Malvaceae).
Kitajima et al. (2003) afirman que el virus CiLV-C es de tipo circulativo y no acumulativo dentro del ácaro B. phoenicis, es decir, una vez el ácaro se ha infectado, el virus circula y se propaga dentro de su cuerpo, de manera que puede transmitirlo durante toda su vida. Boaretto y Chiavegato (1994), al estudiar la transmisión de CiLV en hospederos diferentes a cítricos, encontraron que cuando un ácaro infectado se hospeda hasta seis días sobre hojas de cítricos o de café sanas, no pierde la capacidad de transmitir el virus CiLV-C a nuevas plantas de cítricos. No existe transmisión transovarial del virus desde una hembra adulta infectada hacia sus descendientes (Boaretto et al. 1993).
Recientemente Roy et al. (2015) determinaron que el ácaro B. phoenicis presente en Colombia corres ponde a la especie Brevipalpus yothersi Baker, 1949 (Acari: Tenuipalpidae). Flat Mites of the World (2015) confirmó que la especie B. yothersi fue previamente listada como Brevipalpus phoenicis especie grupo B., y afirma además que B. yothersi se ha encontrado en asociación con el complejo de virus de la leprosis de los cítricos. El Global Biodiversity Information Facility, gbif (2013), corrobora el estatus taxonómico de Brevipalpus yothersi (Baker) como un sinónimo de B. phoenicis (Geijskes).
Roy et al. (2015) adicionalmente encontraron que la especie B. yothersi identificada en muestras colectadas en los departamentos de Casanare y Meta (Colombia) está fuertemente asociada con el complejo CiLV y confirmaron que es vector de va rios virus conocidos de leprosis presentes en el país, como el virus de la leprosis citoplasmático (CiLV-C), el virus de la leprosis citoplasmático tipo 2 (CiLV-C2), el virus de la leprosis nuclear (CiLV-N) y el hibiscus green spot virus 2 (HGSV-2). De acuerdo con León (2012), en Colombia el ácaro vector de la leprosis se encuentra diseminado en varias regiones geográficas del país y puede infestar los cultivos de cítricos durante todo el año. León et al. (2014) confirmaron que el ácaro es vector del CiLV-C2 en los departamentos del Meta y Casanare.
El CiLV puede infectar plantas de cítricos, plantas susceptibles usadas como barreras vivas o malezas en plantaciones de cítricos (Maia y Olivera 2005). Diferentes autores han reportado infección natural, mecánica o experimental por CiLV- C en varias especies de plantas no rutáceas como Chenopodium quinoa Willd., C. amaranticolor H. J. Coste & A. Reyn., Gomphrena globosa L. (Amaranthaceae), Commelina benghalensis L. (Commelinaceae), H. rosa-sinensis L., Malvaviscus arboreus Cav., Grevillea robusta A. Cunn. ex R. Br. (Proteaceae), Phaseolus vulgaris L. (Fabaceae) y Solanum violaefolium Schott (Solanaceae) (Colariccio et al. 1995; Rodrigues et al. 2001; Nunes et al. 2012).
Lovisolo et al. (2000) afirman que la transmisión mecánica del virus desde plantas cítricas es posible, pero solo se ha obtenido un bajo porcentaje de positivos. Nunes et al. (2012) confirmaron la retransmisión del CiLV-C hacia plantas de naranjo dulce (C. x sinensis) var. Pera, después de que el ácaro vector B. phoenicis pasara por hospederos alternos como hibiscos (H. rosa-sinensis), malvaviscus (M. arboreus), roble plateado (G. robusta) y achiote (B. orellana). Adicionalmente, estas plantas produ jeron síntomas de leprosis y resultaron positivas para CiLV-C por análisis RT-PCR y microscopía electrónica. Garita et al. (2014) ampliaron el número de plantas hospederas del CiLV a 59 especies de 24 familias, las cuales desarrollaron lesiones localizadas luego de inoculaciones realizadas con ácaros vectores. Algunas de las familias de plantas reportadas como hospederas del CiLV son Rutaceae, Aizoaceae, Chenopodiaceae, Amaranthaceae, Asteraceae, Brassicaceae, Fabaceae, Malvaceae, Orchidaceae, Solanaceae y Violaceae.
En Colombia, Swinglea glutinosa (Blanco) Merr. (Rutaceae) se reconoció como una planta hospedera natural de CiLV-C y de su ácaro vector B. yothersi (citado como B. phoenicis) (León et al. 2008). Los mismos autores también mencionan varias malezas comunes en huertos de cítricos hospederas del ácaro B. yothersi, como la verbena negra Stachytarpheta cayennensis (Rich.) Vahl, yerba mora Lantana camara L. (Verbenaceae) y escobo Sida sp. (Malvaceae), entre otras (León et al. 2008). Igualmente, en Colombia se detectó infección natural del CiLV-C2 en cultivares de naranjo Valencia (Valencia, Delta Valencia, Rhode Red Valencia y Cara Cara Navel) y también en diferentes plantas no cítricas como Dieffenbachia sp. (Araceae), S. glutinosa y H. rosa-sinensis (Roy et al. 2013; 2015).
Para transmitir el virus, B. phoenicis inyecta saliva tóxica en frutos, hojas, ramas y otros tejidos de las plantas (Oliveira 1996). Solo los ácaros que han tenido acceso a las lesiones pueden transmitir leprosis. Los estados de larva, ninfa y adulto son capaces de adquirir y transmitir el CiLV: el 48,3 % de las larvas del ácaro transmiten la enfermedad, mientras que las ninfas y adultos son menos eficientes en la transmisión (Chagas et al. 1983). De acuerdo con Kitajima et al. (2003), el virus no es sistémico, lo cual significa que no se disemina a través de la planta.
En cuanto a aspectos biológicos, B. phoenicis pasa por los estados de huevo, larva, protoninfa, deutoninfa y adulto. Cada estado de desarrollo tiene fases de quietud y alimentación. Se reproduce de forma asexual por partenogénesis telitoquia; la reproducción sexual es menos común. Cada hembra puede colocar de uno a cuatro huevos por día durante 20 días aproximadamente, con lo cual se pueden presentar varias generaciones por año (Chiavegato 1996). La duración del ciclo de vida de B. yothersi, con un pro -medio de temperatura de 27,6 ± 0,7 °C y humedad relativa de 69 ± 7,9 %, reporta los tiempos siguientes: huevo, 4 a 6 días; larva, 3 a 4 días; protoninfa, 5 a 7 días; deutoninfa, 6 a 8 días; y adulto, 21 a 24 días. De acuerdo con estos datos, el ciclo de huevo a adulto demora de 18 a 25 días y el estado adulto dura en promedio más de 21 días (León et al. 2006).
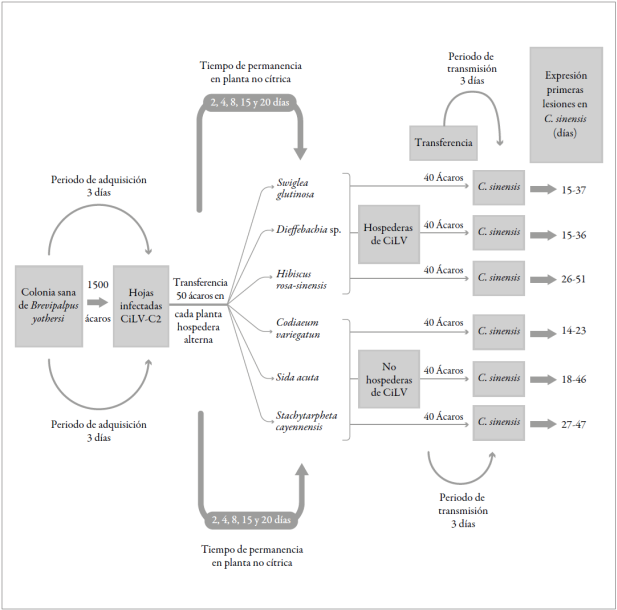
Pocos estudios se han realizado sobre la transmisión del CiLV después de que el ácaro vector B. yothersi se ha alimentado en plantas hospederas alternas de diferentes especies; sin embargo, se conoce una gran abundancia de plantas que pueden hospedar el ácaro vector, así como el reciente número de reportes de plantas hospederas del CiLV-C y CiLV-C2. Por consiguiente, esta investigación se realizó para determinar si existe transmisión cuando el ácaro, luego de ser infectado, se hospeda en una planta no cítrica y regresa nuevamente a una cítrica. El estudio pretende documentar el papel del ácaro vector en relación con la transmisión del virus y su interacción entre plantas alternas no cítricas y plantas cítricas hospederas del virus. Los resultados permitirán generar estrategias para prevenir y evitar la entrada de leprosis a regiones libres del virus, así como para desarrollar medidas de cuarentena preventivas contra la enfermedad. La metodología contribuye al diagnóstico para determinar si los ácaros son virulíferos y cuál es su potencial para transmitir el virus, aunque se encuentren en plantas diferentes a cítricos.
Materiales y métodos
La eficiencia de transmisión del CiLV por el ácaro vector B. yothersi cuando este adquiere el virus de una planta cítrica, pasa a una no cítrica y se relocaliza posteriormente en una planta cítrica sana fue estudiada por medio de pruebas de transmisión dentro de casas de malla. Las pruebas fueron realizadas en la Corporación Colombiana de Investigación Agropecuaria (Corpoica), Centro de Investigación La Libertad (Villavicencio, Colombia), con tempera turas que oscilaron entre 23 y 37 °C (con un promedio de 30,7 °C) y humedades relativas entre 41 y 86 % (con promedio de 54 %). Para este objetivo, se siguieron los pasos que se describen a continuación.
Selección y mantenimiento del material vegetal
Las plantas usadas como hospederos alternos del ácaro vector B. yothersi en este estudio fueron las ornamentales millonaria (Dieffenbachia sp.), hibisco o cayena (Hibiscus rosa-sinensis) y croto (Codiaeum variegatum); la cerca viva (Swinglea glutinosa); y las malezas escobo (Sida acuta) y verbena negra (Stachytarpheta cayennensis). Estas plantas fueron seleccionadas para los estudios de transmisión por ser hospederas del ácaro vector o del virus CiLV. Como planta hospedera cítrica, se utilizó naranjo Valencia (C. x sinensis). Las plantas fueron sembradas individualmente en materas y se mantuvieron libres del virus, bajo condiciones de casa de malla.
Adquisición del virus por ácaros B. yothersi
Para la adquisición del virus por los ácaros B. yothersi, se aislaron en un invernadero dos árboles de naranjo Valencia con lesiones del virus CiLV como fuente de inóculo, los cuales fueron previamente determinados positivos para CiLV-C y CiLV-C2 por medio de RT-PCR según Roy et al. (2013). Se colectaron hojas con abundantes lesiones de la enfermedad de dichos árboles y se llevaron al laboratorio de entomología. Los pecíolos de las hojas se incrustaron dentro de viales de vidrio con agua destilada para mantener la humedad de las hojas durante el tiempo de experimentación. Sobre las lesiones de las hojas seleccionadas y con la ayuda de estereoscopios y pinceles de punta fina se colocaron aproximadamente 1.500 ácaros B. yothersi en alimentación durante un periodo de tres días. Las hojas ya infestadas fueron aisladas mediante la aplicación de una banda de vaselina en su pecíolo, para asegurar el confina miento de los ácaros, su alimentación y la adquisición del virus.
Infestación de ácaros sobre hospederos no cítricos
Transcurrido el tiempo de adquisición de tres días, los ácaros se capturaron con pincel de punta fina y se ubicaron en grupos de 50 por planta en cada una de las seis especies no cítricas (S. glutinosa, Dieffenbachia sp., C. variegatum, H. rosa-sinensis, S. acuta y S. cayennensis). Se utilizaron cinco dife rentes tiempos de exposición (2, 4, 8, 15 y 20 días) y cinco plantas de cada especie hospedera no cítrica. Una vez cumplido el tiempo del tratamiento sobre cada una de las plantas alternas, se procedió a reubicar los ácaros sobre plantas de naranja Valencia (C. x sinensis) sanas.
Retransmisión del virus hacia plantas cítricas
Luego de cumplir el tiempo programado en las especies no cítricas, los ácaros B. yothersi se reubicaron sobre plantas sanas de naranja Valencia (C. x sinensis), para evaluar la transmisión del CiLV. Se utilizó un diseño completamente al azar con cuatro repeticiones de diez ácaros B. yothersi por tiempo de exposición para cada una de las seis especies de plantas receptoras no cítricas. Los ácaros se ubicaron en grupos de diez sobre las cuatro hojas superiores de cada planta de naranja Valencia, de tal forma que cada hoja correspondió a una unidad experimental.
Las plantas receptoras se sometieron a un periodo de tres días de transmisión, después de los cuales, los ácaros de cada tratamiento fueron retirados manualmente con ayuda de un pincel de punta fina y colectados en tubos Eppendorf con etanol 70 % para análisis de RT-PCR. Las plantas receptoras fueron mantenidas en casa de malla durante dos meses para observar la expresión de los síntomas. Las hojas expuestas a los tratamientos se evaluaron de acuerdo con la aparición o ausencia de síntomas de leprosis y adicionalmente fueron analizadas para detección molecular, utilizando cebadores específicos para CiLV-C2 en pruebas RT-PCR, según metodo logía estandarizada por Roy et al. (2014).
Los resultados obtenidos por sintomatología se analizaron mediante prueba X y regresión logística, para establecer el efecto del tiempo de hospedaje del ácaro B. yothersi en las plantas alternas no cítricas y relacionar esto con la probabilidad de aparición de síntomas en las plantas de naranja Valencia receptoras finales.
Resultados y discusión
Expresión de síntomas de leprosis en hojas de naranjo Valencia
En todos los tratamientos evaluados, los resultados muestran aparición de síntomas visuales de la enfermedad sobre las hojas de naranjo expuestas al B. yothersi en porcentajes mayores al 80 %. Esto permite afirmar que el ácaro B. yothersi es capaz de transmitir el CiLV a plantas de naranja Valencia (C. x sinensis), luego de haber permanecido hospedado en cualquiera de las seis plantas alternas no cítricas, para las cuales se permitieron cinco tiempos diferentes de exposición.
Las primeras lesiones de leprosis en hojas de naranjo Valencia se observaron entre los 14 y los 47 días después de relocalizados los ácaros.
Cuando los ácaros vectores virulíferos se alimentaron en S. glutinosa, las primeras lesiones de leprosis fueron observadas en un rango de 15 a 37 días. Cuando los ácaros se hospedaron en C. variegatum, las primeras lesiones de leprosis en hojas de naranjo aparecieron entre 14 y 23 días. Cuando se alimentaron en Dieffenbachia sp., los primeros síntomas de leprosis fueron visibles entre 15 y 36 días. Para S. acuta, entre 18 y 46 días, y para los casos en que los ácaros B. yothersi se alimentaron en S. cayennensis y en H. rosa-sinensis, el tiempo de expresión de las primeras lesiones en naranjo Valencia tomó entre 27 y 47 días y entre 26 y 51 días, respectivamente (figura 1). Locali et al. (2004) observaron síntomas de leprosis entre 17 y 21 días después de la inocu lación, mientras que Freitas et al. (2004) reportan aparición de los primeros síntomas entre 17 y 60 días después de la transmisión.
Porcentaje de lesiones de leprosis en hojas de C. x sinensis
Cuando el ácaro vector B. yothersi se hospedó en H. rosa-sinensis y luego retornó a cítricos, el 80 % de las hojas de naranja Valencia mostró aparición de lesiones de leprosis. Para los tratamientos de C. variegatum, Dieffenbachia sp. y S. cayennensis, se observó aparición de síntomas de la enfermedad en el 95 % de las hojas. Para los tratamientos de S. glutinosa y S. acuta, el 100 % de las hojas tratadas de naranja Valencia mostró síntomas de leprosis (figura 2).
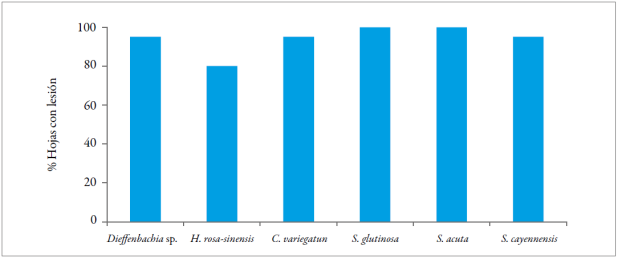
Figura 2 Porcentaje de aparición de lesiones de leprosis en plantas de naranja Valencia (C. x sinensis), en función del tiempo de alimentación del vector B. yothersi sobre plantas no cítricas. Fuente: Elaboración propia
En la tabla 1 se presentan los porcentajes de aparición de síntomas CiLV en hojas de naranjo Valencia en relación con los tiempos de permanencia del ácaro B. yothersi en seis diferentes plantas no cítricas. La aparición de los síntomas de la enfermedad alcanzó el 100 % en la gran mayoría de los tratamientos, por lo cual se deduce que el CiLV puede ser transmitido efectivamente y que los síntomas aparecerán en las plantas de naranja Valencia con una probabilidad del 75 % y el 100 %, luego de que el ácaro vector se haya hospedado de 2 a 20 días en cualquiera de las especies no cítricas evaluadas.
Tabla 1 Porcentaje de hojas de C. x sinensis con lesiones de leprosis en relación con cinco diferentes tiempos de alimentación del ácaro vector B. yothersi en plantas no cítricas
| Tiempo | Porcentaje de hojas de naranjo Valencia con lesiones en seis hospederos no | cítricos (%) | ||||
|---|---|---|---|---|---|---|
| de alimentación de B. yothersi | C. variegatum | Dieffenbachia sp. | H. rosa-sinensis | S. acuta | S. glutinosa | S. cayennensis |
| T1= 2 días | 100 | 100 | 100 | 100 | 100 | 100 |
| T2= 4 días | 100 | 100 | 100 | 100 | 100 | 100 |
| T3= 8 días | 100 | 100 | 100 | 100 | 100 | 100 |
| T4= 15 días | 100 | 100 | 25 | 100 | 100 | 100 |
| T5= 20 días | 75 | 75 | 100 | 100 | 100 | 75 |
| Promedio | 95 | 95 | 85 | 100 | 100 | 95 |
Fuente: Elaboración propia
La tabla 1 muestra altos promedios para todos los tratamientos y define que, cuando los ácaros B. yothersi virulíferos se hospedaron en H. rosa-sinensis y luego fueron transferidos a naranjos (C. x sinensis), en promedio el 85 % de hojas de los naranjos desarrolló síntomas de leprosis. El 95 % de hojas de C. x sinensis en promedio desarrolló lesiones de leprosis cuando los ácaros infectados se hospedaron previamente durante diferentes tiempos en plantas alternas no cítricas como C. variegatum, Dieffenbachia o S. cayennensis. Cuando los ácaros permanecieron en S. glutinosa o S. acuta, el 100 % de las hojas de C. x sinensis desarrolló lesiones de leprosis. Algunas de las lesiones de leprosis observadas en hojas de naranjo C. x sinensis se presentan en la figura 3.

Figura 3 Hojas de C. x sinensis con lesiones sintomáticas de leprosis, 40 días después de la transmisión por ácaros B. yothersi hospedados previamente en plantas no cítricas. a y b. 2 y 15 días de hospedaje previo en Stachytarpheta cayennensis; c y d. 4 y 8 días de hospedaje previo en Sida acuta; e y f. 4 y 8 días de hospedaje previo en Hibiscus rosa sinensis.
Con un nivel de significancia de 0,01 %, se determinó una probabilidad alta de transmisión del CiLV por aparición de los síntomas de leprosis en naranjo Valencia C. x sinensis, luego de que el ácaro se hospedó en cualquiera de las plantas no cítricas evaluadas en este estudio. Con la prueba x2, se pudo establecer que existe dependencia entre la aparición de síntomas de la leprosis en hojas de naranjo con todas las especies no cítricas hospederas temporales del ácaro B. yothersi (x2=101,13; a<0,0001); es decir que no influye el tiempo de permanencia del ácaro en hospederos no cítricos y, en consecuencia, el virus es transmitido con alta probabilidad a las plantas cítricas receptoras finales. Por tanto, se concluye que no hay efecto del tiempo de permanencia del ácaro B. yothersi sobre las especies no cítricas y que el virus puede ser igual mente trasmitido por el vector luego de hospedarse en cualquiera de las plantas no cítricas evaluadas.
En la mayoría de los casos, el desarrollo de lesiones de leprosis en hojas de naranjo fue del 100 %, inde pendientemente del tiempo que el ácaro permaneció alimentándose en las diferentes plantas no cítricas utilizadas como hospederas alternas, excepto para los tratamientos de 20 días de alimentación en C. variegatum, S. cayennensis o Dieffenbachia sp., y para el tratamiento de 15 días sobre H. rosa-sinensis. Los altos promedios de ocurrencia de síntomas de la enfermedad demuestran que el CiLV puede ser transmitido efectivamente con alta probabilidad, una vez que el vector se ha hospedado de 2 a 20 días en cualquiera de las plantas no cítricas evaluadas como hospederos alternos del ácaro (tabla 1). Estos resultados confirman que las plantas hospederas no cítricas no tienen ningún efecto sobre la transmi sión del virus por el ácaro y que el virus de la leprosis de los cítricos se transmite en forma persistente por el ácaro B. yothersi.
Detección del CiLV-C2 luego de hospedar el B. yothersi en plantas no cítricas
Una vez que los ácaros completaron el tiempo de permanencia en las plantas alternas no cítricas, se realizaron pruebas RT-PCR para la detección del CiLV-C2 en hojas de naranjo (C. x sinensis) con lesiones sintomáticas de leprosis, así como en los ácaros B. yothersi utilizados en los tratamientos.
Las figuras 4 y 5 muestran respectivamente el gel de agarosa al 1 % con los productos de pcr de hojas de naranjo (C. x sinensis) sintomáticas y de ácaros B. yothersi virulíferos luego de haber sido alimentados en seis diferentes plantas hospederas no cítricas. La detección del CiLV-C2 en hojas de naranjo (C. x sinensis) con síntomas de leprosis fue positiva para los tratamientos en que el ácaro se hospedó, con un rango de 2 y 20 días de alimen tación, en las plantas no cítricas S. cayennensis, S. glutinosa, H. rosa-sinensis y S. acuta. Sin embargo, no fue posible la detección cuando los ácaros se alimentaron en C. variegatum o Dieffenbachia sp. (figura 4), a pesar de que se observaron lesiones sintomáticas en las hojas de naranjo (C. x sinensis) de dichos tratamientos.

Figura 4 Detección de CiLV-C2 en hojas de naranjo (C. x sinensis), luego de ser hospedado el ácaro B. yothersi en plantas no cítricas. 1: marcador molecular HyperLadder IV (Bioline). 2-4: S. cayennensis (2, 8 y 20 dda). 5-7: H. rosa-sinensis (2, 8 y 20 dda). 8-9: Dieffenbachia sp. (2 y 20 dda). 10-11: C. variegatum (2 y 20 dda). 12-15: S. glutinosa (2, 8, 15 y 20 dda). 16-20: S. acuta (2 y 20 dda). 21: control positivo. 22: control negativo (dda = días de alimentación en hospederos no cítricos). Fuente: Elaboración propia
En la figura 5 se presenta la detección molecular del CiLV-C2 en ácaros B. yothersi por la técnica molecular RT-PCR cuando estos fueron hospedados de 2 a 20 días en plantas no cítricas. Los resultados muestran detección positiva del CiLV-C2 para los mismos tratamientos (S. glutinosa, H. rosa-sinensis, S. acuta y S. cayennensis) en los cuales el virus fue detectado en hojas de naranjo (C. x sinensis).
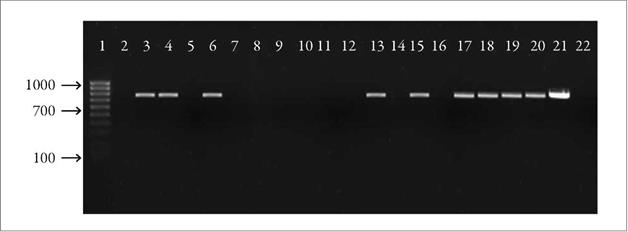
Figura 5 Detección del CiLV-C2 en ácaros B. yothersi luego de ser hospedados en plantas no cítricas. 1: marcador molecular HyperLadder IV (Bioline). 2-4: S. cayennensis (2, 8 y 20 dda). 5-7: H. rosa-sinensis (2, 8 y 20 dda). 8-9: Dieffenbachia sp. (2 y 20 dda). 10-11: C. variegatum (2 y 20 dda). 12-15: S. glutinosa (2, 8, 15 y 20 dda). 16-20: S. acuta (2 y 20 dda). 21: control positivo. 22: control negativo (DDA=días de alimentación en hospederos no cítricos).Fuente: Elaboración propia
Aun cuando los resultados del diagnóstico por RT-PCR para CiLV-C2 deberían haber sido positivos en todos los tratamientos de acuerdo con la expresión de los síntomas en las hojas de C. x sinensis, las pruebas no detectaron este tipo de virus en todos los casos. Esto puede deberse a la falta de uniformidad en tamaño y número de las lesiones observadas y colectadas en cada tratamiento, lo cual implica la obtención de diferentes concentraciones del virus por cada extracción para su procesamiento y detección. El hecho de que algunos tratamientos mostraron síntomas visuales de lesiones de leprosis sin que las pruebas RT-PCR detectaran el virus, podría también deberse a que las lesiones de leprosis desarrolladas en las hojas de naranjo (C. x sinensis) pudieron haberse ocasionado por infección mixta o por más de un tipo de virus de leprosis diferente a CiLV-C2.
Puesto que en este estudio se utilizaron iniciadores para la detección de CiLV-C2 en las pruebas RT-PCR, no fue posible detectar molecularmente otros virus como CiLV-N o CiLV-C, que producen lesiones similares a la leprosis y que recientemente fueron reportados en el país. En Colombia, el CiLV-C fue reportado desde 2004 (León et al. 2006b; León 2012), pero adicionalmente otros tipos de virus que producen lesiones sintomáticas de leprosis como el nuclear (CiLV-N) y el hibiscus green spot virus (HGSV) fueron detectados poste riormente al desarrollo de esta investigación (Roy et al. 2014). Más recientemente, y luego de finalizar esta investigación, también se comprobó infección mixta por más de un virus de leprosis (CiLV-C2 y CiLV-N) tanto en plantas de C. x sinensis y S. glutinosa como en ácaros vectores B. yothersi en la región de la Orinoquía colombiana (Roy et al. 2015).
Conclusiones
Dado que los resultados muestran un promedio mayor al 85 % de hojas con presencia de lesiones de leprosis en hojas de naranjo (C. x sinensis) en todos los tratamientos, se concluye que los ácaros B. yothersi infectados con el virus son capaces de transmitir efectivamente el CiLV a plantas de naranjo Valencia (C. x sinensis) en un alto porcentaje, sin importar que hayan sido hospedados en cualquiera de las plantas alternas no cítricas evaluadas.
Puesto que se encontró alta probabilidad de trans misión del CiLV hacia plantas cítricas (promedios entre 85 y 100 %) cuando el ácaro B. yothersi fue hospedado durante periodos de 2 a 20 días en plantas alternas no cítricas, este estudio confirma que el virus de la leprosis se transmite por el ácaro B. yothersi en forma persistente.
Teniendo en cuenta que las pruebas RT-PCR no fueron positivas para CiLV-C2 en todos los tratamientos, podemos sugerir que otros tipos de virus causantes de lesiones de leprosis reportados recientemente en Colombia (como el CiLV-C, el CiLV-N o el CiLV) pudieron estar presentes en las muestras procesadas en este estudio y lograron producir los síntomas de leprosis que no fueron detectables con los iniciadores específicos para CiLV-C2.