Introducción
Los indicadores de la cadena de hortalizas presentan un mercado mundial creciente. De acuerdo con informes de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) (2014), se registra una producción de 276 millones de toneladas al año, que es favorecida por la preferencia del consumidor por productos saludables, con características nutracéuticas (Corporación Colombia Internacional [CCI], 2015; Quipo, Rojas, Ramírez, & Ordóñez, 2013).
De igual forma, en Colombia esta cadena constituye un importante renglón económico, con una producción bruta de 1.495.835 t en 2015 (Departamento Administrativo Nacional de Estadística [dane], 2016). Dentro de este subsector agrícola, en el Caribe, productos como el fríjol (Phaseolus vulgaris L. [Fabaceae]), el ají (Capsicum spp. [Solanaceae]) y la berenjena (Solanum melongena L. [Solanaceae]) hacen una especial contribución a la seguridad alimentaria.
Esto se demuestra en el hecho de que en 2013 la producción de ají ascendió a 7.735 t, la de berenjena a 2.496 t y la de fríjol a 5.560 t, y en que el Plan Nacional Hortícola promueve el incremento de la productividad para favorecer la exportación (CCI, 2015). Sin embargo, la proyección a mercados tan selectivos como Estados Unidos y la Unión Europea requiere la aplicación de buenas prácticas agrícolas (BPA) (Gaviria, Patiño, & Saldarriaga, 2013).
No obstante, en el Caribe los sistemas productivos con alternativas sostenibles son escasos, y los impactos que causa la agricultura convencional son cada vez más fuertes (Tofiño, Velásquez, & Zapata, 2016). El manejo integrado de cultivos está limitado, entre otras razones, por la escasez de estudios de compatibilidad entre los bioinsumos y los agroquímicos que se usan comúnmente en hortalizas (Melo, Ariza, Lissbrant, & Tofiño, 2015), así como por el desconocimiento de los productores de aspectos relevantes del uso de bioinsumos como estrategia de manejo.
A lo anterior se suma el efecto del cambio climático, que disminuye los intervalos de ocurrencia normal del patrón denominado El Niño-Oscilación del Sur (ENOS), que afecta la dinámica, ocasiona el resurgimiento de plagas y enfermedades, y eleva los costos de producción (Lau, Jarvis, & Ramírez, 2013).
Los estreses bióticos y su control convencional afectan de manera negativa la productividad e inocuidad de los productos agrícolas, en especial del pequeño y mediano productor, debido al uso de productos poco selectivos y altamente residuales que causan grandes pérdidas agrícolas, sobre todo al pequeño y mediano productor, y afectan la salud pública y la seguridad alimentaria (Criollo, Lagos, Piarpuezan, & Pérez, 2011).
Entre las prácticas sostenibles para mejorar el estado sanitario de los cultivos se encuentran los cultivos asociados y el uso de bioinsumos y aceites esenciales para el control de patógenos (Villa et al., 2015). Se ha encontrado que aceites esenciales de limoncillo (Cymbopogon citratus) cumplen una acción antifúngica contra Colletotrichum acutatum, con una efectividad de más del 60 % (Alzate, Mier, Afanador, Durango, & García, 2009). De igual forma, el uso de bioinsumos como Trichoderma spp. constituye una alternativa viable para el control de patógenos (Landero et al., 2015).
Sin embargo, aunque en el Caribe seco colombiano son pocos los estudios sobre la inclusión de bioinsumos en hortalizas, se registró que agroquímicos no fungicidas, como herbicidas e insecticidas, influyen en el cambio de la población microbiana del suelo y la prevalencia de patógenos (Gaviria et al., 2013; Tofiño, Cabal, & Gil, 2012).
Además, investigaciones preliminares acerca del efecto in vitro de C. citratus, agroquímicos y Trichoderma spp. en el control de Colletotrichum gloeosporioides indican que dichos biocidas son efectivos cuando son usados individualmente (Tofiño, Chinchilla, & Ortega, 2016).
Teniendo en cuenta lo anterior, se realizaron ensayos integrados, con el fin de evaluar el impacto de la aplicación, tanto individual como combinada, de fungicidas del paquete tecnológico convencional regional con aceites esenciales en cultivos de ají, fríjol y berenjena en Codazzi, Cesar, Colombia.
Estas acciones tuvieron el objetivo de avanzar en el conocimiento del efecto de productos químicos utilizados en conjunto en la sanidad y el rendimiento hortícola, validar el uso de los aceites esenciales en el control de patógenos de interés, y verificar el posible efecto de los controles utilizados en variables del suelo sensibles al manejo agronómico. Esta información puede contribuir a la formulación de estrategias de BPA para la ecorregión de estudio.
Materiales y métodos
Aceites esenciales
La cosecha de plantas para la extracción de aceites esenciales se realizó manualmente, a partir de material foliar sano que no había sido sometido a planes de fertilización o uso de agroquímicos, clasificado en el herbario José Cuatrecasas de la Universidad Nacional, sede Palmira: C. citratus (dc.) Stapf. (Poaceae) (código 4952 20/10/2014) y Lippia alba (Mill.) N. E. Br. ex Britton & P. Wilson (Verbenaceae) (código 4863 18/10/2014).
El aceite esencial de C. citratus se extrajo en el resguardo indígena Kankuamo en Atánquez, Valledupar, con una humedad relativa entre el 56 % y el 74 %, en cultivos en suelo franco y ligeramente ácido, una fertilidad alta y un 2 % de materia orgánica, y un rendimiento en la extracción del 0,71 %.
El aceite esencial de L. alba se extrajo en el laboratorio de productos naturales de la Universidad de Córdoba, de plantas cosechadas en el Centro de Investigación Motilonia, de la Corporación Colombiana de Investigación Agropecuaria (Corpoica), cuya humedad relativa es del 70,1 %, tiene un suelo franco-arcilloso y ligeramente ácido, una fertilidad moderada y un 1 % de materia orgánica, con un rendimiento del 0,5 %.
La extracción de ambos aceites esenciales se realizó a partir de 1 kg de material vegetal fresco, mediante destilación por arrastre con vapor, sin solvente, durante tres horas; se conservaron en viales color ámbar, con tapas de rosca de sellado hermético, y se almacenaron en refrigerador a 4 °C.
Ambos aceites se analizaron en el laboratorio de productos naturales de la Universidad de Córdoba, a través de una evaluación fitoquímica, mediante cromatografía de gases (GC), con una posterior caracterización de espectrometría de masas (MS) con un detector selectivo, y una identificación presuntiva en columnas Apolar DB-5MS (60 m) y Polar DB-WAX (60 m), utilizando la biblioteca NIST con el programa MassLab.
Aislamiento de patógenos y producción de inóculo
En la unidad de microbiología del ci Motilonia, los hongos fitopatógenos Macrophomina phaseolina (Tassi) Goid., Phytophthora capsici Leonian y Colletotrichum gloeosporioides (Penz.) Sacc. se aislaron de raíces, hojas y frutos sintomáticos de fríjol, berenjena y ají, respectivamente, en agar de papa y dextrosa (pda, por sus siglas en inglés), a 25 °C.
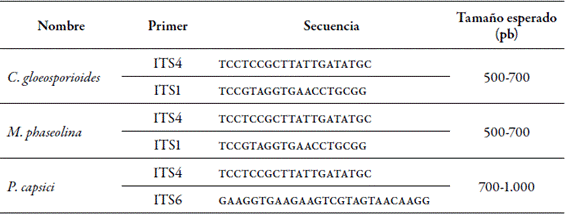
Después, fueron suspendidos a una concentración de 1,0 × 106 ufc/ml en agua destilada estéril, identificados por claves taxonómicas según Gañán, Álvarez y Castaño (2015) , y verificados mediante análisis moleculares realizados en los laboratorios de la Corporación para Investigaciones Biológicas (CIB) en Medellín, con extracción del ADN con el método de bromuro de hexadeciltrimetilamonio (CTAB). Luego se realizó la amplificación de la región espaciadora interna transcrita (ITS), con una técnica de reacción en cadena de la polimerasa (PCR) con primers universales y secuenciación.
Para el caso de Colletotrichum y Macrophomina, se utilizaron TS1 e ITS4, y para Phytophthora ITS4 e ITS6 (tabla 1). Las reacciones se incubaron a 95 °C durante cinco minutos; luego se realizaron 30 ciclos a 94 °C durante un minuto (desnaturalización), a 55 °C durante un minuto (alineamiento), y a 72 °C durante un minuto y medio (extensión); un ciclo de 72 °C durante cinco minutos (extensión final), y un último ciclo por tiempo indefinido a 8 °C.
Los productos de la PCR fueron enviados a Macrogen (Corea) para su secuenciación. Las secuencias forward y reverse fueron depuradas, editadas y alineadas mediante el software Geneious, versión 9.1.5. Las secuencias consenso se compararon con aquellas disponibles en la base de datos del Genebank con nucleótido blast, para determinar la identidad de los aislamientos.
Eficiencia y compatibilidad in vitro
Para evaluar el efecto biocida en los fitopatógenos M. phaseolina, P. capsici y C. gloeosporioides, se midió su crecimiento en PDA a concentraciones de entre 50 y 1.200 µg/ml en cada aceite esencial puro, según el microorganismo, respecto al PDA sin aceite, como control negativo (Barrera & Bautista, 2008).
Se sembraron rodajas de 1 cm de colonias del hongo de ocho días de cultivo. El crecimiento radial se midió por su diámetro a los siete días de incubación a 28 °C, por triplicado. Se expresó como porcentaje de inhibición del crecimiento micelial (ICM) con la fórmula de Broekaert et al. (1990, citado por Díaz et al., 2011): ICM (%) = [(dc - dt)/dc] × 100, donde dc es el diámetro de crecimiento del micelio en PDA sin aceite esencial, y dt es el mismo diámetro, con aceite. La concentración más baja se tomó como la mínima inhibitoria (CMI) del aceite, que produjo un 80 % de inhibición.
Se realizó el análisis de compatibilidad, según Melo et al. (2015) , modificado por diferencias en el agroquímico utilizado. El aislado de cada fitopatógeno creció en un medio de PDA con insecticida clorpirifós, herbicida glifosato, y los fungicidas carbendazim y tiabendazol, con dosis recomendadas de 5 ml/L, 13,9 ml/L, 0,8 ml/L y 0,9ml/L, respectivamente.
También se mezclaron los cuatro agroquímicos con el biocontrolador Trichoderma spp. (Trichol®), y se determinó el porcentaje de inhibición del crecimiento micelial de cada patógeno y de este biocontrolador, de manera similar a como se hizo con los tratamientos con aceites esenciales. De igual forma, se utilizó la cmi del aceite esencial con mayor inhibición del crecimiento micelial, y luego se evaluó su compatibilidad con los agroquímicos.
Siembra de cultivos y aplicación de tratamientos en campo
En el Centro de Investigación Motilonia, en Codazzi, Cesar, ubicado en las coordenadas 10°00'03,0'' N, 73°14'53,3'' O, y a 105 m s. n. m., se sembraron semillas del fríjol biofortificado Corpoica 39 (Phaseolus vulgaris), ají (Capsicum spp.) y berenjena (Solanum melongena), variedades C029, con intervalos entre las plantas de 0,25, 0,50 y 0,80 m, respectivamente, y un metro entre surcos, en parcelas de 5 × 5 m.
El lote experimental se fertilizó de acuerdo con el balance entre los resultados del análisis de suelo y los requerimientos específicos de cada cultivo: en fríjol, 92 kg/ha de Agrimins, 100 kg/ha de fosfato diamónico, 750 cc/ha de Nutrifoliar, y 50 kg/ha de cloruro de potasio (KCl); en el cultivo de ají, se adicionaron dosis de urea (200 kg/ha), ácido fosfórico (150 kg/ha), KCl (400 kg/ha), nitrato de calcio (60 kg/ha), sulfato de magnesio (MgSO4) (60 kg/ha) y Micronutrex (40 kg/ha), y en el de berenjena se utilizaron 135 kg/ha de urea, 310 kg/ ha de fosfato diamónico y 565 kg/ha de KCl.
Las parcelas se distribuyeron en bloques completos al azar con cuatro réplicas, en arreglo factorial. Cada bloque estuvo constituido por el tratamiento de control de fitopatógenos, además del testigo sin control. Los tratamientos fueron los siguientes: T0: sin control de fitopatógenos; T1: aceite esencial de L. alba; T2: aceite esencial de L. alba + tiabendazol; T3: aceite esencial de C. citratus; T4: aceite esencial de C. citratus + tiabendazol, y T5: tiabendazol. La concentración de los aceites esenciales en todos los tratamientos fue de 1.200 µg/ml, y para el tiabendazol, la dosis recomendada: 0,9 ml/L.
La aplicación de todos los aceites esenciales se realizó por aspersión directa sobre el follaje y el suelo próximo a la raíz, y el tiabendazol se utilizó según la ficha técnica, a 45 días de la germinación y en la floración de cada cultivo. Luego de tres días de acción sobre el suelo, se muestreó para hacer análisis de variables de respuesta. Adicionalmente, se verificó la correspondencia entre la cepa evaluada in vitro y la que se controló en campo, mediante caracterizaciones macroscópica y microscópica, comparadas con claves taxonómicas y estudios moleculares.
Medición de criterios fisicoquímicos, biológicos y de rendimiento
Para las muestras de suelo en la presiembra, se recolectaron 500 g de cinco puntos de muestreo en los lotes, para obtener una muestra compuesta de cada unidad experimental, con una profundidad de 15 cm para el análisis microbiológico y de 30 cm para el fisicoquímico. Dada la variabilidad microespecífica del suelo, dichos puntos se marcaron para muestrear durante el cultivo, con el mismo método.
De cada muestra se realizó el recuento de bacterias, hongos y actinomicetos, en unidades formadoras de colonia por gramo de suelo, con la técnica de diluciones seriadas y vaciado en placa de Petri, de acuerdo con la metodología de Tofiño et al. (2012) y Gañán et al. (2015) . Así mismo, se evaluaron los indicadores de calidad de suelo: pH, materia orgánica, capacidad de intercambio catiónico (CIC) y conductividad eléctrica (CE).
Mediante una balanza electrónica de precisión, se determinó la producción de frutos en cada parcela, expresada en t/ha y, a partir de tablas de escalas de daño, en 20 plantas por parcela se midió la incidencia de enfermedades y de plagas como el lorito verde (Empoasca kraemeri Ross & Moore [Hemiptera: Cicadellidae]), la mosca blanca (Bemisia tabaci [Gennadius] [Hemiptera: Aleyrodidae]), y el ácaro Tetranychus urticae C. L. Koch (Acari: Tetranychidae), en fríjol, ají y berenjena.
Análisis estadístico
Se cuantificaron el promedio y la desviación estándar de las variables de crecimiento e inhibición de fitopatógenos, y luego se utilizó un modelo bivariado de regresión lineal para el aceite esencial y los fitopatógenos en estudio, considerando la dosis inhibitoria. Más adelante, se realizó un análisis de varianza, seguido de la prueba de Tukey, con un alfa igual a 0,05 entre tratamientos, en variables fisicoquímicas y microbiológicas de suelo, y el rendimiento de cultivo.
Las variables de reacción a plagas y enfermedades, expresadas en el porcentaje de plantas con mayor grado de severidad, y evaluadas visualmente, se analizaron a través de una evaluación no paramétrica de distribución de frecuencias por grados de reacción, seguida por una prueba de chi cuadrado (Lagarde, Medina, Ramis, & Maselli, 2010).
A estas variables se aplicó el análisis de componentes principales (ACP), para identificar el efecto de cada tratamiento en dichas propiedades, así como las más sensibles frente a la aplicación de fungicidas biológicos o químicos. Se utilizó el software SPSS, versión 20.
Resultados y discusión
Composición de aceites esenciales
En la muestra de aceites esenciales de L. alba se identificaron los compuestos mayoritarios neral (16,2 %), geraniol (8,2 %), geranial (20,7 %), y β-cariofileno (9,0 %), es decir, de quimiotipo citral (36,9 %) (geranial + neral). De igual forma, en la muestra de aceite esencial de C. citratus, los compuestos mirceno (12,0 %), neral (23,1 %) y geranial (34,9 %) fueron también del quimiotipo citral (58,0 %).
Celis, Escobar, Isaza, Martínez y Stashenko (2007) reportan niveles superiores de dicho quimiotipo en aceites esenciales de L. alba extraídos mediante hidrodestilación asistida por la radiación de microondas, cuya mezcla de aldehídos alfa, beta- insaturados representa el 42 %.
Del mismo modo, la concentración del aceite esencial de C. citratus se encuentra ligeramente por debajo del nivel referido en estudios realizados por Alzate et al. (2009) , con un 65 % del quimiotipo citral, extraído por arrastre con vapor de agua, de material vegetal cultivado en Guarne, departamento de Antioquia, Colombia.
Esta heterogeneidad es esperable, dado que la composición del aceite y su calidad están condi- cionados por factores ambientales, el manejo agronómico y los métodos de extracción (Astani, Reichling, & Schnitzler, 2010; Hennebelle, Sahpaz, Dermont, Joseph, & Bailleul, 2006). Se ha reportado el efecto biocida del quimiotipo citral en hongos de importancia agrícola, como C. acutatum (Alzate et al., 2009), Aspergillus flavus (Shukla, Kumar, Singh, & Dubey, 2009) y C. gloeosporioides (Anaruma et al., 2010).
Efecto in vitro de aceites esenciales de L. alba y C. citratus en fitopatógenos, y compatibilidad con fungicidas
Luego de siete días con 400 µg/ml de los aceites esenciales, no hubo inhibición de M. phaseolina, mientras que con 800 µg/ml de C. citratus se dio una inhibición del 92,9 %, que supera el 80,0 % requerido para la CMI(r = 0,988).Por consiguiente, se adoptó para llevar a cabo pruebas de compatibilidad con agroinsumos y un producto comercial de Trichoderma spp.
En cuanto a C. gloeosporioides, el ensayo con 1.000 µg/ml del aceite esencial inhibió el 100 % (r = 0, 994), equivalente a la CMI (tabla 2). Para P. capsici, la CMI se obtuvo con 109 µg/ml de C. citratus (r = 0,949), frente a 150 µg/ml de L. alba. En consecuencia, en la siguiente etapa del estudio se utilizó aceite esencial de C. citratus, ya que en las estrategias sostenibles se busca la economía del agricultor, y una menor dosis disminuye los costos del tratamiento (Alzate et al., 2009; Villa et al., 2015).
Tabla 2 Concentración mínima inhibitoria de aceites esenciales de C. citratus y L. alba
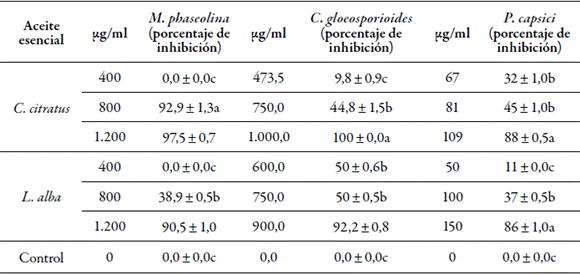
Valores en una columna seguidos de la misma letra no difieren significativamente, de acuerdo con la prueba de Tukey (p = 0,05).
Fuente: Elaboración propia
No obstante, L. alba es una especie promisoria, debido a su capacidad para establecerse en zonas cálidas como el Caribe seco, con un rápido desarrollo y una mayor cantidad de biomasa y de volumen de aceites esenciales en relación con C. citratus (Rivera, Cardozo, & García, 2004).
Por lo tanto, se recomienda su evaluación con otros patógenos de interés regional, como Fusarium y Pythium. El efecto biocida de C. citratus en los tres hongos corrobora diversos estudios en los que se resalta el alto poder fungicida del componente citral, que inhibe la germinación y el desarrollo micelial (Alzate et al., 2009).
Los agroquímicos y sus mezclas tienen un efecto inhibitorio significativo (p = 0,00) en el crecimiento de los fitopatógenos evaluados (tabla 3), a excepción del glifosato en M. phaseolina y C. gloeosporioides. Por su parte, carbendazim y tiabendazol presentaron un alto porcentaje de inhibición: de un 85,7 % a un 88,1 %.
Tabla 3 Prueba de compatibilidad entre agroquímicos Trichoderma spp. y aceites esenciales para el control de M. phaseolina, C. gloeosporioides y P. capsici
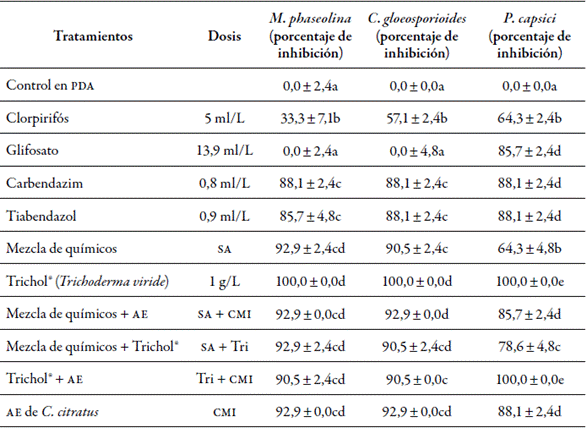
SA: suma de concentraciones de agroquímicos; F: fungicida; AE: aceite esencial; CMI: concentración mínima inhibitoria; Tri: concentración de Trichol®. Las letras en la columna de inhibición hacen referencia a las diferentes significancias, de acuerdo con la prueba de Tukey (p ≤ 0,05).
Fuente: Elaboración propia
También se observa que la mezcla de agroquímicos potencializa los fungicidas, con un 92,9 % de inhibición, al igual que la de agroquímicos con el aceite esencial. En el caso de P. capsici, dicha combinación inhibió el 85,7 %, en comparación con la mezcla sin aceite, que resultó en un 64,3 %. Lo anterior sustenta el uso alternativo de los aceites esenciales para el control de los fitopatógenos M. phaseolina, P. capsici y C. gloeosporioides, y refleja su capacidad de integrarse con químicos fitosanitarios usados en sistemas hortícolas en el Caribe seco colombiano.
Por otra parte, aunque el tratamiento con Trichol® inhibió el patógeno, al igual que sus combinaciones con agroquímicos y aceites esenciales, es importante resaltar que los aceites esenciales inhibieron en un 100 % el crecimiento, tanto del patógeno como el de Trichoderma spp.
Esto evidencia una incompatibilidad en el uso simultáneo del biocontrolador y los aceites esenciales, por lo cual no se continuó su ensayo en campo, dado que se requiere el desarrollo previo de un esquema de rotación de Trichol® y aceites esenciales, de acuerdo con la duración del efecto de los compuestos volátiles relacionados con su capacidad biocida.
En contraste, hubo compatibilidad entre Trichol®, clorpirifós y tiabendazol, pero incompatibilidad con carbendazim, que tampoco se utilizó para pruebas en campo. Se han registrado resultados similares en fríjol cultivado en el Caribe seco (Melo et al., 2015), en el que el aceite esencial de C. citratus inhibió el patógeno M. phaseolina, así como otros aceites en concentraciones diferentes (Khaledi, Taheri, & Tarighi, 2015; Sánchez et al., 2008).
Respuesta del suelo y rendimiento de cultivos frente al control de los fitopatógenos en estudio
En términos generales, la respuesta de rendimiento agronómico de ají, fríjol y berenjena a diferentes tratamientos de control de los fitopatógenos M. phaseolina, P. capsici y C. gloeosporioides, identificados mediante análisis molecular, fue significativamente favorable en relación con el testigo absoluto sin control (p < 0,05).
A su vez, en los tratamientos en los que se aplicaron aceites de L. alba y C. citratus, la actividad microbiológica del suelo presentó diferencias significativas entre los tratamientos y frente al testigo, así como un mayor valor en el contenido de materia orgánica y de conductividad eléctrica (tabla 4).
Tabla 4 Respuesta de los suelos y los cultivos de hortalizas a los diferentes tratamientos para el control de M. phaseolina, P. capsici y C. gloeosporioides
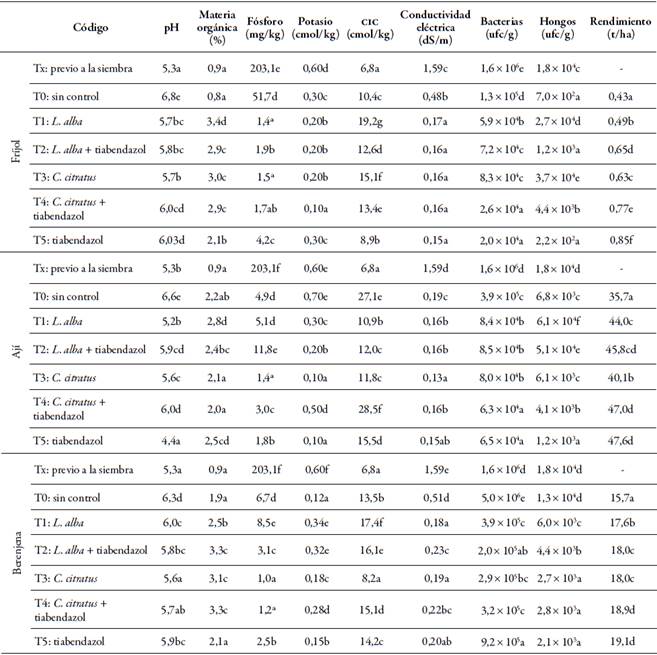
En los análisis de presiembra se observaron mejores condiciones microbiológicas, pero una menor calidad en las propiedades fisicoquímicas respecto a los datos obtenidos en los cultivos en los que se establecieron tratamientos con aceites esenciales. Es decir que, en general, se observa un leve efecto inhibitorio de la población de bacterias y hongos en los suelos de hortalizas que cuentan con un control de fitopatógenos, tanto con aceites esenciales como con tratamiento químico, siendo mayor la inhibición en este último (p < 0,05).
En todo caso, no se afectó la productividad de los cultivos, sino que se vio favorecida por el control de enfermedades (tabla 5). Lo anterior es relevante, dado que en la zona de estudio las prácticas fitosanitarias son deficientes y, en algunos casos, en cultivos pertenecientes a pequeños productores, no se realiza el control de fitopatógenos (Tofiño, Pastrana, Melo, Beebe, & Tofiño, 2016).
Tabla 5 Evaluación de la frecuencia de plantas por tratamiento, en cada escala de enfermedades y plagas
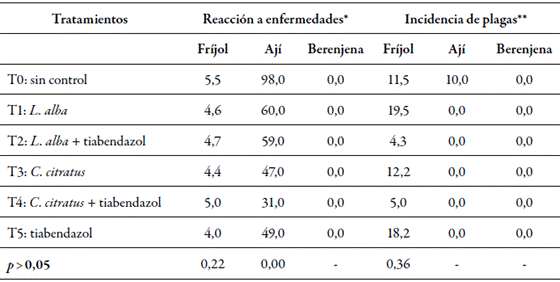
* Porcentaje de prevalencia de enfermedades en nivel 5; ** Porcentaje de plantas con susceptibilidad al ataque de plagas; p: valor de la prueba de Chi cuadrado.
Fuente: Elaboración propia
El pH del suelo en tratamiento en el que se cultivaron las hortalizas varió de fuerte a moderadamente ácido (4,4 y 6,0) -según la escala para suelos agrícolas descrita por Ibarra, Ruiz, González, Flores y Díaz (2009) -, similar a la condición en la presiembra, mientras que en el testigo sin aplicación se observa un nivel que va de moderado a neutro (6,3 a 6,8).
La tendencia acidificante podría asociarse, entre otros factores, a la naturaleza ácida del químico (pH 5,0) y de los aceites (pH 3,0) aplicados (Rodríguez, Castro, Sánchez, Gómez, & Correa, 2015), por lo que la adición de estos productos podría haber afectado el pH en el suelo, respecto al testigo. Esto, además, genera reacciones de los macroelementos, por la disminución del fósforo disponible y del potasio en todos los tratamientos (Balta et al., 2015) (tabla 4).
En cuanto a la materia orgánica en el suelo cultivado con fríjol y berenjena, todos los tratamientos tienen diferencias significativas en relación con el testigo sin control y las condiciones del suelo en la presiembra. El mayor valor se observó en tratamientos de aplicación individual de aceites esenciales T1 y T3.
En los cultivos de ají, los niveles de materia orgánica fueron similares en los tratamientos con C. citratus y el testigo, con valores adecuados para el desarrollo del cultivo en todos los tratamientos, aunque fueron superiores en las condiciones de presiembra. Dicho indicador ha sido reportado por Camacho, Luengas y Leiva (2010), por su sensibilidad a la intervención agrícola.
La respuesta de la CIC fue altamente sensible al manejo, con diferencias significativas entre trata- mientos, incluyendo el testigo. Es probable que esto se deba a la naturaleza de las moléculas de los aceites esenciales y del fungicida químico, que causaron una CIC diferente, influenciada por la solubilidad, la temperatura y el pH en el suelo.
A pesar de la sensibilidad al manejo, la cic fue favorable en los cultivos de hortalizas en estudio, y contribuyó a la asimilación de los nutrientes aportados en la fertilización, lo que se refleja en un rendimiento acorde con lo que se ha reportado en la región (Camacho et al., 2010; Sacchi, Campitelli, Soria, & Ceppi, 2015).
Por su parte, la conductividad eléctrica no presentó diferencias estadísticas entre tratamientos, pero sí entre estos y el testigo, que fue superior en todos los suelos de los cultivos que fueron evaluados y clasificados como no salinos. Es decir que son iguales cualitativamente, por encontrarse dentro del mismo rango de salinidad, por lo que el desarrollo de las plantas no se ve afectado en ninguno de los tratamientos en lo que respecta a esta variable (Mogollón, Martínez, & Torres, 2015).
Se han registrado toxicidad y residualidad en los suelos que integran el sistema productivo hortícola del Caribe seco, a causa de agroquímicos como clorpirifós, glifosato, tiabendazol y carbendazim. En el caso de clorpirifós y glifosato, se reportan efectos negativos en la microbiota de bacterias y hongos cultivables del suelo, lo que constituye un hecho relevante, debido al efecto de la dinámica microbiana en la nutrición vegetal y la resistencia al ataque de patógenos (Sebiomo, Ogundero, & Bankole, 2011).
Algunos autores, como Yunlong, Xiaoqiang, Guohui, Yueqin y Hua (2009), Srinivasulu, Mohiddin, Madakka y Rangaswamy (2012) y Tortella et al. (2013) , reportan poca contaminación o daños asociados a fungicidas como carbendazim, cuando se aplica en dosis menores a las recomendadas comercialmente.
Algunos autores, como Yunlong, Xiaoqiang, Guohui, Yueqin y Hua (2009), Srinivasulu, Mohiddin, Madakka y Rangaswamy (2012) y Tortella et al. (2013) , reportan poca contaminación o daños asociados a fungicidas como carbendazim, cuando se aplica en dosis menores a las recomendadas comercialmente.
Por lo tanto, es necesario que estos y otros productos químicos utilizados en la zona de estudio se manejen en el marco de una estrategia de BPA, basada en el monitoreo y el control de focos de infección, así como en un uso controlado, para mitigar el efecto en el suelo correspondiente al área de influencia de las raíces (Melo et al., 2015).
Además, se observó que la población de bacterias había disminuido, y que se presentaban diferencias significativas frente al testigo sin aplicación y a las características del suelo previas a la siembra. La cuantificación de los hongos fue mayor en los tratamientos en los que solo se aplicaron aceites esenciales de L. alba o C. citratus, mientras que el tratamiento químico individual T5 presentó los valores más bajos.
En todos los casos, se observó que la población microbiana cultivable estaba por debajo de los valores reportados por Melo et al. (2015) para suelos tropicales, lo cual se asocia a suelos ácidos, pues ocurrió de manera más acentuada en los tratamientos que incluyeron control con fungicidas. Esto podría estar vinculado con la naturaleza biocida del químico, que puede generar un efecto letal indiscriminado tanto en microorganismos benéficos como en fitopatógenos (Carbonell et al., 2000; Melo et al., 2015).
Se evidenció una situación similar en los tratamientos con aceites esenciales, pero en una menor magnitud, dado que es inferior la residualidad de los componentes volátiles biocidas como el citral, que impide la germinación de las células fúngicas (Quintana, González, Plascencia, & Cortez, 2010).
Sin embargo, una vez que la vida media del citral se supera, la microbiota se restablece (Alzate et al., 2009; Jaurixje, Torres, Mendoza, Henríquez, & Contreras, 2013). En todo caso, se debe verificar la magnitud del efecto de los aceites esenciales y los fungicidas en la microbiota del suelo, mediante técnicas de alta sensibilidad, como estudios de metagenómica (Dober et al., 2016).
En cuanto al rendimiento, fue mayor respecto al testigo en los cultivos con tratamientos, y también se observaron diferencias significativas entre ellos: en fríjol, el químico T5 (tiabendazol) dio los mejores resultados, con una producción de 0,85 t/ha, seguido de T4 (aceite esencial C. citratus + tiabendazol), con 0,77 t/ha, que es cercana al promedio regional, de 0,8 t/ha. Se observó un efecto similar en la berenjena, donde con el T5 (tiabendazol) se alcanzaron 19,1 t/ ha, un rendimiento superior al promedio regional, de 18 t/ha (CCI, 2015).
Respecto al comportamiento fitosanitario (tabla 5), solo se apreciaron diferencias significativas en la reacción a las enfermedades, pues el ataque fue mayor en el testigo en todos los cultivos, y con una alta incidencia en el ají, con un 98 % de frutos con daño por manchas, pero sin que se afectara el rendimiento, ya que se superó el promedio regional, de 6,6 t/ha. En estudios posteriores deberá evaluarse el efecto de los tratamientos en la durabilidad en el anaquel (CCI, 2015; Guigón & González, 2001; Silva et al., 2014).
En cuanto a la respuesta en la presencia de plagas, se observó una incidencia de entre el 4,3 % y el 19 %. En todos los tratamientos del cultivo de fríjol se presentó un 5 % de lorito verde, mientras en el tratamiento control del cultivo de berenjena se dio un nivel del 10 % de mosca blanca.
Análisis de componentes principales de variables rizosféricas y de rendimiento, en el control de hongos de cultivos de ají, fríjol y berenjena
En términos generales, los resultados del análisis de componentes principales (ACP) -que explicaron en promedio el 98,7 % de la varianza entre variables fisicoquímicas, microbiológicas y de rendimiento en respuesta al control de los fitopatógenos M. phaseolina, P. capsici y C. gloeosporioides- indican diferentes respuestas edafológicas y agronómicas, según el tipo de tratamiento utilizado, en relación con el testigo sin control.
Lo anterior se asocia con una mayor incidencia de plagas y enfermedades, pero una menor alteración de los indicadores fisicoquímicos y microbiológicos en el suelo. Además, también existen diferencias (p < 0,05) entre el uso del aceite esencial por sí solo y el combinado con el fungicida químico.
Por consiguiente, en las condiciones del presente estudio, tanto los tratamientos exclusivos con aceites esenciales como aquellos con productos químicos ocasionaron impactos negativos en el suelo, pero, al mezclarse, estos efectos se redujeron (p = 0,00) o promovieron el comportamiento de algunas variables edafológicas beneficiosas para el cultivo.
Es el caso de las bacterias cultivables del suelo del fríjol, el grado de acidez en el suelo del ají y la materia orgánica en la berenjena, cuyos valores son superiores cuando se realizan tratamientos combinados, como T2 (aceite esencial de L. alba + tiabendazol) y T4 (aceite esencial C. citratus+ tiabendazol), frente a aquellos que emplean los aceites esenciales o los químicos individualmente (tabla 4).
Esta condición responde a diferentes factores. Los pesticidas sintéticos están basados en un único producto, en contraste con los aceites esenciales, que son una mezcla compleja de componentes, y que incluyen constituyentes menores que actúan sinérgicamente dentro de la planta, como una estrategia de defensa (Batish, Singh, Kumar, & Kaur, 2008).
Sin embargo, su naturaleza volátil requiere una compensación con agentes estabilizantes. Se ha documentado que los benzimidazoles cumplen una función antioxidante en bases oleicas de origen vegetal e hidrocarburos (Basta et al., 2016; Komatsu, Souza, Carvalho, de Campos, & Totten, 2010), por lo cual es importante que se lleve a cabo una valoración posterior de este efecto del tiabendazol en los aceites utilizados.
En este ensayo, las bacterias y hongos bajo tratamiento químico disminuyeron en más del 80 % respecto al testigo sin control de fitopatógenos, mientras que con un manejo combinado se alcanzó un máximo del 50 %. Esto sugiere que existe una posibilidad de que se incluya en las bpa, dado el nivel de toxicidad del tiabendazol (Organización Mundial de la Salud [oms], 2010) y la necesidad de evaluar dosis inferiores a las recomendadas convencionalmente, en combinación con los aceites esenciales, con el fin de disminuir la intensidad del uso, ya que la microbiota del suelo se restablece más rápido en ambientes naturales que con un manejo exclusivamente químico (Gaviria et al., 2013).
Yunlong et al. (2009) registraron tendencias similares, y aludieron a una recuperación de la microbiota 21 días después del uso de químicos, respecto al control sin aplicación. En tanto, estudios con fungicidas evidencian una recuperación luego de 90 días de la aplicación, mientras que con extractos naturales se da a los 10 días (Monkiedje, Olusoji, & Spiteller, 2002; Zhao et al., 2016). También se registró que la naturaleza química u orgánica del fertilizante utilizado incide en el pH y en la composición bacteriana (Ling et al., 2014).
Específicamente en el caso del fríjol, los dos componentes explicaron el 96,5 % de la varianza del ensayo (figura 1). El primero, con el 73,2 %, contribuye en mayor medida a las variables pH, materia orgánica y recuento de bacterias. Por su parte, el segundo, con un 23,3 %, está asociado con la cic y la incidencia de la plaga evaluada, el lorito verde (E. kraemeri).
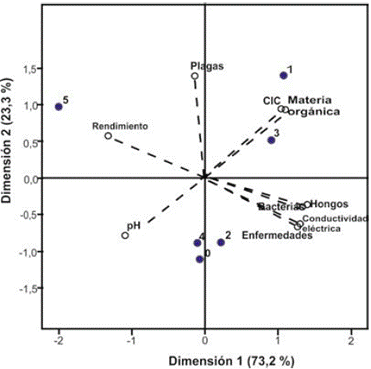
Fuente: Elaboración propia
Figura 1 Diagrama biespacial de dispersiones de variables fisicoquímicas, microbiológicas y de rendimiento del cultivo de fríjol, con diversos manejos de fitopatógenos. Los números indican el tratamiento utilizado: 0: sin control; 1: L. alba; 2: L. alba + tiabendazol; 3: C. citratus; 4: C. citratus + tiabendazol; T5: tiabendazol.
Lo anterior se debe a que la materia orgánica, el pH y la población microbiana del suelo son sensibles a la siembra de fríjol, dada su actividad en la fijación simbiótica del nitrógeno, que a su vez está influenciada por el manejo agronómico del cultivo (Ángeles & Cruz, 2015; Esquivel, Lamadrid, Díaz, Torres, & Pérez, 2014).
Se han observado diferencias entre los tratamientos que consisten exclusivamente en aceites esenciales y aquellos en los que se combinan con químicos. Sin embargo, todos se diferenciaron del testigo, en el que se conservan varias propiedades favorables para el cultivo, pero también se da una mayor incidencia de enfermedades.
El primer grupo, de solo aceites esenciales, favoreció la CIC y el desarrollo adecuado de grupos de hongos en el suelo, pero también presentó una mayor incidencia de plagas, de lo cual se puede deducir que la combinación con un fungicida químico favorece especialmente el rendimiento del cultivo. Esto estaría influenciado por el efecto fitoprotector de los aceites esenciales y sus componentes (Batish et al., 2008), que actúan en sinergia con la alta actividad fungicida del tiabendazol.
Aunque este fungicida controló de forma más efectiva la presión de fitopatógenos en el cultivo, es necesario desarrollar estudios posteriores sobre la sostenibilidad en el tiempo de dicho efecto fitoprotector, dada la naturaleza volátil de los aceites y su alta biodegradabilidad (Batish et al., 2008; Vera, Olivero, Jaramillo, & Stashenko, 2010).
Estos resultados son consistentes con lo que se ha referido en el caso de la soya, respecto a la evaluación del fungicida Vitavax en asocio con Rhizobium, que afectaron la dinámica microbiana en el suelo y la nodulación, así como la reacción a enfermedades y el rendimiento del cultivo (Vozniuk, Tytova, Lyaska, & Lutynska, 2015).
En cuanto al ACP del ají, los dos componentes explicaron el 99,8 % de la varianza del ensayo. El primero, con el 64,6 % de la varianza, contribuyó en mayor medida en las variables pH, conductividad eléctrica y recuento de bacterias por gramo de suelo. Por su parte, el segundo, con un 35,2 %, se asoció con la CIC, la materia orgánica y el recuento de hongos por gramo de suelo, algo similar a lo sucedido en el cultivo de fríjol, lo cual indica la alta sensibilidad de las variables químicas y microbiológicas a los tratamientos en los suelos de la zona en estudio.
Se observó un comportamiento diferente entre el testigo, los demás tratamientos, y el que consistió solo en aceite esencial de L. alba (T1), que se relacionó favorablemente con el contenido de materia orgánica y el desarrollo adecuado de hongos del suelo (figura 2). Estos resultados son consistentes con los registrados con la aplicación de mefenoxam y metalaxyl en suelos franco-arenosos, donde los índices de actividad microbiana, como densidad de población microbiana y sistemas microbianos específicos, fueron los indicadores más sensibles en el cambio (Monkiedje, Ilori, & Spiteller, 2002).
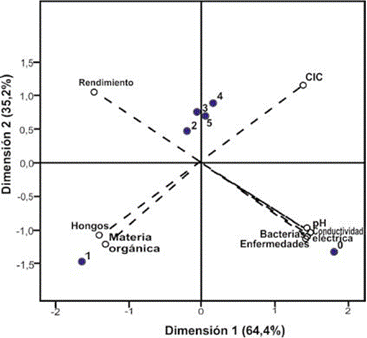
Fuente: Elaboración propia
Figura 2 Diagrama biespacial de dispersiones de variables fisicoquímicas, microbiológicas y de rendimiento del cultivo de ají, con diversos manejos de fitopatógenos. Los números indican el tratamiento utilizado: 0: sin control; 1: L. alba; 2: L. alba + tiabendazol; 3: C. citratus; 4: C. citratus + tiabendazol; T5: tiabendazol.
En concordancia con lo registrado con el fríjol, el testigo sin control conserva varias propiedades favorables para el cultivo, pero también una mayor prevalencia de enfermedades y un menor rendimiento, que fue mayor con T4 y T5. De igual forma, Carvalho et al. (2008, citados por Stangarlin et al., 2011) realizaron un ensayo in vivo con extractos de plantas de C. citratus y Cymbopogon martini para el control de C. gloesporioides en ají, en el cual no se observó una diferencia significativa en el control de la enfermedad en relación con el testigo, aunque, a una concentración del 10 %, se presentó una menor reducción del peso de los frutos con C. martini.
El ACP de la berenjena explicó el 99,9 % de la varianza del ensayo (figura 3). El primer componente, con el 83,7 %, se asoció con el pH, el recuento de bacterias y el rendimiento del cultivo (en una relación negativa), lo cual podría explicarse por las condiciones de acidez del suelo favorables para el desarrollo de bacterias con baja influencia en los ciclos biogeoquímicos o en el rendimiento del cultivo de berenjena (Sapundjieva, Kostadinov, Kartalska, Shilev, & Naidenov, 2009).
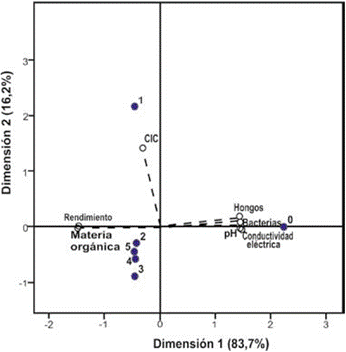
Fuente: Elaboración propia
Figura 3 Diagrama biespacial de dispersiones de variables fisicoquímicas, microbiológicas y de rendimiento del cultivo de berenjena, con diversos manejos de fitopatógenos. Los números indican el tratamiento utilizado: 0: sin control; 1: L. alba; 2: L. alba + tiabendazol; 3: C. citratus; 4: C. citratus + tiabendazol; T5: tiabendazol.
A su vez, el segundo componente, con el 16,2 % de la varianza, incluyó la CIC. Se observaron diferencias entre los tratamientos que contenían aceite esencial de L. alba, el testigo y los demás tratamientos. El testigo, al igual que en los casos del fríjol y el ají, conservó varias propiedades edáficas favorables para el cultivo, pero también una mayor prevalencia de enfermedades.
El T1 (L. alba) se relacionó favorablemente con la CIC, y el T2 (L. alba + tiabendazol) con el contenido de materia orgánica y el rendimiento. Lo anterior podría estar asociado, además de su actividad fungicida, al efecto protector en raíces de hortalizas que fue reportado por Vera et al. (2010) en cebolla (Allium cepa L.), y que se demuestra con la disminución de aberraciones cromosómicas, así como con el aumento de la longitud y el peso de las raíces expuestas a mercurocromo a 10 y 500 μm, más el aceite esencial de L. alba a 100 μm, con diferencias significativas en relación con el químico aplicado individualmente.
En combinación con los químicos, estos tratamientos alcanzaron un rendimiento similar a los promedios regionales, y mejores condiciones fisicoquímicas y microbiológicas. El realizado exclusivamente con fungicida resultó ser más agresivo para la microbiota del suelo y promovió su acidez, aunque obtuvo resultados superiores tanto en control de enfermedades como en el rendimiento de los cultivos.
En términos generales, en fríjol y ají, los componentes principales asociados a la varianza entre tratamientos consistieron en la reacción del pH, el nivel de materia orgánica y la población microbiana (bacterias u hongos).
Por su parte, en el caso de la berenjena, la materia orgánica del suelo fue similar entre los tratamientos, a excepción del testigo sin control. Lo anterior sugiere que el efecto del manejo agronómico en los ciclos biogeoquímicos edáficos influye en mayor o menor medida en el rendimiento según la especie hortícola.
Por consiguiente, se debe avanzar en la estandarización del uso conjunto de fungicidas químicos y aceites esenciales, mediante la medición de su impacto en las propiedades asociadas a la salud y la calidad del suelo agrícola, así como su conservación en el largo plazo.
Además de las variables evaluadas en este estudio, se deben incluir otros criterios biológicos de especial importancia, como la estabilidad de microagregados, la relación entre anélidos y hormigas, el estudio de mesofauna y macrofauna, entre otras variables sensibles para el manejo del cultivo (Altieri & Nicholls, 2001; Tofiño, Velásquez, & Zapata, 2016).
Conclusiones
En general, los aceites esenciales controlaron efectivamente los fitopatógenos M. phaseolina, P. capsici y C. gloeosporioides, con un 100 % de inhibición in vitro y un 67 % de eficiencia en campo. Los resultados sugieren que los tratamientos que consisten en la combinación de aceite esencial y fungicida (T2 y T4) presentaron mejores rendimientos en todos los cultivos de hortalizas, en relación con el testigo sin control de fitopatógenos.
Aparentemente, para las hortalizas evaluadas, esta tendencia tiene un menor impacto en el suelo en lo que se refiere a indicadores de pH, actividad microbiológica de bacterias, hongos rizosféricos y disponibilidad de nutrientes, respecto a los tratamientos con aceites esenciales o fungicidas químicos, en los que se observa una influencia en la dinámica de los nutrientes, que deberá verificarse en trabajos posteriores, de acuerdo con las necesidades diferenciales de cada cultivo.
En consecuencia, se recomienda verificar el control en campo de subdosis de fungicidas asociadas con las concentraciones de aceites esenciales validadas in vitro en los patógenos evaluados el presente estudio. Además, se sugiere avanzar en pruebas más específicas, como medición de impacto en todas las propiedades asociadas a la salud del suelo, y esquemas de degradación y eliminación natural del aceite esencial, de manera individual y combinado con fungicidas químicos.
De igual forma, los resultados alcanzados pueden refinarse, a partir de estudios con estrategias metagenómicas, con el objetivo de definir los efectos de los tratamientos en las funciones generales del suelo agrícola.
Por otro lado, el uso de aceites esenciales de L. alba y C. citratus, acompañados de bioinsumos a base de Trichoderma spp., deberá analizarse en campo, en un esquema de rotación con fungicidas o aceites esenciales, individualmente y en conjunto, dada la incompatibilidad que en el presente estudio se evidenció en su combinación in vitro.
Para la bioprospección de plantas aromáticas y el fortalecimiento regional de la agrocadena, resulta de vital importancia el diseño de estrategias agroproductivas de especies como L. alba y C. citratus, que optimicen la productividad de aceites esenciales con mayor calidad fitoquímica en el Caribe seco.
Finalmente, se requieren estudios de la fitotoxicidad y citotoxicidad de los aceites esenciales aplicados como solución acuosa foliar, con el fin de avanzar en formulaciones como producto fungicida dentro del marco de estrategias de BPA de producción hortícola.











 text in
text in