Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia y Tecnología Agropecuaria
Print version ISSN 0122-8706
Corpoica cienc. tecnol. agropecu. vol.19 no.3 Mosquera Sep./Dec. 2018
https://doi.org/10.21930/rcta.vol19_num2_art:684
Transformación y agroindustria
Métodos de extracción, refinación y concentración de aceite de pescado como fuente de ácidos grasos omega-3
1 Investigador, Universidad del Cauca, Facultad de Ciencias Agrarias. Popayán, Colombia. Correo: jrbonilla@unicauca.edu.co. orcid.org/0000-0001-5362-5950.
2 Docente, Universidad del Cauca, Facultad de Ciencias Agrarias. Popayán, Colombia. Correo: jlhoyos@unicauca.edu.co. orcid.org/0000-0001-9025-9734.
El aceite de pescado es un producto industrial de alto valor nutricional, por su contenido de ácidos grasos poliinsaturados omega-3, valorados en la actualidad por sus efectos benéficos en la salud. En este artículo se revisan estudios y avances realizados desde el año 2000 en la extracción de aceite de pescado de diversas especies, su refinación y concentración de ácidos grasos. Las técnicas de extracción van desde tecnologías convencionales, como prensado húmedo y extracción por solventes, hasta otras propuestas más recientemente, como fluidos supercríticos y ensilaje de pescado. Así mismo, aunque la refinación se realiza con métodos tradicionales, existen nuevas tecnologías con potencial para aplicarse en aceite de pescado. Por otro lado, el interés en la concentración de ácidos omega-3 ha crecido y se han propuesto varias técnicas, como hibernación, métodos enzimáticos, fraccionamiento por fluidos supercríticos y por métodos cromatográficos, formación de complejos con urea y concentración por membranas. La información recopilada indica una tendencia a combinar diferentes tecnologías convencionales y emergentes, con el fin de mejorar los rendimientos y la pureza del producto obtenido.
Palabras clave: aceites de pescado; ácidos grasos poliinsaturados; extracción; lípidos; purificación
Fish oil is an industrial product of high nutritional value because of its Omega-3 polyunsaturated fatty acids content, currently valued for their beneficial effects on health. Studies and advances made since year 2000 on fish oil extraction from several fish species, its refining and polyunsaturated fatty acids concentration are reviewed in this article. Extraction techniques range from conventional technologies such as wet pressing and extraction using solvents, to more recently proposed technologies such as supercritical fluids and fish silage. Moreover, although refining is performed by traditional methods, there are new technologies with potential to be applied on fish oil. On the other hand, interest in omega-3 polyunsaturated fatty acids concentration has increased and several techniques such as winterization, enzymatic methods, super-critical fluids fractionation, complex formation with urea, fractionation by chromatographic methods and concentration by membranes have been proposed. The information collected indicates a trend to combine different conventional and emerging technologies to improve product yields and purity.
Keywords: fish oil; polyunsaturated fatty acids; extraction; lipids; purification
Introducción
El aceite de pescado es un producto industrial de gran valor nutricional, debido a su contenido de ácidos grasos poliinsaturados (AGPI) omega-3 de cadena larga, como el docosahexaenoico (DHA), el docosapentaenoico (DPA) y el eicosapentaenoico (EPA), los cuales, en la actualidad, son altamente valorados por sus propiedades profilácticas y terapéuticas en el campo nutricional y de la salud. El aceite de pescado, que antes era un producto secundario de la obtención de harina de pescado usada para alimentación animal, es ahora reconocido como la fuente primaria de estos ácidos grasos (Valenzuela, Sanhueza, & De la Barra, 2012).
El contenido de EPA y DHA del aceite de pescado es un importante parámetro de calidad de este producto. Estos ácidos grasos se relacionan con diferentes funciones neuronales, y su ausencia se asocia a procesos inflamatorios diversos y al desarrollo precario de neuronas en pacientes humanos. Así mismo, se reconocen su efectos benéficos en enfermedades cardiovasculares (Coronado, Vega y León, Gutiérrez, García, & Díaz, 2006).
El aceite de pescado puede obtenerse de diferentes especies, dependiendo de la zona de producción. La materia prima está compuesta por tres fracciones mayoritarias, que incluyen sólidos, aceite y agua. El propósito es separar estos componentes en la mayor medida posible, obteniendo comúnmente harina y aceite de pescado (Organización de las Naciones Unidas para la Alimentación y la Agricultura [FAO], 1986). Los métodos para extraerlos incluyen cocción, uso de solventes y, recientemente, extracción mediante fluidos supercríticos, por vía enzimática y por ensilajes ácidos (también conocidos como químicos) o biológicos (Mbatia et al., 2010; Menegazzo, Petenuci, & Fonseca, 2014).
El aceite crudo contiene impurezas, que dependen del método de extracción utilizado (Chakraborty & Joseph, 2015a), y requiere un proceso de purificación para alcanzar las características de calidad que lo hagan aceptable para su consumo (Crexi, Legemann-Monte, Almeida de Souza, & De Almeida-Pinto, 2010).
Para lograr tales características, las distintas impurezas deben ser eliminadas mientras se mantienen la mayoría de los compuestos deseables, como los omega-3 y otros AGPI, por lo que se requiere que el proceso de refinación esté diseñado para alcanzar este fin, minimizando pérdidas de aceite y maximizando la disponibilidad de los constituyentes benéficos (Vaisali, Charanyaa, Belur, & Regupathi, 2015).
El interés en una mayor concentración de AGPI de buena calidad se pone de manifiesto en varias investigaciones que tienen como fin extraer aceite de pescado, purificarlo e incrementar el contenido de AGPI, especialmente de EPA y DHA, mediante diferentes técnicas. En torno a los AGPI se han realizado algunas revisiones, que en algunos casos incluyen extracción y fraccionamiento (Rubio et al., 2010; Sahena et al., 2009), pero se centran en la tecnología de fluidos supercríticos y solo abarcan estudios hasta 2009.
Por lo tanto, el objetivo de este artículo es realizar una revisión general de los avances que se han hecho a partir del año 2000 en cuanto a las diferentes tecnologías de extracción, así como los adelantos en refinación y fraccionamiento de aceite de pescado enfocados en la conservación y enriquecimiento en AGPI omega-3.
Extracción de aceite de pescado
Se han desarrollado varios estudios en torno a la extracción y el análisis de calidad del aceite obtenido de diferentes tipos de pescado, así como de sub-productos de su procesamiento, en los cuales se utilizan distintas técnicas, como fluidos supercríticos, prensado húmedo, extracción por solventes, y ensilaje de pescado mediante el uso de enzimas presentes en el pescado o de otras fuentes (Adeoti & Hawboldt, 2014).
Extracción por métodos convencionales
La extracción de aceite de pescado mediante prensado húmedo es el método más utilizado para la producción a escala industrial, y se realiza básicamente en cuatro etapas: cocción del pescado, prensado, decantación y centrifugación (FAO, 1986).
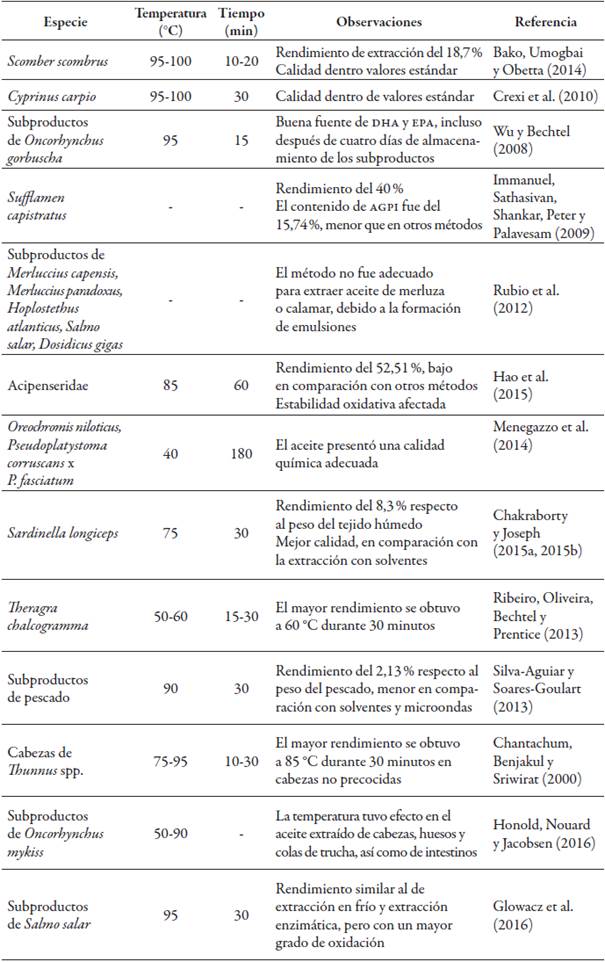
Las condiciones drásticas de temperatura y presión utilizadas para la coagulación de proteínas y la subsecuente liberación de aceite pueden modificar parcialmente los AGPI presentes, debido a reacciones de degradación como la hidrólisis y la oxidación (Linder, Fanni, & Parmentier, 2005; Mbatia et al., 2010). En la tabla 1 se presentan investigaciones que han estudiado el prensado húmedo adaptado en laboratorio, comparándolo además con otros métodos y condiciones de ensayo.
Otro procedimiento convencional es la extracción por solventes, aplicado por lo general para propósitos analíticos, pero no para producción industrial, a causa de las desventajas del uso de sustancias con restricciones en la industria alimentaria (Rubio et al., 2010). Este proceso se basa en la solubilidad de los lípidos en solventes orgánicos y su insolubilidad en agua, gracias a lo cual pueden ser separados de esta y de sus componentes solubles, como proteínas, carbohidratos y minerales.
Las principales limitaciones de esta técnica son que requiere una muestra relativamente seca, es destructiva, e implica un alto consumo de tiempo, además de que genera grandes cantidades de solvente residual (Adeoti & Hawboldt, 2014; Sahena et al., 2009).
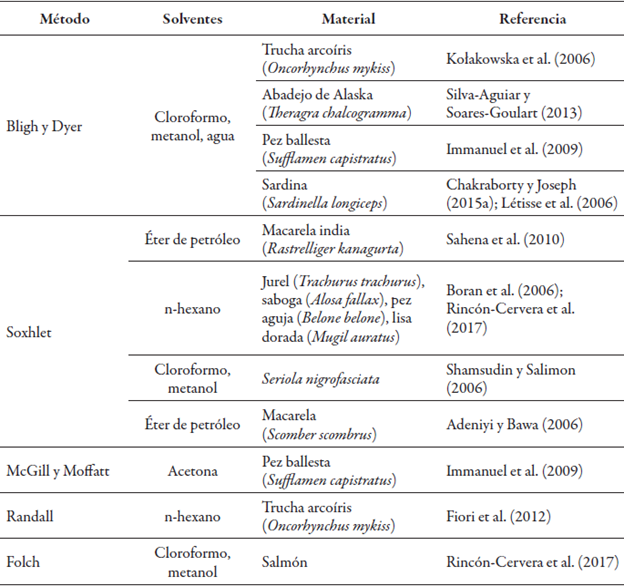
Existen varios métodos que varían de acuerdo con el tipo de solvente o tratamiento de la muestra. Los más comunes son los de Soxhlet y Bligh-Dyer, pero también se han evaluado otros, como el de McGill-Moffatt, así como los de Randall y de Folch (Fiori et al., 2012; Immanuel et al., 2009; Rincón-Cervera, Villarreal-Rubio, Valenzuela, & Valenzuela, 2017).
Se han aplicado para la extracción de aceite de pescado como única tecnología (Adeniyi & Bawa, 2006; Boran, Karaçam, & Boran, 2006; Kołakowska, Domiszewski, Kozłowski, & Gajowniczek, 2006; Shamsudin & Salimon, 2006), así como en estudios comparativos con otros métodos (Chakraborty & Joseph, 2015a; Fiori et al., 2012; Immanuel et al., 2009; Létisse, Rozières, Hiol, Sergent, & Comeau, 2006; Rincón-Cervera et al., 2017; Sahena et Silva-Aguiar & Soares-Goulart, 2013) (tabla 2).
Extracción por fluidos super críticos (EFSC)
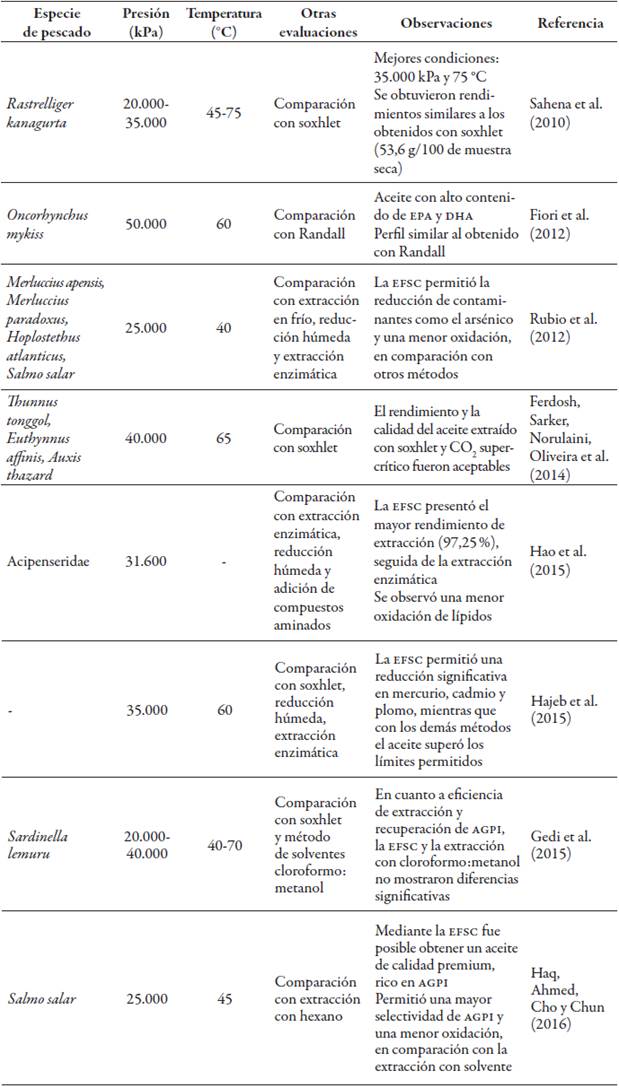
La EFSC es una tecnología emergente de extracción por solventes, que ha ganado gran interés en años recientes, debido a ventajas como el uso de temperatura moderada, ambiente libre de oxígeno y extracción de lípidos de baja polaridad, lo cual evita la extracción de impurezas (Rubio et al., 2012).
Los fluidos supercríticos tienen una viscosidad más baja y una difusividad más alta que los solventes convencionales, lo que mejora la transferencia de masa y, en general, reduce el tiempo necesario para la extracción. Su mayor desventaja es el alto costo de la aplicación de la tecnología a nivel industrial. El fluido más empleado es el CO2, usado como solvente inerte y seguro para la extracción de aceite. Su principal ventaja es que no permanece en el producto, ya que a temperatura y presión ambiente retorna a su fase gaseosa y se evapora (Rubio et al., 2010, 2012).
Los parámetros que por lo general se evalúan son presión, temperatura, flujo de CO2 y tiempo. Sin embargo, en aceites de pescado también se han estudiado el efecto de la humedad, el sentido del flujo, relación solvente: material, tamaño de partícula (Rubio et al., 2008), y se ha modelado el proceso para encontrar condiciones óptimas (Ferdosh et al., 2013; Sarker et al., 2012).
Otros estudios, que comparan la EFSC de aceite de pescado con otras técnicas de extracción (tabla 3) (Ferdosh, Sarker, Norulaini, Oliveira et al., 2014; Fiori et al., 2012; Hao et al., 2015; Rubio et al., 2012; Sahena et al., 2010), muestran que esta tecnología es atractiva en procesos convencionales, para obtener aceites ricos en AGPI y con un contenido reducido de contaminantes.
Extracción por ensilaje
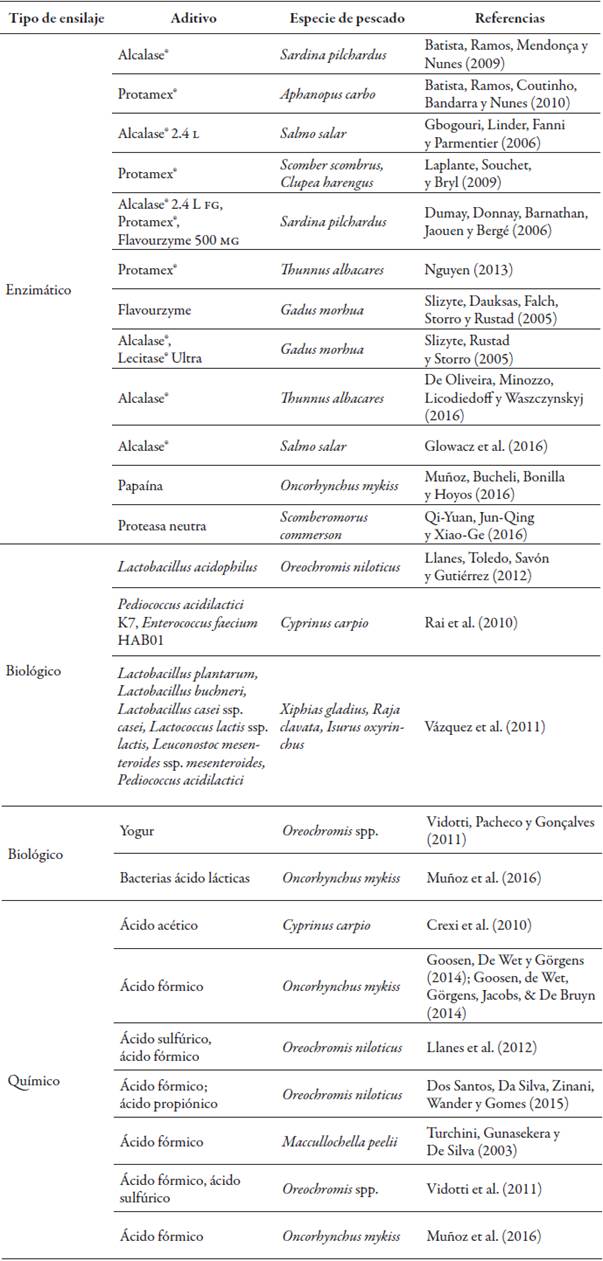
El ensilaje de pescado es un producto semilíquido elaborado a partir del pescado entero o partes de este, a los cuales se les agregan ácidos (ensilaje químico), enzimas (ensilaje o extracción enzimática) o bacterias ácido lácticas (ensilaje biológico), lo que provoca la hidrólisis de proteína (Ferraz de Arruda, Borghesi, & Oetterer, 2007).
Este proceso se ha mostrado como una buena alternativa a los métodos tradicionales, dado que puede ser más simple y económico en cuanto a costos de inversión y gasto energético. Además, es una tecnología en la que no se emplean solventes ni altas temperaturas, y los cambios fisicoquímicos y microbiológicos ocasionados pueden no solo mejorar el rendimiento de extracción, sino también prevenir procesos indeseables, como la oxidación de grasas, así como recuperar ácidos grasos esenciales y otros ingredientes funcionales, como el hidrolizado de proteína y el colágeno, entre otros (Ferraz de Arruda et al., 2007; Rai, Swapna, Bhaskar, Halami, & Sachindra, 2010; Rubio et al., 2010).
Algunos estudios se han orientado a la evaluación de este procedimiento para la extracción de aceite de pescado entero o de sus subproductos (tabla 4). Una de las técnicas más estudiadas es el ensilaje enzimático con diferentes tipos de proteasas, pero los ensilajes biológico y químico también son usados en diversas investigaciones para la separación de aceite de pescado.
Refinación de aceite de pescado
Una vez extraídos, los aceites de pescado requieren un proceso de purificación para alcanzar las características de calidad que lo hagan aceptable para su consumo (Crexi et al., 2010), dado que contienen impurezas insolubles, fosfolípidos, ácidos grasos libres, humedad, productos de oxidación primaria, minerales, pigmentos e incluso contaminantes orgánicos persistentes (POP, por sus siglas en inglés).
Las impurezas en el aceite reducen su calidad (Huang & Sathivel, 2010) y deben ser eliminadas mientras se mantienen la mayoría de los compuestos deseables, como los omega-3 y otros AGPI, por lo que el proceso de refinación debe ser diseñado de tal manera que se alcance este fin, minimizando las pérdidas de aceite y maximizando la disponibilidad de los constituyentes benéficos (Vaisali et al., 2015).
El procedimiento de refinación tradicional incluye varias etapas, como desgomado, neutralización, blanqueado, desodorización y, en algunos casos, hibernación, aunque esta podría ser considerada en mayor medida un método de concentración de AGPI. Cada una de las etapas es especialmente importante para retirar las distintas clases de compuestos (tabla 5) y es el proceso más estudiado y aplicado a nivel industrial para la refinación de aceites de pescado.
Tabla 5 Componentes minoritarios del aceite, efecto en la calidad y etapa de refinación para su remoción
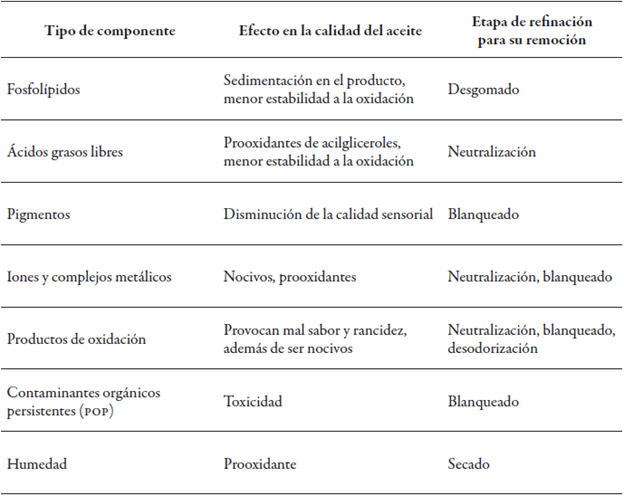
Fuente: Adaptación de Čmolik y Pokorný (2000) y Vaisali et al. (2015)
Se han realizado varios estudios con el fin de evaluar el efecto del proceso de refinación en distintas propiedades del aceite, a través de la determinación de parámetros como índices de acidez, de peróxidos, de ácido tiobarbitúrico, de yodo, de saponificación y de anisidina, que se encuentran entre las más importantes.
No obstante, en la totalidad de las evaluaciones, los índices de peróxidos (IP) y de acidez (IA) se incluyen como indicadores imprescindibles en la evaluación del proceso (tabla 6) y, en gran parte de los casos, se ven afectados negativamente en las etapas en las que la exposición a altas temperaturas es mayor, como neutralización, secado y desodorización, debido a que incrementa la susceptibilidad a la oxidación y la formación de peróxidos (Crexi et al., 2010).
Tabla 6 Parámetros de evaluación de la refinación de aceite de pescado

CA: ácidos conjugados; IA: índice de acidez; IP: índice de peróxidos; IpA: índice de anisidina; IS: índice de saponificación; IR: índice de refracción; IY: índice de yodo; OSI: índice de estabilidad al oxígeno; TBA: índice de ácido tiobarbitúrico; Totox: oxidación total.
Fuente: Elaboración propia
Aunque el proceso de refinación se ha venido estudiando desde hace varios años, muchas de las investigaciones todavía están dirigidas a aceites de origen vegetal, que involucran la evaluación de varias etapas y nuevas técnicas que aún no han sido reportadas para aceite de pescado, pero que cuentan con el potencial para su aplicación en este material.
Algunos autores han realizado una revisión de diferentes tecnologías descubiertas y redescubiertas (como el caso de procesos enzimáticos) para la optimización del proceso de refinación de aceites comestibles (tabla 7) (Čmolik & Pokorný, 2000; Kumar & Krishna, 2015; Misra, Nandi, & Nandi, 2013; Moharana, Byreddy, Puri, Barrow, & Rao, 2016; Vaisali et al., 2015).
Tabla 7 Tecnologías con potencial de aplicación en la refinación de aceite de pescado
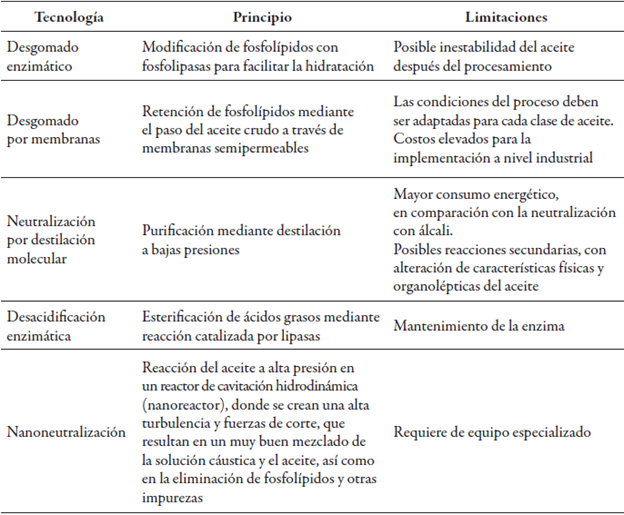
Fuente: Elaboración propia
El verdadero reto consiste en alcanzar un equilibrio entre la calidad y la sostenibilidad del proceso y el ahorro en costos potenciales y en rendimiento de aceite, factores primordiales para la implementación de nuevas tecnologías (De Greyt, 2012).
Concentración de AGPI en aceite de pescado
Se han propuesto varias técnicas para la concentración de AGPI, en especial de omega-3, entre las que se encuentran hibernación, concentración por métodos enzimáticos, fraccionamiento por fluidos super-críticos y por métodos cromatográficos, formación de complejos con urea y concentración por membranas.
Hibernación de aceite de pescado
La hibernación es un proceso que involucra la cristalización parcial del aceite mediante enfriamiento controlado, seguido de filtración. Su principal objetivo es separar ácidos grasos saturados de los insaturados. Esta separación es posible debido a las diferencias en el punto de fusión de los ácidos grasos, el cual depende principalmente de la longitud de la cadena y el grado de insaturaciones.
Así, los ácidos grasos saturados y monoinsaturados, que poseen una temperatura de fusión más alta, cristalizan y pueden ser separados por filtración, mientras que los AGPI permanecen en forma líquida en el aceite (Vázquez & Akoh, 2012).
El uso de solventes orgánicos es común en el proceso de hibernación, con el fin de incrementar la velocidad de transferencia de masa y la cristalización de fracciones de ácidos grasos saturados, a partir de un aceite disuelto en un solvente apropiado (López-Martínez, Campra-Madrid, & Guil-Guerrero, 2004; Morales, Muñío, Pérez, Guadix, & Guadix, 2013). Esta metodología ha sido una de las principales técnicas desarrolladas para la concentración de AGPI omega-3 a partir de triacilgliceroles en forma natural (Lei et al., 2016).
Así, Cunha, Crexi y De Almeida -Pinto (2009) realizaron la optimización del proceso de hibernación de aceite de pescado, evaluaron el tipo de solvente (acetona y hexano), su proporción (40 % y 60 %), y la agitación en la segunda etapa de enfriamiento (0 y 40 r. p. m.), y obtuvieron un modelo estadístico para la concentración de ácidos grasos insaturados y saturados. Las condiciones más adecuadas fueron un 40 % de hexano sin agitación en la segunda etapa de enfriamiento, lo cual incrementó la concentración de ácidos grasos insaturados en un 9,2 % y redujo los ácidos grasos saturados en un 13,3 % respecto al aceite blanqueado.
A su vez, Tengku‐Rozaina y Birch (2013) llevaron a cabo la hibernación de aceite de hoki (Macruronus novaezelandiae) con hexano como solvente y sin él. Observaron que el uso de solvente facilitó la separación de las fracciones del aceite y permitió una mayor concentración de ácidos grasos omega-3.
Por su parte, Homayooni, Sahari y Barzegar (2014) evaluaron tres temperaturas de hibernación diferentes (-5, 0 y 10 °C) en aceite de sardina (Dussumieria acuta) con etanol como solvente, y observaron que a -5 °C se presentó una mayor disminución de los ácidos grasos saturados y un incremento de los insaturados. Los resultados indicaron que la concentración de AGPI omega-3 en la porción no cristalizada se incrementó a medida que disminuyó la temperatura.
Díaz et al. (2016) también evaluaron este proceso en aceite de trucha, mediante la optimización del porcentaje de acetona y el tiempo de cristalización, y lograron un incremento en DHA y EPA del 69 % y el 51,6 %, respectivamente.
Fraccionamiento por fluidos supercríticos (FFSC)
Esta técnica ha sido propuesta para la extracción de aceite, así como para la concentración de AGPI, en particular omega-3 como DHA y EPA, a partir de aceite extraído con métodos convencionales, lo que se conoce también como fraccionamiento.
Varios estudios abordan el fraccionamiento de aceite en su estado natural, pero parece ser poco efectivo, posiblemente debido a la compleja estructura del aceite de pescado, compuesto por un gran número de triacilgliceroles (Corrêa, Peixoto, Gonçalves, & Cabral, 2008; Homayooni et al., 2014).
Lopes et al. (2012) evaluaron el fraccionamiento de aceite de pescado de agua fresca con un bajo contenido de omega-3, aproximadamente del 10 %. El mejor fraccionamiento fue el de las isotermas de 33 y 40 °C a 20.000 kilopascales (kPa). Ferdosh, Sarker Norulaini, Akanda et al. (2014) también estudiaron este proceso en aceite de atún, usando etanol como cosolvente, y encontraron que fue altamente efectivo en la recuperación de AGPI.
La complejidad estructural del aceite de pescado ha dificultado su fraccionamiento, por lo que el interés en la síntesis y el fraccionamiento de metilésteres y etilésteres de triacilgliceroles de aceite de pescado se ha incrementado, por tratarse de compuestos más estables que los ácidos grasos. Estos se obtienen mediante hidrólisis de triacilgliceroles (TAG) y alquilación de ácidos grasos, antes del FFSC (Lopes et al., 2012; Rubio et al., 2010).
Perretti et al. (2007) estudiaron la concentración de omega-3, a partir de una mezcla comercial de ésteres de ácidos grasos de aceite de pescado, mediante FFSC con SC-CO2. Estudiaron diferentes presiones (10.000, 14.000, 15.000 y 30.000 kPa) y diversos flujos de CO2, manteniendo la temperatura de las tres secciones de columna a 40, 50 y 60 °C, respectivamente, con el fin de incrementar la concentración de DHA y reducir la relación EPA:DHA, una característica importante para definir sus propiedades funcionales.
El incremento de la presión y la tasa de flujo ocasionaron un aumento en la concentración de DHA (de un 24,54 % a un 49,57 %) y una reducción deseada de la relación EPA:DHA, de 1,61 a 0,65, mientras que los ácidos grasos saturados y monoinsaturados pasaron de un promedio del 3,33 % al 0,6 %.
Létisse y Comeau (2008) aplicaron este tipo de fraccionamiento en etilésteres de ácidos grasos de aceite de sardina, y observaron el efecto de la temperatura al obtener una relación de concentración mayor de EPA (24,74 %) y DHA (26,02 %) a 60 °C, en comparación con los 40 °C (4,28 % y 7,53 %). Así mismo, la densidad del CO2 mostró una mayor concentración de DHA y EPA, al incrementarse de 700 a 800 kg/m3, alcanzando una composición cercana al 40 % y 60 % de EPA y DHA, respectivamente.
Por otro lado, algunos modelos termodinámicos y simulaciones de este proceso se han realizado con base en ecuaciones de estado, como la de Gironi y Maschietti (2006); contribución de grupos (GC-EOS)
(Espinosa, Díaz, & Brignole, 2002); los métodos de McCabe-Thiele y Ponchon-Savarit (Riha & Brunner, 2000); relaciones entre temperatura de la cima, número de etapas teóricas y razón solvente: alimento en fraccionamiento a contracorriente con reflujo interno (Maschietti & Pedacchia, 2014), y modelos simplificados en la etapa de equilibrio (Pieck, Crampon, Charton, & Badens, 2016), con el fin de diseñar un proceso de separación de etilésteres de ácidos grasos que maximice la concentración de ácidos grasos omega-3.
Fraccionamiento por cromatografía
Los métodos cromatográficos son usados para la concentración de AGPI, en particular de EPA y DHA, e incluyen cromatografía líquida (HPLC), argentométrica y de fluidos supercríticos, para la obtención de productos de alta pureza (>95 %) (Dillon, Aponte, Tarozo, & Huang, 2013). Por lo general, las separaciones aplican cromatografía argentométrica y se conducen sobre etilésteres de ácidos grasos, en algunos casos combinando etapas de preconcentración previas al fraccionamiento final por cromatografía (tabla 8).
Tabla 8 Fraccionamiento de aceite de pescado por métodos cromatográficos (desde el año 2000)
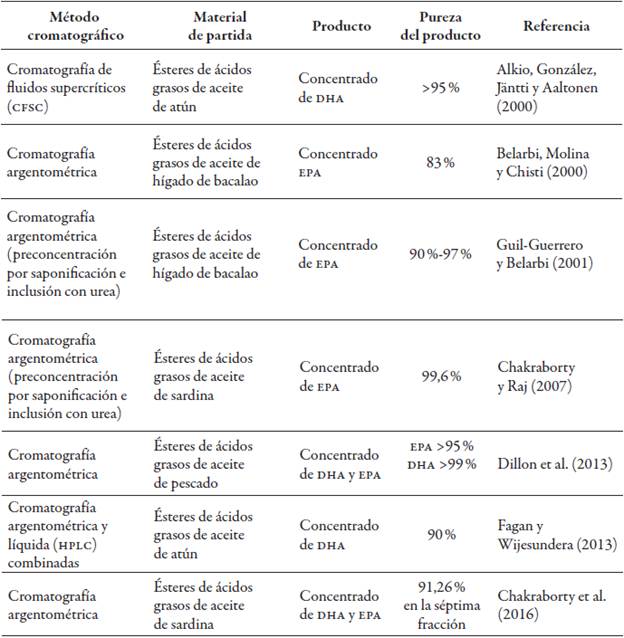
Fuente: Elaboración propia
La cromatografía líquida (HPLC) se emplea para la separación de ácidos grasos omega-3 a partir de microalgas y aceite de pescado. Sin embargo, se reporta que es más fácil separar DHA de aceite de células sencillas que de aceite de pescado, debido a que este último tiene una composición más compleja. Con esta técnica, los ésteres de ácidos grasos son eluidos a partir de su número de equivalentes de carbonos: los ésteres con el mismo número pueden separarse en ciertas condiciones óptimas (Fagan & Wijesundera, 2013).
La cromatografía argentométrica se usa con frecuencia para la concentración de ácidos grasos, de acuerdo con el grado de insaturaciones, dado que la capacidad para formar complejos con los iones de plata se incrementa con este grado. Por tal razón, ácidos grasos altamente insaturados, como el DHA y el EPA, son retenidos con más fuerza que otros con menos insaturaciones, facilitando su separación.
Se han diseñado diferentes configuraciones en la fase estacionaria, con el fin de mejorar la estabilidad del ion plata (i) y reducir su movilidad, como el uso de nitrato de plata, plata covalentemente unida a 3-mercaptopropil como fase estacionaria, y fase estacionaria tiolato-plata (Dillon et al., 2013; Fagan & Wijesundera, 2013).
Por otro lado, los fluidos supercríticos tienen la densidad y la capacidad disolvente de ciertos líquidos, pero con menor viscosidad y mejor difusión, por lo que pueden ser usados como portadores de sustancias, como la fase móvil en cromatografía de gases, o bien disolverlas, como los solventes en HPLC. Esta técnica es conocida como cromatografía de fluidos supercríticos (CFSC) (Taylor, 2009).
La CFSC es apropiada en especial para la separación de AGPI omega-3 de alto grado de pureza, dado que combina la alta selectividad de los fluidos super-críticos y la fase estacionaria (Rubio et al., 2010). Al igual que otras técnicas, las investigaciones son conducidas principalmente sobre etilésteres de ácidos grasos.
En aceite de pescado, esta técnica ha sido aplicada por Alkio et al. (2000) para la concentración de etilésteres de EPA y DHA, usando CO2 supercrítico como fase móvil y una fase estacionaria de octadecilsilano (ODS), obteniendo una tasa de producción de etiléster de DHA con un 90 % de pureza de 0,85 g/(kg ODS*h) y de etiléster de EPA con un 53 % de pureza de 0,23 g/(kg ODS*h).
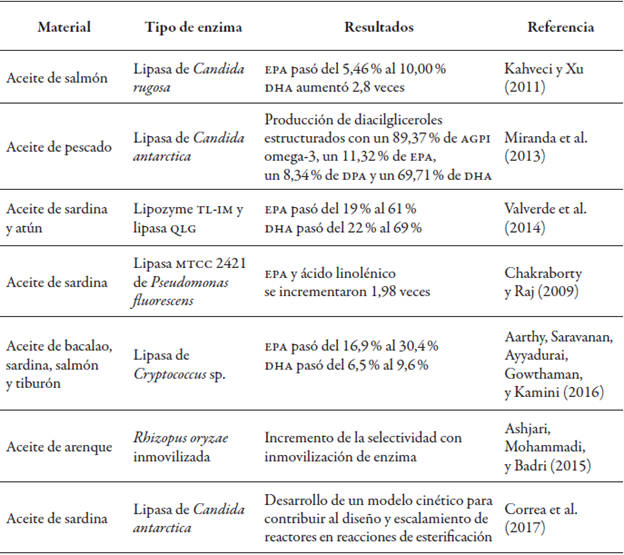
Concentración por métodos enzimáticos
La concentración por métodos enzimáticos se basa en la selectividad de algunas lipasas por determinados ácidos grasos o posiciones en las moléculas de triacilgliceroles, catalizando reacciones de hidrólisis, alcohólisis o transesterificación de triacilgliceroles (Correa, Tejeda, Martín, García, & Noriega, 2017; Miranda, Baeza, Noriega, García, & Otero, 2013; Rubio et al., 2010).
Algunos estudios proponen la aplicación de estos procesos antes de otras etapas, como destilación molecular o filtración por membranas, con el fin de obtener concentrados de ácidos grasos omega-3. La tabla 9 presenta los materiales estudiados y el tipo de enzima utilizado para concentrar aceite de pescado.
Otras investigaciones han estudiado el proceso de alcohólisis en presencia de solventes como el CO2 supercrítico, debido a que es verde, no tóxico y puede removerse con facilidad de los productos de reacción, lo cual lo convierte en un buen medio para llevar a cabo las reacciones enzimáticas (Lin, Chen, & Chang, 2006), además de que puede acoplarse fácilmente con otros procesos, como EFSC, FFSC, CFSC y encapsulación con uso de CO2 supercrítico (Rubio et al., 2010).
Lin et al. (2006) estudiaron la concentración de AGPI omega-3 a partir de aceite de Sardinella aurita, utilizando Lipozyme IM-60, obtuvieron resultados favorables y encontraron que al emplear CO2 supercrítico la conversión fue un 40 % más alta que en condiciones ambientales.
Sin embargo, en investigaciones más recientes (Shin, Sim, Kishimura, & Chun, 2012; Tanbirul-Haque & Chun, 2015), no se encontró un efecto significativo al emplear este mismo solvente en la alcohólisis de aceite de pescado con Lipozyme TL-IM, Lipozyme RM-IM y Novozyme 435, aunque parece mejorar la estabilidad térmica de la enzima y reducir la oxidación de AGPI omega-3 en aceite de atún (Thunnus sp.) y sardina (S. pilchardus) (Melgosa et al., 2017).
Otros métodos de concentración de AGPI
Entre otros métodos para la concentración de AGPI se encuentran la destilación molecular o de vía corta (short-path), la filtración por membranas y la formación de complejos con urea.
La destilación molecular es una tecnología que puede ser usada apropiadamente para la separación, purificación o concentración de sustancias termo-lábiles, dado que opera con presiones de alto vacío (inferiores a una presión absoluta de 1.000-500 kPa) (Cerón, Cardona, & Toro, 2012; Pramparo, Prizzon, & Martinello, 2005).
Si bien en algunos casos esta tecnología se usa como un proceso de purificación de aceite para la remoción de contaminantes orgánicos (Olli, Breivik, & Thorstad, 2013), también se ha aplicado en la concentración de AGPI, particularmente de EPA y DHA en forma libre o como etilésteres (Oliveira & Miller, 2014; Solaesa, Sanz, Falkeborg, Beltran, & Guo, 2016; Wang et al., 2012).
En aceite de atún, Wang et al. (2012) lograron el incremento de la concentración de estos componentes de un contenido total de EPA y DHA de un 32,11 % a un 82,23 % y, de manera similar, Solaesa et al. (2016) alcanzaron un aumento en la concentración de acilgliceroles de AGPI omega-3 del 63 % al 91 % en aceite de sardina.
La filtración por membranas se caracteriza por la aplicación de presión hidráulica como fuerza motriz para la transferencia de masa. La naturaleza de la membrana controla qué componentes permearán y cuáles serán retenidos, de acuerdo con su masa molar o tamaño de partícula.
Esta tecnología se ha utilizado en desgomado, recuperación de solventes en procesos de extracción, remoción de pigmentos, reducción de la acidez, concentración de componentes minoritarios, remoción de ceras y separación de emulsiones (De Morais-Coutinho et al., 2009), así como en concentración de AGPI (Ghasemian, Sahari, Barzegar, & Ahmadi, 2016; Ghasemian, Sahari, Barzegar, & Gavlighi, 2015; Linder et al., 2005; Linder, Matouba, Fanni, & Parmentier, 2002).
Así, en aceite de salmón se ha observado la disminución de ácidos grasos saturados de un 27,2 % a un 20,2 %, mientras el contenido de AGPI se incrementó del 41,6 % al 46,5 %, con un aumento de DHA del 9,9 % al 11,6 % y de EPA del 3,6 % al 5,6 % (Linder et al., 2005).
Por su parte, Ghasemian et al. (2015) realizaron un estudio de optimización para la concentración de AGPI omega -3 por membrana polimérica en aceite de pescado, en el cual evaluaron el efecto de la temperatura, la presión y la velocidad de la agitación, y encontraron que las condiciones óptimas fueron 36,19 °C, 4,82 bares y 43,01 r. p. m., respectivamente, que resultaron en un máximo de AGPI omega-3 del 35,11 %.
La formación de complejos con urea es la técnica más sencilla y eficiente para obtener concentrados de AGPI omega-3 en la forma de ácidos grasos libres o etilésteres de triacilgliceroles. Los ácidos grasos saturados y monoinsaturados son separados de los poliinsaturados partiendo de una solución saturada de urea, en la cual se encuentran todos los ácidos grasos.
Por enfriamiento y filtración, los compuestos formados entre los ácidos grasos saturados y mono-insaturados pueden ser removidos durante la cristalización. Los AGPI no forman complejos de inclusión con la urea, por lo que quedan concentrados en la fracción líquida (Homayooni et al., 2014).
Los estudios acerca de esta técnica evalúan principalmente la relación entre urea y ácido graso, la temperatura y el tiempo de cristalización (Gámez et al., 2003; Homayooni et al., 2014; Liu, Zhang, Hong, & Ji, 2006; Suriani, Lawalata, & Komansilan, 2014; Tengku‐Rozaina & Birch, 2013).
Con este método se obtuvo un contenido de DHA y EPA superior al 85,02 % en aceite de atún (Liu et al., 2006), con una relación de urea y ácido graso de 15, una temperatura de -5 °C y un tiempo de 20 horas. En aceite de sardina, las más altas cantidades de DHA y EPA se encontraron a -10 °C y 1 °C, respectivamente, donde el DHA fue enriquecido del 17,45 % al 29,61 % y el EPA del 15,39 % al 19,76 % (Homayooni et al., 2014).
Conclusiones
Los ácidos grasos poliinsaturados (AGPI) omega-3 son altamente valorados en la actualidad por sus efectos benéficos en la salud. El aceite de pescado es reconocido como fuente primaria de estos ácidos grasos, principalmente el eicosapentaenoico (EPA) y el docosahexaenoico (DHA).
Algunos estudios emplean la extracción de aceite de pescado por métodos tradicionales, como prensado húmedo y solventes convencionales, pero en investigaciones recientes se está optando por la aplicación de tecnologías como fluidos supercríticos y ensilaje de pescado. Los métodos de refinación aún están basados en las etapas tradicionales, aunque hay un potencial importante para la aplicación de nuevas tecnologías, como refinación enzimática y física.
Así mismo, para la concentración de AGPI se han propuesto distintos métodos, como los enzimáticos y cromatográficos, hibernación, fluidos supercríticos, formación de complejos con urea y filtración por membranas. Sin embargo, hasta el momento la combinación de diferentes técnicas parece ofrecer una buena alternativa para incrementar la pureza y el rendimiento de estos componentes.
Agradecimientos
Los autores agradecen al Sistema General de Regalías, por su apoyo en la publicación de este artículo, a través del proyecto Alternativas para el uso de subproductos derivados de la Agroindustria Piscícola (Altpez), ejecutado por la Universidad del Cauca.
REFERENCIAS
Aarthy, M., Saravanan, P., Ayyadurai, N., Gowthaman, M. K., & Kamini, N. R. (2016). A two step process for production of omega 3-polyunsaturated fatty acid concentrates from sardine oil using Cryptococcus sp. MTCC 5455 lipase. Journal of Molecular Catalysis B: Enzymatic, 125, 25-33. doi:10.1016/j.molcatb.2015.12.013. [ Links ]
Adeniyi, O. D., & Bawa, A. A. (2006). Mackerel (Scomber scrombrus) oil extraction and evaluation as raw materials for industrial utilization. Leonardo Journal of Sciences, 5(8), 33-42. [ Links ]
Adeoti, I. A., & Hawboldt, K. (2014). A review of lipid extraction from fish processing by-product for use as a biofuel. Biomass and Bioenergy, 63, 330-340. doi: 10.1016/j.biombioe.2014.02.011. [ Links ]
Alkio, M., González, C., Jäntti, M., & Aaltonen, O. (2000). Purification of polyunsaturated fatty acid esters from tuna oil with supercritical fluid chromatography. Journal of the American Oil Chemists’ Society, 77(3), 315-321. doi:10.1007/s11746-000-0051-3. [ Links ]
Ashjari, M., Mohammadi, M., & Badri, R. (2015). Selective concentration of eicosapentaenoic acid and docosahexaenoic acid from fish oil with immobilized/stabilized preparations of Rhizopus oryzae lipase. Journal of Molecular Catalysis B: Enzymatic, 122, 147-155. doi:10.1016/j.molcatb.2015.08.017. [ Links ]
Bako, T., Umogbai, V. I., & Obetta, S. E. (2014). Extraction and characterizatin of Mackery (Scomber scombrus) oil for industrial use. Researcher, 6(8), 80-85. [ Links ]
Batista, I., Ramos, C., Coutinho, J., Bandarra, N. M., & Nunes, M. L. (2010). Characterization of protein hydrolysates and lipids obtained from black scabbardfish (Aphanopus carbo) by-products and antioxidative activity of the hydrolysates produced. Process Biochemistry, 45(1), 18-24. doi:10.1016/j.procbio.2009.07.019. [ Links ]
Batista, I., Ramos, C., Mendonça, R., & Nunes, M. L. (2009). Enzymatic hydrolysis of sardine (Sardina pilchardus) by-products and lipid recovery. Journal of Aquatic Food Product Technology, 18(1-2), 120-134. doi:10.1080/10498850802581823. [ Links ]
Belarbi, E.-H., Molina, E., & Chisti, Y. (2000). A process for high yield and scaleable recovery of high purity eicosapentaenoic acid esters from microalgae and fish oil. Process Biochemistry, 35(9), 951-969. doi:10.1016/S0032-9592(00)00126-6. [ Links ]
Boran, G., Karaçam, H., & Boran, M. (2006). Changes in the quality of fish oils due to storage temperature and time. Food Chemistry, 98(4), 693-698. doi:10.1016/j.foodchem.2005.06.041. [ Links ]
Cerón, I. X., Cardona, C. A., & Toro, L. A. (2012). Simulación del proceso de concentración de aceite esencial de cidrón (Lippia citriodora) por destilación molecular de película descendente. Ingeniería y Competitividad, 14(1), 107-120. Retrieved from http://hdl.handle.net/10893/5497. [ Links ]
Chakraborty, K., & Joseph, D. (2015a). Cooking and pressing is an effective and eco-friendly technique for obtaining high quality oil from Sardinella longiceps. European Journal of Lipid Science and Technology, 117(6), 837-850. doi:10.1002/ejlt.201400539. [ Links ]
Chakraborty, K., & Joseph, D. (2015b). Production and characterization of refined oils obtained from Indian oil sardine (Sardinella longiceps). Journal of Agricultural and Food Chemistry, 63(3), 998-1009. doi:10.1021/jf505127e. [ Links ]
Chakraborty, K., Joseph, D., & Joseph, D. (2016). Changes in the quality of refined fish oil in an accelerated storage study. Journal of Aquatic Food Product Technology, 25(7), 1155-1170. doi:10.1080/10498850.2015.1036482. [ Links ]
Chakraborty, K., & Raj, R. P. (2007). Eicosapentaenoic acid enrichment from sardine oil by argentation chromatography. Journal of Agricultural and Food Chemistry, 55(18), 7586-7595. doi:10.1021/jf071407r. [ Links ]
Chakraborty, K., & Raj, R. P. (2009). Selective enrichment of n-3 polyunsaturated fatty acids with C18-C20 acyl chain length from sardine oil using Pseudomonas fluorescens MTCC 2421 lipase. Food Chemistry, 114(1), 142-150. doi:10.1016/j.foodchem.2008.09.029. [ Links ]
Chantachum, S., Benjakul, S., & Sriwirat, N. (2000). Separation and quality of fish oil from precooked and non-precooked tuna heads. Food Chemistry, 69(3), 289-294. doi:10.1016/S0308-8146(99)00266-6. [ Links ]
Čmolik, J., & Pokorný, J. (2000). Physical refining of edible oils. European Journal of Lipid Science and Technology, 102(7), 472-486. doi:10.1007/BF02636265. [ Links ]
Coronado, M., Vega y León, S., Gutiérrez, R., García, B., & Díaz, G. (2006). Los ácidos grasos omega-3 y omega-6: nutrición, bioquímica y salud. Revista de Educación Bioquímica, 25(3), 72-79. [ Links ]
Corrêa, A. P. A., Peixoto, C. A., Gonçalves, L. A. G., & Cabral, F. A. (2008). Fractionation of fish oil with supercritical carbon dioxide. Journal of Food Engineering, 88(3), 381-387. doi:10.1016/j.jfoodeng.2008.02.025. [ Links ]
Correa, C., Tejeda, A., Martín, A. R., García, H. S., & Noriega, J. A. (2017). Cinética de esterificación enzimática de ácidos grasos poliinsaturados N-3 a glicerol: mecanismo ping-pong multi-sustrato multi-producto. Revista Mexicana de Ingeniería Química, 10(1), 17-28. [ Links ]
Crexi, V. T., Legemann-Monte, M., Almeida de Souza, L., & De Almeida-Pinto, L. (2010). Production and refinement of oil from carp (Cyprinus carpio) viscera. Food Chemistry, 119(3), 945-950. doi:10.1016/j.foodchem.2009.07.050. [ Links ]
Cunha, D. C., Crexi, V. T., & De Almeida-Pinto, L. A. (2009). Winterization of fish oil with solvent. Food Science and Technology, 29(1), 207-213. [ Links ]
De Greyt, W. F. (2012). Current and future technologies for the sustainable and cost-efficient production of high quality food oils. European Journal of Lipid Science and Technology, 114(10), 1126-1139. doi:10.1002/ejlt.201200068. [ Links ]
De Morais-Coutinho, C., Chiu, M. C., Basso, R. C., Ribeiro, A. P. B., Gonçalves, L. A. G., & Viotto, L. A. (2009). State of art of the application of membrane technology to vegetable oils: a review. Food Research International, 42(5-6), 536-550. doi:10.1016/j.foodres.2009.02.010. [ Links ]
De Oliveira, D. A., Minozzo, M. G., Licodiedoff, S., & Waszczynskyj, N. (2016). Physicochemical and sensory characterization of refined and deodorized tuna (Thunnus albacares) by-product oil obtained by enzymatic hydrolysis. Food Chemistry, 207, 187-194. doi:10.1016/j.foodchem.2016.03.069. [ Links ]
Díaz, M. A., Bonilla, R., Hoyos, J. L., & Benítez, R. (2016). Evaluación de refinación de aceite extraído de ensilaje de subproductos de trucha arcoíris (Oncorhynchus mykiss). Agronomía Colombiana, 34(Suplemento), 351-354. [ Links ]
Dillon, J. T., Aponte, J. C., Tarozo, R., & Huang, Y. (2013). Purification of omega-3 polyunsaturated fatty acids from fish oil using silverthiolate chromatographic material and high performance liquid chromatography. Journal of Chromatography A, 1312, 18-25. doi:10.1016/j.chroma.2013.08.064. [ Links ]
Dos Santos, C. E., Da Silva, J., Zinani, F., Wander, P., & Gomes, L. P. (2015). Oil from the acid silage of Nile tilapia waste: physicochemical characteristics for its application as biofuel. Renewable Energy, 80, 331-337. doi:10.1016/j.renene.2015.02.028. [ Links ]
Dumay, J., Donnay, C., Barnathan, G., Jaouen, P., & Bergé, J. P. (2006). Improvement of lipid and phospholipid recoveries from sardine (Sardina pilchardus) viscera using industrial proteases. Process Biochemistry, 41(11), 2327-2332. doi: 10.1016/j.procbio.2006.04.005. [ Links ]
Espinosa, S., Díaz, M. S., & Brignole, E. A. (2002). Thermodynamic modeling and process optimization of supercritical fluid fractionation of fish oil fatty acid ethyl esters. Industrial and Engineering Chemistry Research, 41, 1516-1527. doi:10.1021/ie010470h. [ Links ]
Fagan, P., & Wijesundera, C. (2013). Rapid isolation of omega-3 long-chain polyunsaturated fatty acids using monolithic high performance liquid chromatography columns. Journal of Separation Science, 36(11), 1743-1752. doi:10.1002/jssc.201201156. [ Links ]
Ferdosh, S., Sarker, Z., Norulaini, N., Akanda, J., Ghafoor, K., & Kadir, O. (2014). Simultaneous extraction and fractionation of fish oil from tuna by-product using supercritical carbon dioxide (SC -CO2). Journal of Aquatic Food Product Technology, 25(2), 230-239. doi:10.1080/10498850.2013.843629. [ Links ]
Ferdosh, S., Sarker, Z., Norulaini, N., Oliveira, A., Yunus, K., Chowdury, A. J., … & Omar, M. (2014). Quality of tuna fish oils extracted from processing the by-products of three species of neritic tuna using supercritical carbon dioxide. Journal of Food Processing and Preservation, 39, 432-441. doi:10.1111/jfpp.12248. [ Links ]
Ferdosh, S., Sarker, M. Z. I., Rahman, N. N. N., Akand, M. J. H., Ghafoor, K., Awang, M. B., & Kadir, M. O. (2013). Supercritical carbon dioxide extraction of oil from Thunnus tonggol head by optimization of process parameters using response surface methodology. Korean Journal of Chemical Engineering, 30(7), 1466-1472. doi:10.1007/s11814-013-0070-3. [ Links ]
Ferraz de Arruda, L., Borghesi, R., & Oetterer, M. (2007). Use of fish waste as silage: a review. Brazilian Archives of Biology and Technology, 50(5), 879-886. [ Links ]
Fiori, L., Solana, M., Tosi, P., Manfrini, M., Strim, C., & Guella, G. (2012). Lipid profiles of oil from trout (Oncorhynchus mykiss) heads, spines and viscera: Trout by-products as a possible source of omega-3 lipids? Food Chemistry, 134(2), 1088-1095. doi:10.1016/j.foodchem.2012.03.022. [ Links ]
Gámez, N., Noriega, J. A., Medina, L. A., Ortega, J., Monroy, J., Toro, F. J., … & Angulo, O. (2003). Concentration of eicosapentaenoic acid and docosahexaenoic acid from fish oil by hydrolysis and urea complexation. Food Research International, 36(7), 721-727. doi:10.1016/S0963-9969(03)00052-8. [ Links ]
Gbogouri, G. A., Linder, M., Fanni, J., & Parmentier, M. (2006). Analysis of lipids extracted from salmon (Salmo salar) heads by commercial proteolytic enzymes. European Journal of Lipid Science and Technology, 108(9), 766-775. doi:10.1002/ejlt.200600081. [ Links ]
Gedi, M. A., Bakar, J., Mariod, A. A., Road, C., Arabia, A., & North, K. (2015). Optimization of supercritical carbon dioxide (CO2) extraction of sardine (Sardinella lemuru Bleeker) oil using response surface methodology (RSM). Grasas y Aceites, 66(2), 1-12. [ Links ]
Ghasemian, S., Sahari, M. A., Barzegar, M., & Ahmadi, H. (2016). Omega-3 polyunsaturated fatty acids concentration using synthesized polyvinylidene fluoride (PVDF) asymmetric membranes. Journal of the American Oil Chemists’ Society, 93(9), 1201-1210. doi:10.1007/s11746-016-2876-8. [ Links ]
Ghasemian, S., Sahari, M. A., Barzegar, M., & Gavlighi, H. A. (2015). Concentration of Omega-3 polyunsaturated fatty acids by polymeric membrane. International Journal of Food Science & Technology, 50(11), 2411-2418. doi:10.1111/ijfs.12907. [ Links ]
Gironi, F., & Maschietti, M. (2006). Separation of fish oils ethyl esters by means of supercritical carbon dioxide: Thermodynamic analysis and process modelling. Chemical Engineering Science, 61(15), 5114-5126. doi:10.1016/j.ces.2006.03.041. [ Links ]
Glowacz, A., Tynek, M., Malinowska, E., Martysiak, D., Pawlowicz, R., & Kolodziejska, I. (2016). Comparison of oil yield and quality obtained by different extraction procedures from salmon (Salmo salar) processing byproducts. European Journal of Lipid Science and Technology, 118(11), 1759-1767. doi:10.1002/ejlt.201500269. [ Links ]
Goosen, N. J., De Wet, L. F., & Görgens, J. F. (2014). The effects of protein hydrolysates on the immunity and growth of the abalone Haliotis midae. Aquaculture, 428, 243-248. doi:10.1016/j.aquaculture.2014.03.018. [ Links ]
Goosen, N. J., De Wet, L. F., Görgens, J. F., Jacobs, K., & De Bruyn, A. (2014). Fish silage oil from rainbow trout processing waste as alternative to conventional fish oil in formulated diets for Mozambique tilapia Oreochromis mossambicus. Animal Feed Science and Technology, 188, 74-84. doi:10.1016/j.anifeedsci.2013.10.019. [ Links ]
Guil-Guerrero, J. L., & Belarbi, E.-H. (2001). Purification process for cod liver oil polyunsaturated fatty acids. Journal of the American Oil Chemists’ Society, 78(5), 477-484. doi:10.1007/s11746-001-0289-9. [ Links ]
Hajeb, P., Selamat, J., Afsah-Hejri, L., Mahyudin, N. A., Shakibazadeh, S., & Sarker, M. Z. I. (2015). Effect of supercritical fluid extraction on the reduction of toxic elements in fish oil compared with other extraction methods. Journal of Food Protection, 78(1), 172-179. doi:10.4315/0362-028X.JFP-14-248. [ Links ]
Hao, S., Wei, Y., Li, L., Yang, X., Cen, J., Huang, H., … & Yuan, X. (2015). The effects of different extraction methods on composition and storage stability of sturgeon oil. Food Chemistry, 173, 274-282. doi:10.1016/j.foodchem.2014.09.154. [ Links ]
Haq, M., Ahmed, R., Cho, Y.-J., & Chun, B.- S. (2016). Quality properties and bio-potentiality of edible oils from atlantic salmon by-products extracted by supercritical carbon dioxide and conventional methods. Waste and Biomass Valorization, 8(6), 1953-1967. doi:10.1007/s12649-016-9710-2. [ Links ]
Homayooni, B., Sahari, M. A., & Barzegar, M. (2014). Concentrations of omega-3 fatty acids from rainbow sardine fish oil by various methods. International Food Research Journal, 21(2), 743-748. [ Links ]
Honold, P. J., Nouard, M., & Jacobsen, C. (2016). Fish oil extracted from fish-fillet by-products is weakly linked to the extraction temperatures but strongly linked to the omega-3 content of the raw material. European Journal of Lipid Science and Technology, 118(6), 874-884. doi:10.1002/ejlt.201500343. [ Links ]
Huang, J., & Sathivel, S. (2010). Purifying salmon oil using adsorption, neutralization, and a combined neutralization and adsorption process. Journal of Food Engineering, 96(1), 51-58. doi:10.1016/j.jfoodeng.2009.06.042. [ Links ]
Immanuel, G., Sathasivan, S., Shankar, V. S., Peter, M. J. P., & Palavesam, A. (2009). Processing and characterisation of low cost Balistid fish Sufflamen capistratus liver oil for edible purpose. Food Chemistry, 115(2), 430-435. doi:10.1016/j.foodchem.2008.12.023. [ Links ]
Kahveci, D., & Xu, X. (2011). Repeated hydrolysis process is effective for enrichment of omega 3 polyunsaturated fatty acids in salmon oil by Candida rugosa lipase. Food Chemistry, 129(4), 1552-1558. doi:10.1016/j.foodchem.2011.05.142. [ Links ]
Kołakowska, A., Domiszewski, Z., Kozłowski, D., & Gajowniczek, M. (2006). Effects of rainbow trout freshness on n-3 polyunsaturated fatty acids in fish offal. European Journal of Lipid Science and Technology, 108(9), 723-729. doi:10.1002/ejlt.200600054. [ Links ]
Kumar, P. K. P., & Krishna, A. G. G. (2015). Effect of different deacidification methods on phytonutrients retention in deacidified fractionated palm oil. Journal of the American Oil Chemists’ Society, 92(5), 645-658. doi:10.1007/s11746-015-2626-3. [ Links ]
Laplante, S., Souchet, N., & Bryl, P. (2009). Comparison of low-temperature processes for oil and coenzyme Q10 extraction from mackerel and herring. European Journal of Lipid Science and Technology, 111(2), 135-141. doi:10.1002/ejlt.200800133. [ Links ]
Lei, Q., Ba, S., Zhang, H., Wei, Y., Lee, J. Y., & Li, T. (2016). Enrichment of omega-3 fatty acids in cod liver oil via alternate solvent winterization and enzymatic intereste-rification. Food Chemistry, 199, 364-371. doi:10.1016/j.foodchem.2015.12.005. [ Links ]
Létisse, M., & Comeau, L. (2008). Enrichment of eicosa-pentaenoic acid and docosahexaenoic acid from sardine by-products by supercritical fluid fractionation. Journal of Separation Science, 31(8), 1374-1380. doi:10.1002/jssc.200700501. [ Links ]
Létisse, M., Rozières, M., Hiol, A., Sergent, M., & Comeau, L. (2006). Enrichment of EPA and DHA from sardine by supercritical fluid extraction without organic modifier. The Journal of Supercritical Fluids, 38(1), 27-36. doi:10.1016/j.supflu.2005.11.013. [ Links ]
Lin, T. J., Chen, S. W., & Chang, A. C. (2006). Enrichment of n-3 PUFA contents on triglycerides of fish oil by lipase-catalyzed trans-esterification under supercritical conditions. Biochemical Engineering Journal, 29(1-2), 27-34. doi:10.1016/j.bej.2005.02.035. [ Links ]
Linder, M., Fanni, J., & Parmentier, M. (2005). Proteolytic extraction of salmon oil and PUFA concentration by lipases. Marine Biotechnology, 7(1), 70-76. doi:10.1007/s10126-004-0149-2. [ Links ]
Linder, M., Matouba, E., Fanni, J., & Parmentier, M. (2002). Enrichment of salmon oil with n-3 PUFA by lipolysis, filtration and enzymatic re-esterification. European Journal of Lipid Science and Technology, 104(8), 455-462. doi:10.1002/1438-9312(200208)104:8<455::AID-EJLT455>3.0.CO;2-Q. [ Links ]
Liu, S., Zhang, C., Hong, P., & Ji, H. (2006). Concentration of docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) of tuna oil by urea complexation: Optimization of process parameters. Journal of Food Engineering, 73(3), 203-209. doi:10.1016/j.jfoodeng.2005.01.020. [ Links ]
Llanes, J., Toledo, J., Savón, L., & Gutiérrez, O. (2012). Composición y calidad de la fracción lipídica de los ensilajes de residuos de tilapias. Revista Cubana de Investigaciones Pesqueras, 29(1), 44-48. [ Links ]
Lopes, B. L. F., Sánchez-Camargo, A. P., Ferreira, A. L. K., Grimaldi, R., Paviani, L. C., & Cabral, F. A. (2012). Selectivity of supercritical carbon dioxide in the fractionation of fish oil with a lower content of EPA+DHA. The Journal of Supercritical Fluids, 61, 78-85. doi:10.1016/j.supflu.2011.09.015. [ Links ]
López-Martínez, J. C., Campra-Madrid, P., & Guil-Guerrero, J. L. (2004). γ-Linolenic acid enrichment from Borago officinalis and Echium fastuosum seed oils and fatty acids by low temperature crystallization. Journal of Bioscience and Bioengineering, 97(5), 294-298. doi:10.1016/S1389-1723(04)70208-X. [ Links ]
Maschietti, M., & Pedacchia, A. (2014). Supercritical carbon dioxide separation of fish oil ethyl esters by means of a continuous countercurrent process with an internal reflux. The Journal of Supercritical Fluids, 86, 76-84. doi:10.1016/j.supflu.2013.12.003. [ Links ]
Mbatia, B., Adlercreutz, D., Adlercreutz, P., Mahadhy, A., Mulaa, F., & Mattiasson, B. (2010). Enzymatic oil extraction and positional analysis of Omega 3 fatty acids in Nile perch and salmon heads. Process Biochemistry, 45(5), 815-819. doi:10.1016/j.procbio.2010.02.010. [ Links ]
Melgosa, R., Sanz, M. T., García, Á., Paz, E., Beltrán, S., & Lamas, D. L. (2017). Supercritical carbon dioxide as solvent in the lipase- catalyzed ethanolysis of fish oil: kinetic study. Journal of CO2 Utilization, 17, 170-179. doi:10.1016/j.jcou.2016.11.011. [ Links ]
Menegazzo, M. L., Petenuci, M. E., & Fonseca, G. G. (2014). Production and characterization of crude and refined oils obtained from the co -products of Nile tilapia and hybrid sorubim processing. Food Chemistry, 157, 100-104. doi:10.1016/j.foodchem.2014.01.121. [ Links ]
Miranda, K., Baeza, R., Noriega, J., García, H., & Otero, C. (2013). Optimization of structured diacylglycerols production containing ω-3 fatty acids via enzyme-catalysed glycerolysis of fish oil. European Food Research and Technology, 236(3), 435-440. [ Links ]
Misra, G., Nandi, S., & Nandi, S. (2013). Enzymatic deacidifi-cation of rice bran oil containing high free fatty acids with recycling. Chemical Science Review and Letters, 2(5), 376-381. [ Links ]
Moharana, T. R., Byreddy, A. R., Puri, M., Barrow, C., & Rao, N. M. (2016). Selective enrichment of omega-3 fatty acids in oils by phospholipase A1. PLoS ONE, 11(3), 1-14. doi:10.1371/journal.pone.0151370. [ Links ]
Morales, R., Muñío, M. M., Pérez, R., Guadix, A., & Guadix, E. M. (2013). Lipids from marine sources. En R. Pérez-Gálvez & J.-P. Berge (Ed.). Utilization of fish waste. Boca Raton, EE. UU.: CRC Press. [ Links ]
Motalebi-Moghanjoghi, A., Hashemi, G., Mizani, M., Gharachorloo, M., & Tavakoli, H. R. (2015). The effects of refining steps on Kilka (Clupeonella delicatula) fish oil quality. Iranian Journal of Fisheries Sciences, 14(2), 382-392. [ Links ]
Muñoz, A., Bucheli, J., Bonilla, R., & Hoyos, J. L. (2016). Evaluación de la tecnología de ensilaje como método de extracción de aceite de subproductos de trucha arcoíris (Oncorhynchus mykiss). Vitae, 23(1), 278-282. [ Links ]
Nguyen, T. M. H. (2013). Protein and lipid recovery from tuna head using industrial protease. Journal of Science and Development, 11(8), 1150-1158. [ Links ]
Noriega, J. A., Ortega, J., Angulo, O., García, H. S., Medina, L. A., & Gámez, N. (2009). Oil production from sardine (Sardinops sagax caerulea). CyTA. Journal of Food, 7(3), 173-179. doi:10.1080/19476330903010243. [ Links ]
Oliveira, A. C. M., & Miller, M. R. (2014). Purification of Alaskan walleye pollock (Gadus chalcogrammus) and New Zealand hoki (Macruronus novaezelandiae) liver oil using short path distillation. Nutrients, 6(5), 2059-2076. doi:10.3390/nu6052059. [ Links ]
Olli, J. J., Breivik, H., & Thorstad, O. (2013). Removal of persistent organic pollutants in fish oils using short-path distillation with a working fluid. Chemosphere, 92(3), 273-278. doi:10.1016/j.chemosphere.2013.02.037. [ Links ]
Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). (1986). The production of fish meal and oil. Roma, Italia: FAO. Retrieved from http://www.fao.org/docrep/003/x6899e/X6899E00.HTM. [ Links ]
Perretti, G., Motori, A., Bravi, E., Favati, F., Montanari, L., & Fantozzi, P. (2007). Supercritical carbon dioxide fractionation of fish oil fatty acid ethyl esters. The Journal of Supercritical Fluids, 40(3), 349-353. doi:10.1016/j.supflu.2006.07.020. [ Links ]
Pieck, C. A., Crampon, C., Charton, F., & Badens, E. (2016). A new model for the fractionation of fish oil FAEEs. The Journal of Supercritical Fluids, 120, 258-265. doi:10.1016/j.supflu.2016.05.02. [ Links ]
Pramparo, M., Prizzon, S., & Martinello, M. A. (2005). Estudio de la purificación de ácidos grasos, tocoferoles y esteroles a partir del destilado de desodorización. Grasas y Aceites, 56(3), 228-234. [ Links ]
Qi-Yuan, L., Jun-Qing, Q., & Xiao -Ge, W. (2016). Optimization of enzymatic fish oil extraction from mackerel viscera by response surface methodology. International Food Research Journal, 23(3), 992-997. [ Links ]
Rai, A. K., Swapna, H. C., Bhaskar, N., Halami, P. M., & Sachindra, N. M. (2010). Effect of fermentation ensilaging on recovery of oil from fresh water fish viscera. Enzyme and Microbial Technology, 46(1), 9-13. doi:10.1016/j.enzmictec.2009.09.007. [ Links ]
Ribeiro, V., Oliveira, A., Bechtel, P., & Prentice, C. (2013). Avaliação do processamento a baixas temperaturas do óleo de fígado de Alaska pollock (Theragra chalcogramma). Brazilian Journal of Food Technology, 16(2), 99-106. doi:10.1590/S1981-67232013005000013%0A. [ Links ]
Riha, V., & Brunner, G. (2000). Separation of fish oil ethyl esters with supercritical carbon dioxide. The Journal of Supercritical Fluids, 17(1), 55-64. doi:10.1016/S0896-8446(99)00038-8. [ Links ]
Rincón-Cervera, M. Á., Villarreal-Rubio, M. B., Valenzuela, R., & Valenzuela, A. (2017). Comparison of fatty acid profiles of dried and raw by-products from cultured and wild fishes. European Journal of Lipid Science and Technology, 119(9), 1-10. doi:10.1002/ejlt.201600516. [ Links ]
Rubio, N., Beltrán, S., Jaime, I., Diego, S. M., Sanz, M. T., & Carballido, J. R. (2010). Production of omega-3 polyunsaturated fatty acid concentrates: a review. Innovative Food Science and Emerging Technologies, 11(1), 1-12. doi:10.1016/j.ifset.2009.10.006. [ Links ]
Rubio, N., Diego, S. M., Beltrán, S., Jaime, I., Sanz, M. T., & Rovira, J. (2008). Supercritical fluid extraction of the omega-3 rich oil contained in hake (Merluccius capensis-Merluccius paradoxus) by-products: study of the influence of process parameters on the extraction yield and oil quality. The Journal of Supercritical Fluids, 47(2), 215-226. doi:10.1016/j.supflu.2008.07.007. [ Links ]
Rubio, N., Diego, S. M., Beltrán, S., Jaime, I., Sanz, M. T., & Rovira, J. (2012). Supercritical fluid extraction of fish oil from fish by-products: a comparison with other extraction methods. Journal of Food Engineering, 109(2), 238-248. doi:10.1016/j.jfoodeng.2011.10.011. [ Links ]
Sahena, F., Zaidul, I. S. M., Jinap, S., Jahurul, M. H. A., Khatib, A., & Norulaini, N. A. N. (2010). Extraction of fish oil from the skin of Indian mackerel using supercritical fluids. Journal of Food Engineering, 99(1), 63-69. doi:10.1016/j.jfoodeng.2010.01.038. [ Links ]
Sahena, F., Zaidul, I. S. M., Jinap, S., Saari, N., Jahurul, H. A., Abbas, K. A., & Norulaini, N. A. (2009). PUFAs in fish: extraction, fractionation, importance in health. Comprehensive Reviews in Food Science and Food Safety, 8(2), 59-74. doi:10.1111/j.1541-4337.2009.00069.x. [ Links ]
Sarker, M. Z. I., Selamat, J., Habib, A. S., Ferdosh, S., Akanda, M. J. H., & Jaffri, J. M. (2012). Optimization of supercritical CO2 extraction of fish oil from viscera of African catfish (Clarias gariepinus). International Journal of Molecular Sciences, 13(9), 11312-11322. doi:10.3390/ijms130911312. [ Links ]
Shamsudin, S., & Salimon, J. (2006). Physicochemical characteristics of aji-aji fish (Seriola nigrofasciata) lipids. Malaysia Journal of Analytical Sciences, 10(1), 55-58. [ Links ]
Shin, S. K., Sim, J. E., Kishimura, H., & Chun, B. S. (2012). Characteristics of menhaden oil ethanolysis by immobilized lipase in supercritical carbon dioxide. Journal of Industrial and Engineering Chemistry, 18(1), 546-550. doi:10.1016/j.jiec.2011.11.065. [ Links ]
Silva-Aguiar, G. P., & Soares-Goulart, G. A. (2013). Utilização de material residual da indústria de pescado para obtenção de óleo e farinha. Tecnologia & Ciência Agropecuária, 7(4), 55-60. doi:10.13140/2.1.4435.5844. [ Links ]
Slizyte, R., Dauksas, E., Falch, E., Storro, I., & Rustad, T. (2005). Yield and composition of different fractions obtained after enzymatic hydrolysis of cod (Gadus morhua) by-products. Process Biochemistry, 40(3-4), 1415-1424. doi:10.1016/j.procbio.2004.06.033. [ Links ]
Slizyte, R., Rustad, T., & Storro, I. (2005). Enzymatic hydrolysis of cod (Gadus morhua) by-products: optimization of yield and properties of lipid and protein fractions. Process Biochemistry, 40(12), 3680-3692. doi:10.1016/j.procbio.2005.04.007. [ Links ]
Solaesa, Á. G., Sanz, M. T., Falkeborg, M., Beltrán, S., & Guo, Z. (2016). Production and concentration of monoacylglycerols rich in omega-3 polyunsaturated fatty acids by enzymatic glycerolysis and molecular distillation. Food Chemistry, 190, 960-967. doi:10.1016/j.foodchem.2015.06.061. [ Links ]
Suriani, N. W., Lawalata, H. J., & Komansilan, A. (2014). Urea crystallization on the concentrate making of omega-3 fatty acid from oil of tuna fish (Thunnus sp.) canning byproduct. International Journal of PharmTech Research, 6(7), 1981-1990. [ Links ]
Tanbirul-Haque, A. S., & Chun, B.-S. (2015). Particle formation and characterization of mackerel reaction oil by gas saturated solution process. Journal of Food Science and Technology, 53(1), 293-303. doi:10.1007/s13197-015-2000-3. [ Links ]
Taylor, L. T. (2009). Supercritical fluid chromatography for the 21st century. The Journal of Supercritical Fluids, 47(3), 566-573. doi:10.1016/j.supflu.2008.09.012. [ Links ]
Tengku‐Rozaina, M., & Birch, E. J. (2013). Enrichment of omega-3 fatty acids of refined hoki oil. Journal of the American Oil Chemists’ Society, 90(8), 1111-1119. doi:10.1007/s11746-013-2260-x. [ Links ]
Turchini, G. M., Gunasekera, R. M., & De Silva, S. S. (2003). Effect of crude oil extracts from trout offal as a replacement for fish oil in the diets of the Australian native fish Murray cod Maccullochella peelii peelii. Aquaculture Research, 34(9), 697-708. doi:10.1046/j.1365-2109.2003.00870.x. [ Links ]
Vaisali, C., Charanyaa, S., Belur, P. D., & Regupathi, I. (2015). Refining of edible oils: a critical appraisal of current and potential technologies. International Journal of Food Science & Technology, 50(1), 13-23. doi:10.1111/ijfs.12657. [ Links ]
Valenzuela, A., Sanhueza, J., & De la Barra, F. (2012). El aceite de pescado: ayer un desecho industrial, hoy un producto de alto valor nutricional. Revista Chilena de Nutrición, 39(2), 201-209. [ Links ]
Valverde, L. M., Moreno, P. A. G., Cerdán, L. E., López, E. N., López, B. C., & Medina, A. R. (2014). Concentration of docosahexaenoic and eicosapentaenoic acids by enzymatic alcoholysis with different acylacceptors. Biochemical Engineering Journal, 91, 163-173. doi:10.1016/j.bej.2014.08.010. [ Links ]
Vázquez, J. A., Nogueira, M., Durán, A., Prieto, M. A., Rodríguez-Amado, I., Rial, D., ... & Murado, M. A. (2011). Preparation of marine silage of swordfish, ray and shark visceral waste by lactic acid bacteria. Journal of Food Engineering, 103(4), 442-448. doi:10.1016/j.jfoodeng.2010.11.014. [ Links ]
Vázquez, L., & Akoh, C. C. (2012). Enrichment of stearidonic acid in modified soybean oil by low temperature crystallisation. Food Chemistry, 130(1), 147-155. doi:10.1016/j.foodchem.2011.07.022. [ Links ]
Vidotti, R. M., Pacheco, M. T. B., & Gonçalves, G. S. (2011). Characterization of the oils present in acid and fermented silages produced from tilapia filleting residue. Revista Brasileira de Zootecnia, 40(2), 240-244. doi:10.1590/S1516-35982011000200002. [ Links ]
Wang, W., Li, T., Ning, Z., Wang, Y., Yang, B., Ma, Y., & Yang, X. (2012). A process for the synthesis of PUFA-enriched triglycerides from high-acid crude fish oil. Journal of Food Engineering, 109(3), 366-371. doi:10.1016/j.jfoodeng.2011.11.020. [ Links ]
Wu, T. H., & Bechtel, P. J. (2008). Salmon by-product storage and oil extraction. Food Chemistry, 111(4), 868-871. doi:10.1016/j.foodchem.2008.04.064. [ Links ]
Editor temático: Miguel Ángel Rincón Cervera (Instituto de Nutrición y Tecnología de los Alimentos [INTA])
Recibido: 05 de Julio de 2017; Aprobado: 15 de Marzo de 2018











 text in
text in