Introducción
La babesiosis es una enfermedad transmitida por garrapatas, cuyo agente causal son hemoparásitos intracelulares del filum Apicomplexa, orden Piroplasmorida, familia Babesiidae y genero Babesia (Montes-Farah, De la Vega-del Risco, Bello-Espinosa, & Fortich-Salvador, 2012). Dentro de este género, las especies más importantes asociadas a la infección del ganado bovino son Babesia bovis y B. bigemina (Mosqueda, Olvera-Ramírez, Aguilar- Tipacamu, & Canto, 2012), y su transmisión se lleva a cabo de forma natural por la picadura de la especie de garrapata Rhipicephalus (Boophilus) microplus (Canestrini, 1888) (Ixodida: Ixodidae), que tiene un desarrollo relacionado con las condiciones climáticas y ecológicas características de las zonas tropicales y subtropicales (Mosqueda et al., 2012), en donde son abundantes y parasitan a animales domésticos; por lo tanto, la presencia del parasito y su vector dificultan la erradicación de la enfermedad (Polanco & Ríos, 2016).
La babesiosis es considerada una zoonosis emergente, que afecta a animales domésticos y salvajes (Becker, 2011). Los brotes de la enfermedad en el ganado ocasionan hemoglobinuria, fiebre, ictericia, anemia, pérdida de peso, deshidratación, temblor muscular y debilidad (Benavides & Sacco, 2007; Ríos, Zapata, Reyes, Mejía, & Baena, 2010).
Además de la disminución en la producción de leche y carne, también se presenta reducción en la tasa reproductiva por alteración en la calidad del semen en machos, así como abortos en hembras y, finalmente, la muerte del individuo (Ríos et al., 2010), lo que provoca un incremento en los costos de manejo del sistema de explotación bovino, debido a los tratamientos farmacológicos, la atención veterinaria y el control sobre el vector del hemoparásito (Polanco & Ríos, 2016).
En Colombia, la industria ganadera es la principal modalidad de producción pecuaria con gran importancia en la economía nacional. Este recurso económico se ve afectado por las infecciones hemoparasitarias, como la babesiosis bovina, que registra una incidencia de dos casos por cada 100 bovinos en el país, según el Boletín de Sanidad Animal del Instituto Colombiano Agropecuario (ica) para el 2014 (Diaz-Martínez et al., 2017), cuya transmisión se determina por la relación vectorparasito- hospedero, que además está condicionada por los factores bióticos y abióticos del ambiente (Ríos et al., 2010).
En el país, el primer reporte de la enfermedad fue descrito por Lleras en 1908, quien catalogo el agente etiológico como Piroplasma bigeminum (actualmente conocido como Babesia bigemina), por observación al microscopio de eritrocitos de bovinos infectados (Mosqueda et al., 2012), y más tarde reconocida como una enfermedad ampliamente distribuida (Lleras, 1908). Colombia posee las características geoclimaticas para que se manifieste la babesiosis en bovinos, por infestación masiva de garrapatas distribuidas en la mayoría de las zonas geográficas del país, registradas inicialmente por debajo de los 2.100 m s. n. m. Si bien se han reportado a alturas superiores a 2.800 m n. s. m., no se ha demostrado si el vector se reproduce en esas condiciones (Benavides, Polanco, Vizcaino, & Betancur, 2012).
Los actuales registros publicados en el país indican la presencia de las especies Babesia bovis y B. bigemina en varias regiones: en el Bajo Cauca (Antioquia) y Alto San Jorge (Córdoba), la prevalencia de parásitos Babesia sp. es de 3,1% (Herrera et al., 2008); en Puerto Berrio (Antioquia), la serorreactividad frente a anticuerpos tipo IgG específicos contra B. bovis y B. bigemina fue del 65% en bovinos entre tres y nueve meses de edad (Ríos et al., 2010); en el municipio Gómez Plata (Antioquia), la seroprevalencia encontrada en bovinos fue de 89,8% para al menos una especie de Babesia spp. (Zapata et al., 2011); en Córdoba, la seroprevalencia de Babesia spp. en bovinos raza Gyr puros fue de 3,05% (Blanco-Martínez, Cardona-Álvarez, & Vargas-Viloria, 2015).
No obstante, los datos se restringen en su mayoría a los departamentos de Antioquia y Córdoba, mientras que el departamento de Sucre es un área sin registro, control o estudios publicados de hemoparásitos del género Babesia que afecten a bovinos. Sin embargo, en 2014, un estudio realizado en Ovejas (Sucre) encontró una frecuencia de infección del 17,34% para B. bigemina en bovinos (Barboza, 2018); además, esta enfermedad no se encuentra dentro de las zoonosis vigiladas por el ica (Osorio et al., 2013). A partir de lo anterior, y teniendo en cuenta que la costa norte colombiana reúne las condiciones que contribuyen al mantenimiento del ciclo biológico de muchas enfermedades transmitidas por estos artrópodos (Buelvas, Alvis, Buelvas, Miranda, & Mattar, 2008) —como la babesiosis—, el objetivo de esta investigación fue la detección mediante PCR dúplex de especies de Babesia spp. que estén presentes en bovinos, en el municipio Los Palmitos (Sucre).
Materiales y métodos
Área de estudio
El municipio Los Palmitos está ubicado a 185 m s. n. m., a 09°22'52'' latitud norte y 75°16'17'' longitud oeste, con una extensión geográfica de 211 km2. Este municipio presenta una temperatura media anual de 25,5 °C y una precipitación media anual de 1.319 mm (Instituto Geográfico Agustín Codazzi-Seccional Sucre [igac], 1996). El inventario bovino de Los Palmitos, según el Instituto Colombiano Agropecuario (ica, 2016), fue de 18.041, a partir del cual se evaluó un numero de muestra de 218 bovinos. El tamaño de la población se estimó mediante el programa Epi- Info versión 7.2.0.1, con un nivel de confianza de 95%; de error de 0,05% y de prevalencia de 17,34%.
Este último valor se obtuvo a partir de un estudio realizado sobre babesiosis bovina en el municipio de Ovejas, del mismo departamento (Barbosa, 2018).
Aspectos éticos
Para este estudio, se muestrearon bovinos de todas las edades, con previa firma de un consentimiento informado por los dueños o encargados de los predios, en cuyo formato se explican los fines, beneficios, objetivos del estudio y potenciales riesgos de acuerdo con lo establecido en la Resolución 8430 de 1993 del Ministerio de Salud de Colombia (1993).
Recolección y almacenamiento de muestras
Las muestras sanguíneas fueron extraídas por punción en la vena yugular, utilizando una jeringa de 5 mL, y se recolectaron en un tubo Vacutainer* con anticoagulante ácido etilendiaminotetraacetico (edta); además, se mezclaron por inversión con el anticoagulante, para posteriormente llevarlas al laboratorio de Investigaciones Biomédicas de la Universidad de Sucre y almacenarlas en frio hasta su análisis, tal y como lo sugieren Benavides et al. (2012).
Identificación microscópica
La observación de los hemoparásitos se realizó mediante extendidos de sangre; para ello, se depositó una gota de esta en un portaobjeto y se realizó el extendido con otro, formando un ángulo de 45o y dejando secar durante 3 min a temperatura ambiente. Posteriormente, se agregó metanol para fijar el frotis y se dejó secar durante 4 min; luego, se agregó el colorante de Giemsa y se dejó secar por 10 min más. Después, se lavó el portaobjetos para eliminar el exceso de colorante y se secó a temperatura ambiente. Finalmente, se observaron los parásitos al microscopio, con objetivo 100X en aceite de inmersión, según lo propuesto por Herrera et al. (2008) y Mosqueda et al. (2012).
Extracción de ADN
A partir de sangre periférica, se realizó la extracción de ADN, siguiendo el protocolo de altas concentraciones de sales (Miller, Dykes, & Polesky, 1988), con las siguientes modificaciones. Inicialmente, se transfirieron 200 μL de sangre a un tubo Eppendorf R y se centrifugo a 12.000 rpm durante 5 min, se descartó el sobrenadante y, al precipitado obtenido, se le adicionaron 500 μL de solución de lisis tes (Tris- HCl: 10 mM pH 8,0; edta: 1 mM pH 8,0, y sds: 0,1%); luego, se agito vigorosamente y se agregaron 3 μL de proteinasa K para la digestión a 55 °C durante 1 hora. Se inactivo la proteinasa a 95 °C por 1 min, para nuevamente centrifugarse a 12.000 rpm; el sobrenadante fue transferido a un nuevo vial, al que se le adicionaron 300 μL de acetato de potasio (5 M). El precipitado obtenido se lavó con 400 μL de etanol al 70% y, finalmente, el ADN se resuspendio en 30 μL de solución amortiguadora te (Tris-HCl: 10 mM, y edta: 0,1 mM).
PCR Dúplex
La mezcla de reacción se hizo en un volumen por muestra de 25 μL que incluía búfer Taq (1X), MgCl2 (1,5 mM), dNTP Mix (0,2 mM), cebadores (10 pmol) (tabla 1) y DNA Taq Polymerase (1U/ μL). El perfil térmico de amplificación inicio con una denaturacion a 90 °C durante 3 min, seguido de 35 ciclos de denaturacion a 95 °C por 30 s, el alineamiento a 60 °C por 30 s y extensión a 72 °C durante 30 s. Además, se hizo una extensión final a 72 °C por 5 min. Para terminar, los productos de conservaron a 4 °C, modificando lo propuesto por Smeenk et al. (2000).
Visualización de los productos de PCR
A partir de los productos obtenidos, se tomó una alícuota de 5 μL y se realizó una electroforesis en gel de agarosa al 1,5%, en el que se visualizaron los fragmentos de ADN en un transiluminador de luz uv (Smeenk et al., 2000).
Purificación y secuenciación de los productos de PCR
Posteriormente, se seleccionaron los amplimeros que resultaron positivos en la PCR; se cuantifico la cantidad de ADN y se purificaron con el PureLink Gel Quick Extraction Kit, siguiendo las indicaciones del fabricante. Después, los productos fueron transferidos en viales de 1,5 mL y se enviaron a secuenciar. La determinación de la secuencia nucleotídica de los productos amplificados se realizó en un secuenciador automático de electroforesis capilar abi 3730xl DNA analyzer), basado en el método de terminación de cadena con dideoxinucleotidos marcados con diferentes grupos fluorescentes (Sanger, Nicklen, & Coulson, 1977), en cuyo proceso se utilizaron los cebadores descritos en la tabla 1 (servicio contratado en la compañía Macrogen).
Análisis filogenético
Los electroforegramas resultantes fueron editados con el programa MEGAR, versión 6.0 (Tamura, Stecher, Peterson, Filipski, & Kumar, 2013).
Luego, las secuencias adquiridas se compararon con las secuencias registradas en la base de datos GenBank, mediante la herramienta Basic Local Alignment Search Tool (blast),1 para corroborar la especie del género Babesia que parasita a los bovinos infectados.
Análisis estadístico
Se hizo un análisis univariado y bivariado de los datos registrados en la encuesta, tales como predio de procedencia, raza, edad y sexo. Estos fueron contrastados con los resultados de observación microscópica y PCR. Para ello, se empleó una prueba exacta de Fisher (tabla 2), con el fin de determinar la relación entre las variables y los resultados de los análisis. La prueba estadística se realizó con el software R, versión 2.9.1.
Resultados
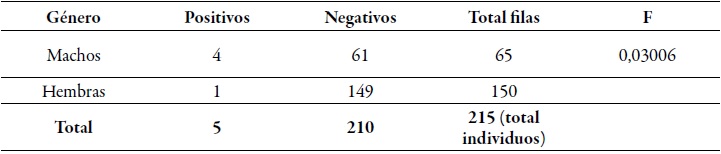
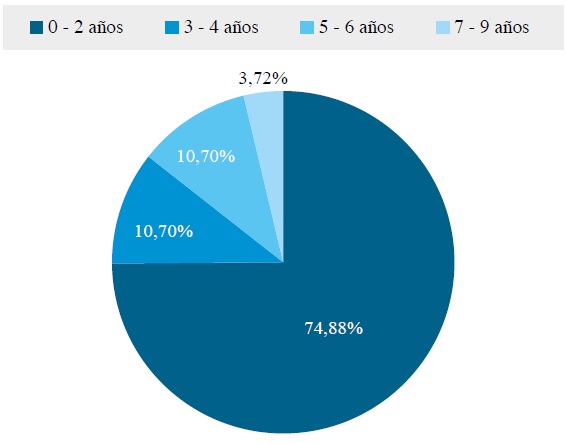
De la muestra de 218 bovinos, se analizaron en total 215 individuos, de los cuales 69,77% fueron hembras (150) y 30,23%, machos (65), distribuidos según la edad en rangos entre 0 y 2 años (161 bovinos, 74,88%); entre 3 y 4 años (23 bovinos, 10,70%); entre 5 y 6 años (23 bovinos, 10,70%), y entre 7 y 9 años (8 bovinos, 3,72%) (figura 1). En relación con la raza, todos los bovinos estudiados pertenecen a la raza Cebú. Las muestras positivas obtenidas (5/215) para Babesia bigemina se encuentran en un mismo predio de los 12 encuestados durante la fase de campo, que además son animales asintomáticos portadores del parasito.
Fuente: Elaboración propia
Figura 1. Distribución porcentual de los diferentes grupos de edades de los bovinos involucrados en el estudio.
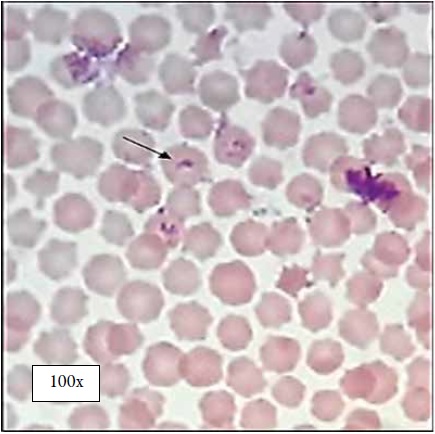
En la observación directa, se consideraron como positivas las muestras que permitieron evaluar formas parasitarias intracelulares morfológicamente compatibles con Babesia spp. La visualización de los extendidos se realizó en forma de laberinto, observando entre 100 y 200 campos en los frotis sanguíneos, cuyo resultado indico que el 1,4% (3/215) de los bovinos contenían parásitos en sus glóbulos rojos, que correspondían además a individuos machos menores a dos años (figura 2).
Fuente: Resultados del trabajo (Foto tomada con cámara microscopio Leica)
Figura 2. Observación microscópica de Babesia bigemina en frotis sanguíneo de bovinos. La flecha indica el merozoito de B. bigemina observado a través de microscopia óptica con objetivo 100x.
Al utilizar la técnica de PCR dúplex, en la determinación molecular de Babesia en bovinos, se encontró que cinco muestras fueron positivas para la especie B. bigemina, que corresponde al fragmento amplificado de 278 bp (figura 3), que corresponden al 2,32% del total de bovinos estudiados. Las muestras coinciden, además, con las tres encontradas en frotis sanguíneo. En ningún animal hubo amplificación de ADN para B. bovis.

Fuente: Resultados del trabajo (tomada con cámara fotodocumentador Vilber Quantum AT4)
Figura 3. PCR de las muestras positivas para Babesia bigemina. Los numerales 11b, 12b, 13b, 14b y 42b corresponden a las muestras positivas por PCR; C+b es el control positivo; C-b es el control negativo; mpm es el marcador de peso molecular.
La prueba estadística F reflejada en la tabla 2 indica que existe una diferencia significativa en el genero de los bovinos positivos detectados por PCR: los bovinos del grupo etario entre 0 y 2 años (2,48% de los 161 individuos muestreados con esa edad) son los más susceptibles a infectarse con el protozoo B. bigemina, siendo estos cuatro individuos machos. Solo un bovino del grupo etario entre 3 y 4 años (4,34% del total de 23 muestreados) fue positivo por la técnica de PCR para la especie de B. bigemina, siendo el único animal hembra infectado. Además, concuerdan con los tres resultados positivos por búsqueda directa en frotis sanguíneo.
Discusión
En los 12 predios ganaderos estudiados, se encontró que la babesiosis es ocasionada por el hemoparásito B. bigemina, identificada por PCR dúplex en cinco bovinos infectados, que se localizan en un mismo predio. Allí, llevan a cabo tratamientos garrapaticidas y eliminación manual de artrópodos.
Sin embargo, en los bovinos infectados no se encontraron garrapatas. En la zona, las medidas de control de la garrapata vector es la aplicación de garrapaticidas u otras sustancias como veneno u extractos naturales cada cuatro meses, además de la eliminación manual de los artrópodos durante el proceso de ordeno en las mañanas.
Esto interrumpe el ciclo de transmisión de Babesia spp. (Mtshali & Mtshali, 2013), puesto que las garrapatas hembras pueden infectarse al final de la fase aguada de la infección, cuando hay una parasitemia manifiesta en el hospedero bovino; sin embargo, esta parasitemia es poco frecuente y el tiempo de infestación es limitado. Por lo tanto, solo un numero pequeño de artrópodos contrae el parasito (Ríos et al., 2010). Con esto, la alta frecuencia de tratamientos garrapaticidas genera un menor grado de infección de R. microplus y la baja frecuencia de tratamiento se traduce en mayor grado de infección por las garrapatas (Ríos et al., 2010).
La identificación microscópica de Babesia bigemina en frotis sanguíneo proporciono como resultado tres bovinos infectados con el parasito; no obstante, este método requiere personal entrenado para identificar las especies de Babesia que infectan los eritrocitos (Benavides et al., 2012; Homer, Aguilar-Delfín, Telford, Krause, & Persing, 2000), puesto que su diferencia morfológica radica en el tamaño, en el que B. bigemina es más grande que B. bovis (Benavides et al., 2012; Smeenk et al., 2000). Si bien la detección microscópica es la técnica de referencia en la identificación de babesiosis (Homer et al., 2000), especialmente durante el estadio agudo de la enfermedad —en el que el número de parásitos intraeritrociticos aumenta de tal manera que pueden ser detectados microscópicamente (Mosqueda et al., 2012)—, esta técnica es poco útil en animales crónicamente infectados, en los que la enfermedad se produce de forma subclínica o asintomática. Por tal motivo, es necesario recurrir a métodos moleculares, como la PCR para la detección de ácidos nucleicos, debido a su alta sensibilidad y especificidad para identificar las especies de Babesia en hospederos y vectores (Mosqueda et al., 2012; Mtshali & Mtshali, 2013).
Por esta técnica se obtuvo que B. bigemina es el hemoparásito que puede causar la babesiosis en Los Palmitos, encontrada en 5 de los 215 bovinos analizados en este estudio.
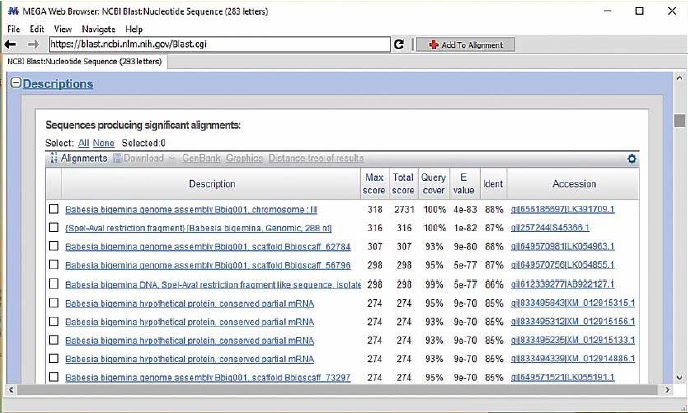
Además, al amplificar un fragmento de 278 pb (figura 3) correspondiente al gen gp45, especifico de B. bigemina (glicoproteína de superficie de merozoito con 45 kD) (Figueroa et al., 1993; Mtshali & Mtshali, 2013), se determinó que la especie coincide con las registradas en la base de datos de GenBank (figura 4), y corresponde también a la encontrada en un trabajo no publicado del municipio de Ovejas (Sucre). Asimismo, corresponde con las publicaciones recientes que registran la presencia de las especies Babesia spp., B. bovis y B. bigemina como los agentes etiológicos de la babesiosis bovina en la región del Bajo Cauca y alto San Jorge (Herrera et al., 2008); en Puerto Berrio (Antioquia) (Ríos et al., 2010); en el municipio Gómez Plata (Antioquia) (Zapata et al., 2011); en el Magdalena medio (López, Florez, Munera, Ríos, & Ríos, 2012), y en Córdoba (Blanco et al., 2015).
Fuente: Base de datos GeneBank (http://blast.ncbi.nlm.nih.gov/Blast.cgi.).
Figura 4. Comparación de las secuencias nucleotídicas amplificadas con las registradas en la base de datos de GenBank con la herramienta blast.
En Los Palmitos (Sucre), la frecuencia de infección encontrada fue de 2,32% (5/215), considerada baja en relación con el estudio realizado en Ovejas del mismo departamento (17,34%) y en Córdoba, en donde la frecuencia de Babesia spp. fue de 3,05% en bovinos Gyr puros (Blanco et al., 2015). Los bovinos estudiados fueron asintomáticos, lo que indica que, aun cuando son positivos a Babesia, el daño globular por parte del protozoo es mínimo. Esto evidencia que en estos animales no hay indicios de anemia (Blanco et al., 2015), debido al uso de garrapaticidas que interrumpen el ciclo de transmisión de Babesia spp. y que disminuye así el número de bovinos infectados en la zona.
Además, el hemoparásito se presenta en su mayoría en bovinos entre 0 y 2 años (4/5), que son menos susceptibles a los efectos clínicos de la enfermedad que los bovinos adultos (1/5) (Benavides et al., 2012; Benavides & Sacco, 2007). Los individuos infectados con el parasito a edad temprana adquieren inmunidad pasiva, que perdura hasta la edad de 9 meses, suministrada por la madre a través del calostro (Blanco et al., 2015; Ríos et al., 2010), aunque puede persistir por cuatro años más (Bock, Jackson, De Vos, & Jorgensen, 2004), lo que hace que sean asintomáticos.
A partir de lo anterior, el individuo desarrolla una inmunidad adquirida que está condicionada con la inoculación de parásitos por parte del vector, lo que permite que se mantenga dicha inmunidad adquirida en los hospederos y, por ende, la ausencia de signos o síntomas clínicos que ocasiona la enfermedad (Ríos et al., 2010); de igual forma, en una región endémica para el vector y el hemoparásito, como lo es la costa norte colombiana, la infección puede pasar desapercibida cuando ocurre en edad temprana, situación que se conoce como “estabilidad enzootica” (Benavides et al., 2012; Ríos et al., 2010). En conjunto, estos mecanismos contribuyen con el control natural de la babesiosis.
Conclusiones
En Los Palmitos (Sucre), los bovinos menores de dos años son portadores de Babesia bigemina, detectada por PCR dúplex. La ausencia de síntomas clínicos en los bovinos infectados puede deberse a que actúan como reservorio del microorganismo, que espera las condiciones fisiológicas óptimas para causar la patología o la trasmisión por parte del vector a otros bovinos.











 texto em
texto em