Introducción
El acaro rojo de las aves o “piojillo de los gallineros” Dermanyssus gallinae (De Geer, 1778) pertenece a la clase Arachnida (De Geer, 1778), familia Dermanyssidae, y es la especie más abundante dentro de este grupo (Walter & Proctor, 2013). Este es el ectoparásito hematófago que más daño causa en los sistemas de producción aviar (Rodríguez- Vivas & Cob-Galera, 2005), especialmente en explotaciones de cría de gallinas ponedoras, en las que la producción de huevos puede caer hasta en un 25 %, disminuyendo su calidad y causando pérdida de peso, anemia y mortalidad en las aves (Green, Sparling, & Sperling, 2007), además de encontrarse con frecuencia en todo el mundo (Kim, Na, Yi, Kim, & Ahn, 2007).
Para su control se hace uso de acaricidas sintéticos, pero existen poblaciones que han desarrollado resistencia a plaguicidas como carbamatos y piretroides (George et al., 2015), incrementando la problemática (George, Callaghan, Guy, & Sparagano, 2008). Para su control, se han evaluado aceites esenciales de cilantro (Coriandrum sativum), lavanda (Lavandula angustifolia), tomillo (Thymus vulgaris), manuka (Leptospermum scoparium), poleo (Mentha pulegium), albahaca dulce (Ocimum basilicum), menta (Mentha spicata), ajedrea de jardin (Satureja hortensis), canela (Cinnamomum zeylanicum) y eucalipto (Eucalyptus globulus), con resultados tóxicos sobre D. gallinae a través de ensayos de contacto (Kim, Yi, Tak, & Ahn, 2004; Kim et al., 2007; George, Smith, Shiel, Sparagano, & Guy, 2009; Magdaş, Cernea, Baciu, & Şuteu, 2010; Nechita, Poirel, Cozma, & Zenner, 2015). Igualmente, se han estudiado hongos entomopatógenos como Beauveria bassiana y Metharhizium anisopliae con altos porcentajes de mortalidad (Steenber & Kilpinen, 2003; Tavassoli, Ownag, Porseyed, & Mardani, 2008). Sin embargo, se deben evaluar otras alternativas, debido a que no se ha podido determinar la solución de control final.
Los plaguicidas a base de productos naturales se muestran como una alternativa para mitigar el ataque de ácaros tanto hematófagos como fitófagos. Tal es el caso de los aceites esenciales (ae), cuyo uso es viable gracias a su baja toxicidad para mamíferos y a que son biodegradables (Toloza, Zygadlo, Biurrun, Rotman, & Picollo, 2010). Los ae con propiedades insecticidas se han comercializado con éxito en aplicaciones agrícolas específicas y cumplen los criterios de riesgo mínimo como pesticidas (United States Environmental Protection Agency [us epa], 2004). De acuerdo con Toloza (2010), los insecticidas naturales como los ae son una opción viable y deben tenerse en cuenta para el desarrollo de nuevos productos amigables con el medio ambiente.
Por su parte, el cilantro (Coriandrum sativum L.) es una planta herbácea anual, que pertenece a la familia Apiaceae (Mahendra & Bisht, 2011) y contiene ae en hojas, tallos, flores, frutos, semillas, raíces y cortezas (Mandal & Mandal, 2015). El rendimiento del ae de C. sativum y su composición química sufren cambios durante la ontogénesis (Bhuiyan, Begum, & Sultana 2009), cuyo mayor constituyente es el linalool; además, contiene limoneno, α-pineno, canfeno, acetato de geranilo, acetato de linalilo, geraniol, terpin- 4-ol, α-terpineol, c-terpinterpinene, mirceno y alcanfor (Zeb, 2016). Estos compuestos tienen un amplio espectro de actividades biológicas, incluyendo sus funciones insecticidas (Pavela & Vrchotova, 2013) y acaricida (Song, Yang, Suh, & Lee, 2011). La actividad de los ae depende de su composición, que es afectada por factores como la estructura genética, el clima y las prácticas agrícolas (Telci, Toncer, & Sahbaz, 2006).
El objetivo de esta investigación fue evaluar la actividad acaricida del ae de cilantro (C. sativum) contra el acaro rojo de aves (D. gallinae), bajo condiciones controladas de laboratorio.
Materiales y métodos
Cría del ácaro Dermanyssus gallinae
Se recogieron colonias de ácaros D. gallinae bajo las plumas y pecho de aves Gallus gallus (L., 1758) (Aves: Galliformes: Phasianidae), y de hendiduras de los gallineros en una producción traspatio de la Finca Samaria en Duitama (Boyacá, Colombia).
Los ejemplares de D. gallinae se transfirieron inmediatamente a recipientes de polietileno (4,8 cm × 8,4 cm) y se taparon. Los ácaros fueron transportados al laboratorio de Sanidad Vegetal de la Fundación Universitaria Juan de Castellanos de la ciudad de Tunja (Boyacá, Colombia). En el laboratorio, los ácaros se colocaron en una caja de Petri, sobre papel filtro y un trozo de algodón húmedo, y se sellaron con Parafilm*; se mantuvieron a una temperatura de entre 20 ±} 9 °C y humedad relativa de 60-90 %, con ciclos de 16:8 horas luz-oscuridad. Las pruebas se llevaron a cabo dentro de los 2 días después de la recogida de los ácaros. Estos ejemplares no fueron alimentados pues pueden sobrevivir hasta ocho meses lejos de las aves de corral sin alimentarse y además resisten la desecación (Chauve, 1998).
Bioensayos
Para este tipo de prueba se siguieron parámetros de metodologías ya establecidas y estandarizadas con algunas modificaciones a las condiciones del laboratorio, como lo son las de Kim et al. (2004) y George et al. (2009).
El ae de cilantro fue adquirido en Bioryz Biovegetal (Bogotá, Colombia). Con el fin de evaluar su actividad acaricida, se realizaron bioensayos de contacto con papel filtro sobre adultos de D. gallinae. Para ello, se aplicaron concentraciones de 1,0, 2,0 y 3,0 mg/cm2 de ae de C. sativum sobre papel filtro (Whatman No. 2, 4,25 cm de diámetro) en 50 μl de etanol al 70 %. El tratamiento de control se llevó a cabo con 50 μl de etanol y se utilizó el acaricida comercial (Neguvon*) como un estándar, cuyo ingrediente activo es triclorfon, con el fin de comparar los ensayos de toxicidad. El papel filtro se secó en una campana extractora durante 2 minutos; posteriormente, este se dispuso en la parte inferior de una caja de Petri (4,8 cm de diámetro × 1,2 cm). Se ubicaron 10 ácaros adultos en cada caja y un trozo de algodón (5 mm × 5 mm) impregnado con 100 μl de agua destilada. A continuación, cada caja de Petri se cubrió con la tapa y se selló con Parafilm*. Cada tratamiento fue repetido seis veces.
Finalmente, se determinó la mortalidad cada 5 min después de la exposición a los tratamientos, para lo cual se usó un estereomicroscopio Motic* SMZ-168. Los adultos fueron considerados muertos si sus apéndices no se movían cuando se pinchaban con un alfiler fino. Veinticuatro horas después se hicieron pruebas de residualidad.
Análisis estadístico
El porcentaje de mortalidad se determinó con la fórmula de Henderson y Tilton (1995), mientras que la actividad letal se clasifico según Kim et al. (2007): fuerte mortalidad, > 80 %; moderada, 80- 61 %; débil, 60-40 %; poca o ninguna actividad, < 40 %. Se determino el análisis de varianza (anova) y se realizó un análisis no paramétrico, utilizando la prueba de Shapiro-Wilk (n < 30). Además, se analizaron las diferencias significas a través de la prueba de Kruskal-Wallis y, con la prueba de Tukey, se evaluaron diferencias significativas entre los tratamientos y el tiempo de exposición.
La concentración letal media (CL50) se estimó con el análisis Probit, utilizando el programa BioStat (2009). Asimismo, se determinó el tiempo letal medio (TL50) para cada concentración con la pendiente de la recta que contenía el valor de 50 % de mortalidad y se reemplazaron los valores X y Y en la ecuación (Y = A + X) para hallar A para cada tratamiento.
Resultados y discusión
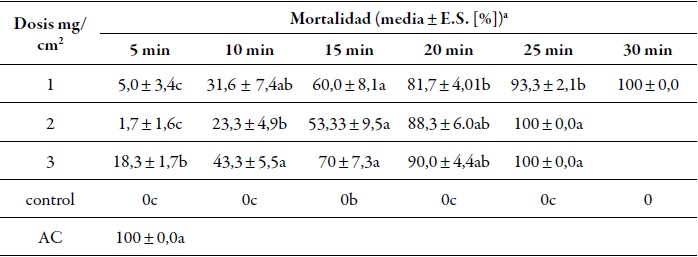
La actividad acaricida del ae de cilantro (C. sativum) sobre ácaros rojos adultos (D. gallinae) a través de bioensayos por contacto, según las diferentes dosis y el tiempo de exposición, se presenta en la tabla 1.
Tabla 1 Actividad acaricida del ae de cilantro (C. sativum) contra ácaros rojos adultos (D. gallinae), a través de bioensayos por contacto
Fuente: Elaboración propia
a datos con la misma letra en cada columna expresan que no hay diferencia significativa p = 0,05.ac: tratamiento control químico acaricida comercial Neguvon*.
De acuerdo con los datos reportados en la tabla 1, se puede establecer que la dosis de 3 mg/cm2 es la que ofrece mayor mortalidad en cualquier tiempo (5, 10, 15, 25 y 30 minutos). La eficacia de las dosis evaluadas de ae de cilantro (1, 2 y 3 mg/cm2) presento una mortalidad fuerte (100 % mortalidad) a los 30 min de contacto. En el grupo control, todos los individuos sobrevivieron, mientras que el control químico, a partir del primer instante de contacto sobre los ácaros, causo el 100 % de mortalidad. La media y el error estándar se reporta con los datos sin transformar. Se comparan los tiempos y tratamientos con la prueba de Kruskal-Wallis y hubo diferencias significativas p < 0,05 de acuerdo con la dosis aplicada y el tiempo de exposición.
Kim et al. (2004) reportaron el 100 % de mortalidad en D. gallinae después de 24 horas de contacto con el ae de cilantro a 0,07 mg/cm2. Para el presente estudio, el ae de cilantro causo el 100 % de mortalidad sobre la población de D. gallinae a los 25 min después del contacto con una concentración de 2 y 3 mg/cm2, y a los 30 min con 1 mg/cm2. Magdaş et al. (2010) registraron una mortalidad del 100 % a las 24, 48 y 72 horas del contacto de D. gallinae con ae de cilantro a 0,4 y 0,6 mg/cm2 en ensayos in vitro, utilizando el método de contacto directo. Al comparar los anteriores trabajos con este estudio, se pudo observar que el efecto del aceite de cilantro sobre D. gallinae es más rápido, alcanzado el 100 % de mortalidad con las tres concentraciones evaluadas a los 30 min de exposición.
Las dosis de ae de cilantro en etanol evaluadas (1,0, 2,0 y 3,0 mg/cm2) sobre D. gallinae son relativamente altas en comparación con lo registrado por otros autores (Kim et al., 2004; Magdaş et al., 2010; Nechita et al., 2015), lo que demuestra una forma más rápida de eliminar la plaga objetivo, con una toxicidad residual baja, tal y como lo plantean George, Olatunji, Guy y Sparagano (2010). En este caso no se registró actividad residual del ae de cilantro sobre D. gallinae 24 horas después de la aplicación y se alcanzó el 100 % de mortalidad a los 30 min de exposición. Según Isman (2000), la falta de toxicidad residual de los compuestos volátiles podría considerarse beneficiosa, porque la persistencia ambiental de los compuestos bioactivos será baja. Por otra parte, de acuerdo con George et al. (2008), los aceites esenciales son muy volátiles en la naturaleza, por lo que el efecto es de corta duración, y si se emplean como acaricidas actúan en la fase de vapor. Además, de acuerdo con los resultados de Kim et al. (2004, 2007), el ae de cilantro fue más eficaz sobre D. gallinae en recipientes cerrados, lo que indica que la ruta de acción de los aceites esenciales está en gran parte en la fase de vapor a través del sistema respiratorio, aunque se desconoce su modo de acción.
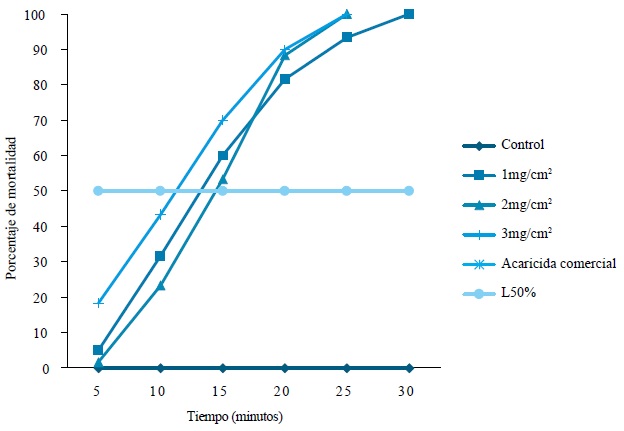
La CL50 del ae de cilantro fue de 1,301 mg/cm2, y se alcanzó en TL50 de 13 min, que redujo el 50 % de la población de D. gallinae (figura 1). Para el grupo control no se registraron valores, porque son de cero desde los 5 min hasta los 30 min; igualmente, no hay valores para el acaricida comercial, pues la mortalidad fue del 100 % a partir de los 5 min (figura 1).
Fuente: Elaboración propia
Figura 1 Tiempo de concentración letal de ae de C. sativum sobre D. gallinae. Se determinó a partir de la pendiente de la recta con el 50 % de mortalidad; se reemplazaron los valores X y Y en la ecuación (Y = A + BX).
Se podría considerar que la letalidad del ae de cilantro sobre D. gallinae se debe al linalool.
De acuerdo con Khani y Rahdari (2012) y Chung et al. (2012), aproximadamente el 70 % de la composición química de este aceite es este compuesto. Los estudios sobre el modo de acción de los ae indican actividad neurotóxica, incluyendo hiperactividad, convulsiones y temblores, seguidos de parálisis, síntomas similares a los producidos por los insecticidas piretroides (Kostyukovsky, Rafaeli, Gileadi, Demchenko, & Shaaya 2002) y en el comportamiento observado en D. gallinae en este estudio. Por otra parte, Chung et al. (2012), con un valor LC50 de 21,5 ppm del ae de cilantro evaluado, observaron que este tiene efectos tóxicos significativos contra las larvas de Aedes aegypti (L., en Hasselquist, 1762) (Diptera: Culicidae), actuando como inmunotoxico sobre el insecto. Se ha reconocido que los ae son potentes neurotoxinas que afectan, a través de la inhibición de la enzima acetil colinesterasa, el sistema nervioso central (Keane & Ryan, 1999).
En el presente estudio, el potencial del aceite de cilantro vario de acuerdo con la concentración y tiempo de exposición. Los resultados de este trabajo muestran que el ae de C. sativum puede desempeñar un papel de control sobre D. gallinae y reducir riesgos asociados con el uso de insecticidas sintéticos. El modo de acción del ae de C. sativum es de especial interés, por lo que otras investigaciones deberían centrarse en la forma que estos penetran la cutícula de los insectos y sus efectos en los mamíferos alimentados con el material tratado. Además, cabe resaltar que el ae de cilantro en hojas tiene baja citotoxicidad en las células humanas, considerándose seguro para el consumo humano (Mandal & Mandal, 2015).
Conclusiones
Este estudio muestra que el ae de C. sativum tiene actividad acaricida contra el D. gallinae mediante contacto directo, y no presenta actividad residual. Por lo tanto, este puede ser usado como un acaricida natural para el manejo de individuos adultos de D. gallinae y considerarse en una alternativa interesante para reducir el uso convencional del control químico.











 text in
text in 



